高考专题盐类的水解知识点和经典习题
- 格式:doc
- 大小:187.50 KB
- 文档页数:11


盐类的水解一、探究盐溶液的酸碱性(注)结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
(1)强酸弱碱盐如:NH4C1的水解离子方程式:NH4+ + 1120 二可逆二NH3*II20 + H+强酸弱碱盐的水溶液-定显酸性.(2)强碱弱酸盐如:CH3C00Na的水解离子方程式:CH3C00- + H20 二可逆二CH3C00H + 0H-强奸弱酸盐的水溶液一定显碱性.(3)弱酸弱碱盐如:CH3C00NH4 的水CH3C00- + NH44- + H20 二可逆二CH3C00H + NH3*H20CH3C00NH4水溶液显中性如:NH4F的水NH4+ + F- + H20 二可逆二NH3*H20 + HFNH4F的水溶液显酸性.如:NH4C10的水解离子方程式;NH4+ CIO- + H20 二可逆二NH3*H20 + HC10NH4C10的水溶液显碱性.弱酸弱碱盐的酸碱性和阴离子与阳离子有关.二、盐溶液呈现不同酸碱性的原因(上)三、盐的水解原理1.定义:在溶液中,盐电离出来的阴离子或阳离子与水所电离岀来的H•或0肝结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件a.盐必须溶于水中b.生成盐的酸或碱是弱酸或弱碱(冇弱才水解,无弱不水解,都弱双水解)【小结】水解规律:有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性(1)有弱才水解要求盐要冇弱酸根离子或者弱碱金属离子(包括铁离子).如:NaCl中的Na+对应的碱是强碱NaOII,则Na+是强碱金属离子,不会水解.MCI中的Cl-对应的酸是强酸HC1,则C1-是强酸根离子,也不会水解.所以,NaCl在水溶液中不会发生水解.乂如:CH3C00Na中的CH3C00-对应的是弱酸CH3C00H,则CH3C00-是弱酸根离子,会水解.消耗H20电离出的H+,结合成CH300H分子.使得水中0H-多出.所以,CH3C00Na的水溶液显碱性.(2)越弱越水解盐屮的离了对应的酸或碱的酸性越弱或碱性越弱,水解的程度越大.如:Na2C03 和Na2S03C0:「2-对应的酸是H2C03; S03"2-对应的酸是H2S03由于H2C03的酸性弱于H2S03则,C03"2-的水解程度比S03"2-的水解程度更大,结合的H+更多.所以,Na2C03的碱性比NaS03的碱性强.(3)双弱双水解当盐屮的阳离子对应的碱是弱碱并且盐小的阴离子对应的是弱酸时,则盐的这两种离子都会发生水解•阳离子水解结合水电离出的0H-;阴离子水解结合水电离出的H卜,所以双水解发主的程度往往较大.如:C113C00NI14中的NH4+对应的碱是弱碱NH3*H20 ; CH3C00-对应的酸是弱酸C113C00H则NH4+和CH3C00-都会发生水解,NH4+结合011-形成NH3*H20; CH3C00-结合H+形成CI13C00H,相互促进,水解程度较大.(4)谁强显谁性主要是针对双水解的盐,即弱酸弱碱盐,山于盐中的阴离子水解结合1I+,阳离子水解结合011 -要判断盐溶液的酸碱性,则要比较阴离子的水解成度和阳离子的水解程度的大小.如:(NH4)C03 ,由于NH3的碱性比H2C03的酸性强(实际上比较的是两者的电离度,中学不做要求,只需记忆),则NH4+的水解程度比C03"2-的水解程度弱,使得水溶液中消耗的山更多,有01卜多出.所以,(NH4) 2C03溶液显碱性.又如:C113C00N114,由于N113的碱性和C113C00H的酸性相当,则NH4+的水解度和CH3C00-的程度差不多,使得水溶液屮的H+和0H-也差不多.所以CH3C00NH4溶液显中性.再如:(NH4)2S03,由于NH3的碱性比H2S03的酸性弱,则NH4+的水解度比SO3"2-的水解度大,使得水溶液中消耗的0H-更多,有H+多出.所以,(NH4)2S03溶液显酸性.5盐溶液屮水的电离规律【例题】1、pH=3的HC1和pH=ll的NaOH溶液中由水电离出來的水2> pH=3的NKC1和pH=l 1的CHQOONa溶液中由水电离出来的c(H')水【小结】盐溶液中水的电离有如下规律:乩在强酸弱碱盐溶液屮,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离) 中水的电离程度大。

盐类水解知识结构盐类水解1.定义:在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。
2.条件:盐必须溶于水,盐必须能电离出弱酸根离子或弱碱阳离子。
3.实质:弱电解质的生成,破坏了水的电离,促进水的电离平衡发生移动的过程。
4.结果:(1)促进了水的电离(2)盐溶液呈现一定的酸碱性(3)生成弱电解质,如:弱酸、弱碱等4.规律:有弱才水解,无弱不水解,越弱越水解;都弱都水解;谁强显谁性,弱弱相对定。
越弱越水解,越热越水解,越稀越水解。
5.特点:(1)水解微弱,可逆自我感悟:已知0.1 mol·L-1CH3COONa溶液的pH=8,如何理解盐类水解的程度一般较小?可以算出:c(CH3COOH)=10-6 - 10-8 mol·L-1(2)水解反应和中和反应互为逆反应,中和反应放热,水解反应为吸热反应。
(3)盐类溶解于水,以电离为主,水解为辅。
水解程度一般较小,不易产生气体或沉淀,但若水解相互促进,则水解程度一般较大。
6.盐类水解的离子反应方程式因为盐类的水解是微弱且可逆的,在书写其水解离子反应方程式时应注意以下几点:(1)应用可逆符号表示,(2)一般生成物中不出现沉淀和气体,因此在书写水解离子方程式时不标“↓”“↑”(3)多元弱酸盐的水解分步进行,且以第一步为主。
例如Na2CO3水解:CO32-+H2O HCO3-+OH-多元弱碱盐的水解方程式可一步写完。
例如:FeCl 3的水解:Fe3++3H2O Fe(OH)3+3H+(4)两种水解情况相反的盐溶液混合时会相互促进,从而使双方水解程度均增大,以致离子能彻底水解。
能彻底水解的离子组,由于水解程度大,当书写离子方程式时要用“=”,生成的难溶物或气体要标“↓”“↑”。
例如A lCl3溶液与Na2S溶液混合时,反应的离子方程式为:2A l3++3S2—+6H2O=2A l(OH)3↓+H2S↑FeCl3溶液与你Na HCO3溶液混合:Fe3++HCO3- = Fe(OH)3↓+3CO2↑能彻底水解的离子组常见的有:A l3+与CO32- 、HCO3—、S2—、[A l(OH)4]—Fe3+与CO32- 、HCO3—等答案:B答案:C7.水解平衡的因素影响水解平衡进行程度最主要因素是盐本身的性质。

高中盐类水解试题及答案1. 盐类水解的实质是什么?答案:盐类水解的实质是弱酸或弱碱离子与水电离出的氢离子或氢氧根离子结合生成弱电解质的过程。
2. 为什么强酸强碱盐不发生水解?答案:强酸强碱盐中的阳离子和阴离子都是强电解质,它们不会与水电离出的氢离子或氢氧根离子结合,因此不发生水解。
3. 写出下列盐类水解的离子方程式:(1) Na2CO3(2) NH4Cl答案:(1) CO3^2- + H2O ⇌ HCO3^- + OH^-(2) NH4^+ + H2O ⇌ NH3·H2O + H^+4. 盐类水解对溶液酸碱性的影响是什么?答案:盐类水解会使溶液的酸碱性发生变化。
阳离子水解使溶液呈酸性,阴离子水解使溶液呈碱性。
5. 影响盐类水解程度的因素有哪些?答案:影响盐类水解程度的因素包括盐的浓度、温度、水解离子的强弱等。
6. 为什么在配制pH为10的Na2CO3溶液时,需要加入少量的NaOH?答案:在配制pH为10的Na2CO3溶液时,需要加入少量的NaOH来抑制CO3^2-的水解,从而保持溶液的碱性。
7. 写出下列盐类水解的化学方程式:(1) Na2SO3(2) NaClO答案:(1) 2Na2SO3 + H2O ⇌ NaHSO3 + NaOH(2) NaClO + H2O ⇌ NaOH + HClO8. 盐类水解在实际应用中有哪些?答案:盐类水解在实际应用中包括调节溶液的酸碱性、制备缓冲溶液、水处理中的软化水等。
9. 为什么在制备Fe(OH)3胶体时,需要加入少量的FeCl3?答案:在制备Fe(OH)3胶体时,需要加入少量的FeCl3来提供Fe^3+离子,这些离子与水反应生成Fe(OH)3胶体。
10. 写出下列盐类水解的离子方程式:(1) Na2S(2) NaCN答案:(1) S^2- + H2O ⇌ HS^- + OH^-(2) CN^- + H2O ⇌ HCN + OH^-。

高中化学水解知识点总结(zǒngjié)及习题(有答案)高中化学水解(shuǐjiě)知识点总结及习题(有答案)一、盐类水解(shuǐjiě)的实质盐电离出来的某些离子(一般是弱酸根离子或弱碱阳离子)跟水电离出来的H+或OH-结合(jiéhé)生成了弱电解质,促使水的电离平衡发生移动,结果溶液中c(H+)、c(OH-)发生了相对改变,从而使溶液呈一定的酸碱性。
盐类的水解(shuǐjiě)程度一般都很小,且是可逆反响,书写水解方程式时要用“〞表示。
因水解是微弱的,平衡时生成的弱电解很少,所以一般不会产生沉淀和气体,生成物不应加沉淀符号(↓)或气体符号(↑)。
二、盐类水解的类型和规律1、强碱弱酸盐水解,溶液呈碱性,pH>7,如a、NaCO3等。
多元弱酸根离子是分步水解的,且第一步水解程度>>第二步水解程度,溶液的酸碱性主要决定于第一步水解程度。
如Na2CO3在水溶液中水解应分两步写:①CO32-+H2OHCO3-+OH-,②HCO3-+H2OH2CO3+OH-多元弱酸的酸式根离子同时具备电离和水解两种趋势:HR-H+---+R2(电离,呈酸性),HR+H2OH2R+OH(水解,呈碱性),这需要具体分析。
很显然如果电离趋势占优势,那么显酸性,如:---H2PO4、HSO3,如果水解趋势占优势,那么显碱性,如:HCO3、HS-、HPO42-等。
2、强酸弱碱盐水解,溶液呈酸性,pH4、溶液的酸碱性盐类水解后,溶液会呈现不同的酸碱性。
因此,控制溶液的酸碱性可以促进或抑制盐的水解。
如在配制FeCl3溶液时常参加少量盐酸来抑制FeCl3水解。
四、盐类水解的应用水解的应用实例原理+3Al+3H2OAl(OH)3(胶明矾净水+1、净水体)+3H2、去油污用热碱水冼油污物品CO32-+H2O+△HCO3-+OH -Fe3+3H2OFe(OH)3+3H+CO32-+H2OHCO3-+-OH假设不然,那么:由MgCl26H2O制无水MgCl26H2O△Mg(OH)2+4、制备无水盐MgCl2在HCl气流中加热2HCl+4H2O△Mg(OH)2MgO+H2O①配制FeCl3溶液时常参加少量盐酸3、药品的保存②配制Na2CO3溶液时常参加少量NaOH用Al2(SO4)3与NaHCO3溶液Al3++3HCO3-=Al(OH)3↓+5、泡沫灭火器混合3CO2↑NH4+H2+H6、比拟盐溶液比拟NH4Cl溶液中离子浓度+中离子浓度的的大小c(Cl-)>c(NH4+)>c(H +)>大小c(OH)-例1、浓度为0.1mol/L的八种溶液:①HNO3②H2SO4③④Ba(OH)2⑤NaOH⑥a⑦KCl⑧NH4Cl,其pH值由小到大的顺序为。

盐类水解知识点及习题考点1盐类水解反应的本质一盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟结合生成 ,从而了水的电离;二盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等;三盐类水解的结果1 了水的电离;2盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 ;3生成了弱电解质;四特征1水解:盐+水酸 + 碱,ΔH 02盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大;特别提醒:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素;强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中cH+减小,cOH-增大,即cOH->cH+;如Na2CO3,NaHCO3强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中cH+增大,cOH-减小,即cOH->cH+;NH4Cl,AlCl3弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子;CH3COONH4例1 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是①KNO3②NaOH③CH3COO NH4④NH4Cl A、①>②>③>④ B、④>③>①>②C、③>④>②>① D、③>④>①>②解析①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO—对水的电离平衡无影响;②NaOH为强碱在水溶液中电离出的OH—对水的电离起抑制作用,使水的电离程度减小;③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO—均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大;④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH4+可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度;答案D规律总结酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用;考点2溶液中粒子浓度大小的比较规律1.多元弱酸溶液,根据电离分析,如在H3PO4的溶液中,2.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2 S溶液中cNa+>cS2->cOH->cHS-3.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素;如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,cNH4+由大到小的顺序是 ;4.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素,水解因素等;1弱酸与含有相应酸根的盐混合,若溶液呈酸性,说明弱酸的电离程度相应酸根离子的水解程度;如CH3COOH与CH3COONa溶液呈 ,说明CH3COOH的电度程度比CH3COO—的水解程度要大,此时,c CH3COOH<c CH3COO—;2弱酸与含有相应酸根的盐混合,若溶液呈碱性,说明弱酸的电离程度相应酸根离子的水解程度;如HCN与NaCN的混合溶液中,c CN—<c Na+,则说明溶液呈碱性,HCN的电度程度比CN—的水解程度要 ,则c HCN>c CN—;3弱碱与含有相应弱碱阳离子的盐的混合的情况,与1、2的情况类似;特别提醒理解透水解规律:有弱才水解,越弱越水解,谁强显谁性;例2 在mol·L-1的 NH4Cl和mol·L-1的氨水混合溶液中,各离子浓度的大小顺序;答案cNH4+>cCl->cOH->cH+;在该溶液中,NH3·H2O的电离与NH4+的水解互相抑制,NH3·H2O电离程度大于NH4+的水解程度时,溶液呈碱性:c OH->c H+,同时c NH4+>c Cl-;规律总结要掌握盐类水解的内容这部分知识,一般来说要注意几个方面:1、盐类水解是一个可逆过程;2、盐类水解程度一般都不大;3、要利用好守恒原则即电量守恒和物料守恒这两个方法在比较离子浓度和相关计算方面有较多的运用;考点3 盐类水解的应用1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 ;如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、NH42SO4、NaHSO4等溶液,pH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>NH42SO4>NaHSO42.比较盐溶液中各离子浓度的相对大小时,当盐中含有的离子,需考虑盐的水解;3.判断溶液中离子能否大量共存;当有和之间能发出双水解反应时, 在溶液中大量共存;如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存;4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来盐的水解;5.选择制备盐的途径时,需考虑盐的水解;如制备Al2S3时,因无法在溶液中制取会完全水解,只能由干法直接反应制取;加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体;6.化肥的合理使用,有时需考虑盐的水解;如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用;因草木灰有效成分K2CO3水解呈 ;7.某些试剂的实验室存放,需要考虑盐的水解;如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 ;8.溶液中,某些离子的除杂,需考虑盐的水解;9.用盐溶液来代替酸碱10.明矾能够用来净水的原理特别提醒:盐类水解的应用都是从水解的本质出发的;会解三类习题:1比较大小型,例:比较PH值大小;比较离子数目大小等;2实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等;3反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等;例3蒸干FeCl3水溶液后再强热,得到的固体物质主要是A. FeCl3B. FeCl3·6H2OC. FeOH3D. Fe2O3解析 FeCl3水中发生水解:FeCl3+3H2O FeOH3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成FeOH3,FeOH3为不溶性碱,受热易分解,最终生成Fe2O3;答案D规律总结易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体;例如:AlCl3、FeCl3;而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2;参考答案考点1 一水电离出来的H+或OH- 弱电解质促进;二溶于水弱酸的酸根离子或弱碱阳离子三1促进; 2酸性碱性中性谁强显谁性四 1吸热 >;2小考点2 1.多步c H+>c H2PO4->c HPO42->c PO43-;3. ③>①>②;4.1大于酸性 2小于小考点3 1. 盐的水解 2. 易水解 3. 弱碱阳离子弱酸阴离子不能4. 对应的强酸抑制5. HCl6. 碱性7. 磨口玻璃塞盐类水解盐类水解,水被弱解;有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强呈谁性,同强呈中性;电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等;如NaHCO3溶液中:nNa++nH+=nHCO3-+2nCO32-+nOH-推出:Na++H+=HCO3-+2CO32-+OH-物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的;如NaHCO3溶液中:nNa+:nc=1:1,推出:C Na+=c HCO3-+c CO32-+c H2CO3质子守恒:不一定掌握电解质溶液中分子或离子得到或失去质子H+的物质的量应相等;例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c H3O++c H2CO3=c NH3+c OH-+c CO32-;。

第三节盐类的水解一、单项选择题1. 水中加入下列溶液对水的电离平衡不产生影响的是()A . NaHS04溶液B. KF溶液C. KAl(SO 4)2 溶液 D . NaI 溶液解析:厂、Al3+的水解能促进水的电离;NaHS04电离出的H*能抑制水的电离,厂对应的酸(HI)为强酸,故Nal溶液对水的电离平衡无影响。
答案:D1 —1.(双选)25 C时,某浓度的氯化铵溶液的pH = 4,下列叙述中正确的是()A .溶液中的c(OH —)= 1 X 10—10 mol L—1B. 溶液中的c(NH 才)>c(CI—)>c(H +) >c(OH —)C. 溶液中的c(H +)+ c(NH才)=c(Cl—) + c(OH —)D•溶液中的c(NH3 H2O) = c(NH才)解析:A项中由K w可计算出c(OH —)= 1 X 10—10 mol L —1,所以A项正确,B项中因为NH才水解,故c(CI—)>c(NH才),所以B项错误;C项中符合电荷守恒,所以C项正确;D 项中NHf的水解程度较小,故c(NH3 H2O)小于c(NH才),所以D项错误。
答案:AC2. 已知某溶液中只存在OH、Cl、NH 4、H四种离子,下列说法不正确的是()A •若溶液中c(NH4) = c(Cl—),则该溶液一定显中性B•若溶液中c(NH4 )>c(Cl—)>c(OH —)>c(H +),则溶液中一定含有NH4CI 和NH3 H2OC.若溶液中c(Cl—)>c(NH;)>c(H +)>c(OH —),则溶液中可能含有NH4CI或可能含有NH4CI 和HClD •若溶液中c(CI—)> c(H +)> c(NH;)>c(OH —),则溶液中含有大量的NH4CI和少量的HCI解析:A项,若溶液中c(NH才)=c(CI —),由电荷守恒知c(OH —) = c(H +),则该溶液一定显中性;B项,溶液呈碱性,溶质只能是NH4CI和NH3H2O; C项,溶液呈酸性,溶质可能含有NH4CI或可能含有NH4CI和HCI,但若溶质是大量的NH4CI和少量的HCI,则c(CI —)>c(NH才)>c(H + )>c(OH —), D 项错误。

11.1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理H O H++OH—HB (n— 1) —A(OH)n当盐 AB 能电离出弱酸阴离子(B n—)或者弱碱阳离子(A n+ ),即可与水电离出的 H+或者OH—结合成电解质份子,从而促进水进一步电离.与中和反应的关系:水解盐+水酸+碱(两者至少有一为弱)中和由此可知,盐的水解为中和反应的逆反应,但普通认为中和反应程度大,大多认为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为:1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定如 NH CN4碱性CH CO NH3 2 4中性NH F4酸性取决于弱酸弱碱相对强弱AB== B n—+ A n+22.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO )②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性 电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如 H PO 及其三种阴离子随溶液 pH 变化可相互转化:3 4pH 值增大H PO H PO — HPO 2— PO 3—3 4 2 4 4 4pH 减小③常见酸式盐溶液的酸碱性碱性: NaHCO 3 、NaHS 、Na 2HPO 4 、NaHS.酸性(很特殊,电离大于水解):NaHSO 3、NaH 2PO 4 、NaHSO 4内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大. (2)浓度不变,湿度越高,水解程度 越大. (3)改变溶液的 pH 值,可抑制或者促进水解。
HA+OH ——Q温度(T) T ↑ → α↑ 加水 平衡正移,α↑增大[H +] 抑制电离,α↑ 增大[OH — ]促进电离,α↑ 增大[A — ] 抑制电离,α↑注:α— 电离程度 h —水解程度思量:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在 CH COOH 和 CH COONO 的溶液中分别加入少量冰醋酸,对 CH COOH 电离程度 和3 3 2 3CH COO —水解程度各有何影响?3例如: ①正盐 KX 、KY 、KZ 的溶液物质的量浓度相同, 其 pH 值分别为 7、8、9,则 HX 、HY 、促进水解, h ↑ 促进水解, h ↑ 抑制水解, h ↑ 水解程度, h ↑2 T ↑ →h ↑ HA H ++A ——Q A —+H OHZ 的酸性强弱的顺序是________________②相同条件下,测得①NaHCO ②CHCOONa ③NaAlO 三种溶液的 pH 值相同。

水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何影响?(五)盐类水解原理的应用考点 1.判断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。

(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
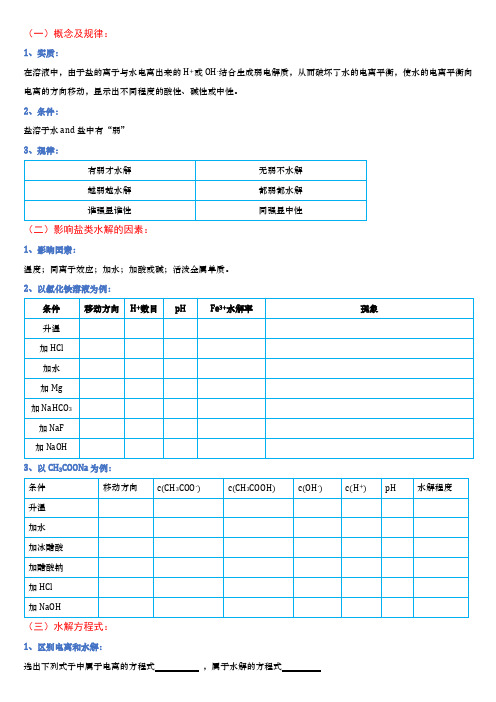
(一)概念及规律:1、实质:在溶液中,由于盐的离子与水电离出来的H+或OH-结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,显示出不同程度的酸性、碱性或中性。
2、条件:盐溶于水and盐中有“弱”3、规律:(二)影响盐类水解的因素:1、影响因素:温度;同离子效应;加水;加酸或碱;活泼金属单质。
2、以氯化铁溶液为例:3、以CH3COONa为例:(三)水解方程式:1、区别电离和水解:选出下列式子中属于电离的方程式,属于水解的方程式A . HCO 3-+H 2O ⇌H 3O ++CO 32-B . HCO 3-+OH -=H 2O+CO 32-C. HCO 3-⇌H ++CO 32-D. HCO 3-+H 2O ⇌H 2CO 3+OH -E. HCO 3-+H +=H 2O+CO 2 2、写出下列水解的离子方程式:NH 4Cl CH 3COONa Na 2S NaHCO 3 NaAlO 2 AlCl 3 Na 2HPO 43、写出下列水解的化学方程式:Na 2S NaAlO 2 Na 2HPO 4 NaH 2PO 4 (NH 4)2SO 44、双水解——单一二元化合物的水解:CaC 2 Mg 2C 3 PCl 3 Al 4C 3 Mg 3N 2 Al 2S 3 ICl SOCl 2SiHCl 3 NH 2Cl(已知产物具有漂白性) 5、双水解——两物质混合: 泡沫灭火器原理 FeCl 3+Na 2CO 3NaAlO 2+AlCl 3制备Al 2S 3不用AlCl 3和Na 2S 水溶液 CH 3COONa+NH 4Cl6、特殊情况——看似像双水解但实质是强酸制弱酸: NaHCO 3+NaAlO 2 NaHCO 3+Na 2SiO 37、特殊情况——双水解和氧化还原同时进行FeCl 3+Na 2SO 3: 氧化还原: 双水解:(四)三个守恒:1、书写下列溶液的三个守恒:电荷守恒&物料守恒&质子守恒 1. Na 2HPO 4弱碱阳离子水解一步到位,弱酸根水解分步进行1)先标化合价,带+电的与OH -结合,带—电的与H +结合。

盐类水解知识点总结(附带例题)答:同窗,你好!为你归纳重点内容供参考:盐类的水解【知识点精讲】一、盐类水解的实质盐电离出来的某些离子(一样是弱酸根离子或弱碱阳离子)跟水电离出来的H+或OH-结合生成了弱电解质,促使水的电离平稳发生移动,结果溶液中c(H+)、c(OH-)发生了相对改变,从而使溶液呈必然的酸碱性。
盐类的水解程度一样都很小,且是可逆反映,书写水解方程式时要用“”表示。
因水解是微弱的,平稳时生成的弱电解很少,因此一样可不能产生沉淀和气体,生成物不该加沉淀符号(↓)或气体符号(↑)。
二、盐类水解的类型和规律一、强碱弱酸盐水解,溶液呈碱性,pH>7,如CH3COONa、NaCO3等。
多元弱酸根离子是分步水解的,且第一步水解程度>>第二步水解程度,溶液的酸碱性要紧决定于第一步水解程度。
如Na2CO3在水溶液中水解应分两步写:①CO32-+H2HCO3-+OH-,②HCO3-+H2H2CO3+OH-多元弱酸的酸式根离子同时具有电离和水解两种趋势:HR-H++R2-(电离,呈酸性),HR-+H2H2R+OH-(水解,呈碱性),这需要具体分析。
很显然若是电离趋势占优势,那么显酸性,如:H2PO4-、HSO3-,若是水解趋势占优势,那么显碱性,如:HCO3-、HS-、HPO42-等。
二、强酸弱碱盐水解,溶液呈酸性,pH<7,如NH4Cl、Al2(SO4)3等。
3、强酸强碱盐不水解,溶液呈中性,pH=7,如NaCl、KNO3等。
4、弱酸弱碱盐水解,溶液呈什么性由水解生成的弱酸、弱碱的相对强弱比较来决定。
当碰到某些弱酸弱碱盐两种离子都发生水解,应在同一..离子方程式中表示,而且因强烈水解,假设是水解产物中有气体或难溶物质或易分解物质的话,这种水解往往能进行到底,如此水解方程式应用“=”号表示,并在生成的沉淀和气体的后面标上“↓”或“↑”。
如2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。

盐类的水解(二)基础练习一、选择题1.酸式盐的水溶液是A.一定呈酸性B.一定呈碱性C.一定呈中性D.不能肯定呈酸性还是呈碱性2.下列物质的水溶液,当加热后,溶液的pH减小的是A.碳酸钠B.氯化铵C.氯化钠D.醋酸钠3.某电解质的水溶液呈酸性,溶液中的阳离子只有一种,此溶液中的电解质是A.酸B.强酸弱碱盐C.酸式盐D.弱酸强碱盐4.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。
根据上述信息,下列说法不正确的是A.CaO2的水解产物是Ca(OH)2和H2O2B.PCl3的水解产物是HClO和PH3C.NaClO的水解产物之一是HClOD.Mg3N2的水解产物是两种碱5.同温同物质的量浓度条件下,NaHCO3和NaHSO4溶液中水的电离度前者与后者之间的关系是A.大于B.小于C.等于D.不能确定6.在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是A.HCl溶液B.NaOH溶液C.KCl溶液D.KOH溶液7.在0.1mol/L K2CO3溶液中,要使CO32-的浓度达到0.1mol/L,则应向溶液中加入一定量的A.H2OB.CO2C.HClD.KOH8.等物质的量浓度的下列溶液中,pH最小的是A.NaHCO3B. Al2(SO4)3C.NaAlO2D.NaHSO49.把下列物质的水溶液加热蒸干后,能得到原溶质的是A.NaHCO3B.FeCl3C. KClD.Al2(SO4)310.有下列四种溶液:①HCl ②AlCl3③NaOH ④Na2CO3,此四种溶液中水的电离度分别为α1、α2、α3、α4,已知α1=α3,α2=α4,且α2/α1=106,则四种溶液的pH不可能是A.5 5 10 10B.4 4 10 10C.3 5 11 9D.5 3 9 1111.今有pH=10的Na2CO3溶液、pH=10的NaOH溶液和pH=4的CH3COOH溶液。

高考专题盐类的水解知识点和经典习题第25说盐类的水解基础考点梳理最新考纲1.明白盐类水解的原理,掌握盐类水解的规律和应用。
2.了解盐溶液的酸碱性,会比较盐溶液中离子浓度的大小。
自主复习一、盐类水解的定义和实质1.盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成难电离的物质,使水的电离平衡被破坏而建立起了新的平衡。
3.盐类水解反应离子方程式的书写盐类水解普通程度非常小,水解产物也非常少,通常别生成沉淀或气体,书写水解方程式时,普通别用“↑”或“↓”。
盐类水解是可逆反应,除发生强烈双水解的盐外,普通离子方程式中别写===号,而写号。
4.盐类的水解与溶液的酸碱性①NaCl②NH4Cl ③Na2CO3④CH3COONa ⑤AlCl3五种溶液中呈酸性的有:②⑤。
呈碱性的有:③④。
呈中性的有:①。
二、盐类水解的妨碍因素及应用1.内因:盐本身的性质(1)弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
2.外因(1)温度:升高温度,水解平衡正向挪移,水解程度增大。
(2)浓度①增大盐溶液的浓度,水解平衡正向挪移,水解程度减小,但水解产生的离子浓度增大,加水稀释,水解平衡正向挪移,水解程度增大,但水解产生的离子浓度减小。
②增大c(H+),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c (OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
3.盐类水解的应用(写离子方程式)(1)明矾净水:Al3++3H2O Al(OH)3+3H+。
(2)制备Fe(OH)3胶体:Fe3++3H2O错误!Fe(OH)3(胶体)+3H+。
(3)制泡沫灭火剂:Al3++3HCO错误!===Al(OH)3↓+3CO2↑。
(4)草木灰与铵态氮胖混施:NH错误!+CO错误!+H2O NH3·H2O+HCO -。

盐类水解专题一、水解的实质1、盐类水解定义在溶液中盐电离出来的离子跟水所电离出来的+-联合生成弱电解质的反响,叫做盐类的水解。
(在溶H或 OH液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子联合生成弱电解质弱酸或弱碱,损坏了水的电离均衡,使其均衡向右挪动,惹起氢离子或氢氧根离子浓度的变化。
)中和盐 + 水酸 + 碱水解2、盐类水解的实质弱酸的阴离子和弱碱的阳离子和水电离出的+-H 或 OH离子联合生成弱电解质,促使了水的电离。
( 1)只有弱酸的阴离子或弱碱的阳离子才能与H+或 OH-联合生成弱电解质。
(2)盐类水解使水的电离均衡发生了挪动,并使溶液呈酸性或碱性。
(3)盐类水解反响是酸碱中和反响的逆反响。
3、影响水解的要素内因:盐类自己的性质这是影响盐类水解的内在要素。
构成盐的酸或碱越弱,盐的水解程度越大,其盐溶液的酸性或碱性就越强。
“无弱不水解,有弱即水解,越弱越水解,谁强显谁性”注:酸式盐的水解①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于二者相对大小电离程度>水解程度,呈酸性;电离程度<水解程度,呈碱性③常有酸式盐溶液的酸碱性碱性: NaHCO3、 NaHS、 Na2HPO4、 NaHS.酸性:NaHSO3、NaH2PO4、NaHSO4外因:(1)温度因为盐的水解作用是中和反响的逆反响,所以盐的水解是吸热反响,温度高升,水解程度增大。
(2) 浓度溶液浓度越小,其实是增添了水的量,可使均衡相正反响方向挪动,使盐的水解程度增大。
(最好用勒沙特例原理中浓度同时减小的原理来解说)(3) 溶液的酸碱性盐类水解后,溶液会体现不一样的酸碱性。
所以,控制溶液的酸碱性能够促使或克制盐的水解。
如在配制FeCl3溶液经常加入少量盐酸来克制FeCl3水解。
盐的离子与水中的氢离子或氢氧根离子联合的能力的大小,构成盐的酸或碱的越弱,盐的水解程度越大。
1.以下对于盐的水解的表达中,正确的选项是()A.盐类的水解过程是中和反响的逆过程,是吸热过程B.易水解的盐溶于水后,都克制了水的电离C.易水解的盐溶液中,水电离出的以游离态存在的+-H和 OH的浓度永久相等D.易水解的盐溶液必定不是中性的2.(海南卷)以下离子方程式中,属于水解反响的是()A . HCOOH+H 2O-+ HCOO+ H3OB .CO2+H 2O-+ HCO 3+ H2---C.CO3 + H 2O HCO 3+ OH ;..-2- +D .HS + H 2OS + H 3O3.以下物质加入金属镁能够产生氢气的是A .HNO 3B . NaHCO 3C .NH 4ClD . CH 3COONa 4. 25℃时,同样物质的量浓度以下溶液中,水的电离程度由大到小摆列次序正确的选项是()①KNO 3②NaOH③ CH 3COO NH 4④ NH 4ClA 、① >②>③ >④B 、④ >③>①>②C 、③ >④ >②>①D 、③ >④>①>②5.(重庆卷)向三份 0.1mol/L CH 3COONa 溶液中分别加入少量NH 4NO 3、Na 2SO 3、 FeCl 2 因体(忽视溶液体积变化),则 CH 3COO - 浓度的变化挨次为( )A .减小、增大、减小B .增大、减小、减小C .减小、增大、增大D .增大、减小、增大CO 2- + H 2 O--6.(福建卷) 在必定条件下, Na 2CO 3 溶液存在水解均衡:HCO + OH以下说法正确的选项是3A. 稀释溶液,水解均衡常数增大B. 通入 CO 2,均衡朝正反响方向挪动C.高升温度,c( HCO3) 减小c(CO 32 )D. 加入 NaOH 固体,溶液 PH 减小7. ( 1)25℃时, 向 0.1mol/L 的氨水中加入少量氯化铵固体,当固体溶解后, 测得溶液 pH 减小,主要原由是 (填序号)__ _ 。


专题06 盐类的水解考点01 盐类的水解及其规律 考点02 盐类水解方程式的书写 考点03 盐类水解的影响因素 考点04 水解常数考点05 盐类水解的应用考点06 溶液中粒子浓度的变化分析▉考点01 盐类的水解及其规律1.盐类水解的概念在水溶液中,盐电离出来的离子与水电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
3.盐类水解的规律:(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
如:碳酸的酸性大于次氯酸,则相同浓度的NaHCO 3溶液的水解程度小于NaClO 溶液。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
如:碳酸的电离常数K a1小于NH 3·H 2O 的电离常数K b ,故NH 4HCO 3溶液显碱性。
(5)“同强显中性”——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数K b与盐中的阴离子对应的酸的电离常数K a相等时,盐溶液显中性。
如K b(NH3·H2O)=K a(CH3COOH),故CH3COONH4溶液显中性。
4.盐类水解程度大小比较规律(1)组成盐的弱碱阳离子水解使溶液显酸性,组成盐的弱酸根离子水解使溶液显碱性。
(2)盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
(3)多元弱酸的酸根离子比酸式酸根离子的水解程度大得多。
第25讲盐类的水解基础考点梳理最新考纲1.理解盐类水解的原理,掌握盐类水解的规律和应用。
2.了解盐溶液的酸碱性,会比较盐溶液中离子浓度的大小。
自主复习一、盐类水解的定义和实质1.盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成难电离的物质,使水的电离平衡被破坏而建立起了新的平衡。
3.盐类水解反应离子方程式的书写盐类水解一般程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↑”或“↓”。
盐类水解是可逆反应,除发生强烈双水解的盐外,一般离子方程式中不写===号,而写号。
4.盐类的水解与溶液的酸碱性①NaCl②NH4Cl ③Na2CO3④CH3COONa ⑤AlCl3五种溶液中呈酸性的有:②⑤。
呈碱性的有:③④。
呈中性的有:①。
二、盐类水解的影响因素及应用1.内因:盐本身的性质(1)弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
2.外因(1)温度:升高温度,水解平衡正向移动,水解程度增大。
(2)浓度①增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大,加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
②增大c(H+),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c(OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
3.盐类水解的应用(写离子方程式)(1)明矾净水:Al3++3H2O Al(OH)3+3H+。
(2)制备Fe(OH)3胶体:Fe3++3H2O错误!Fe(OH)3(胶体)+3H+。
(3)制泡沫灭火剂:Al3++3HCO错误!===Al(OH)3↓+3CO2↑。
(4)草木灰与铵态氮肥混施:NH错误!+CO错误!+H2O NH3·H2O+HCO -。
3网络构建热点典例突破热点考向1.盐类水解方程式的书写与判断。
2.水解平衡的影响因素以及盐溶液酸碱性的判断和比较。
3.溶液中微粒浓度的大小比较。
4.盐类水解在化工生产、日常生活中的应用。
热点探究热点1盐类的水解的概念及实质1.定义在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
盐类的水解可看作是酸碱中和反应的逆反应。
2.实质盐电离出来的离子(弱碱阳离子或弱酸阴离子)跟水电离产生的H+或OH-结合生成弱电解质(弱酸或弱碱)并建立平衡,使水的电离平衡向右移动,使溶液中的c(H+)和c(OH-)不再相等,所以,溶液显示出一定的酸性或碱性。
3.规律:概括为“有弱才水解,无弱不水解,越弱越水解,都弱双水解,谁强显谁性,同强显中性”。
说明:①“越弱越水解”指的是盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
如CH3COOH的酸性比HCN强,则相同浓度的CH3COONa 和NaCN溶液中,CH3COO-的水解程度比CN-小,后者的碱性强。
②“都弱双水解”指的是两种离子分别结合水电离的H+和OH-而水解,其水解必然相互促进。
双水解分两种情况,一种是虽然两种离子的水解相互促进,但水解程度仍然很小,离子间可以大量共存,如NH错误!与CO错误!、HCO错误!、S2-等;另一种是水解进行完全,离子间不能大量共存,往往生成沉淀或气体,如Al3+与S2-、HCO错误!、CO错误!、AlO错误!,Fe3+与CO错误!、HCO错误!、AlO错误!等[如Al3++3HCO错误!===Al(OH)3↓+3CO2↑]。
4.影响盐类水解的因素(1)内因盐类水解程度的大小,主要由盐的本性所决定,所谓“越弱越水解”。
(2)外因①温度:盐的水解反应是吸热反应,因此,温度升高水解程度增大。
②浓度:盐的浓度越小,水解程度越大。
③外加酸碱:能促进或抑制盐的水解。
5.水解方程式的书写(1)一般盐类水解程度很小,水解产物也很少,在书写盐类水解方程式时要写“”,产物不标“↑”或“↓”,不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
(2)多元弱酸盐的水解是分步进行的,第一步较易发生,水解时以第一步为主,一般只写第一步水解的离子方程式。
例如:Na2CO3水解的离子方程式写作:CO错误!+H2OHCO错误!+OH-。
(3)多元弱碱阳离子的水解实际也是分步进行的,在中学阶段多步并为一步,水解可写为Fe3++3H2O Fe(OH)3+3H+。
例如:FeCl3(4)能彻底水解的离子组,由于不形成水解平衡,书写时要用“===”“↑”“↓”等,如NaHCO3溶液与AlCl3溶液混合:Al3++3HCO错误! ===Al(OH)3↓+3CO2↑。
【例1】在一定条件下,Na2CO3溶液存在水解平衡:CO错误!+H2O HCO错误!+OH-。
下列说法正确的是( )A.稀释溶液,水解平衡常数增大B.通入CO2,平衡朝正反应方向移动C.升高温度,错误!减小D.加入NaOH固体,溶液pH减小[解析]水解平衡常数只与温度有关,温度不变,平衡常数不变,A不正确。
通入CO2,发生反应CO2+2OH-===CO错误!+H2O,OH-的浓度降低,平衡向正反应方向移动,B正确。
水解反应吸热,升高温度,平衡向右移动,错误!增大,C不正确。
加入NaOH固体,OH-浓度增大,溶液pH增大,D不正确。
[答案] B变式1向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、N SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为() a2A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大解析:因发生水解,NH4NO3、Na2SO3、FeCl3分别显酸性、碱性、酸性,而酸性会促进CH3COO-的水解,使c(CH3COO-)减小,碱性则会抑制CH3COO-的水解,使c(CH3COO-)增大。
答案:A热点2盐类水解的应用1.判断盐溶液的酸碱性如Na2CO3溶液因CO错误!的水解而显碱性,NH4Cl溶液因NH错误!的水解而显酸性。
2.配制盐溶液如在配制FeCl3溶液时,由于Fe3+的水解使溶液浑浊而得不到澄清溶液,故在配制时,要加入一定量的HCl来抑制Fe3+的水解。
同样在配制FeSO、Sn4等溶液时也需要加入相应的酸来抑制水解。
Cl23.比较盐溶液中的离子浓度大小如NHCl溶液中各离子浓度的大小顺序判断:NH错误!+H2O NH3·H24O+H+,如果不水解,溶液中c(NH错误!)=c(Cl-),但由于水解的存在,c(NH错误!)降低,而同时生成了一定量的H+,c(H+)>c(OH-),所以c(Cl-)>c(NH错误!)>c(H+)>c(OH-)。
4.分析某些盐的制备方法如AlCl的制备,不能通过加热溶液、浓缩结晶的方法,因为温度升高,水解3程度增大,生成Al(OH)3,若继续加热灼烧,Al(OH)3将分解生成Al2O3。
5.化学肥料的施用酸性的化学肥料不能和碱性肥料混用,如硝酸铵和草木灰(主要有效成分为K2CO3)不能混合施用,因NH4NO3水解显酸性,K2CO3水解显碱性,混合将促进水解,降低肥效。
6.盐的净水作用用明矾净水的原理是Al3+发生水解反应:Al3++3H2OAl(OH)3+3H+,生成絮状的氢氧化铝,能吸附水中的悬浮物,从而使水澄清。
7.生活中的应用如用纯碱溶液洗涤油污。
因为油污主要是酯类物质,Na2CO3水解使溶液显CO3水解程碱性,碱性条件下酯类易水解生成溶于水的醇和羧酸钠,加热使Na2度增大,溶液碱性增强所以热的纯碱溶液洗涤效果比冷的好。
【例2】在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HCl;ΔH>0(1)将饱和FeCl3溶液,滴入沸腾的蒸馏水中可得到一种红褐色透明液体。
SO4产生的现象为_______________________向这种液体中加入稀H2_________________________________________________。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是________________________________________________________________________。
(3)在配制FeCl3溶液时,为防止产生浑浊,应________________________________________________________________________。
(4)向FeCl3溶液中加入少量浓苯酚钠溶液,预计可能看到的现象是________________________________________________________________________。
[解析] 将FeCl3溶液滴入沸腾的蒸馏水中,得到Fe(OH)3胶体,加入稀H2SO4则胶体聚沉而得到红褐色沉淀,当H2SO4过量时沉淀又溶解生成黄色溶液。
(2)加热可促进盐类水解,由于HCl挥发,可使水解进行彻底,得到Fe(OH)沉淀,Fe(OH)3受热分解,最终产物为Fe2O3。
3(3)为防止FeCl3水解,应加入浓盐酸抑制FeCl3水解。
[答案](1)先生成红褐色沉淀,又逐渐溶解生成黄色溶液(2)Fe2O3(3)加入少许浓盐酸(4)产生红褐色沉淀,且溶液变为紫色变式2(1)Na2CO3溶液中滴入酚酞呈红色,原因是(用离子方程式表示)__________________________。
加热后颜色变________(深或浅),原因是_____________________________________。
(2)若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是________。
其原因是(以离子方程式和简要文字说明)___________________________________。
答案:(1)CO2-3+H2OHCO错误!+OH-深随温度升高,水解平衡右移c(OH-)增大,碱性增强,故溶液的红色加深(2)产生白色沉淀,且红色褪去加入BaCl2后,Ba2++CO错误!===Ba CO3↓(白色),由于c(CO错误!)减小,CO错误!水解平衡左移,c(OH-)减小,溶液变无色热点3溶液中微粒浓度的大小比较1.酸溶液或碱溶液酸溶液中氢离子浓度即c(H+)最大,碱溶液中氢氧根离子浓度即c(OH-)最大,其余离子浓度应根据酸或碱的电离程度比较。
多元弱酸或多元弱碱以第一步电离为主。
例如:H2S中各离子浓度比较为:c(H+)>c(HS-)>c(S2-)>c(OH-)。