《水溶液中的离子平衡》单元测试题
- 格式:doc
- 大小:359.50 KB
- 文档页数:4

第三章水溶液中的离子平衡单元测试题(时间:90分钟共100分)相对原子质量:H 1 O 16 Na 23 S 32 K 39 Ag 108 I 127 Ba 137第I卷(选择题共50分)一.单选择题1、在pH=1的无色溶液中能大量共存的离子组是A、NH4+.、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-C. Al3+、Cu2+、SO42-、Cl-D.Na+、Ca2+、Cl-、AlO2-2、纯水在20℃和80℃时的pHA.前者大 B.后者大 C.相等 D.无法确定3、能正确表示下列反应的离子方程式是A.铁跟盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑B.磷酸二氢钙溶液跟氢氧化钙反应:H2PO4—+ 2OH—=PO43—+ 2H2OC.碳酸钙跟醋酸反应:CaCO3 + 2CH3COOH=Ca2+ + 2CH3COO—+ H2O + CO2↑D.铜片跟稀硝酸反应:Cu + NO3-+ 4H+=Cu2++ NO↑+ 2H2O4、用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏低的是A.酸式滴定管未用待装溶液润洗B.碱式滴定管未用待装溶液润洗C.锥形瓶未用待装溶液润洗D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失5、下列物质的水溶液能导电,但属于非电解质的是A.CH3CH2COOHB.Cl2C.NH4HCO3D.SO26、将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大C.醋酸电离平衡向左移动 D.溶液的pH增大7、从下列现象可以判断某酸是强酸的是A.加热该酸至沸腾也不分解B.该酸可以与石灰石反应放出CO2C.该酸可以把Al(OH)3沉淀溶解D.该酸浓度为0.1 mol·L-1时的pH为18、常温下某溶液中由水电离产生的[H+]=1×10-5mol·L-1,则下列叙述正确的是A.PH值为5 B.一定是酸溶液C.可能是强酸的酸式盐溶液 D.PH值可能为99、当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是A. AgI比AgCl稳定B. 碘氧化性比氯弱C. I-的还原性比Cl-强D. 溶解度AgI<AgCl10、0.02mol·L-1的HCN溶液与0.02mol·L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是A.[Na+]>[CN-]>[OH-]>[H+] B.[HCN]+[CN-]=0.04 mol·L-1C.[Na+]+[H+]=[CN-]+[OH-] D.[CN-]>[HCN]二.选择题(本题包括10小题,每小题3分,共30分。

第三章 水溶液中的离子平衡 测试题一、选择题1.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH变小、呈酸性 B.水的离了积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性2.下列有关“电离平衡”的叙述中正确的是( )A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动D.电解质达到电离平衡后,各种离子的浓度相等3.下列关系一定正确的是( )A.当溶液中c(H+)>10-7 molL-1时,其pH<7,溶液呈现酸性B.当溶液中c(H+)>10-7 molL-1时,其pH>7,溶液呈现碱性C.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现中性D.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现酸性4.从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR 加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )A.HR应为红色 B.HR应为蓝色 C.R-应为无色 D.R- 应为红色5.在稀氨水溶液中存在如下平衡体系:NH3·H2ONH4++OH-,当增大溶液的pH时,c(NH4+)会( )A.可能增大也可能减小 B.增大 C.减小 D.无变化6.将pH=1的盐酸平均分为2份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高1,则加入的水与NaOH 溶液的体积比为( )A.9 B.10 C.11 D.12 7.有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )A.氨水的电离作用大于氯化铵的水解作用 B.氯化铵的水解作用大于氨水的电离作用C.氨水的存在抑制了氯化铵的水解 D.氯化铵的存在抑制了氨水的电离8.将0.lmol∙L-1醋酸溶液加水稀释,下列说法正确的是( )A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大C.醋酸电离平衡向左移动 D.溶液的pH增大9.室温下,某溶液中由水电离出的c(OH-)=10-5mol·L-1,则其溶质可能是( )A.CH3COOH B.H2SO4 C.NaOH D.Na2CO310.pH=3的醋酸溶液加水冲稀到原溶液体积的3倍,则稀释后的pH为( )A.3.2 B.3.5 C.3.7 D.411.已知,往0.1mol∙L-1的氨水中滴入酚酞试液时,溶液将呈现粉红色。

1. 甲酸的下列性质中,可以证明它是弱电解质的是( )A. 1 mol ·L-1 的甲酸溶液中c(H+)约为1×10-2 mol/LB. 甲酸能与水以任意比例互溶C. 甲酸与盐酸都能与NaOH 发生反应D. 甲酸溶液的导电能力比盐酸溶液的导电能力弱2.硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料,印泥及朱红雕刻漆器等。
某温度时,HgS 在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )A. 向硫化汞的浊液中加入硫化钠溶液,硫化汞的K sp 减小B. 图中a 点对应的是饱和溶液C. 向c 点的溶液中加入Hg(NO3)2 ,则c(S2-)减小D.升高温度可以实现c 点到b 点的转化3.氢氧化钙在80℃时的溶解度为xg ,20℃时的溶解度为yg 。
取20℃的氢氧化钙饱和溶液,蒸发掉Wg 水后再恢复到20℃ ,其溶液里面溶质的质量分数为z% ,则下列关系正确的是( )A.y>x ,y>zB.x>y>zC.y<x ,y<zD.x<y<z4.在-50℃时液氨中存在着下列平衡:2NH3(液) NH4++NH2- ,两种离子的平衡浓度均为 1.0×10-15mol ·L-1 。
以下有关-50℃时离子积的叙述中正确的是( )A.离子积为1.0×10-15B.离子积为1.0×10-30C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大D. 向液氨中加入NH4Cl ,c(NH4+)增大,离子积的数值也随之增大5.在氨水中,NH3 ·H2O 电离达到平衡的标志是( )A.溶液显电中性C.c(OH-)恒定不变B.溶液中检测不出NH3 ·H2O 分子的存在D.c( NH ) =c(OH-)6.对室温下pH 相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )A.加适量的醋酸钠晶体后,两溶液的pH 均增大B.使温度都升高20℃后,两溶液的pH 均不变C.加水稀释2 倍后,两溶液的pH 均减小D.加足量的锌充分反应后,盐酸中产生的氢气速率快7.已知室温时,0. 1mo1/L 某一元酸HA 在水中有0.1%发生电离,下列叙述错误的是:( )A.该溶液的pH=4B.升高温度,溶液的pH 增大C.此酸的电离平衡常数约为1×10-7D. 由HA 电离出的c(H+)约为水电离出的c(H+)的106 倍8.下列物质的水溶液能导电,但其本身属于非电解质的是( )A.CH3COOHB.干冰C.酒精D.Cl29.已知CaCO3 的Ksp=2.8×10-9 ,现将浓度为2×10-4 mol •L- 1 的Na2CO3 溶液与CaCl2 溶液等体积混合,若要产生沉淀,则所用CaCl2 溶液的浓度至少应为( )A.2.8×10-2 mol •L- 1B. 1.4×10-5 mol •L- 1C.2.8×10-5 mol •L- 1D.5.6×10-5 mol •L- 110.下列事实能说明亚硝酸是弱电解质的是( )①25℃时亚硝酸钠溶液的pH 大于7 ②用HNO2 溶液做导电试验,灯泡很暗③HNO2溶液不与Na2SO4 溶液反应④0. 1mol ·L- 1HNO2 溶液的pH=2A.①②③B.②③④C.①④D.①②④11.关于浓度均为0. 1mol ·L- 1 的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )A.c(NH4+) :③>①B.水电离出的c(H+) :②>①C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3 ·H2O)D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH- >c(H+)12.25 ℃时,水电离出的H+浓度是5×10-13mol ·L-1 的硫酸溶液中,硫酸溶液的浓度为( )A.0.01mol ·L-1B.0.02 mol ·L-1C. 1×10-7mol ·L-1D. 1×10-12mol ·L-113.下列各式中属于正确的水解方程式的是( )A.NH4++H2O NH3 ·H2O+H+B.S2-+2H2O H2S+2OH-C.CH3COOH+H2O CH3COO-+H3O+D.CH3COOH+OH-===CH3COO-+H2O14.室温下,用0. 100 mol ·L- 1NaOH 溶液分别滴定20.00 mL 0. 100 mol ·L- 1 的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )A. Ⅰ表示的是滴定盐酸的曲线B.pH=7 时,滴定醋酸消耗的V(NaOH)小于20mLC.V(NaOH)=20mL 时,两份溶液中c(Cl-)=c(CH3COO-)D.V(NaOH)=10mL 时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)15.25℃时,将某强酸和某强碱溶液按1 ∶ 10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH 和为( )A. 12B. 13C. 14D. 1516.某温度(T℃)时,水的离子积为K w=1×10-13 。

第三章《水溶液中的离子反应与平衡》测试题一、单选题(共12题)1.下列实验能达到预期目的的是选项实验内容实验目的A向溶液X 中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色证明溶液X 中含有23SO -或3HSO -B室温下,向135mL0.1mol L AgNO -⋅溶液中加入几滴10.1mol L NaCl -⋅溶液出现白色沉淀,再滴加几滴10.1mol L aI N -⋅溶液,出现黄色沉淀证明相同温度下:()()sp sp K AgCl >K AgI C常温下,测得相同浓度溶液的pH :NaA NaB>证明常温下的水解程度:A B -->D将2FeCl 溶液滴入酸性4KMnO 溶液中,紫红色褪去证明2Fe +有还原性A .AB .BC .CD .D2.下列实验中,由实验现象不能..得到正确结论的是选项实验现象结论A向1.0mol·L -1的NaHCO 3溶液中滴加2滴甲基橙溶液呈黄色NaHCO 3溶液呈碱性B 在醋酸钠溶液中滴入酚酞溶液并加热加热后红色加深证明盐类水解是吸热反应C将FeCl 3溶液加入Mg(OH)2悬浊液中,振荡沉淀由白色变为红褐色Fe(OH)3的溶解度小于Mg(OH)2的溶解度D相同的铝片分别与同温同体积,且c(H +)=1mol·L -1的盐酸、硫酸反应铝与盐酸反应产生气泡可能是Cl -对该反应起到促进作用较快A .AB .BC .CD .D3.有一支50mL 酸式滴定管中盛盐酸,液面恰好在amL 刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是A .a mLB .(50-a)mLC .大于(50-a)mLD .大于a mL4.已知甘氨酸在水中存在三种微粒,它们的转化关系如下:pI 为该溶液中-COO -和+3H N -数目相等时的pH ,K 1和K 2分别表示-COOH 和+3H N -的解离常数,K 1=10-2.4,K 2=10-9.4。

高三第一轮复习《溶液中的离子平衡》单元测试姓名学号相对原子质量:H-1 O-16 Na-23 Mg-24 Al-27 S-32 Fe-56 Cu-64一、选择题(共42分)1、以N A表示阿伏加德罗常数,下列说法不正确的是()A.0.1mol/L1L的NH4Cl溶液中,含有NH4+数小于0.1N AB.0.1mol/L1L的Na2CO3溶液中,含有阴离子数小于0.1N AC.0.1mol/L1L的CH3COOH溶液中,含有分子数大于0.1N AD.0.1mol/L1L的H2S溶液中,含有H+数小于0.1N A2、CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH=4.7,下列说法错误的是()A. CH3COOH电离作用大于CH3COONa的水解作用B. CH3COONa的水解作用大于CH3COOH电离作用C. CH3COOH的存在抑制了CH3COONa的水解D. CH3COONa的存在抑制了CH3COOH电离3、25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是()A.a=b B.a>b C.c (A-)= c(Na+)D.c (A-)< c(Na+)4、下列离子方程式正确的是()A.将氢氧化镁固体加入到氯化铁溶液中:3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+B.用氢氧化钠溶液滴定醋酸溶液:H++OH-===H2OC.向硫酸钙悬浊液中加入碳酸钠溶液:Ca2++CO32-===CaCO3↓D.向氯化铁溶液中加入碘化钾溶液:Fe3++2I-===I2+Fe2+5、已知:H2CO3H++HCO3-··········K A1HCO3-H++CO32-··········K a2H2O H++OH-·········K WCO32-+H2O HCO3-+OH-········K h1HCO3-+H2O H2CO3+OH-········K h2则K A1、K A2、K W、K h1、K h2的相互关系正确是()A.K h1= K W-K a2 B. K h2= K W-K a1C. K h1= K wKa1. D. K h2 =K wKa16、将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。

第三章水溶液中的离子平衡单元测试姓名成绩一、选择题(每小题只有一个选项符合题意)1. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为()A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-12.对H2O的电离平衡不产生影响的粒子是()3. 在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是()A. H+的物质的量B. 醋酸的电离常数C. 中和时所需NaOH的量D. CH3COOH的物质的量4. 0.1 mol•L-1 KHS溶液中下列表达式不正确的是()A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)C.c(HS-)+ c(S2-)+ c(H2S)= 0.1 mol•L-1D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)5. 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。
则下列描述正确的是()A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和6. 在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是A.c (Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH-)C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)7. 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:(1) CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑次要:Cu2+ + CO32─ = CuCO3↓(2) CuSO4 +Na2S 主要:Cu2+ + S2─ = CuS↓次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑则下列几种物质的溶解度大小的比较中,正确的是 ( )A. CuS <Cu(OH)2<CuCO3B. CuS >Cu(OH)2>CuCO3C. Cu(OH)2>CuCO3>CuSD. Cu(OH)2<CuCO3<CuS8. 把足量熟石灰放入蒸馏水中,一段时间后达到平衡:C a(O H)2(s) C a2+(a q)+2O H-(a q),下列叙述正确的是()A. 给溶液加热,溶液的pH升高B. 恒温下向溶液中加入CaO,溶液的pH升高C. 向溶液中加入NaCO3溶液,则其中的C a(O H)2的固体增多D. 向溶液中加入少量的NaOH固体,则其中的C a(O H)2的固体增多9. 在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有()A. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+D. 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+10. 某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是()A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性B. 溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)C. 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)D. 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)11. 下列操作中,能使电离平衡H 2O H ++OH -,向右移动且溶液呈酸性的是( )A .向水中加入NaHSO 4溶液B .向水中加入Al 2(SO 4)3固体C .向水中加入Na 2CO 3溶液D .将水加热到100℃,使pH =612. 下列叙述正确的是( )A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO 42-)>c(NH 4+)B. 两种醋酸溶液的物质的量浓度分别为c 1和c 2,pH 分别为a 和a+1,则c 1=10c 2C. pH=11的NaOH 溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D. 向0.1 mol/L 的氨水中加入少量硫酸铵固体,则溶液中增大13.(1)对于Ag 2S(s) 2Ag +(aq)+ S 2-(aq),其K sp =____________。

第三章《水溶液中的离子平衡》测试题一、单选题1.某二元酸(化学式用H 2A 表示)在水中的电离方程式为:H 2A====H ++HA - HA -H ++A 2- 在0.1mol·L -1Na 2A 溶液中存在的粒子,其浓度关系正确的是( )A .c (Na +)+ c (H +)= c (OH -)+ c (HA -)+ c (A 2-)B .c (Na +)+ c (OH -)= c (H +)+ c (HA -)C .c (Na +)="2" c (A 2-)+2 c (HA -)+2 c (H 2A )D .c (A 2-) + c (HA -)="0.1" mol·L -12.室温时,将浓度和体积分别为C 1、V 1的NaOH 溶液和C 2、V 2的CH 3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是( )A .若pH >7,则一定是C 1V 1=C 2V 2B .在任何情况下都是C(Na +)+C(H +)=C(CH 3COO -)+C(OH -)C .当pH=7时,若V 1=V 2,一定是C 2>C 1D .若V 1=V 2,C 1=C 2,则C(CH 3COO -)+C(CH 3COOH)=C(Na +)3.下列各离子方程式属于水解反应,且可使溶液呈酸性的是A .HS -+H 2OH 3O ++S 2-B .NH 4++2H 2O NH 3·H 2O +H 3O +C .HCO 3-+OH - CO 32-+ H 2OD .CO 32- + 2H 2OH 2CO 3 + 2OH - 4.某温度下,关于①0.01mol·L -1醋酸溶液,①pH=2醋酸溶液,下列说法正确的是( ) A .c(CH 3COOH):①>① B .c(CH 3COO -):①>①C .c(CH 3COOH)+c(CH 3COO -):①=①D .c(CH 3COO -)+c(OH -):①<①5.利用如图所示装置进行下列实验,能得出相应实验结论的是实验 试剂甲试剂乙 试剂丙 实验结论A浓硝酸铜片 淀粉—KI 溶液 氧化性:NO 2>I 2 B稀硫酸FeS 含AgNO 3的AgCl 浊液 Ksp(AgCl)>Ksp(Ag 2S) C浓氨水 CaO 紫色石蕊溶液 氨水呈碱性D稀盐酸石灰石 BaCl 2溶液 丙中生成BaCO 3沉淀 A .A B .B C .C D .D6.对于溶液的酸碱性说法正确的是( )A .含OH -的溶液一定呈碱性B .pH 小于7的溶液一定呈酸性C .c(H +)=c(OH -)的溶液一定呈中性D .pH =14的溶液碱性最强7.下表四组实验中“操作及现象”与“溶液”对应关系错误的是选项溶液 操作及现象 ABaCl 2溶液 通入SO 2,无明显现象。

高中化学选修4第三章<<水溶液中的离子平衡>>单元测试题可能用到的元素的相对原子质量: H—1 C—12 O—16 Na—23 Cl—一、选择题?每小题3分,共60分。
每小题只有一个选项符合题意 ?....1.下列反应中,属于水解反应且使溶液显酸性的是()A.NH 4 + H 2O NH 3·H 2O + H C.S + H 2O HS + OH 2--++B.HCO 3-+ H 2O CO 3 + H 3O +-2-+-D.NH 3 +H 2O NH 4 +OH 2.下列实验符合要求的是 ( )A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定B.用托盘天平称取NaOH 固体时需先在左右两盘中各放上大小相同的纸片C.若25 mL 滴定管中液面的位置在刻度为10mL 处,则滴定管中液体的体积一定大15 mL D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH 试纸上测得其pH 为123.常温下,下列溶液中可能大量共存的离子组是()..A.加入金属镁能产生大量H 2的溶液中:Na 、NH 4、F 、SO 3B.含有大量S 的溶液中:K 、Mg 、ClO 、SO 43+++2-+2+-2-++-2--C.能使Al 生成沉淀的溶液中:NH 4、Na 、SiO 3、HCO 3D.水电离产生的c (OH )=1×10--102-mol/L 的溶液中:Al 、SO 4、NO 3、Cl 3+2---4.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液是 ( )A.pH=12的Ba(OH)2溶液B.pH=12的氨水-1-1C.·L NaOH 溶液D.·L BaCl 2溶液5.下列说法正确的是()A.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低B.中和pH 与体积均相同的盐酸和醋酸溶液,消耗NaOH 的物质的量相同C.已知pOH=-lg[c (OH )],又知体温下正常人的血液pH=,则血液的pOH 为D.KCN 溶液中有剧毒HCN 挥发出来,为了减少HCN 的生成,最佳方法是加入KOH6.某温度下,100mL mol/L 醋酸溶液与足量Zn 粒反应生成H 2的速率v (H 2)=mol/(L·min)。
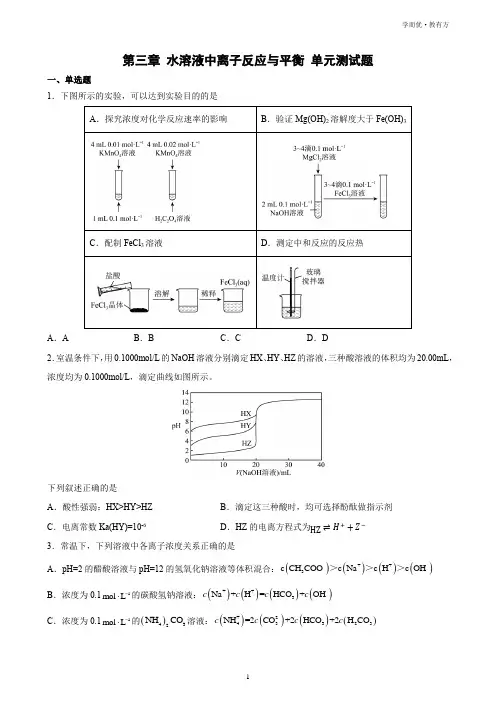
第三章 水溶液中离子反应与平衡 单元测试题一、单选题1.下图所示的实验,可以达到实验目的的是A .AB .BC .CD .D2.室温条件下,用0.1000mol/L 的NaOH 溶液分别滴定HX 、HY 、HZ 的溶液,三种酸溶液的体积均为20.00mL ,浓度均为0.1000mol/L ,滴定曲线如图所示。
下列叙述正确的是A .酸性强弱:HX>HY>HZB .滴定这三种酸时,均可选择酚酞做指示剂C .电离常数Ka(HY)=10-6D .HZ 的电离方程式为HZ ⇌H ++Z −3.常温下,下列溶液中各离子浓度关系正确的是A .pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:()()()()-++-3c CH COO c Na c H c OH >>>B .浓度为0.11mol L -⋅的碳酸氢钠溶液:()()()()++--3Na+H =HCO +OH c c c cC .浓度为0.11mol L -⋅的()432NH CO 溶液:()()()()+2--43323NH =2CO +2HCO +2H CO c c c cD .浓度均为0.11mol L -⋅的醋酸溶液与NaOH 溶液混合后:()()()-+3c OH =c H +c CH COOH4.工业上以2SO 和纯碱为原料制备无水3NaHSO 的主要流程如图,已知:23H CO 的电离平衡常数分别为-7-11a1a2K =4.510K =4.710⨯⨯、,23H SO 的电离平衡常数分别为-a12-8a2K =1.410K =6.010⨯⨯、。
下列说法不.正确的是A .吸收后的溶液中:()()-2-33c HSO >c SOB .中和后溶液中主要溶质为3NaHSO 和3NaHCOC .纯碱溶液中:()()()()-+-323c OH =c H +c HCO +2c H COD .气流干燥湿料时温度不宜过高5.硫元素的很多化合物用途广泛。

《第三章 水溶液中的离子均衡》 单元测试题满分: 100 分时间 90 分钟1.以下电离方程式书写正确的选项是 ( )A . H 2S2H++ S 2-B . H 2S + H 2 OH 3O ++ HS-+-++ClO -C . NH 3+ H 2O===NH 4 + OHD . HClO===H2.等体积等物质的量浓度 MOH 强碱和 HA 弱酸溶液混淆后,混淆液中有关离子浓度应满 足的关系是 ()A . c(M +)> c(OH -) > c(A -)> c(H +)B . c(M +)> c(A -)> c(H +)> c(OH -)+--)> c(H +++--C . c(M )> c(A )> c(OH )D . c(M )>c(H )> c(A )> c(OH ) 3.向盛有3 溶液的试管中滴加2S 溶液至积淀完整,再向上层清液中滴加足量 NaCl ,产生的现象及发生的反响是 ( ) A .黑色积淀完整转变成白色积淀 B .既有 Ag S 也有 AgCl2C .不可以由黑色积淀转变成白色积淀D .只有 AgCl 白色积淀- 1 的盐酸滴定 0.10mol ·L - 1的氨水,滴定过程中不行能 出现的结果是 () 4.用 0.1mol ·L- - ++ ... - + A . c(NH +)B . c(NH -4 )>c(Cl ), c(OH )>c(H4 )= c(Cl ), c(OH)= c(H )-+-+)D . c(Cl -++-C . c(Cl )>c(NH 4 ), c(OH )>c(H)>c(NH 4 ), c(H )>c(OH)5.25℃,向纯水中加入 NaOH ,使溶液的 pH 为 11,则该溶液中由NaOH-电离出的 c(OH )与由水电离出的 -)c(OH )之比为 (A . 1010∶ 1B . 5× 109∶ 1C . 108∶1D . 1∶ 16. 25℃时, BaCl 2溶液呈中性,溶液中存在均衡: 2+-; H > 0,以下表达正H OH + OH 确的是A. 向溶液中加入稀氨水,均衡逆向挪动, c(OH ―) 降低, K w 不变B. 向溶液中加入少许固体4+wCuSO , c(H )增大, K 不变C. 向溶液中加入少许固体 CH 3COONa ,均衡逆向挪动, c (H +) 降低 , K w 不变D. 将溶液加热到 90℃, K w 增大,溶液仍呈中性, pH 不变 7.以下各组离子必定能大批共存的是3+ ++ --A .在含大批 Fe 的溶液中: NH 4 、 Na 、 Cl 、 SCN++-2-B .在强碱溶液中: Na 、 K 、 AlO 2 、 CO 3+— 13+3+2--C .在 c(H)=10mol/L 的溶液中: NH 、Al 、CO、 NO43 3D .在 pH=1 的溶液中: +2+--K 、 Fe 、 Cl 、 NO 38.室温下,物质的量浓度同样的三种盐 NaX 、 NaY 、 NaZ 溶液,其 pH 挨次为 7、 8、 9。

水溶液中的离子平衡一、单选题(每小题只有一个正确答案)1.常温下,pH=8的NaOH溶液与pH=10的KOH溶液等体积混合,溶液的c(H+)为()A.(10-8+10-10)/2 mol/L B.(10-8+10-10)mol/LC.(10-14-5×10-5)mol/L D.2×10-10 mol/L2.下列实际问题,不涉及到盐类水解原理的是()A.草木灰不宜与铵盐氮肥混合施用 B.用醋酸清洗保温瓶里的水垢C.配置FeCl3溶液时加入适量的盐酸 D.用热的纯碱溶液洗涤油污效果较好3.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流强度I随氨水的加入体积V的变化曲线图是图是()A. B. C. D.4.下表是常温下某些一元弱酸的电离常数,则0.1 mol·L-1的下列溶液中,pH最小的是( )A. HCN B. HF C. CH3COOH D. HNO25.下列说法不正确的是( )A.在25℃时,将c mol•L-1的醋酸溶液与0.02mol•L-1 NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数K a=B.0.1mol•L-1醋酸溶液中:c(H+)2=c(H+)•c(CH3COO-)+K WC.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如上图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后6.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中,离子浓度关系正确的是()A. c(Na+)>c(A-)>c(H+)>c(OH-) B. c(Na+)>c(OH-)>c(A-)>c(H+)C. c(Na+)+c(H+)=c(A-)+c(OH-) D. c(Na+)+c(OH-)=c(A-)+c(H+)7.对滴有酚酞试液的下列溶液,操作后颜色变深的是()A.明矾溶液加热 B.小苏打溶液中加入少量NaCl固体C.氨水中加入少量NH4Cl固体 D.CH3COONa溶液加热8.已知25℃时,0.2mol/L某酸HA 与0.1mol/LNaOH等体积混合,溶液pH>7;含等物质的量的盐NaB和酸HB混合液pH<7。
高中化学:《水溶液中的离子平衡》测试卷(含答案)一、单选题(共15小题)1.25 □时,水的电离达到平衡:氏0一+ AH>0,下列叙述正确的是()A.向水中加入稀氨水,平衡逆向移动,c(OH )降低B.向水中加入少量固体硫酸氢钠,c(Hj增尢心不变C.向水中加入少量CH3COOH,平衡逆向移动,c(H J降低D.向水中加入少量固体醋酸钠,水的电离程度增大,心增大2 .下列说法中错误的是()A.在N^S溶液中滴入酚駄试液,呈红色B.硫酸鞍溶液显酸性C.一切钾盐、钠盐、硝酸盐都不发生水解D.醋酸盐洛于水能发主水解3.图中未标记元素符号的代表C原子,该图表示此物质发生了()A.中和反应B.水解反应C.电离反应D.取代反应4.在一定条件下,Na2CO3溶液存在水解平衡:CO舟-+H20^^HCO? + OH「.下列说法正确的是()A.稀释溶液,水解平衡向逆反应方向移动,水解程度减小B.通入CO2,平衡向正反应方向移动C.升高温度,c(HCO?)/c(CO訂)减小D.加入NaOH固体,溶液pH减小5.下列应用与盐类的水解无关的是()A.已知时+在水中强烈水解,加热TiCb溶液得不到原溶质B.FeCb饱和溶液滴入沸水中制Fe(OH)3胶体C.配制氯化亚铁溶液时需加少量铁粉D.将氯化铝洛液加热蒸干并灼烧,最后得到的固体是氧化铝6•下列事实可证明NH3-H2O是弱碱的是()A.氨水能跟氯化亚铁洛液反应生成氢氧化亚铁B.鞍盐受热易分解C.0.1 molL-1氨水可以使酚猷;溶液变红D.0.1mol L-i氯化鞍溶液的pH约为57.25 □时,某酸性溶液中只含NH[、CT、H\ OH_四种离子,下列说法不正确的是()A.可能由pH = 2的盐酸与pH=12的氨水等体积混合而成B.该溶液可能山等物质的量浓度的盐酸和氨水等体积混合而成C.加入适量氨水,溶液中离子浓度可能为c(NH:)>c(Cr)>c(OH-)>c(H t)D.该溶液中c(NH:)=c(CT)+c(OH )—c(H+)8.室温下,往0.1 mol L-i的氨水中滴入酚酥溶液时,溶液将呈现粉红色.现釆取下列措施,滴有酚酥的氨水溶液颜色不会变浅的是()A.往溶液中滴入稀硫酸B.往溶液中加入NH4C1晶体C.把溶液加热至沸腾D.往溶液中加入NaOH固体9•已知室温时,CH3COOH的电离常数为1.75X10-5?NH3H2O的电离常数为1.75X10P0.1 mol-L_1的下列溶液:EiCHsCOONa、匚NH4CI、OCH3COONH4> 匚(NH4)2SO4,pH 由小到大排列正确的是( )A.□<□<□<□B.二 v二 v二 v二C.二 v二 v二 v二D.□<□<□<□ 10 •下列说法正确的是()A.用图示仪器□准确量取25.00 mL酸性KMnO4溶液B.装置:j可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验C.中和滴定时,滴定管用所盛装的待装液润洗2〜3次D.中和滴定实验时,用待测液润洗锥形瓶11 •在中和滴定实验中用到的仪器,只需用蒸镭水洗净,不能用待盛放液体润洗的是()A.酸式滴定管B.碱式滴定管C.移液管D.锥形瓶12•已知HA为酸性略强于酷酸的一元弱酸,则在0.1 mol L-iNaA^液中,离子浓度关系正确的是()A.c(Na+) >c(A-)> c(H+)>c(OH_)B.c(NaJ+c(H+) =c(A_)+c(OH )C.c(Na+)+c(OH )=c(Aj+c(H+)D.c(Na+)>c(OH )>c(A「)>c(H+)13.今有室温下四种溶液,下列有关叙述不正确的是()A.□和□中分别加入适量的酷酸钠晶体后,两溶液的pH均增大B.:j和丁两溶液等体积混合,所得溶液中c(H+)>c(OH )C.分别加水稀释10倍,四种溶液的pH:□>□>□>□D.内L □与V2L□溶液混合后,若混合后溶液pH=7,则14.在溶液中有浓度均为0.01 mol L-i的Fe3 \ C"、Zn2\ Mg2+等离子,已知:^sp[Fe(OH)3] =2.6x10-39; K sp[Cr(OH)3]=7.0x 10-31; K sp[Zn(OH)2] = 1.0xlO~17; /C sp[Mg(OH)2] = 1.8x10-11.当氢氧化物开始沉淀时,下列离子中所需pH最小的是()A.Fe3+B.Cr3+C.Zn2+D.Mg?+15.常温下,0.1 mol-L^NazS溶液中存在着水解平衡:$2一+曰20一=笳一+011 .下列说法正确的是()A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大B.通入NH3,平衡正向移动C.滴加少量AgNOs溶液,平衡逆向移动D.升高温度,c(HS_)/c(S2—)减小二、实验题(共3小题)16.KM II O4溶液常用作氧化还原反应滴定的标准液,山于KM II O4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将洛液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnCU溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在70〜80匚条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度•请回答下列问题:(1) _______________________________________________________________________ 将溶液加热并保持微沸]h的目的是______________________________________________________ .⑵如何保证在70〜80 口条件下进行滴定操作: ________________________________________ .(3)准确量取一定体积的KMnO4溶液用 ______________________________________________(填仪器名称).(4)在下列物质中,用于标定KM II O4溶液的基准试剂最好选用________ (填序号).A. H2C2O4 2H2OB. FeSO4C.浓盐酸D. Na2SO3(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高镭酸钾溶液滴定至终点,消耗高猛酸钾溶液UmL:□滴定终点标志是 __________________________________________________________ ;□所配制KMnCU标准溶液的物质的量浓度为 ________ mol L-1:(6)若用放置两周的KMnCU标准溶液去滴定水样中FX十含量,测得的浓度值将___________ (填“偏高诫“偏低”).17 .利用其它反应测定未知溶液浓度实验同中和滴定实验类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)•现有0.01 rnol-L^1酸性KMnCU溶液和未知浓度的无色Na2SO3溶液仮应的离子方程式为2MnO[ + 5SO旷+ 6H+=2Mn2+ + 5so尹+3吐0,回答下列问题(已知Na2SO3溶液呈碱性).(1)该滴定实验所需仪器有下列中的_________ (填序号).A.酸式滴定管(50 mL)B.碱式滴定管(50 inL)C.量筒(10 niL)D.锥形瓶E.铁架台F.滴定管夹G.烧杯H.白纸I.胶头滴管J.漏斗⑵不用 _________ (填“酸”或'碱。
水溶液中的离子平衡【习题】1.对常温下pH=3的CH3COOH溶液,下列叙述不.正确..的是A.c(H+)=c(CH3COO-)+c(OH-)B.加入少量CH3COONa固体后,c(CH3COO-)降低C.该溶液中由H2O电离出的c(H+)是1.0×10-11 mol/LD.与等体积pH=11的NaOH溶液混合后所得溶液显酸性2.欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是A.通入二氧化碳气体B.加入氢氧化钠固体C.通入氯化氢气体D.加入饱和石灰水溶液3.人体血液中存在平衡:CO2+H2O H2CO3HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。
已知pH随c(HCO3-)︰c(H2CO3)变化关系如下表所示,则下列说法中不正确的是A.pH=7的血液中,c(HCO3-)>c(H2CO3)B.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒C.常温下将pH=7.40的血液稀释至pH=7时,c(H+)·c(OH-)一定不变D.c(HCO3-)︰c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度4.已知氯水中存在反应:Cl2+H2O H++Cl-+HClO,取5 mL饱和氯水进行如下实验。
下列说法中,正确的是A.加5 mL水,c (H+)增大B.加少量NaCl固体,c (H+)不变C.加少量碳酸钙粉末,c(HClO)升高D.加少量Na2SO3固体,溶液pH升高5.实验:①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
《第三章水溶液中的离子平衡》单元测试题满分:100分时间90分钟1.下列电离方程式书写正确的是()+-+-2B.HS+HOHO+HSA.HS2H+S 3222+-+-C.NH+HO===NH+OH D.HClO===H+ClO 4322.等体积等物质的量浓度MOH强碱和HA弱酸溶液混合后,混合液中有关离子浓度应满足的关系是()+--++-+-A.c(M)>c(OH)>c(A)>c(H) B.c(M)>c(A)>c(H)>c(OH)+--+++--C.c(M)>c(A)>c(OH)>c(H) D.c(M)>c(H)>c(A)>c(OH)3.向盛有0.1mol/LAgNO溶液的试管中滴加0.05mol/LNaS溶液至沉淀完全,再向上层清23液中滴加足量NaCl,产生的现象及发生的反应是()A.黑色沉淀完全转化为白色沉淀 B.既有AgS也有AgCl 2C.不能由黑色沉淀转变为白色沉淀 D.只有AgCl白色沉淀--11的氨水,滴定过程中不可能出现的结果是(L4.用0.1mol·) 的盐酸滴定0.10mol·L...+--++--+A.c(NH)>c(Cl),c(OH)>c(H) B.c(NH)=c(Cl),c(OH)=c(H)44-+-+-++-C.c(Cl)>c(NH),c(OH)>c(H) D.c(Cl)>c(NH),c(H)>c(OH)44-5.25℃,向纯水中加入NaOH,使溶液的pH为11,则该溶液中由NaOH电离出的c(OH)-与由水电离出的c(OH)之比为()1098∶1 D C.10.1∶105∶1 B.×101∶1 A.+-6. 25℃时,BaCl溶液呈中性,溶液中存在平衡:HOH+OH;ΔH>0,下列叙述正22确的是―A.向溶液中加入稀氨水,平衡逆向移动,c(OH)降低,K不变w+c(H)增大,,K不变 B.向溶液中加入少量固体CuSO w4+c(H)降低,K不变C.向溶液中加入少量固体CHCOONa,平衡逆向移动,w3D.将溶液加热到90℃,K增大,溶液仍呈中性,pH不变w7.下列各组离子一定能大量共存的是+3++--A.在含大量Fe的溶液中:NH、Na、Cl、SCN4++-2-B.在强碱溶液中:Na、K、AlO、CO32+—13+3+2--C.在c(H)=10mol/L的溶液中:NH、Al、CO、NO343+2+--D.在pH=1的溶液中:K、Fe、Cl、NO 38.室温下,物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。
《第三章水溶液中的离子平衡》单元测试题满分:100分时间90分钟1.下列电离方程式书写正确的是()A.H2S2H++S2-B.H2S+H2O H3O++HS-C.NH3+H2O===NH+4+OH-D.HClO===H++ClO-2.等体积等物质的量浓度MOH强碱和HA弱酸溶液混合后,混合液中有关离子浓度应满足的关系是()A.c(M+)>c(OH-)>c(A-)>c(H+) B.c(M+)>c(A-)>c(H+)>c(OH-)C.c(M+)>c(A-)>c(OH-)>c(H+) D.c(M+)>c(H+)>c(A-)>c(OH-)3.向盛有0.1mol/LAgNO3溶液的试管中滴加0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量NaCl,产生的现象及发生的反应是()A.黑色沉淀完全转化为白色沉淀B.既有Ag2S也有AgClC.不能由黑色沉淀转变为白色沉淀D.只有AgCl白色沉淀4.用0.1mol·L-1的盐酸滴定0.10mol·L-1的氨水,滴定过程中不可能...出现的结果是() A.c(NH+4)>c(Cl-),c(OH-)>c(H+) B.c(NH+4)=c(Cl-),c(OH-)=c(H+)C.c(Cl-)>c(NH+4),c(OH-)>c(H+) D.c(Cl-)>c(NH+4),c(H+)>c(OH-) 5.25℃,向纯水中加入NaOH,使溶液的pH为11,则该溶液中由NaOH电离出的c(OH-)与由水电离出的c(OH-)之比为()A.1010∶1 B.5×109∶1 C.108∶1 D.1∶16. 25℃时,BaCl2溶液呈中性,溶液中存在平衡:H2O H++OH-;ΔH>0,下列叙述正确的是A.向溶液中加入稀氨水,平衡逆向移动,c(OH―)降低,K w不变B.向溶液中加入少量固体CuSO4,c (H+)增大,K w不变C.向溶液中加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,K w不变D.将溶液加热到90℃,K w增大,溶液仍呈中性,pH不变7.下列各组离子一定能大量共存的是A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-B.在强碱溶液中:Na+、K+、AlO2-、CO32-C.在c(H+)=10—13mol/L的溶液中:NH4+、Al3+、CO32-、NO3-D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-8.室温下,物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。
下列有关说法正确的是A.HX、HY、HZ三种酸的强弱顺序为:HZ>HY>HXB.HX是强酸,HY、HZ是弱酸,且酸HY强于酸HZC.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X-D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)9.下列关于盐酸与醋酸两种稀溶液的说法正确的是()A.相同浓度的两溶液中c(H+)相同B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液稀释100倍,pH都为5D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小10.常温下,以下4种溶液pH最小的是()A.0.01mol/L醋酸溶液B.0.02mol/L醋酸与0.02mol/L NaOH溶液等体积混合液C.0.03mol/L醋酸与0.01mol/L NaOH溶液等体积混合液D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液11.25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是()A.弱碱B.一元强碱C.多元强碱D.任何强碱12.浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是①NaHCO3溶液②NaHSO4溶液③NaCl溶液④AlCl3溶液⑤NaClO溶液A.①< ②< ③< ④< ⑤B.④< ②< ①< ③< ⑤C.②< ④< ③< ①< ⑤D.②< ④< ①< ③< ⑤13.为了配制NH+4的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入①适量NH4NO3;②适量NaCl;③适量氨水;④适量NaOHA.①② B.②③ C.①③ D.②④14.要求设计实验证明:某种盐的水解是吸热。
有四位同学作了如下回答,其中不正确的是A.甲:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的B.乙:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含有Fe3+的盐的水解是吸热的C.丙:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好D.丁:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的15.下列说法正确的是A.中和pH与体积都相同的硫酸和硝酸,消耗NaOH的物质的量之比是2:1B.常温下,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中c (NH4+)与c (SO42-)之比为2:1C.相同温度下,1mol·L-1氨水与0.5 mol·L-1氨水中c (OH-)之比是2:1D.相同温度下,物质的量浓度相同的Ba(OH)2溶液和氨水c (OH-)之比是2:116.下列溶液蒸干后,能析出溶质固体的是( )①FeCl3 ②Fe2(SO4)3③Ca(HCO3)2 ④Na2CO3A.仅①④ B.仅②④ C.仅①② D.全部17.要除去MCl2溶液中的Cu2+, Pb2+, Cd2+等金属离子,可以通过添加过量难溶电解质MnS,使这些金属离子形成硫化物沉淀而除去。
可推知MnS具有的相关性质是()A.具有吸附性 B.溶解度与CuS, PbS, CdS相同C.溶解度小于CuS, PbS, CdS D.溶解度大于CuS, PbS, CdS18. 常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为()A.V(酸)=102V(碱) B.V(碱)=102V(酸)C.V(酸)=2V(碱) D.V(碱)=2V(酸)19. (2010上海卷)下列溶液中微粒浓度关系一定正确的是A.氨水与氯化铵的pH=7的混合溶液中:c ( Cl-)> c ( NH4+)B.pH=2的一元酸和pH=12的一元强碱等体积混合:c ( OH-)= c ( H+)C.0.1 mol·L-1的硫酸铵溶液中:c ( NH4+)> c ( SO42-)> c ( H+)D.0.1 mol·L-1的硫化钠溶液中:c ( OH-)= c ( H+)+ c ( HS-)+ c ( H2S)20.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是A.Ca(OH)2的溶解度、溶剂的质量B.溶液中溶质的质量分数C.溶液的质量、水的电离平衡D.溶液中Ca2+的数目二、填空题(共40分)21.(16分)(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):;(2)氯化铝水溶液呈性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________ _____ __ ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。
下列是关于MgCl2·6H2O的综合应用:Mg(OH)2 MgO(耐火材料)MgCl2·6H2OMgCl2 Mg请回答下列问题:①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) Mg2++2OH-。
向体系中加入(请填出两种不同类别的物质)有利于Mg(OH)2溶解。
22.(6分)有下列实验事实:① 0.1 mol · L-1的NaA溶液呈碱性;②将0.1 mol · L-1 HA溶液加水稀释100倍,pH变化小于2;③ HA溶液和Na2CO3溶液反应能产生CO2;④ 同体积同浓度的盐酸和HA溶液分别与相同的锌粒反应,盐酸反应快。
(1)上述事实中能证明某酸HA为弱电解质的是(2)为证明HA是弱酸,某同学提出方案:用pH试纸测出0.l mol·L-1的HA溶液的pH,即可证明HA是弱酸。
该同学方案中,说明HA是弱电解质的理由是:测得溶液的pH 1(选填>、<、=)(3)若HA、HB均为弱酸,请你设计实验方案,证明二者酸性的强弱:23.(10分)某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液,(1)该学生指示剂和装标准液的仪器选用正确的一组是。
(写编号)(2)该同学滴定操作的正确顺序是(用序号填写):()→( ) → d →( )→( ) →( ) →f。
a.用酸式滴定管取盐酸溶液25 .00mL,注入锥形瓶中,加入指示剂。
b.用蒸馏水洗干净滴定管。
c.用待测定的溶液润洗酸式滴定管。
d.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
(3)若采用(1)选择进行实验,滴定终点为。
(4)已知滴定管中装有浓度为0.1000mol/L的氢氧化钠。
逐滴加入到装有盐酸溶液的锥形瓶中。
开始时读数及恰好反应时氢氧化钠溶液的读数见下表。
实验编号待测盐酸溶液体积(mL)滴定开始读数(mL)滴定结束读数(mL)①25.00 0.00 20.00②25.00 1.10 21.30③25.00 0.20 20.00请计算待测的盐酸的物质的量浓度。
(5)下面操作会导致待测盐酸的浓度偏大的是(写编号)a. 其它操作均正确,滴定终点读数时,仰视滴定管的刻度b. 盛装待测液的锥形瓶用水洗后未用所装待测液润洗c. 盛装待测液的酸式滴定管未用待测液润洗d. 盛装标准液的碱式滴定管未用标准液洗24.(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。