实验5 金黄色葡萄球菌的检验
- 格式:docx
- 大小:88.89 KB
- 文档页数:4

猪金黄色葡萄球菌的分离培养和药敏试验龚岳【期刊名称】《养猪》【年(卷),期】2017(000)006【总页数】3页(P108-110)【作者】龚岳【作者单位】滨海新区塘沽动物卫生监督所,天津滨海新区 300454【正文语种】中文【中图分类】S858.282.61金黄色葡萄球菌(Staphylococcus aureus)为革兰氏阳性球形细菌,显微镜下排列成葡萄串状,无芽孢、鞭毛,大多数无荚膜,是常见的引起食物中毒的致病菌,常见于皮肤表面及上呼吸道黏膜。
金黄色葡萄球菌对营养要求不高,在普通培养基上生长良好,需氧或兼性厌氧,最适生长温度37℃,最适生长pH 7.4。
平板上菌落厚、有光泽、圆形凸起,直径1~2 mm。
血平板菌落周围形成透明的溶血环。
金黄色葡萄球菌有高度的耐盐性,可在10%~15%氯化钠(NaCl)肉汤中生长。
可分解葡萄糖、麦芽糖、乳糖、蔗糖,产酸不产气,甲基红反应阳性,VP反应弱阳性[1]。
许多菌株可分解精氨酸,水解尿素,还原硝酸盐,液化明胶。
在干燥环境中可存活数月;在空气中存在,但不繁殖。
耐热性强,加热70℃1 h或80℃30 min不被杀死;耐低温,在冷冻食品中不易死亡;耐高渗,在含有50%~66%蔗糖或15%以上食盐食品中才可被抑制。
日常生活中,人之间的接触或打喷嚏,被猫、狗咬伤等,尤其是猪群大规模饲养中,如果不注意人和易感动物的交叉感染,都可感染金黄色葡萄球菌。
此外,耐药的金黄色葡萄球菌可能通过食物、水源、毛发和其他接触方式传递给人,对公共卫生造成了严重威胁[2]。
本试验采集患病猪只患处脓汁、渗出液、伤口分泌物、血液、尿液、粪便等不同样品,分离培养和鉴定金黄色葡萄球菌,并进行生化试验和药敏试验,研究金黄色葡萄球菌对先锋V、庆大霉素、氯霉素、四环素、青霉素、链霉素和红霉素的耐药性。
细菌分离培养与药敏试验于2016年9月中旬至9月底在天津农学院动物医学实验室进行。
1.2.1 培养皿的准备(1)将30个培养皿清洗干净,并用蒸馏水冲洗、晾干。
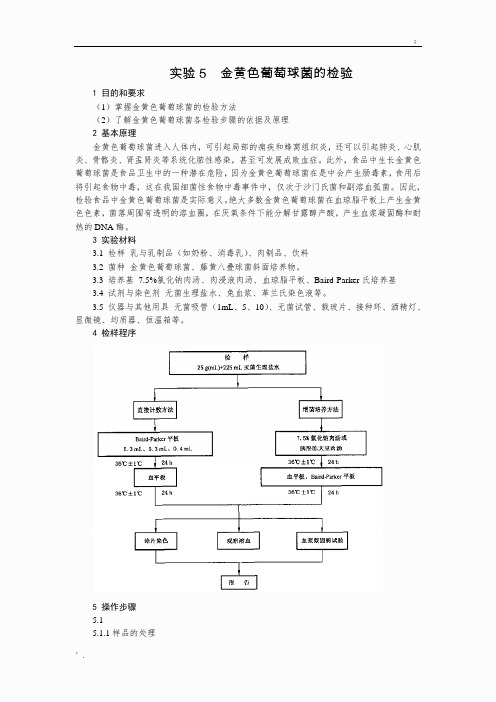
实验5 金黄色葡萄球菌的检验1 目的和要求(1)掌握金黄色葡萄球菌的检验方法(2)了解金黄色葡萄球菌各检验步骤的依据及原理2 基本原理金黄色葡萄球菌进入人体内,可引起局部的痈疾和蜂窝组织炎,还可以引起肺炎、心肌炎、骨骼炎、肾盂肾炎等系统化脓性感染,甚至可发展成败血症。
此外,食品中生长金黄色葡萄球菌是食品卫生中的一种潜在危险,因为金黄色葡萄球菌在是中会产生肠毒素,食用后将引起食物中毒,这在我国细菌性食物中毒事件中,仅次于沙门氏菌和副溶血弧菌。
因此,检验食品中金黄色葡萄球菌是实际意义。
绝大多数金黄色葡萄球菌在血琼脂平板上产生金黄色色素,菌落周围有透明的溶血圈,在厌氧条件下能分解甘露醇产酸,产生血浆凝固酶和耐热的DNA酶。
3 实验材料3.1 检样乳与乳制品(如奶粉、消毒乳)、肉制品、饮料3.2 菌种金黄色葡萄球菌、藤黄八叠球菌斜面培养物。
3.3 培养基7.5%氯化钠肉汤、肉浸液肉汤、血琼脂平板、Baird-Parker氏培养基3.4 试剂与染色剂无菌生理盐水、兔血浆、革兰氏染色液等。
3.5 仪器与其他用具无菌吸管(1mL、5、10)、无菌试管、载玻片、接种环、酒精灯、显微镜、均质器、恒温箱等。
4 检样程序5 操作步骤5.15.1.1样品的处理称取25 g 样品至盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌均质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌均质袋中,用拍击式均质器拍打 1 min~2 min。
若样品为液态,吸取25 mL 样品至盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
5.1.2 增菌和分离培养5.1.2.1 将上述样品匀液于36 ℃±1 ℃培养18 h~24 h。

第一章1.什么是菌落?了解菌落有何实际意义?2.绘出细菌的基本结构和特殊结构图。
3.比较革兰阳性菌和阴性菌的细胞壁结构及化学组成的差异。
4.试述脂多糖及外膜蛋白的组成及功能。
5.叙述细菌核体与真核细胞核的异同。
6.解释荚膜的概念及其功能。
7.S层是什么样的结构?8.试述鞭毛的结构和功用。
9.菌毛的本质、分类及功能如何?10.叙述芽胞的结构、功能及对外界环境抵抗力强的原因。
11.根据鞭毛、芽胞为何能鉴别细菌?12.什么是革兰染色?有何意义?其染色机制如何?13.试述应用电镜观察细菌有哪些特点和限制?第二章1.细菌菌体分裂为什么只需较短时间?2.细菌的生长曲线如何确定?有何意义?3.试述细菌生长的各个期的特点。
4.培养基有哪些种类?各有何用途?6.生物被膜有何特点?7.何谓密度感应系统调控?举例说明其作用。
8.试述益生菌及益生元的概念及应用价值。
9.何谓菌群失调?保持动物正常菌群有何重要意义?10.试述悉生生物学和悉生动物的概念、实验动物分类(包括定义)以及培育实验动物的意义。
第三章1.何谓灭菌、消毒、防腐?举例比较它们的异同。
2.试述影响微生物的主要物理因素及其实用价值。
3.试述各种热力灭菌法的方法原理及其主要用途。
4.根据对微生物的灭活作用可分为哪些类型?列举常用的辐射方法及其杀菌原理和应用。
5.试述滤过除菌的概念及其应用。
第四章1.什么是柯赫法则?如何从分子水平解释柯赫法则?2.试述致病菌侵入宿主细胞的主要过程。
3.什么样的细菌能内化入胞?意义何在?4.什么是细菌外毒素?其基本特性及组成如何?5.什么是类毒素?有何用途?6.试述内毒素的来源、组成、致病意义及检测方法。
7.比较外毒素与内毒素的主要异同点。
第五章1.何谓细菌遗传?细菌变异?2.概述细菌遗传变异的物质基础。
3.质粒有哪些主要特点及类型?4.试述毒力岛的概念及特点。
5.在自然条件下细菌的基因转移重组主要方式有哪几种?6.什么叫转化?试述转化的一般过程。

实验检测牛奶中是否感染有金黄色葡萄球菌并鉴定实验目的1、认识金黄色葡萄球菌;2、学习运用PCR方法检测金黄色葡萄球菌。
实验原理金黄色葡萄球菌(Staphyloccocus aureus)属于葡萄球菌属(Staphylococcus),无芽孢、鞭毛,大多数无荚膜,革兰氏染色阳性。
在普通培养基上生长良好,需氧或兼性厌氧,最适生长温度37°C,最适生长pH7.4,干燥环境下可存活数周。
平板上菌落厚、有光泽、圆形凸起,直径1~2mm。
平板上菌落厚、有光泽、圆形凸起,直径1~2mm。
血平板菌落周围形成透明的溶血环。
金黄色葡萄球菌有高度的耐盐性,可在10~15%NaCl肉汤中生长。
微生物学方法是鉴定牛奶中病原菌的“金标准”,传统方法是进行细菌分类培养,通过生化试验、血清型、各种酶试验分析细菌的表型特点。
对牛奶中病原微生物培养需要很长时间用生化试验的方法进行种属特异性的鉴定至少需要48h以上传统的鉴定技术时间较长,从国外进口诊断试剂费用相对较高。
因此,本文建立了直接从牛奶中鉴别病原菌的PCR检测技术,这种快速、准确、有效、直接从牛奶中检测致病菌的方法将为检验检疫、食品安全质检系统以及兽医检疫提供技术支撑,从而为乳制品病原菌的检测提供一定的帮助。
建立一种直接从牛奶中检测金黄色葡萄球菌的PCR快速诊断方法。
方法是根据已发表的金黄色葡萄球菌16-23SrRNA特异性序列设计并合成一对引物,通过优化反应条件建立从牛奶中直接检测金黄色葡萄球菌的PCR方法。
结果是与细菌的常规分离方法相比,PCR 法敏感性高与其它型葡萄球菌无交叉反应,特异性达100%,检测细菌基因组DNA最低浓度为35ng/L(纳克每升),能在5h内对送检的牛奶样品直接进行金黄色葡萄球菌的测定,可用于乳制品中金黄色葡萄球菌的检测。
所以,建立了一种直接从牛奶中检测金黄色葡萄球菌的PCR快速诊断方法。
实验仪器、试剂与材料仪器:冰箱、摇床、显微镜、PCR反应管、PCR仪、微量加样器、高速离心官、水平电泳槽、恒压电泳仪和凝胶自动成像系统、紫外检测仪、电热恒温水浴槽。

实验五微生物大小的测定实验五微生物大小的测定一、实验目的1. 学会测微尺的使用和计算方法。
2. 学习用测微尺对细菌和酵母菌的测量方法。
二、实验内容:1.认识测微尺,学习目镜测微尺的标定。
2.测定细菌和酵母菌菌体的大小。
三、实验材料和用具金黄色葡萄球菌、大肠杆菌和酵母菌的菌种斜面。
香柏油、擦镜液。
显微镜、目镜测微尺、镜台测微尺、擦镜纸。
四、操作步骤l.测微尺的构造显微镜测微尺是由目镜测微尺和镜台接物测微尺组成,目镜测微尺是一块圆形玻璃片,其中有精确的等分刻度,在5mm刻尺上分50份。
目镜测微尺每格实际代表的长度随使用接目镜和接物镜的放大倍数而改变,因此在使用前必须用镜台测微尺进行标定。
镜台测微尺为一专用中央有精确等分线的载玻片,一般将长为1mm的直线等分成100个小格每格长0.0lmm即10μm,是专用于校正目镜测微尺每格长度的。
2.目镜测微尺的标定把目镜的上透镜旋开,将目镜测微尺轻轻放在目镜的隔板上,使有刻度的一面朝下。
将镜台测微尺放在显微镜的载物台上,使有刻度的一面朝上。
先用低倍镜观察,调焦距,待看清镜台测微尺的刻度后,转动目镜,使目镜测微尺的刻度与镜台测微尺的刻度相平行,并使两尺左边的一条线重合,向右寻找另外一条两尺相重合的直线。
3.计算方法标定公式:目镜测微尺每格长度(μm)=两条重合线间镜台测微尺的格数×10/两条重合线间目镜测微尺的格数例如,目镜测微尺20个小格等于镜台测微尺3小格,已知镜台测微尺每格为10μm,则3小格的长度为3×10=30μm,那么相应地在目镜测微尺上每小格长度为3×10÷20=1.5μm。
用以上计算方法分别校正低倍镜、高倍镜及油镜下目镜测微尺每格实际长度。
4.菌体大小的测定将镜台测微尺取下,分别换上大肠杆菌及金黄色葡萄球菌玻片标本,先在低倍镜和高倍镜下找到目的物,然后在油镜下用目镜测微尺测量菌体的大小。
先量出菌体的长和宽占目镜测微尺的格数,再以目镜测微尺每格的长度计算出菌体的长和宽。

2.2.5金黄色葡萄球菌的相关表型实验方法2.2.5.1生长曲线的测定(1)从37 ℃培养16-20 小时的新鲜平板中挑取一个单菌落,接种至含有1ml TSB 的10 ml 培养管中。
于37 ℃振荡培养(转速220 RPM)过夜。
(2)1:100 将菌转接入含有50 ml TSB,MH 或PN 培养基的250 ml 烧瓶中,37 ℃震荡培养(转速220 RPM)。
(3)每小时测量各瓶OD600 数值,至细菌进入稳定期数值基本不再改变(约12 小时)。
2.2.5.2 自溶实验(1)从37 ℃培养16-20 小时的新鲜平板中挑取单菌落,接种至TSB 培养基中,于37 ℃振荡培养至指数中期。
(2)离心10 min,回收细胞。
(3)用PBS 洗细胞,重复三次。
(4)将细胞重悬于等量含有0.05% (W/V)Triton X-100 的Tris-HCl (pH 7.5)缓冲液中。
(5)将细胞重悬液于30 ℃振荡培养(转速220 RPM)。
(6)从测量零时开始,每隔30 min 测量OD600 的值,直到OD 值降到初始值的一半以下。
2.2.5.3 生物膜实验(1)从37 ℃培养16-20 小时的新鲜平板中挑取单菌落,接种至含有1 mlTSB 的10 ml 培养管中。
于37 ℃振荡培养(转速220 RPM)过夜。
(2)将过夜培养的金葡菌按照1:100 的接种量接种至新鲜TSB 培养基,混匀。
(3)将混合接种物分装至96 孔板(Costar 3599),每孔或者24 孔板(Costar 3524),每孔。
在37 ℃恒温箱静置培养。
(4)培养一定时间后,取出孔板,弃掉上清,并用水轻柔地洗孔板三次。
(5)每孔加入(96 孔板)或(24 孔板)结晶紫染色液,常温下静置15 min 染色。
(6)弃掉结晶紫染色液,用水轻柔地洗孔板三次,吹干。
(7)拍照,用酶标仪检测OD560 度数。
2.2.5.4 alpha 溶血素检测(1)从37 ℃培养16-20 小时的新鲜平板中挑取单菌落,接种至含有1 mlTSB 的10 ml 培养管中。


金黄色葡萄球菌检验原理
金黄色葡萄球菌检验的原理是通过培养和鉴定来确定细菌是否为金黄色葡萄球菌。
具体步骤如下:
1. 培养:将样本在含有富含营养物质的培养基上进行培养。
金黄色葡萄球菌在常见的琼脂培养基上能够快速生长并形成典型的黄色菌落。
2. 鉴定:通过一系列的生化反应和特征性实验来确认细菌的身份。
金黄色葡萄球菌一般具有以下特征:
- 革兰氏染色:呈阳性,即菌体呈紫色。
- 非运动性:无鞭毛或鞭毛不活跃。
- 产生黄色色素:金黄色葡萄球菌能够产生一种特殊的黄色色素,使得菌落呈现金黄色。
3. 确认:通过进一步的检测,如凝胶酶试验和DNA鉴定等,来进一步确认菌株是否为金黄色葡萄球菌。
金黄色葡萄球菌是一种常见的致病菌,可以引起多种感染,如皮肤感染、呼吸道感染和食物中毒等。
通过对其进行准确快速的检验可以帮助医生进行针对性治疗和控制传播。

金黄色葡萄球菌检验实验原理
金黄色葡萄球菌检验是一种常见的微生物检验方法,用于检测环境中是否存在金黄色葡萄球菌。
实验原理:
1.准备好检测环境样品。
2.将样品加入培养基中,培养基中含有可抑制其他细菌生长的
物质。
3.将培养基移植到培养皿中,利用平板法悬浮液平铺在培养皿
表面。
4.将培养皿置于孵箱中,设定适当的温度和时间,有利于金黄
色葡萄球菌的生长。
5.观察培养皿上是否有金黄色菌落的出现。
6.对金黄色菌落的特征进行仔细观察,如菌落的形状、颜色等。
7.进行进一步的鉴定确认,通过其他实验方法验证金黄色菌落
是否为金黄色葡萄球菌。
金黄色葡萄球菌检验实验原理简单易懂,能够快速准确地检测金黄色葡萄球菌的存在与否。

实验一光学显微镜----油镜的使用一、实验目的1 复习显微镜低倍镜和高倍镜的使用技术2 了解油浸系物镜的基本原理,掌握油浸系物镜的使用方法。
二、实验材料和用具细菌三型的染色装片、香柏油、二甲苯、显微镜、擦镜纸。
三、操作步骤(一)观察前的准备1.将显微镜置于平稳的实验台上。
2.调节光源。
(二)低倍镜观察染色装片首先上升镜简,将枯草芽孢杆菌染色装片置于载物台上,用标本夹夹住,将观察位置移至物镜正下方,物镜降至距装片0.5cm处,适当缩小光圈然后两眼从目镜观察,转动粗调节器使物镜逐渐上升(或使镜台下降)至发现物像时,改用细调节器调节到物像清楚为止。
移动装片,把合适的观察部位移至视野中心。
(三)高倍镜观察眼睛离开目镜从侧面观察,旋转转换器,将高倍镜转至正下方,注意避免镜头与玻片相懂。
再由目镜观察,仔细调节光圈,使光线的明亮度适宜。
用细调节器校正焦距使物镜清晰为止。
将最适宜观察部位移至视野中心,绘图。
不要移动装片位置,准备用油镜观察。
(四)油镜观察1.提起镜筒约2cm,将油镜转至正下方。
在玻片标本的镜检部位(镜头的正下方)滴一滴香柏油。
2.从侧面注视,小心慢慢降下镜筒,使油镜浸在油中至油圈不扩大为止,镜头几乎与装片接触,但不可压及装片,以免压碎玻片,损坏镜头。
3.将光线调亮,左眼从目镜观察,用粗调节器将镜筒徐徐上升(切忌反方向旋转),当视野中有物像出现时,再用细调节器校正焦距。
如因镜头下降未到位或镜头上升太快末找到物像,必须再从侧面观察,将油镜降下,重复操作直至物像看清为止。
仔细观察并绘图。
4.再次观察提起镜筒,换上金黄色葡萄球菌染色装片,依次用低倍镜、高倍镜和油镜观察,绘图。
重复观察时可比第一次少加香柏油。
(五)镜检完毕后的工作1.移开物镜镜头。
2.取出装片。
3.清洁油镜。
4.擦净显微镜,将各部分还原。
四、注意事项1.使用油镜必须按先用低倍镜和高倍镜观察,再用油镜观察。
2.下降镜头时,一定要从侧面注视,切忌用眼睛对着目镜,边观察边下降镜头的错误操作,以免压碎玻片而损坏镜头。



方法验证报告公共场所卫生检验方法第4部分:公共用品用具微生物金黄色葡萄球菌GB/T 18204.4-2013(5)1.目的验证平皿鉴定法测定公共用品用具微生物中的金黄色葡萄球菌,来判断在本实验室此方法的适用性。
2.培养基和试剂2.1培养基和试剂2.1.1胰酪胨大豆肉汤成分:胰酪胨(或胰蛋白胨) 17g植物蛋白胨(或大豆蛋白胨) 3g氯化钠100g磷酸氢二钾 2.5 g葡萄糖 2.5 g蒸馏水1000mL制法:将上述成分混合后,加热溶解,调pH为7.2~7.3,分装,121 C、20 min 高压灭菌。
2.1.2氯化钠肉汤(75 g/L)成分:蛋白胨10g牛肉膏10g氯化钠75 g蒸馏水 1 000 mL制法:将上述成分加热溶解,调pH为7.4,分装,121 ℃、20 min高压灭菌。
2.1.3 Baird Parker平板成分:胰蛋白胨10g牛肉膏5g酵母浸膏1g丙酮酸钠10g甘氨酸12g氯化锂(LiCl. 6H2O) 5g琼脂20g蒸馏水950 mL增菌剂的配制:卵黄盐水(30%,体积分数)50mL与除菌过滤的亚碲酸钾溶液(质量浓度=1%)10mL混合,保存于冰箱内。
制法:将各成分加到蒸馏水中,加热煮沸完全溶解,冷至25℃校正pH至7.0±0.2。
分每瓶95 mL,121℃高压灭菌15min,临用时加热熔化琼脂,每95mL 加入预热至50C的卵黄亚碲酸钾增菌5mL,摇匀后倾注平板。
培养基应是致密不透明的。
使用前在冰箱储存,不得超过48 h。
2.1.4血琼脂培养基成分:营养琼脂100 mL脱纤维羊血(或兔血) 10 mL制法:将营养琼脂加热溶化,待冷至50 C左右以无菌方法加人脱纤维羊血,摇匀,制成平板,置冰箱内备用。
2.1.5革兰氏染色液2.1.5.1结晶紫染色液成分:结晶紫1g乙醇(95% ,体积分数) 20 mL草酸铵水溶液(质量浓度=1%) 80 mL制法:将结晶紫溶于乙醇中,然后与草酸铵溶液混合。



实验五牛津杯(琼脂孔洞法)测定抗菌剂的抑菌效果一、目的:观察抗菌剂抗菌的作用效果,熟练掌握牛津杯法(琼脂孔洞法)体外测定抗菌物质的抗菌活性。
二、原理:抗菌物质从孔洞向琼脂培养基扩散渗透,通过对试验菌的抑杀作用而影响细菌生长繁殖,使菌落形成抑菌圈,依抑菌圈的大小确定抗菌物质抗菌能力的强弱。
三、材料1. 菌种:金黄色葡萄球菌,用营养肉汤培养16~18 h得到的菌液。
2. 药品:氨苄青霉素,肉汤培养基。
3. 器材:生化培养箱、高压蒸汽灭菌锅、水浴锅、灭菌肉汤琼脂培养基、酒精灯、平皿、吸管、0.5 cm 纸片、镊子、记号笔、尺子等。
四、实验步骤1.按照实验一(培养基的配制)的方法步骤配制好肉汤培养基,并在121℃,灭菌20 min后,放在60 ℃水浴锅中保温,注意温度恒定,不要让培养基凝固。
2. 将用于试验的防腐剂(抑菌物质)配制成2个所需的浓度(见表1)。
3.将已经培养好的菌制成一定浓度(106cfu/mL)的悬浮液,用移液管移取1 mL该菌悬液至灭过菌的(121℃,20分钟)培养皿中,倒入15 mL已灭菌的培养基(温度约45℃,用手摸瓶壁不感觉烫手即可),轻轻转动培养皿,使培养基与菌液混匀,静置凝成平板。
4.将凝固后的平板用灭菌后的打孔器在平板上打孔(4个孔洞),并挑出培养基。
(或将已灭菌的牛津杯依次轻轻放置在平板上)5.按照顺时针方向依次在每个孔洞(或牛津杯)中加入抑菌剂,以无菌水做空白对照,每种抑菌剂的浓度做三个平行样。
6.在37 ℃下培养24 h观察,用尺子测量抑菌圈的大小。
五、注意事项1.应在无菌条件下操作,试验完毕后及时灭菌处理。
2.添加抑菌剂的时候注意滴到其他地方,以免影响观察。
六、实验结果表测定抗菌剂的抑菌效果思考题:如何判定防腐剂或抑菌物质的抑菌效果,说明其食品应用的指导意义。
附:1. 药敏试验判定标准表 抗菌药物的抑菌效果判定标准抑菌圈直径(mm )敏感性 <9 耐药 9~11 低度敏感 12~17 中度敏感 >18高度敏感菌株 药物浓度(µg/mL ) 抑菌圈直径(mm )抑菌圈平均数判定结果金黄色葡萄球菌氨苄青霉素101010 3030 30。

金黄色葡萄球菌检查标准操作规程1 目的建立规范金黄色葡萄球菌检查标准操作规程,确保检查操作正确。
2 范围适用于本公司的金黄色葡萄球菌的检查操作。
3 职责4 术语及定义无5 内容5.1 实验5.1.1 仪器设备:生物安全柜、显微镜、电热恒温培养箱、酒精灯、电动移液器、电子天平。
5.1.2 耗材:载玻片、90mm培养皿、10mL移液管、一次性接种环、无菌巴氏吸管。
5.1.3 培养基及试剂:SCDLP 液体培养基、Baird Parker 氏培养基、亚碲酸钾卵黄增菌液、血琼脂培养基、甘露醇发酵培养基、兔(人)血浆制备。
5.2 供试品处理:对于亲水性样品,直接称取10g或者量取10mL样品加入到90mL生理盐水中,充分振荡均匀待检;对于疏水性样品,需先称取10g样品研碎或者量取10mL液体样品,然后加入到10mL灭菌液体石蜡中混匀,再加入10mL灭菌吐温80,混匀待溶解后,最后加入70mL生理盐水混匀后待检。
5.2.1 液体样品:水溶性的液体样品,可量取10mL加到90mL生理盐水中,如样品少于10mL,仍按10倍稀释法进行,如为5mL则加到45mL生理盐水中,混匀后制成1:10检液。
5.2.2 油性液体样品:取样品10mL,先加5mL灭菌液体石蜡混匀,再加10mL灭菌的吐温80,在40℃~44℃水浴中充分混合,制成1:10检液。
5.2.3 固体样品:称取10g,加到90mL生理盐水中,充分振荡混匀,使其分散混悬,静置后,取上清液作为1:10的检液,如有均质器,上述水溶性膏、霜、粉剂等,可称10g样品加入90mL灭菌生理盐水,均质1min~2min;疏水性膏、霜及眉笔、口红等,称10g样品,加入10mL灭菌液体石蜡、10mL吐温80、70mL灭菌生理盐水,均质3min~5min;5.3 操作过程5.3.1 增菌:取1:10稀释的样品接种到90mL SCDLP液体培养基中,置36℃±1℃培养箱培养24h±2h。

实验5 金黄色葡萄球菌的检验
1 目的和要求
(1)掌握金黄色葡萄球菌的检验方法
(2)了解金黄色葡萄球菌各检验步骤的依据及原理
2 基本原理
金黄色葡萄球菌进入人体内,可引起局部的痈疾和蜂窝组织炎,还可以引起肺炎、心肌炎、骨骼炎、肾盂肾炎等系统化脓性感染,甚至可发展成败血症。
此外,食品中生长金黄色葡萄球菌是食品卫生中的一种潜在危险,因为金黄色葡萄球菌在是中会产生肠毒素,食用后将引起食物中毒,这在我国细菌性食物中毒事件中,仅次于沙门氏菌和副溶血弧菌。
因此,检验食品中金黄色葡萄球菌是实际意义。
绝大多数金黄色葡萄球菌在血琼脂平板上产生金黄色色素,菌落周围有透明的溶血圈,在厌氧条件下能分解甘露醇产酸,产生血浆凝固酶和耐热的DNA酶。
3 实验材料
3.1 检样乳与乳制品(如奶粉、消毒乳)、肉制品、饮料
3.2 菌种金黄色葡萄球菌、藤黄八叠球菌斜面培养物。
3.3 培养基7.5%氯化钠肉汤、肉浸液肉汤、血琼脂平板、Baird-Parker氏培养基
3.4 试剂与染色剂无菌生理盐水、兔血浆、革兰氏染色液等。
3.5 仪器与其他用具无菌吸管(1mL、5、10)、无菌试管、载玻片、接种环、酒精灯、显微镜、均质器、恒温箱等。
4 检样程序
5 操作步骤
5.1
5.1.1样品的处理
称取25 g 样品至盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌均质杯内,8000 r/min~10000 r/min 均质1 min~2 min,或放入盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌均质袋中,用拍击式均质器拍打1 min~2 min。
若样品为液态,吸取25 mL 样品至盛有225 mL 7.5 %氯化钠肉汤或10 %氯化钠胰酪胨大豆肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
5.1.2 增菌和分离培养
5.1.2.1 将上述样品匀液于36 ℃±1 ℃培养18 h~24 h。
金黄色葡萄球菌在7.5%氯化钠肉汤中呈混浊生长,污染严重时在10%氯化钠胰酪胨大豆肉汤内呈混浊生长。
5.1.2.2 将上述培养物,分别划线接种到Baird-Parker 平板和血平板,血平板36 ℃±1 ℃培养18 h~24 h。
Baird-Parker 平板36 ℃±1 ℃培养18 h~24 h 或45 h~48 h。
5.1.2.3 金黄色葡萄球菌在Baird-Parker 平板上,菌落直径为2 mm~3 mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈。
用接种针接触菌落有似奶油至树胶样的硬度,偶然会遇到非脂肪溶解的类似菌落;但无混浊带及透明圈。
长期保存的冷冻或干燥食品中所分离的菌落比典型菌落所产生的黑色较淡些,外观可能粗糙并干燥。
在血平板上,形成菌落较大,圆形、光滑凸起、湿润、金黄色(有时为白色),菌落周围可见完全透明溶血圈。
挑取上述菌落进行革兰氏染色镜检及血浆凝固酶试验。
5.1.3 鉴定
5.1.3.1 染色镜检:金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,直径约为0.5 μm~1 μm。
5.1.3.2 血浆凝固酶试验:挑取、Baird-Parker平板或血平板上可疑菌落1个或以上,分别接种到5 mL BHI和营养琼脂小斜面,36 ℃±1℃培养18 h~24 h。
取新鲜配置兔血浆0.5 mL,放入小试管中,再加入BHI 培养物0.2 mL~0.3 mL,振荡摇匀,置36℃±1℃温箱或水浴箱内,每半小时观察一次,观察6 h,如呈现凝固(即将试管倾斜或倒置时,呈现凝块)或凝固体积大于原体积的一半,被判定为阳性结果。
同时以血浆凝固酶试验阳性和阴性葡萄球菌菌株的肉汤培养物作为对照。
也可用商品化的试剂,按说明书操作,进行血浆凝固酶试验。
结果如可疑,挑取营养琼脂小斜面的菌落到5 mL BHI,36 ℃±1℃培养18 h~48 h,重复试验。
病原性葡萄球菌多数产生血浆凝固酶,非病原性的一般不产生。
因此,该法是判定葡萄球菌有无致病性的重要指标。
5.2 金黄色葡萄球菌Baird-Parker平板计数
5.2.1 样品的稀释
5.2.1.1固体和半固体样品:称取25 g样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000r/min~10000 r/min均质1 min~2 min,或置盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1min~2 min,制成1:10的样品匀液。
5.2.1.2 液体样品:以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
5.2.1.3 用1 mL 无菌吸管或微量移液器吸取1:10 样品匀液1 mL,沿管壁缓慢注于盛有9 mL 稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1 支1 mL 无菌吸管反复吹打使其混合均匀,制成1:100 的样品匀液。
5.2.1.4 按5.2.1.3 操作程序,制备10 倍系列稀释样品匀液。
每递增稀释一次,换用1 次1 mL 无菌吸管或吸头。
5.2.2 样品的接种
根据对样品污染状况的估计,选择2 个~3 个适宜稀释度的样品匀液(液体样品可包括原液),在进行10 倍递增稀释时,每个稀释度分别吸取1 mL 样品匀液以0.3 mL、0.3 mL、0.4 mL 接种量分别加25 g(mL)样品+225 mL 稀释液,均质45 h~48 h入三块Baird-Parker 平板,然后用无菌L棒涂布整个平板,注意不要触及平板边缘。
使用前,如Baird-Parker平板表面有水珠,可放在25 ℃~50 ℃的培养箱里干燥,直到平板表面的水珠消失。
5.2.3 培养
5.2.3.1.在通常情况下,涂布后,将平板静置10 min,如样液不易吸收,可将平板放在培养箱36 ℃±1℃培养1 h;等样品匀液吸收后翻转平皿,倒置于培养箱,36 ℃±1 ℃培养,45 h~48 h。
5.2.4 典型菌落计数和确认
5.2.4.1 金黄色葡萄球菌在Baird-Parker 平板上,菌落直径为2 mm~3 mm,颜色呈灰色到黑色,边缘为
淡色,周围为一混浊带,在其外层有一透明圈。
用接种针接触菌落有似奶油至树胶样的硬度,偶然会遇
到非脂肪溶解的类似菌落;但无混浊带及透明圈。
长期保存的冷冻或干燥食品中所分离的菌落比典型菌
落所产生的黑色较淡些,外观可能粗糙并干燥。
5.2.4.2 选择有典型的金黄色葡萄球菌菌落的平板,且同一稀释度3 个平板所有菌落数合计在20 CFU~200 CFU 之间的平板,计数典型菌落数。
如果:
a)只有一个稀释度平板的菌落数在20 CFU~200 CFU之间且有典型菌落,计数该稀释度平板上的典型菌落;
b)最低稀释度平板的菌落数小于20 CFU 且有典型菌落,计数该稀释度平板上的典型菌落;
c)某一稀释度平板的菌落数大于200 CFU 且有典型菌落,但下一稀释度平板上没有典型菌落,应计数该稀释度平板上的典型菌落;
d)某一稀释度平板的菌落数大于200 CFU 且有典型菌落,且下一稀释度平板上有典型菌落,但其平板上的菌落数不在20 CFU~200 CFU 之间,应计数该稀释度平板上的典型菌落;
以上按公式(1)计算。
e)2 个连续稀释度的平板菌落数均在20 CFU~200 CFU 之间,按公式(2)计算。
5.2.4.3 从典型菌落中任选5 个菌落(小于5 个全选),分别按5.3.2 做血浆凝固酶试验。
5.2.5 结果计算:
公式(1):
式中:
T——样品中金黄色葡萄球菌菌落数;
A——某一稀释度典型菌落的总数;
B——某一稀释度血浆凝固酶阳性的菌落数;
C——某一稀释度用于血浆凝固酶试验的菌落数;
d——稀释因子。
公式(2):
式中:
T ——样品中金黄色葡萄球菌菌落数;
A1——第一稀释度(低稀释倍数)典型菌落的总数;
A2——第二稀释度(高稀释倍数)典型菌落的总数;
B1——第一稀释度(低稀释倍数)血浆凝固酶阳性的菌落数;
B2——第二稀释度(高稀释倍数)血浆凝固酶阳性的菌落数;
C1——第一稀释度(低稀释倍数)用于血浆凝固酶试验的菌落数;
C2——第二稀释度(高稀释倍数)用于血浆凝固酶试验的菌落数;
1.1——计算系数;
d ——稀释因子(第一稀释度)。
6 试验结果与报告
6.1 结果判定
(1)形态和染色反应符合葡萄球菌特征,血浆凝固酶阳性,报告“发现致病性葡萄球菌”。
(2)形态和染色反应符合葡萄球菌特征,血浆凝固酶阴性,报告“发现非致病性葡萄球菌”。
6.2 报告要求
列表记录实验过程中各步骤结果,并据此做出结论。
7 思考题
为什么采用血浆凝固酶试验来决定葡萄球菌致病和不致病?。