初中化学溶液 溶解度易错题精选经典
- 格式:doc
- 大小:316.50 KB
- 文档页数:13

中考化学溶解度易错压轴选择题易错(难)测试题含答案一、溶解度易错压轴选择题1.下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是A.蒸发前原溶液是饱和溶液B.甲的溶解度随温度的升高而减小C.n的数值是11D.20℃时甲的溶解度是6g2.几种固体物质在水中的溶解度如下表所示:温度/℃2030405060溶解度/gNaCl36.036.336.637.037.3KNO331.645.863.985.5110Ca(OH)20.170.150.130.120.11分析上表中的数据不能得出的结论是()A.KNO3在水中的溶解度随温度的升高而增大B.NaCl在水中的溶解度受温度变化影响不大C.固体物质在水中溶解度的大小与溶质的种类有关D.固体物质在水中溶解度的大小与溶剂的种类有关3.物质甲与乙的溶解度曲线如图所示,下列说法错误的是A.常温下,乙易溶于水B.t2℃甲的饱和溶液中溶质的质量分数比乙的饱和溶液大C.从t2℃降至t1℃,甲溶液中有晶体析出D.甲的溶解度受温度的影响程度比乙的大4.甲、乙两种固体物质的溶解度曲线如图所示,下列结论正确的是()A.乙的溶解度小于甲的溶解度B.甲的溶解度受温度影响比乙大C.t2℃时,100g乙的饱和溶液中含乙50gD.相同质量的甲、乙的饱和溶液由t2℃降至t1℃,析出晶体较多的是乙5.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是()A.加入溶质B.降低温度C.升高温度D.恒温蒸发溶剂6.t℃时,向饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是()A.仍为饱和溶液B.溶质的质量变小C.溶质的溶解度不变D.溶质的质量分数不变7.如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M物质的溶液。
下列有关说法或a、b间的转化方法错误的是()A.t2℃时,a是饱和溶液,b是不饱和溶液B.将两份溶液温度降到t1℃时,a、b中都有晶体析出C.从a→b:先将a降温到t1℃,过滤后将滤液升温到t2℃D.从b→a:在b中加入M至刚好饱和8.向t℃时饱和的Na2CO3溶液中加入ng无水Na2CO3,会析出mgNa2CO3·10H2O,则(m-n)的值为()A.饱和溶液失去水的质量B.饱和溶液失去溶质的质量C.饱和溶液失去水和溶质的质量之和D.其数值为0,即溶液质量不变9.KNO3和NaNO3的溶解度曲线如图所示。
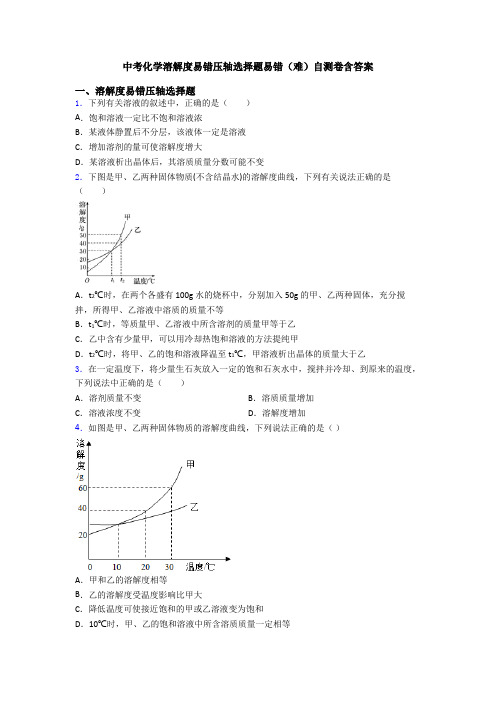
中考化学溶解度易错压轴选择题易错(难)自测卷含答案一、溶解度易错压轴选择题1.下列有关溶液的叙述中,正确的是()A.饱和溶液一定比不饱和溶液浓B.某液体静置后不分层,该液体一定是溶液C.增加溶剂的量可使溶解度增大D.某溶液析出晶体后,其溶质质量分数可能不变2.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是()A.t2℃时,在两个各盛有100g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲D.t2℃时,将甲、乙的饱和溶液降温至t1℃,甲溶液析出晶体的质量大于乙3.在一定温度下,将少量生石灰放入一定的饱和石灰水中,搅拌并冷却、到原来的温度,下列说法中正确的是()A.溶剂质量不变B.溶质质量增加C.溶液浓度不变D.溶解度增加4.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是()A.甲和乙的溶解度相等B.乙的溶解度受温度影响比甲大C.降低温度可使接近饱和的甲或乙溶液变为饱和D.10℃时,甲、乙的饱和溶液中所含溶质质量一定相等5.如图是A、B、C三种物质的溶解度曲线.下列叙述正确的是A.三种物质溶解度大小顺序为A>B>CB.t1℃时,110gA的溶液中含有溶质A的质量是10gC.B中混有少量A,可用降温结晶法提纯BD.t3℃时,配制等质量的A、B、C三种物质的饱和溶液需要水最多的是C6.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是()A.加入溶质B.降低温度C.升高温度D.恒温蒸发溶剂7.t℃时,向饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是()A.仍为饱和溶液B.溶质的质量变小C.溶质的溶解度不变D.溶质的质量分数不变8.已知:Na2O + H2O = 2NaOH,向饱和的氢氧化钠溶液中加入一定量的Na2O,充分反应后恢复到原来温度。

初中化学溶液溶解度易错题精选一、溶液选择题1.右图是NaCl、MgSO4的溶解度曲线.下列说法正确的是()A.只有在t1℃时,NaCl和MgSO4的溶解度才相等B.t1℃~t3℃,MgSO4的溶解度随温度升高而增大C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出【答案】C【解析】根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即t1℃和t2℃时,两物质的溶解度相等,故A错误;由硫酸镁的溶解度曲线可知,在t1℃~t3℃时,硫酸镁的溶解度先随温度的升高而增大,后随温度的升高而减小,故B错误;在t2℃时,由于硫酸镁的溶解度大于氯化钠的溶解度,所以硫酸镁饱和溶液中溶质的质量分数大,故C正确;由于在t2﹣t3℃,硫酸镁的溶解度随温度的降低而增大,因此把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故D错误。
【答案】B【解析】饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。
判断溶液是否饱和的方法是:向溶液中在加入少量同种溶质,搅拌,如能继续溶解,原溶液是不饱和溶液;如不能溶解,原溶液为饱和溶液。
A. 温度不变时,向该溶液中加入少量水,溶质的质量分数都变小;B. 温度不变时,向该溶液中加入少量KNO3晶体,晶体不再溶解,可证明原溶液是饱和溶液;C. 取少量该溶液,升温后无KNO3晶体析出,可能是升温时物质的溶解度变大,使溶液由饱和溶液变成不饱和溶液;D. 取少量该溶液,降温到10℃时,有KNO3晶体析出,是因为降温时,物质的溶解度变小。
选B点睛:证明溶液是否饱和的关键是清楚饱和溶液与不饱和溶液是的区别。
2.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。
下列说法正确的是( )A.该温度下,KNO3的溶解度为30gB.乙溶液的质量分数为30%C.降低温度,可以使甲溶液变成饱和溶液D.升高温度,甲、乙两溶液的质量分数都增大【答案】C【解析】溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。

精选中考化学易错题专题复习化学溶解度及详细答案一、初中化学溶解度1.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量B.溶剂的质量C.溶液的质量D.溶质与溶剂的质量比【答案】A【解析】【详解】A项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质的质量不变,正确;B项,饱和溶液用水稀释变成不饱和溶液的过程中,溶剂的质量增加,错误;C项,饱和溶液用水稀释变成不饱和溶液的过程中,溶液的质量增加,错误;D项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质与溶剂的质量比发生改变,错误。
故选A。
2.如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是()A.Z的溶解度随温度的升高而降低B.t1℃时,Y的溶解度大于Z的溶解度C.t3℃时,X的饱和溶液中溶质的质量分数为40%D.t2℃时,X的溶解度和Y的溶解度相等【答案】C【解析】根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;还可以判断或比较某一物质在不同温度下的溶解度大小;饱和溶液中溶质的质量分数=×100%。
观察溶解度曲线,可以看出Z的溶解度随温度的升高而降低,A正确;观察溶解度曲线,可以看出t1℃时,Y的溶解度大于Z的溶解度,B正确;观察溶解度曲线,可以看出t3℃时,X的溶解度是100g,所以其饱和溶液溶质的质量分数是:×100%=50%,故C错误;观察溶解度曲线,可以看出t2℃时,X的溶解度和Y的溶解度相交于一点,说明二者的溶解度在此温度下相等, D正确。
3.如图是A、B、C三种固体物质的溶解度曲线。
下列分析正确的是()A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3 C.将t2℃时A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系是B=C>AD.将t1℃时C的饱和溶液变为不饱和溶液,可采用的方法是升高温度【答案】B【解析】【详解】A、t1℃时,A、C两种物质的溶解度相等,但是饱和溶液的质量不能确定,所以饱和溶液中溶质的质量也不能确定,选项错误;B、t2℃时,A物质的溶解度是50g,所以把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为25g:75g=1:3,选项正确;C、t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,降低温度,A、B物质的溶解度减小,C物质的溶解度增大,应该按照t2℃时的溶解度计算,所以将t2℃时A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系是B>A>C,选项错误;D、C物质的溶解度随温度的升高而减小,所以将t1℃时C的饱和溶液变为不饱和溶液,可采用的方法是降低温度,选项错误,故选B。

【化学】初中化学溶液溶解度易错题精选经典一、溶液选择题1.下图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )A.40℃恒温蒸发甲、乙两物质的饱和溶液,析出的乙比甲多B.20℃~40℃时,乙中含有少量甲,可用升温的方法提纯乙C.35℃,等质量的甲、乙溶液中,溶质的质量分数相等D.50℃向 100g25%的甲溶液中加入12.5g甲,溶液刚好饱和【答案】D【解析】A、甲、乙两物质的饱和溶液的质量不确定,错误;B、由溶解度曲线可知,20℃~40℃时,甲、乙的溶解度都随温度的升高而增大,且乙受温度的影响变化较大,故20℃~40℃时,乙中含有少量甲,可用降温的方法提纯乙,错误;C、由溶解度曲线可知,35℃时,甲、乙的溶解度相等,故35℃,等质量的甲、乙饱和溶液中,溶质的质量分数相等,错误;D、由溶解度曲线可知,50℃时,甲的溶解度为50g,即100g水中最多溶解50g甲物质,那么75g水中最多溶解37.5g甲物质。
100g25%的甲溶液中溶质的质量为100g×25%=25g,溶剂的质量为75g。
故50℃向100g25%的甲溶液中加入12.5g甲,溶液刚好饱和,正确。
故选D。
点睛:重点是抓住溶解度的实质结合溶解度曲线进行分析即可解决。
2.将100g 质量分数为20%的硝酸钾溶液稀释为5%的硝酸钾溶液,需要加水的质量为()A.100g B.200g C.300g D.400g【答案】C【解析】【分析】【详解】根据稀释前后溶质质量不变,可设需要加水的质量为x,100g×20%=(100g+x)×5%,解得x=300g,故选C.3.一定温度下,向盛有100g蔗糖溶液的烧杯中再加入5克蔗糖,充分搅拌后一定不变的是A.溶质的质量B.溶液的质量C.溶质的质量分数D.蔗糖的溶解度【答案】D【解析】【分析】溶液由溶质和溶剂组成,溶液的质量等于溶质和溶剂的质量和,被溶解的物质叫溶质。

初中化学溶液-溶解度易错题精选经典work Information Technology Company.2020YEAR初中化学溶液溶解度易错题精选经典一、溶液选择题1.请根据右图的溶解度曲线图,判断下列说法正确的是()A.a、b两物质的溶解度相等B.t1℃时,向20g a固体加入50g 水,充分搅拌后固体能全部溶解C.将t2℃时a、b饱和溶液降温到t1℃时,两者的溶质质量分数相等D.b中含有少量a,可以用冷却热饱和溶液的方法提纯b【答案】C【解析】试题分析:A 根据溶解度曲线可知,只有在℃时两物质溶解度相等;B t 1℃时,a物质的溶解度为36g,也就是说此温度下100g水中最多可以溶解36g a物质;C 从t2℃降温至t1℃时,两物质溶解度相等,且都为饱和溶液,因此质量分数相等;D a、b两物质溶解度变化随温度变化相差较大,因此可以用冷却热饱和溶液的方法提纯a,不可以用来提纯b。
考点:溶解度曲线的意义点评:关于溶解度曲线的题目一直是中考的必考点,常在双选中出现,得分率不是很高,注意仔细审题,避免粗心。
2.甲、乙、丙三种物质的溶解度曲线如图所示。
下列说法错误的是( )A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5% C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法【答案】B【解析】【详解】A、通过分析溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙,故A正确;B、t2℃时,甲物质的溶解度是50g,所以30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为×100%=33.3%,故B错误;C、将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,甲物质的溶解度变化最大,所以析出晶体最多的是甲,故C正确;D、丙物质的溶解度随温度的升高而减小,所以欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法,故D正确。

【化学】初中化学溶液溶解度易错题精选(word)1一、溶液选择题1.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是A.t2℃时,乙的饱和溶液中溶质的质量分数为20%B.把t1℃时甲、乙的饱和溶液升温至t2℃,均有晶体析出C.M点对应的甲溶液,是t2℃时甲的不饱和溶液D.把t2℃时甲、乙的饱和溶液降温至t1℃,此时溶液中溶质的质量分数相等。
【答案】C【解析】A、t2℃时,乙物质的溶解度等于20g,乙的饱和溶液中溶质的质量分数为×100%≈16.7%,错误;B、t1℃时,甲、乙的饱和溶液升温至t2℃时,甲物质的溶解度增大,不会析出晶体,乙物质的溶解度减小,会析出固体,错误;C、t2℃时,N点在溶解度曲线的下方,所以对应的甲的溶液不饱和溶液,正确;D、甲物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小,所以t2℃的甲、乙饱和溶液降温至t1℃时,甲物质降温后析出晶体,仍然饱和,质量分数用t1℃时溶解度计算即可;乙物质降温后变为不饱和,所以溶质质量分数不变,所以乙物质的质量分数按照t2℃时乙物质的溶解度计算,所以只要比较出t1℃时甲物质溶解度与t2℃时乙物质的溶解度的大小即可,可知甲>乙,错误。
故选C。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是A.将℃时b的饱和溶液加水可变为不饱和溶液B.将℃时a的饱和溶液降温至℃,溶液质量不变C.℃时,两种物质的饱和溶液中溶质质量分数a bD.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等【解析】试题分析:A、任何物质的饱和溶液加水都可变为不饱和溶液,故将t1℃时b的饱和溶液加水可变为不饱和溶液,正确,B、根据溶解度曲线,物质a的溶解度随温度的升高而增大,故将t2℃时a的饱和溶液降温至t1℃,有晶体析出,故溶液质量变小,错误,C、根据溶解度曲线,t2℃时,物质a的溶解度比物质b的溶解度要更大,故两种物质的饱和溶液中溶质质量分数a>b,正确,D,根据溶解度曲线,t1℃时, a、b种物质的溶解度大小关系是:a=b,将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等,正确,故选B考点:溶解度曲线的意义3.氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )A.50℃时,氯化铵的溶解度大于硝酸钾B.a℃时,氯化铵与硝酸钾溶液的质量分数相等C.将60℃的硝酸钾饱和溶液降温会变为不饱和溶液D.40℃时,50g水中加入50g硝酸钾,充分搅拌,得到质量分数约为39%的硝酸钾溶液【答案】D【解析】【分析】【详解】A、从图中看出,50℃时,硝酸钾的溶解度大于氯化铵的,故A不正确;B、a℃时,硝酸钾和氯化铵的溶解度曲线相交,此时两物质的溶解度相等,则其饱和溶液的溶质质量分数相等,其不饱和溶液的质量分数是否相等无法确定,故B不正确;C、硝酸钾的溶解度随温度的升高明显增大,将60℃时硝酸钾饱和溶液降温后会析出晶体,剩余的溶液仍然是低温下的饱和溶液,故C不正确;D、40℃时,硝酸钾的溶解度为64g,则50g水中最多溶解硝酸钾32g,所得溶液的溶质质量分数为32g100%39%32g+50g⨯≈,故D正确。

初三化学溶解度易错压轴选择题易错检测题含答案一、溶解度易错压轴选择题1.如图是A,B,C三种物质的溶解度曲线,下列说法正确的是()A.将C的饱和溶液变为不饱和溶液,可采用升温的方法B.等质量的A,B溶液降温后,析出晶体的质量一定是A>BC.t2℃时三种物质的饱和溶液中溶质质量分数的大小关系是A>B>CD.t2℃时,将50gA放入50g水中,得到A的饱和溶液,其中溶质和溶液的质量比为1:2 2.三种不含结晶水的固体物质甲、乙、丙的溶解度曲线如下图,下列说法正确的是()A.将t1℃时的三种物质的饱和溶液升温至t2℃时,所得溶液的的溶质质量分数大小顺序是乙>甲>丙B.在t2℃时,甲、乙两饱和溶液中含的溶质质量一定相等C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液D.要从含有少量甲的乙溶液中得到较多的乙晶体,通常可采用降温结晶的方法3.将60℃的饱和硝酸钾溶液降温至20℃,没有变化的是()A.溶质质量B.溶剂质量C.溶液质量D.溶质的质量分数4.下列现象或事实,用分子的相关知识解释不正确的是()A.一滴水中大约有个水分子,说明分子很小B.石油气加压后可贮存在钢瓶中,说明分子之间有间隙C.水沸腾时可掀起壶盖,说明分子大小随温度升高而增大D.湿衣服晾在太阳下干得快,说明分子运动速率与温度有关5.根据如图物质的溶解度曲线,判断下列说法正确的是A.将乙的饱和溶液过滤,能得到不饱和溶液B.t1℃时,甲溶液、乙溶液的溶质质量相等C.t2℃185g甲溶液降温至t1℃时,能析出49g晶体D.将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变6.溶液是一种重要的混合物。
下列有关溶液的说法正确的是()A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动B.饱和溶液是一定温度下不能再溶解该物质的溶液C.不饱和溶液通过降低温度一定能变成饱和溶液D.一种物质分散到另一种物质里一定能形成溶液7.下列说法正确的是A.均一稳定的液体一定是溶液B.饱和济液一定是浓溶液C.汽油洗涤油污属于乳化现象D.将氢氧化钠溶于水,所得溶液温度升高8.根据如图的溶解度曲线判断,下列说法正确的是A.50℃时,A 物质的溶解度为 80B.20℃时,B 的溶解度大于 A 的溶解度C.升温可使 C 物质的饱和溶液变成不饱和溶液D.将 50℃三种物质的饱和溶液分别降温到 20℃时,A 析出固体最多9.现有30℃时的氯化钾饱和溶液,在下列情况下溶液中溶质的质量分数不变的是()A.温度不变,向溶液中加入氯化钾晶体B.温度不变,向溶液中加入水C.降低温度至10℃D.升高温度蒸发掉一部分水,温度保持在40℃10.甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是()A.t1℃时,甲乙的溶解度相等,它们饱和溶液的溶质质量分数也相等,都为20%B.t1℃时,30g甲加入到50g水中最多可得80g溶液C.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙D.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲>乙11.如图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是()A.氯化钠B.氢氧化钠C.硝酸铵D.硝酸钾12.M是硝酸钾或氯化铵中的一种。

溶液 溶解度易错题经典一、溶液选择题1.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )A .将等量甲、乙的饱和溶液从t3℃降到t2℃,析出甲的质量大大B .t2℃时,甲和乙的饱和溶液各100 g ,其溶质的质量一定相等C .分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D .t1℃时,丙的饱和溶液中溶质的质量分数为40%【答案】D【解析】A 、将相同质量甲、乙的饱和溶液从t 3℃降到t 2℃,可通过比较甲、乙两物质在t 2℃和t 3℃时溶解度的差的大小作出判断,差值大析出晶体多。
由溶解度曲线可知,t 2℃时两物质的溶解度相等,而t 3℃时甲物质的溶解度大于乙,故析出甲的质量大,正确;B 、据溶解度曲线知,t 2℃时,甲和乙两种溶液的溶解度相同,故t 2℃时,甲和乙的饱和溶液各100g ,其溶质的质量一定相等,正确;C 、甲、乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,t 3℃时甲、乙、丙的溶解度大小关系是甲>乙>丙,由于饱和溶液中饱和时质量分数的计算式: =?100%+100溶解度溶质的质量分数溶解度,即溶解度越大质量分数也就越大,故t 3℃时甲、乙、丙的溶质质量分数大小关系是甲>乙>丙;降温至t 1℃,甲、乙析出晶体,依然是饱和溶液,此时溶解度大小关系是乙>甲,丙降温后变为不饱和溶液,溶质的质量分数与t 3℃时相等,而t 3℃时丙的溶解度小于t 1℃时甲的溶解度,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙,正确;D 、饱和溶液中=?100%+100溶解度溶质的质量分数溶解度知。
t 1℃时,丙的饱和溶液中40g =?100%40g+100g溶质的质量分数<40%,错误。
故选D 。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。

精选备战中考化学易错题专题复习化学溶解度附答案解析一、初中化学溶解度1.下列有关溶液的叙述中,正确的是()A.饱和溶液一定比不饱和溶液浓B.某液体静置后不分层,该液体一定是溶液C.增加溶剂的量可使溶解度增大D.某溶液析出晶体后,其溶质质量分数可能不变【答案】D【解析】【详解】A、同一温度下,同种溶质饱和溶液比不饱和溶液浓,溶液的浓稀与是否饱和没有关系,故A错误;B、静置后不分层的液体不一定是溶液,例如蒸馏水,故B错误;C、对于某固体物质来说其溶解度只与温度有关与溶剂的量无关,故C错误;D、饱和溶液在恒温的条件下,蒸发溶剂,析出晶体后,溶质质量分数不变,故D正确;故选:D。
2.如图是A、B、C三种物质的溶解度曲线,下列说法错误的是A.t1℃时,A、B、C的饱和溶液恒温蒸发等质量的水,析出晶体质量: B>A=CB. t1℃时,物质C饱和溶液的溶质质量分数为20%C.A中混有少量C时,应采用降温结晶的方法提纯AD.将t2℃时的物质A、B饱和溶液降温到t1℃时,两溶液的溶质质量分数: A>B【答案】D【解析】【分析】【详解】A、在t1℃时,B的溶解度比A、C的溶解度大,当饱和溶液恒温蒸发等质量的水,析出晶体质量:B>A=C,说法正确;故不符合题意;B、在t1℃时,物质C饱和溶液的溶质质量分数为:25g100%20%10025g g⨯=+,说法正确;故不符合题意;C、由于A的溶解度受温度的升高而升高,且变化较大,C的溶解度随温度的升高溶解度下降,因此当A中混有少量C时,应采用降温结晶的方法提纯A,说法正确;故不符合题意;D、将t2℃时的物质A、B饱和溶液降温到t1℃时,两物质的溶解度均降低,但是A物质降低的更大,析出的晶体更多;因此,此时两溶液的溶质质量分数:B > A,说法错误;故符合题意;故选D3.图是A、B、C三种物质的溶解度曲线,当等质量的A、B、C三种物质的饱和溶液同时从t=2℃降温到t=1℃时,其中溶质质量分数没有发生改变的是A.AB.BC.CD.AB【答案】C【解析】试题分析:由题中所给的坐标曲线可知,A、B两物质的溶解度随温度升高而升高,C物质随温度的升高而降低,所以当等质量的A、B、C三种物质的饱和溶液同时从t=2℃降温到t=1℃时,C物质的溶解度增大,没有物质析出,所以溶质质量分数不变,A、B均有溶质析出,所以溶质质量分数减小。

初中化学溶液溶解度易错题精选(word)一、溶液选择题1.NaCl、KNO3两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.20℃时,NaCl的溶解度为31.6 gB.将10℃时两物质饱和溶液升温至30℃,溶液中溶质的质量分数都增大C.为了除去NaCl固体中混有的少量KNO3,可加热将其完全溶解后,再通过降温结晶、过滤来除之D.50℃时,将50g KNO3加入50g水中,充分溶解后溶液的质量为92.75g【答案】D【解析】A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
20℃时,NaCl的溶解度为31.6 g;B. 将10℃时两物质饱和溶液升温至30℃,;两种物质的溶解度变大,溶质的质量不变,溶液中溶质的质量分数都不变;C. 为了除去NaCl固体中混有的少量KNO3,可加热将其完全溶解后,再通过降温结晶、过滤来除之;因为硝酸钾的溶解度随温度的降低而迅速减小,而氯化钠的溶解受温度的影响很小,所以降温析出晶体几乎全是硝酸钾。
过滤得硝酸钾固体。
D. 50℃时,将50g KNO3加入50g水中,溶解硝酸钾42.75g,充分溶解后溶液的质量为92.75g;选D2.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是()A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%【答案】D【解析】A、根据题中溶解度曲线图可知t2℃时,甲乙两种物质的溶解度相等,故正确.B、根据题中溶解度曲线图可知, 甲的溶解度随温度的升高而增大,故正确C、t2℃时,甲、乙、丙三种物质的饱和溶液溶质质量分数由大到小的顺序为:甲乙丙;当降温到t1℃,甲乙仍为饱和溶液,丙为不饱和溶液,在t1℃乙的饱和溶液的溶质质量分数大于甲饱和溶液的溶质质量分数;故降温至t1℃,所得溶液中溶质的质量分数的大小顺序为乙>甲>丙D、 t1℃时,丙的饱和溶液中溶质的质量分数为40/140100%=28.6%,故错误故选D3.不含结晶水的甲、乙两种固体物质的溶解度曲线如图所示。

备战中考化学复习化学溶解度专项易错题含答案解析一、初中化学溶解度1.下列有关溶液的说法中,错误的是A.外界条件不改变,溶质不会从溶液中分离出来B.物质的溶解过程通常会伴随着能量的变化C.溶液中的溶质以分子或离子的形式均匀分散在溶剂中保持静止不动,所以溶液具有均一性和稳定性D.改变条件,能够使饱和溶液与不饱和溶液相互转化【答案】C【解析】【分析】【详解】A.溶液是均一稳定的混合物,外界条件不改变,溶质不会从溶液中分离出来,正确;B.微观上看,物质溶解时都有扩散过程(吸热)和水合(放热)两个过程,物质的溶解过程通常会伴随着能量的变化,正确;C.溶液中的溶质以分子或离子的形式均匀分散在溶剂中,相互混合的微粒间以几乎相同的速度远动着,所以溶液具有均一性和稳定性,错误;D.饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。
因此物质的溶解能力受溶质、溶剂、温度的影响,所以改变条件,能够使饱和溶液与不饱和溶液相互转化,正确;选C。
2.下列排序正确的是A.利用金属的年代 B.铁元素质量分数C.碳元素的化合价: D.物质在水中的溶解性:【答案】B【解析】【详解】A、金属的活动性越弱,使用的年代越早,人类最早使用的金属是铜、其次是铁和铝,错误;B、氧化亚铁中铁元素的质量分数是,氧化铁中铁元素的质量分数是,硫化亚铁中铁元素的质量分数是,铁元素的质量分数依次降低,正确;C、甲烷中碳元素的化合价为-4价,一氧化碳中碳元素的化合价为+2价,C60是单质,元素的化合价为0,错误;D、氯化钙易溶于水,碳酸钙难溶于水,氢氧化钙微溶于水,错误。
故选B。
本题考查金属的活动性与使用年代的关系,元素质量分数的求算,元素的化合价和物质的溶解性等知识。
3.如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是()A.Z的溶解度随温度的升高而降低B.t1℃时,Y的溶解度大于Z的溶解度C.t3℃时,X的饱和溶液中溶质的质量分数为40%D.t2℃时,X的溶解度和Y的溶解度相等【答案】C【解析】根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;还可以判断或比较某一物质在不同温度下的溶解度大小;饱和溶液中溶质的质量分数=×100%。
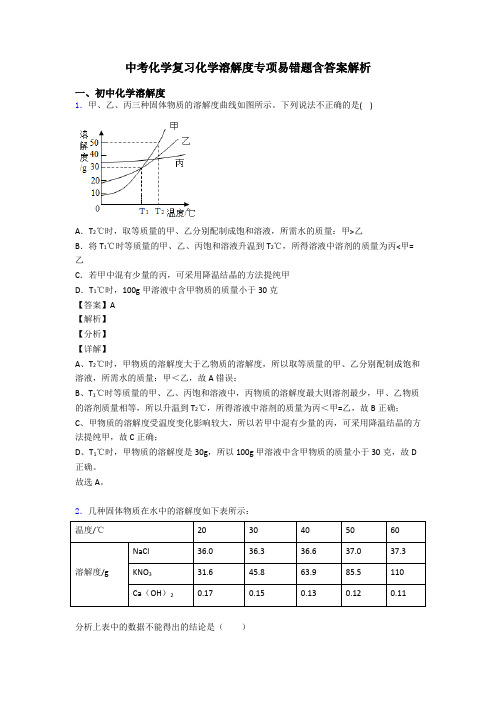
中考化学复习化学溶解度专项易错题含答案解析一、初中化学溶解度1.甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法不正确的是( )A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙B.将T1℃时等质量的甲、乙、丙饱和溶液升温到T2℃,所得溶液中溶剂的质量为丙<甲=乙C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲D.T1℃时,100g甲溶液中含甲物质的质量小于30克【答案】A【解析】【分析】【详解】A、T2℃时,甲物质的溶解度大于乙物质的溶解度,所以取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲<乙,故A错误;B、T1℃时等质量的甲、乙、丙饱和溶液中,丙物质的溶解度最大则溶剂最少,甲、乙物质的溶剂质量相等,所以升温到 T2℃,所得溶液中溶剂的质量为丙<甲=乙,故B正确;C、甲物质的溶解度受温度变化影响较大,所以若甲中混有少量的丙,可采用降温结晶的方法提纯甲,故C正确;D、T1℃时,甲物质的溶解度是30g,所以100g 甲溶液中含甲物质的质量小于30克,故D 正确。
故选A。
2.几种固体物质在水中的溶解度如下表所示:温度/℃2030405060溶解度/g NaCl36.036.336.637.037.3 KNO331.645.863.985.5110 Ca(OH)20.170.150.130.120.11分析上表中的数据不能得出的结论是()A.KNO3在水中的溶解度随温度的升高而增大B.NaCl在水中的溶解度受温度变化影响不大C.固体物质在水中溶解度的大小与溶质的种类有关D.固体物质在水中溶解度的大小与溶剂的种类有关【答案】D【解析】【详解】A、由表中的数据可知,KNO3在水中的溶解度随温度的升高而增大,选项正确;B、由表中的数据可知,NaCl在水中的溶解度受温度变化影响不大,选项正确;C、由表中的数据可知,不同溶质的溶解度在同一温度的溶解度不同,可以得出固体物质在水中溶解度的大小与溶质的种类有关,选项正确;D、由题意可知,表中的数据是不同物质在水中的不同温度时的溶解度,溶剂相同,得不出固体物质在水中溶解度的大小与溶剂的关系,选项错误,故选D。

最新初中化学溶液溶解度易错题精选经典一、溶液选择题1.下表是NaCl、KNO3在不同温度时的溶解度:温度/℃102030405060 NaCl35.836.036.336.637.037.3溶解度/gKNO320.931.645.863.985.5110据此数据,判断下列说法错误的是A.KNO3和NaCl的溶解度曲线在20℃—30℃温度范围内会相交B.在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%C.在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液D.从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法【答案】C【解析】A、根据表格提供的数据可以发现,在20℃~30℃温度范围内硝酸钾和氯化钠存在溶解度相同的数值,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内会相交,错误;B、在60℃时,硝酸钾的溶解度为110g,则105g的KNO3饱和溶液,含有硝酸钾55g,加入95g水后,溶液中溶质的质量分数=×100%=27.5%,错误;C、在20℃时,氯化钠的溶解度为36g,硝酸钾的溶解度为31.6g,NaCl 和KNO3固体各35g分别加入两只各盛有100g 水的烧杯中,氯化钠不能形成饱和溶液,硝酸钾形成饱和溶液,正确;D、硝酸钾的溶解度随温度的升高而变化很大,含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常采用冷却热的饱和溶液的方法,错误。
故选C。
点睛:掌握溶解度随温度变化的特点以及饱和溶液中结晶析出晶体的方法是正确解答本题的关键。
2.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是( )A.用装置甲收集氧气B.用装置乙溶解完全反应后的固体C.用装置丙分离MnO2和KCl溶液D.用装置丁蒸发分离后的溶液得KCl晶体【答案】D【解析】【分析】【详解】A、氧气的密度比空气大,可用向上排空气法收集,故A正确;B、氯化钾易溶于水,二氧化锰难溶于水,溶解用玻璃棒搅拌以加快溶解速率,故B正确;C、过滤时要用玻璃棒引流,故C正确;D、蒸发时要变加热边搅拌,故D不正确。

中考化学复习化学溶解度专项易错题附答案解析一、初中化学溶解度1.t℃时,向饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是()A.仍为饱和溶液B.溶质的质量变小C.溶质的溶解度不变D.溶质的质量分数不变【答案】C【解析】【详解】A、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶液能继续溶解硝酸钠,溶液变为不饱和溶液,故选项说法错误;B、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶质质量不变,故选项说法错误;C、固体物质的溶解度受温度影响较大,不受溶剂质量、溶液质量多少的影响,由于温度不变,溶质的溶解度不变,故选项说法正确;D、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶质质量不变,溶剂质量增加,溶质的质量分数变小,故选项说法错误。
故选C。
【点睛】掌握饱和溶液与饱和溶液的特征与转化、溶质质量分数、溶解度的概念等并能灵活运用是正确解答本题的关键。
2.KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是()温度/℃20304050KCl34.037.040.042.6溶解度S/gKNO331.645.863.985.5A.甲表示KNO3溶解度曲线B.温度t1℃应在20~30℃之间C.40℃时,10gKC1加入20g水中,可得到33.3%的溶液D.50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出【解析】【分析】【详解】A、通过分析溶解度表中的数据可知,硝酸钾的溶解度受温度变化影响较大,所以甲表示KNO3溶解度曲线,故A正确,不符合题意;B、20~30℃,氯化钾的溶解度从34g增大到37g,硝酸钾的溶解度从31.6g增大到45.8g,所以温度t1℃应在20~30℃之间,故B正确,不符合题意;C、40℃时,氯化钾的溶解度是40.0g,所以10gKCl加入20g水中,有固体剩余,形成的是该温度下的氯化钾饱和溶液,故溶液的质量分数为:40.0g100%28.6% 100g+40.0g⨯≈,故C错误,符合题意。

初三化学溶解度易错压轴选择题易错(难)复习测试题含答案一、溶解度易错压轴选择题1.如图是A,B,C三种物质的溶解度曲线,下列说法正确的是()A.将C的饱和溶液变为不饱和溶液,可采用升温的方法B.等质量的A,B溶液降温后,析出晶体的质量一定是A>BC.t2℃时三种物质的饱和溶液中溶质质量分数的大小关系是A>B>CD.t2℃时,将50gA放入50g水中,得到A的饱和溶液,其中溶质和溶液的质量比为1:2 2.A、B、C三种物质的溶解度曲线如图所示,下列说法中正确的是()A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等B.t2C时,把50gA物质放入50g水中得到100g饱和溶液C.将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=AD.将C的不饱和溶液变为饱和溶液,可采用升温的方法3.如图是甲、乙两种物质(不含结晶水)的溶解度曲线,根据图象及相关知识判断,下列说法中正确的是( )A.t2℃时,甲溶液溶质质量分数一定大于乙溶液溶质质量分数B.甲物质的溶解度一定大于乙物质的溶解度C.t1℃时,甲、乙两种物质的饱和溶液,升温到t2℃时,所得溶液溶质质量分数相等D.t2℃时,甲、乙两种物质的饱和溶液,降温到t1℃时,甲析出的晶体比乙多4.如图是甲、乙、丙三种固体物质的溶解度曲线。
下列有关说法错误的是()A.丙物质的溶解度随温度的升高而降低B.T1℃时三种物质的饱和溶液,乙的溶质质量分数最大C.P点表示T2℃时甲、乙两物质的溶解度相等,均为50%D.保持溶质质量分数不变的情况下,使处于Q点的甲溶液达到饱和状态应采取降温的方法5.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是()A.加入溶质B.降低温度C.升高温度D.恒温蒸发溶剂6.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述正确的是()A.t2℃时,甲、乙两种溶液降温至t l℃均有固体析出时,所得甲、乙溶液溶质质量分数相等B.甲中混有少量乙,可用加热蒸发的方法提纯乙C.t l℃时,甲、乙两种饱和溶液的溶质质量相等D.t2℃时,用210 g甲的饱和溶液加水可以配制成500 g 20%的甲溶液7.如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M物质的溶液。

备战中考化学易错题精选-化学溶解度练习题含答案解析一、初中化学溶解度1.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量B.溶剂的质量C.溶液的质量D.溶质与溶剂的质量比【答案】A【解析】【详解】A项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质的质量不变,正确;B项,饱和溶液用水稀释变成不饱和溶液的过程中,溶剂的质量增加,错误;C项,饱和溶液用水稀释变成不饱和溶液的过程中,溶液的质量增加,错误;D项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质与溶剂的质量比发生改变,错误。
故选A。
2.下列排序正确的是A.利用金属的年代 B.铁元素质量分数C.碳元素的化合价: D.物质在水中的溶解性:【答案】B【解析】【详解】A、金属的活动性越弱,使用的年代越早,人类最早使用的金属是铜、其次是铁和铝,错误;B、氧化亚铁中铁元素的质量分数是,氧化铁中铁元素的质量分数是,硫化亚铁中铁元素的质量分数是,铁元素的质量分数依次降低,正确;C、甲烷中碳元素的化合价为-4价,一氧化碳中碳元素的化合价为+2价,C60是单质,元素的化合价为0,错误;D、氯化钙易溶于水,碳酸钙难溶于水,氢氧化钙微溶于水,错误。
故选B。
【点睛】本题考查金属的活动性与使用年代的关系,元素质量分数的求算,元素的化合价和物质的溶解性等知识。
3.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是()A.t1℃时,甲、乙的溶解度相等B.t2℃时,甲的溶解度为50C.甲中混有少量的乙时,可用降温结晶的方法提纯甲D.t1℃时,甲、乙两种饱和溶液恒温蒸发等质量的水,析出晶体的质量相等【答案】B【解析】【详解】A、通过分析溶解度曲线可知,t1℃时,甲、乙的溶解度相等,故A正确,不符合题意;B、t2℃时,甲的溶解度为50g,题中未加单位,故B错误,符合题意;C、甲物质的溶解度受温度变化影响较大,所以甲中混有少量的乙时,可用降温结晶的方法提纯甲,故C正确,不符合题意;D、t1℃时,甲、乙的溶解度相等,所以甲、乙两种饱和溶液恒温蒸发等质量的水,析出晶体的质量相等,故D正确,不符合题意。
初中化学溶液溶解度易错题精选经典一、溶液选择题1.请根据右图的溶解度曲线图,判断下列说法正确的是()A.a、b两物质的溶解度相等B.t1℃时,向20g a固体加入50g 水,充分搅拌后固体能全部溶解C.将t2℃时a、b饱和溶液降温到t1℃时,两者的溶质质量分数相等D.b中含有少量a,可以用冷却热饱和溶液的方法提纯b【答案】C【解析】试题分析:A 根据溶解度曲线可知,只有在℃时两物质溶解度相等;B t 1℃时,a物质的溶解度为36g,也就是说此温度下100g水中最多可以溶解36g a物质;C 从t2℃降温至t1℃时,两物质溶解度相等,且都为饱和溶液,因此质量分数相等;D a、b两物质溶解度变化随温度变化相差较大,因此可以用冷却热饱和溶液的方法提纯a,不可以用来提纯b。
考点:溶解度曲线的意义点评:关于溶解度曲线的题目一直是中考的必考点,常在双选中出现,得分率不是很高,注意仔细审题,避免粗心。
2.甲、乙、丙三种物质的溶解度曲线如图所示。
下列说法错误的是( )A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5% C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法【答案】B【解析】【详解】A、通过分析溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙,故A正确;B、t2℃时,甲物质的溶解度是50g,所以30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为×100%=33.3%,故B错误;C、将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,甲物质的溶解度变化最大,所以析出晶体最多的是甲,故C正确;D、丙物质的溶解度随温度的升高而减小,所以欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法,故D正确。
故选B。
【点睛】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
3.如图是KNO3、MgSO4、NaCl三种物质的溶解度曲线。
下列说法正确的是()A.t2℃时,把40g KNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为4:9B.t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3C.t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,在此操作过程中溶液里无明显现象D.KNO3中含有少量的NaCl杂质,采用蒸发结晶法提纯【答案】B【解析】【详解】A、t2℃时,硝酸钾的溶解度是40g,所以把40g KNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为20g:70g=2:7,故A错误;B、t1℃时,氯化钠的溶解度最大,硝酸钾的溶解度最小,所以t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3,故B正确;C、t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,溶解度减小,在此操作过程中溶液里会析出晶体,故C错误;D、硝酸钾的溶解度受温度变化影响较大,所以KNO3中含有少量的NaCl杂质,采用降温结晶法提纯,故D错误。
故选:B。
4.下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质【答案】C【解析】【详解】A、由题中信息知,A. P点表示甲、丙两种物质溶解度相等,故错误。
B、乙溶解度随温度升高而增大, t1℃时,乙物质的饱和溶液,升温至t2℃时不再是饱和溶液;故C错误。
C、 t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为25∶100=1∶4;故C正确。
D、将三种物质的饱和溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质;故D错误。
故选C。
5.NH4C1和Na2SO4的溶解度表及溶解度曲线如下,下列说法正确的是:()A.甲为NH4C1B.t2时,甲溶液的溶质质量分数一定比乙大C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等【答案】D【解析】A、通过分析溶解度表中的数据可知,氯化铵的溶解度随温度的升高而增大,所以乙为氯化铵;B、饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,由图可知,t2时,甲乙两物质的溶解度相等,所以两物质的饱和溶液溶质的质量分数相同;不饱和时,浓度大小关系不确定,C、甲物质饱和溶液从t3降温到t2,溶解度变大,溶质的质量不变,溶质的质量分数不变;D、t1℃、t3℃时,两物质的溶解度相等,所以等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等,故D正确.选D点睛:在溶解度曲线图上,溶剂的量都是100g,所以分析溶质的质量分数时,只需要比较溶质的多少即可。
溶解度变大时,溶质不变,溶解度减小时溶质质量等于减小后的溶解度6.甲、乙的溶解度曲线如图所示。
下列有关说法不正确...的是A.t2℃时,甲的饱和溶液中溶质和溶剂的质量之比为2:5B.t2℃时甲、乙各100g饱和溶液从t2℃降温到t1℃,溶液质量仍相等C.t1℃时,甲、乙两种饱和溶液中溶质的质量分数相等D.甲中含有少量乙,可以采用降温结晶的方法提纯甲【答案】B【解析】【分析】【详解】A. t2℃时,甲的溶解度为40g,溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。
饱和溶液中溶质和溶剂的质量之比为40:100=2:5;B. t2℃时甲、乙各100g饱和溶液从t2℃降温到t1℃,甲析出晶体较多,剩余溶液质量,甲小于乙;C. 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% ,t1℃时,甲、乙两种物质的溶解度相同,其饱和溶液中溶质的质量分数相等。
D. 甲中含有少量乙,可以采用降温结晶的方法提纯甲;选B7.NaCl、KNO3两种固体物质的溶解度曲线如图所示。
下列说法正确的是A .20℃时,NaCl 的溶解度为31.6 gB .将10℃时两物质饱和溶液升温至30℃,溶液中溶质的质量分数都增大C .为了除去NaCl 固体中混有的少量KNO 3,可加热将其完全溶解后,再通过降温结晶、过滤来除之D .50℃时,将50g KNO 3加入50g 水中,充分溶解后溶液的质量为92.75g【答案】D【解析】A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
20℃时,NaCl 的溶解度为31.6 g ;B. 将10℃时两物质饱和溶液升温至30℃,;两种物质的溶解度变大,溶质的质量不变,溶液中溶质的质量分数都不变;C. 为了除去NaCl 固体中混有的少量KNO 3,可加热将其完全溶解后,再通过降温结晶、过滤来除之;因为硝酸钾的溶解度随温度的降低而迅速减小,而氯化钠的溶解受温度的影响很小,所以降温析出晶体几乎全是硝酸钾。
过滤得硝酸钾固体。
D. 50℃时,将50g KNO 3加入50g 水中,溶解硝酸钾42.75g ,充分溶解后溶液的质量为92.75g ;选D8.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是A .甲的溶解度比乙的大B .t2℃时,甲的溶解度是50 gC .t1℃时,100 g 乙的饱和溶液中溶质的质量为30 gD .t1℃时,甲和乙的饱和溶液中溶质的质量分数均为30%【答案】B【解析】A 、在比较物质的溶解度时,需要指明温度,故错误;B 、通过分析溶解度曲线可知,t 2℃时,甲的溶解度是50g ,故正确;C 、t 1℃时,乙物质的溶解度是30g ,所以130g 乙的饱和溶液中溶质的质量为30g ,故错误;D 、t 1℃时,甲、乙物质的溶解度是30g ,甲和乙的饱和溶液中溶质的质量分数均为30130g g×100%=23.1%,故错误。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
9.如图是a,b,c三种物质的溶解度曲线,下列分析错误的是A.t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中溶解可得a的饱和溶液C.t1℃时,a,b,c三种物质的溶液中溶质质量分数关系是b>a=cD.除去a中少量的c,可采用降温结晶的方法【答案】C【解析】【详解】A. 由溶解度曲线可知,t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c,此选项正确;B. t2℃时,a的溶解度是50g,即t2℃时,100g水中最多能溶解50ga,将50ga物质放入100g水中溶解可得a的饱和溶液,此选项正确;C. t1℃时,a,b,c三种物质的溶解度大小关系是:b>a=c,饱和溶液中溶质质量分数关系是b>a=c,此选项错误;D. 由溶解度曲线可知,a的溶解度受温度影响较大,除去a中少量的c,可采用降温结晶的方法,此选项正确。
故选C。
10.下列有关溶液的说法符合实际的是()A.将澄清的饱和石灰水加热,无白色浑浊出现B.20℃时氯化钠溶解度是36g,将30g氯化钠放入50g水中充分搅拌,得到80g溶液C.硫酸溶液中存在的阳离子全部是H+D.溶液一定是无色透明的液体【答案】C【解析】A、氢氧化钙的溶解度随温度的升高而减小,升温会使溶质析出出现浑浊,故此选项错误.B、由20℃时氯化钠溶解度可知,30g氯化钠不能都溶解在50g水中,只能溶解18g形成68g溶液,故此选项错误.C、硫酸在水中电离时会出现氢离子与硫酸根离子,除氢离子外再无其他带正电的离子,故此选项正确.D、溶液一定透明但不一定无色,例如硫酸铜的溶液是蓝色的,故此选项错误.故选C11.在20℃时,刘冰同学向100g水中依次加入NaCl固体,充分溶解,实验过程如图所示。
下列说法错误的是()A.图②中的溶液是不饱和溶液B.图③中的溶液是饱和溶液C.图③中溶液的溶质质量为40 gD.图③和图④中NaCl溶液的溶质质量分数相等【答案】C【解析】【分析】【详解】A、图②中继续加热氯化钠后,继续溶解,故说明②中是不饱和溶液,故正确;B、由图④可知,在20℃时,100g的水中最多能溶解36g的氯化钠,图3前已经向100g的水中加入了40g的氯化钠,故是饱和溶液,故正确;C、在20℃时,100g的水中最多能溶解36g的氯化钠,图3中已经加入40g的氯化钠,故溶解了36g,故错误;D、③和④中都达到了变化状态,故溶质的质量分数相等,故正确。