2017年高考化学真题分类汇编 专题1 常用化学计量
- 格式:doc
- 大小:353.00 KB
- 文档页数:8

第一单元常用化学计量第一单元│知识框图内容特点1.物质的量是一种以“堆量”计量微观粒子的物理量,不仅难以理解,而且其涉及的知识面也很广泛。
阿伏加德罗常数是物质的量的计量标准,有关它的判断是历年高考题的热点。
2.摩尔质量是在物质的量概念建立的基础上,连接微粒数目和物质质量的一个物理量,从定量角度了解或计算实验或反应中各物质的量的关系。
3.标况下气体摩尔体积是22.4 L·mol-1,是阿伏加德罗定律的特例。
4.物质的量浓度是便于了解溶液中分散质粒子的存在数量的物理量,以此可以了解溶液中离子的量的关系。
5.本单元的重点是物质的量、质量、气体体积、物质的量浓度及其他物理量之间的换算关系,这部分也是高考计算类命题的核心。
第1讲物质的量气体摩尔体积考纲导学要点探究探究点一物质的量摩尔质量【知识梳理】一、物质的量1.物质的量:物质的量是一个表示含有____________粒子集合体的物理量,它的符号是___,物质的量的单位是摩尔(简称摩,符号是_____ )。
物质的量适用于微观粒子,如原子、分子、_______、________、电子、质子、中子等。
2.阿伏加德罗常数:国际上规定,1 mol粒子所含的粒子数与0.012 kg 12C中所含的碳原子数相同,符号为________,通常用_____________________表示。
3.关系式:物质所含粒子数目(N)、物质的量(n)、阿伏加德罗常数(N A)三者之间的关系式:_______。
二、摩尔质量单位物质的量的物质所具有的质量叫____________。
符号为____,单位为__________ (或_______)。
表达式:M=____。
摩尔质量单位为g/mol时,在数值上与物质的________________ ____________ 相等。
【要点深化】1.洞悉阿伏加德罗常数的误区 (1)状况条件在对气体的体积与物质的量关系考查时,题目经常给出非标准状况,如常温常压下或不指明温度和压强等,要特别注意。

第3讲化学用语及常用计量考点一化学用语Z错误!(课前)1.(2017·江苏高考·2)下列有关化学用语表示正确的是(A)A.质量数为31的磷原子:错误!PB.氟原子的结构示意图:C.CaCl2的电子式:D.明矾的化学式:Al2(SO4)3[解析]B代表氟离子,C的电子式表达错误,应该为,D的化学式应为KAl(SO4)2·12H2O,故选A.2.(2016·江苏·2)下列有关化学用语表示正确的是(B)A.中子数为10的氧原子:错误!OB.Mg2+的结构示意图:C.硫化钠的电子式:D.甲酸甲酯的结构简式:C2H4O2[解析]对物质结构的表达式要有清楚的认识,并具有判断能力。
A项考查原子符号,要正确理解符号错误!X的具体含义,左上角A代表质量数,左下角Z代表质子数,如图所示:,其中质量数(A)=质子数(Z)+中子数(N),原子核外电子数=核内质子数=核电荷数,故中子数为10的氧原子可表示为错误!O,错误;B项考查离子结构示意图,正确;C项考查离子化合物的电子式,Na2S的电子式应为,错误;D 项考查有机物的结构简式,结构简式应体现有机物中所含的官能团,故甲酸甲酯的结构简式应为HCOOCH3,错误。
3.(2018·江苏·2)用化学用语表示NH3+HCl===NH4Cl中的相关微粒,其中正确的是(C)A.中子数为8的氮原子:错误!NB.HCl的电子式:-C.NH3的结构式:D.Cl-的结构示意图:[解析]C对:NH3的结构式正确。
A错:中子数为8的氮原子为错误!N。
B错:HCl是共价化合物,电子式为.D错:Cl-的结构示意图为。
4.(2018·北京·8)下列化学用语对事实的表述不正确的是(A)A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H错误!OH错误! C17H35COOC2H5+H182OB.常温时,0。

化学·参考答案与解析专题1化学与STSE化学用语1.解析:选C。
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,A项正确;绿色化学要求从源头上消除或减少生产活动对环境的污染,B项正确;燃煤中加入CaO,CaO可以与燃烧后生成的二氧化硫反应生成CaSO3,并进一步被氧化为CaSO4,从而减少二氧化硫的排放,因此可以减少酸雨的形成,但燃煤中加入CaO不能减少温室气体的排放,C项错误;天然气和液化石油气完全燃烧的产物是二氧化碳和水,属于清洁燃料,D项正确。
2.解析:选C。
石灰、碳酸钠等碱性物质能与废水中的酸反应,因此可以用于处理废水中的酸,A项正确;可溶性的铝盐和铁盐溶于水,电离出的Al3+、Fe3+水解分别生成Al(OH)3、Fe(OH)3胶体,其可吸附水中的悬浮物质,因此可以处理水中的悬浮物,B项正确;氯气与Cu2+、Hg2+等重金属离子不反应,不能用Cl2处理水中的Cu2+、Hg2+等重金属离子,可用Na2S来处理,C项错误;烧碱能与NH+4反应生成NH3,因此可用烧碱处理含高浓度NH+4的废水并回收利用NH3,D项正确。
3.解析:选C。
空调温度低时,需要消耗大量的电能,A项错误;推广使用一次性塑料袋和纸巾会产生“白色污染”且浪费资源,B项错误;少开私家车,可以减少汽车尾气的排放,C项正确;豪华包装会浪费不必要的材料,D项错误。
4.解析:选A。
P的左上角标质量数,左下角标质子数,A项正确;F原子的最外层有7个电子,B项错误;两个Cl-应放在Ca2+的两侧,C项错误;明矾的化学式为KAl(SO4)2·12H2O,D项错误。
5.解析:选A。
人呼出的CO2可与Na2O2反应生成O2,故可用作呼吸面具供氧剂,A 项正确;ClO2具有氧化性,可用于自来水的杀菌消毒,B项错误;SiO2可用于制造光导纤维的原因是其导光性能好,与硬度无对应关系,C项错误;液氨汽化吸收大量的热是其作制冷剂的原因,D项错误。

2017 年高考化学真题分类汇编专题1常用化学计量Ⅰ—阿伏伽德罗常数和物质的量1.(2017?新课标Ⅱ-8 )阿伏加德罗常数的值为N A.下列说法正确的是﹣1NH +的数量为0.1NA.1L0.1mol?L 4CL 溶液中,N H4AB.2.4gMg 与H2SO4 完全反应,转移的电子数为0.1N AC.标准状况下, 2.24LN2 和O2 的混合气体中分子数为0.2N AD.0.1mol H 2 和0.1mol I 2 于密闭容器中充分反应后,其分子总数为0.2N A2.( 2017?新课标Ⅲ-10) N A为阿伏加德罗常数的值。
下列说法正确的是11B 中,含有0.6N+ A.0.1 mol 的 A 个中子 B .pH=1的H3PO4 溶液中,含有0.1N A个HC.2.24L (标准状况)苯在O2 中完全燃烧,得到0.6N A个C O2 分子D.密闭容器中 1 mol PCl 3 与1 mol Cl 2 反应制备P Cl 5(g) ,增加 2 N A个P﹣C l 键3.(2017?浙江-22 )设N A为阿伏伽德罗常数的值,下列说法正确的是A.标准状况下, 2.24 L 乙醇中碳氢键的数目为0.5 N AB.1 L 0.1 mol?L ﹣1 硫酸钠溶液中含有的氧原子数为0.4 N AC.0.1 mol KI 与0.1 mol FeCl 3 在溶液中反应转移的电子数为0.1 N AD.0.1 mol 乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 N AⅢ—常用化学计量综合1. (15 分)(2017?新课标Ⅰ-26 )凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。
已知:NH3 H3BO3 NH3 H3BO3 ;NH3 H3BO3 HCl NH4Cl H3BO3回答下列问题:(1)a 的作用是。

精心整理专题一:化学计量在实验中的应用知识点一:物质的量、摩尔质量以及阿伏伽德罗常数(考点,易错点)1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
(注意任何粒子)2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
(注意任何粒子)3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
(注意单位)4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/N A5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1(3)6.物质的量=物质的质量/摩尔质量 ( n = m/M )例1:列说法中正确的是()A.H2的摩尔质量是2 gB.1 mol氧的质量是C.氧气的摩尔质量是32 g·mol-1D.2 g H2含6.02×10变式练习1.标准状况下有①0.112 L水②0.5N A个HCl氦气⑥6.02×10232.含0.4 mol Al2(SO4)3的溶液中,含、“<”或“=”)3.(1)1 mol_______________________个氢原子。
(2)水所含氢原子数相同。
4. 5 K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·12.2 g该晶体中含氧原子数__________,氢原5.用N A()。
A2N AB.28 g2N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A知识点二:气体摩尔体积与阿伏伽德罗定律(考点,重点,易错点)1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol4. 阿伏加德罗定律:同温同压下,相同的任何气体,含有数目的分子(或气体的物质的量相同)。



2017年高考化学真题分类汇编专题1常用化学计量I —阿伏伽德罗常数和物质的量1. (2017?新课标II ・8 )阿伏加德罗常数的值为 N A .下列说法正确的是+A. lL0.1mol?L 14NHCL 洛液屮.NH 的:助0.1 N AB. 2.4gMg 与H2SO4完全反应,转移的电子数为 0」N A 八“丫C. 标准获沆卡,2.24LN 和O 的混合气体屮分子数为 0.2ND. 0.1molH 2和0 .lmoll 2于密闭容器中充分反应后,其分子总数为0.2N A 2. (2017?新课标III -10) N A 为阿伏加德罗常数的值。
下列说法正确的是0.1 N A 个A. 0.1 mol 的中,含有0.6N A 个中子 B . pH=l 的HsPCh 溶液中,含有H+ C. 2.24L (标准状况)苯在 0中完全燃烧,得到 0.6N 个CO 分子2A2D. 密闭容器屮lmolPCl 3与1 molCl 2反应制备PCl 5(g ),增加2N A 个P - C1键 3. (2017?浙江-22 )设N 为阿伏伽德罗常数的值,下列说法正确的是AA. 标准状况下,2.24 L 乙醇中碳氢键的数目为 0.5 N AB. 1 L0.1 mol?L - 1硫酸钠溶液中含有的氧原子数为0.4 N AC. OJmolKI 与0.1 molFeCl 3在溶液中反应转移的电子数为 0」N A D ・0」mol 乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 N AIII —常用化学计量综合(15分)(2017?新课标I -26 )凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓 硫酸在催化剂存在下将样品屮有机氮转化成镀盐,利用如图所丞装置处理镀盐丄然后通过滴 定测量。
已知: = ' ===回答下列问题:(1)a 的作用是 o(2) b 中放入少量碎瓷片的目的是o f 的名称是o(3) 清洗仪器:g 中加蒸憎水;打开 ki ,关闭k? 、k3 ,加热b ,蒸气充满管路;停止加热,关闭ki , g 中蒸镭水倒吸进入c ,原因是k;打开2放掉水,重复操作2 ~3 次。

2017年高考化学真题分类汇编专题1 常用化学计量(必修1)Ⅰ—阿伏伽德罗常数和物质的量1.(2017•新课标Ⅱ-8)阿伏加德罗常数的值为NA.下列说法正确的是A.1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NAB.2.4gMg与H2SO4完全反应,转移的电子数为0.1NAC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NAD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA【答案】D【解析】A.铵根易水解,所含NH4+数小于0.1NA,故A错误;B.n(Mg)=0.1mol,Mg与H2SO4反应生成Mg2+,则1molMg参与反应转移2mol电子,故0.1molMg参与反应转移0.2mol电子,即0.2NA,故B错误;C.标准状况下,22.4L任何气体所含的分子数为1mol,故2.24LN2和O2的混合气体中分子数为0.1mol,即0.1NA,故C错误;D.H2+I22HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA。
【考点】阿伏加德罗常数。
【专题】阿伏加德罗常数和阿伏加德罗定律。
【点评】本题考查了阿伏伽德罗常数的应用,题目难度不大,注意气体摩尔体积指的是1mol 任何气体的体积为22.4L.2.(2017•新课标Ⅲ-10) NA为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol 的11B中,含有0.6NA个中子B.pH=1的H3PO4溶液中,含有0.1NA个H+C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2NA个P﹣Cl键【答案】A【解析】A.11B中含有中子数=11﹣5=6,0.1 mol 的11B中含有0.6mol中子,含有0.6NA 个中子,故A正确;B.没有告诉pH=1的H3PO4溶液的体积,无法计算溶液中含有氢离子的物质的量就数目,故B错误;C.标准状况下苯不是气体,不能使用标况下的气体摩尔体积计算,故C错误;D.PCl3与Cl2生成PCl5的反应为可逆反应,则生成PCl5的物质的量小于1mol,增加的P ﹣Cl键小于2NA,故D错误;【考点】阿伏加德罗常数;弱电解质的电离;化学计量;物质结构。
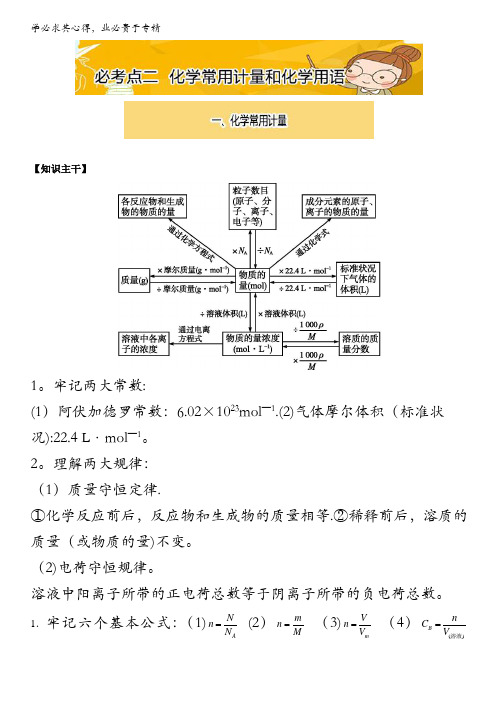
【知识主干】1。
牢记两大常数:(1)阿伏加德罗常数:6.02×1023mol —1.(2)气体摩尔体积(标准状况):22.4 L·mol —1。
2。
理解两大规律:(1)质量守恒定律.①化学反应前后,反应物和生成物的质量相等.②稀释前后,溶质的质量(或物质的量)不变。
(2)电荷守恒规律。
溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
1.牢记六个基本公式:(1)A Nn N = (2)m n M = (3)m V n V = (4)()B n C V =溶液(5)((=100%m m ω⨯溶质)溶液) (6)1000C M ρω= (或=1000cM ωρ )5.阿伏加德罗定律:在同温同压下,同体积的气体含有相同的分子数.同温、同压、同体积、同分子数,这“四同"相互制约,只要其中“三同"成立,第“四同”也成立,即“三同”定“一同”。
即: T 1=T 2;P 1=P 2 ;V 1=V 2 ⇒ n 1 = n 26。
阿伏加德罗定律的推论:原理:同T 、P 下,错误!=错误!=错误! ①n =错误!=错误!=错误! ②气体状态方程 PV=nRT ③(1)三正比:同温同压下,气体的体积比等于它们的物质的量之比错误!=错误! 同温同体积下,气体的压强比等于它们的物质的量之比错误!=n 1n 2同温同压下,气体的密度比等于它们的相对分子质量之比错误!=错误!(2)二反比:同温同压下,相同质量的任何气体的体积与它们的相对分子质量成反比错误!=错误!同温同体积时,相同质量的任何气体的压强与它们的摩尔质量的反比错误!=错误!。
(3)一连比:同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比,也等于它们的密度之比。
m 1m 2 =M 1M 2=错误! (注:以上用到的符号:ρ为密度,p 为压强,n 为物质的量,M 为摩尔质量,m 为质量,V 为体积,T 为温度;上述定律及其推论仅适用于气体,不适用于固体或液体。


化学高考题分类目录A单元常用化学计量A1 阿伏伽德罗常数和物质的量A2 气体摩尔体积阿伏加德罗定律A3 物质的量浓度及溶液的配制A4 常用化学计量综合B单元化学物质及其变化B1 离子反应与离子方程式B2 氧化还原反应概念B3 氧化还原反应的规律及其应用B4 化学物质及其变化综合C单元金属及其化合物C1 钠及其化合物C2 镁、铝及其化合物C3 铁、铜及其化合物C4 金属的通性及金属材料C5 金属及其化合物综合D单元非金属及其化合物D1 无机非金属材料的主角——碳硅D2 富集在海水中的元素——氯D3 硫及其化合物(涉及绿色化学)D4 氮及其化合物(氮、磷)D5 非金属及其化合物综合E单元物质结构元素周期律E1 原子结构E2 元素周期表和元素周期律E3 分子结构化学键E4 晶体结构E5 物质结构元素周期律综合F单元化学反应与能量F1 化学反应与能量变化F2 反应热的计算与重要的反应热F3 原电池原理F4 电解原理F5 化学反应与能量综合G单元化学反应速率和化学平衡G1 化学反应速率G2 化学平衡及勒夏特列原理化学反应进行的方向(课标中必须有)G3 速率、平衡图像G4 等效平衡与化学平衡计算G5 化学反应速率和化学平衡综合H单元水溶液中的离子平衡H1 弱电解质的电离H2 水的电离和溶液的酸碱性H3 盐类的水解H4 胶体的性质及其运用H5 难溶电解质的溶解平衡H6 水溶液中的离子平衡综合I单元有机化合物I1 甲烷、乙烯、乙炔、苯I2 乙醇、乙酸I3 基本营养物质I4 有机化合物综合J单元化学实验J1化学实验常见仪器与基本方法J2 物质的分离、提纯与检验J3 气体的制取J4 综合实验(实验方案设计与评价)J5 化学实验综合K单元烃K1 有机结构认识K2 脂肪烃K3 苯芳香烃K4 烃综合L单元烃的衍生物L1 卤代烃L2 乙醇醇类L3 苯酚L4 乙醛醛类L5 乙酸羧酸L6 酯油脂L7 烃的衍生物综合M单元糖类蛋白质合成材料M1 糖类M2 蛋白质合成材料M3 有机物合成M4 糖类蛋白质合成材料综合N单元物质结构与性质N1 原子结构与元素的性质N2 化学键N3 分子的结构与性质N4 晶体结构与性质N5 物质结构与性质综合O单元化学与技术O1 化学与工农业生产O2 海水的综合利用O3 石油、煤和天然气的综合利用O4 化学与材料、技术的发展发展O5 化学与技术综合。
2017年高考化学真题分类汇编专题1 常用化学计量(必修1)Ⅰ—阿伏伽德罗常数和物质的量1.(2017•新课标Ⅱ-8)阿伏加德罗常数的值为N A.下列说法正确的是A.1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2N AD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2N A【答案】D【解析】A.铵根易水解,所含NH4+数小于0.1N A,故A错误;B.n(Mg)=0.1mol,Mg与H2SO4反应生成Mg2+,则1molMg参与反应转移2mol电子,故0.1molMg参与反应转移0.2mol电子,即0.2N A,故B错误;C.标准状况下,22.4L任何气体所含的分子数为1mol,故2.24LN2和O2的混合气体中分子数为0.1mol,即0.1N A,故C错误;D.H2+I22HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA。
【考点】阿伏加德罗常数。
【专题】阿伏加德罗常数和阿伏加德罗定律。
【点评】本题考查了阿伏伽德罗常数的应用,题目难度不大,注意气体摩尔体积指的是1mol 任何气体的体积为22.4L.2.(2017•新课标Ⅲ-10) N A为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol 的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2N A个P﹣Cl键【答案】A【解析】A.11B中含有中子数=11﹣5=6,0.1 mol 的11B中含有0.6mol中子,含有0.6N A 个中子,故A正确;B.没有告诉pH=1的H3PO4溶液的体积,无法计算溶液中含有氢离子的物质的量就数目,故B错误;C.标准状况下苯不是气体,不能使用标况下的气体摩尔体积计算,故C错误;D.PCl3与Cl2生成PCl5的反应为可逆反应,则生成PCl5的物质的量小于1mol,增加的P ﹣Cl键小于2N A,故D错误;【考点】阿伏加德罗常数;弱电解质的电离;化学计量;物质结构。
【专题】阿伏加德罗常数和阿伏加德罗定律【点评】本题考查阿伏伽德罗常数的计算与判断,题目难度不大,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其它物理量之间的关系,B为易错点,注意缺少溶液体积。
3.(2017•浙江-22)设N A为阿伏伽德罗常数的值,下列说法正确的是A.标准状况下,2.24 L乙醇中碳氢键的数目为0.5 N AB.1 L 0.1 mol•L﹣1硫酸钠溶液中含有的氧原子数为0.4 N AC.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 N AD.0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 N A【答案】CD【解析】A、标况下乙醇为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;B、硫酸钠溶液中,除了硫酸钠外,水也含氧原子,故此溶液中的氧原子的个数大于0.4N A 个,故B错误;C、0.1 mol KI与0.1 mol FeCl3在溶液中能完全反应,且碘元素由﹣1价变为0价,故0.1molKI 反应后转移0.1mol电子即0.1N A个电子,故C正确;D、1mol乙烯和乙醇均消耗3mol氧气,故0.1mol乙烯和乙醇消耗0.3mol氧气即0.3N A个氧气分子,故D正确.【考点】阿伏加德罗常数【专题】阿伏加德罗常数和阿伏加德罗定律【点评】本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构。
Ⅱ—气体摩尔体积和阿伏加德罗定律1.(2017•新课标Ⅱ-8)阿伏加德罗常数的值为N A.下列说法正确的是A.1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2N AD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2N A【答案】D【解析】A.铵根易水解,所含NH4+数小于0.1N A,故A错误;B.n(Mg)=0.1mol,Mg与H2SO4反应生成Mg2+,则1molMg参与反应转移2mol电子,故0.1molMg参与反应转移0.2mol电子,即0.2N A,故B错误;C.标准状况下,22.4L任何气体所含的分子数为1mol,故2.24LN2和O2的混合气体中分子数为0.1mol,即0.1N A,故C错误;D.H2+I22HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA。
【考点】阿伏加德罗常数。
【专题】阿伏加德罗常数和阿伏加德罗定律。
【点评】本题考查了阿伏伽德罗常数的应用,题目难度不大,注意气体摩尔体积指的是1mol 任何气体的体积为22.4L.2.(2017•新课标Ⅲ-10)N A为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol 的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2N A个P﹣Cl键【答案】A【解析】A.11B中含有中子数=11﹣5=6,0.1 mol 的11B中含有0.6mol中子,含有0.6N A 个中子,故A正确;B.没有告诉pH=1的H3PO4溶液的体积,无法计算溶液中含有氢离子的物质的量就数目,故B错误;C .标准状况下苯不是气体,不能使用标况下的气体摩尔体积计算,故C 错误;D .PCl 3与Cl 2生成PCl 5的反应为可逆反应,则生成PCl 5的物质的量小于1mol ,增加的P ﹣Cl 键小于2N A ,故D 错误;【考点】 阿伏加德罗常数;弱电解质的电离;化学计量;物质结构。
【专题】 阿伏加德罗常数和阿伏加德罗定律【点评】本题考查阿伏伽德罗常数的计算与判断,题目难度不大,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其它物理量之间的关系,B 为易错点,注意缺少溶液体积。
Ⅲ—常用化学计量综合1.(15分)(2017•新课标Ⅰ-26)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。
已知:333333NH H BO NH H BO +===⋅;333433NH H BO HCl NH Cl H BO ⋅+===+回答下列问题:(1)a 的作用是 。
(2)b 中放入少量碎瓷片的目的是 。
f 的名称是 。
(3)清洗仪器:g 中加蒸馏水;打开1k ,关闭23k k 、,加热b ,蒸气充满管路;停止加热,关闭1k g ,中蒸馏水倒吸进入c ,原因是 ;打开2k 放掉水,重复操作2~3次。
(4)仪器清洗后,g 中加入硼酸(33H BO )和指示剂。
铵盐试样由d 注入e ,随后注入氢氧化钠溶液,用蒸馏水冲洗d ,关闭3k d ,中保留少量水。
打开1k ,加热b ,使水蒸气进入e 。
①d 中保留少量水的目的是 。
②e 中主要反应的离子方程式为 ,e 采用中空双层玻璃瓶的作用是 。
(5)取某甘氨酸(252C H NO )样品m 克进行测定,滴定g 中吸收液时消耗浓度为1mol L c -⋅的盐酸mL V ,则样品中氮的质量分数为 %,样品的纯度≤ %。
【答案】(1)使容器内气体压强与外界大气压相同(或平衡压强)(2)防暴沸 直形冷凝管(3)停止加热,水蒸气变为液态,装置内压强减小(4)①液封,防漏气 ②432NH OH NH H O ===+-++△↑;保温 (5)1.4cV m ;7.5cV m【解析】(1)该装置利用水蒸气推动3NH 进入g 装置,故a (空心玻璃管)的作用是使容器内气体压强与外界大气压相同(或平衡压强)。
(2)防暴沸 直形冷凝管(3)加热圆底烧瓶使整个装置内充满水蒸气,停止加热,关闭1k 时,右侧装置内水蒸气冷凝为液态,装置内压强减小。
(4)①防止漏气 ②e 采用中空双层玻璃瓶的作用是减少热量损失,尽量保证水以水蒸气形式存在。
(5)①根据N 守恒,甘氨酸中的N 元素被处理成铵盐后,在e 装置中转化为NH 3进入g装置:325243(C H NO )(NH )(NH )(HCl)10n n n n cV +-====⨯,3(N)10n cV -=⨯,(N) 1.4(N)100%%m cV w m m=⨯= ②由于HCl 具有挥发性,可能有部分逸出,导致测量结果偏高,测得N 的含量应为最大值,纯度为757.51000100%%cV cV m m⨯⨯= 。
【考点】探究物质的组成;化学实验基本操作;离子反应与离子方程式;化学计算。
【专题】定量测定与误差分析.【点评】本题考查含量的测定实验设计,为高考常见题型,试题涉及了元素化合物的性质、实验原理、物质制备等,侧重考查学生对实验方案理解及对元素化合物的知识的应用能力, 难度中等。
2.(14分)(2017•新课标Ⅱ-26)水泥是重要的建筑材料.水泥熟料的主要成分为CaO 、SiO 2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。
加入硝酸的目的是 ,还可使用 代替硝酸。
(2)沉淀A 的主要成分是 ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 。
(3)加氨水过程中加热的目的是 。
沉淀B 的主要成分为 (填化学式)。
(4)草酸钙沉淀经稀H 2SO 4处理后,用KMnO 4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO 4﹣+H ++H 2C 2O 4→Mn 2++CO 2+H 2O .实验中称取0.400g 水泥样品,滴定时消耗了0.0500mol•L﹣1的KMnO 4溶液36.00mL ,则该水泥样品中钙的质量分数为 。
【答案】⑴将样品中的Fe 2+氧化为Fe 3+ H 2O 2⑵SiO2SiO2+4HF=SiF4↑+2H2O⑶防止胶体生成,易生成沉淀。
Al(OH)3、Fe(OH) 3⑷45.0%【解析】(1)铁离子在pH较小时易生成沉淀,加入硝酸可氧化亚铁离子生成铁离子,比避免引入新杂质,还可用过氧化氢代替硝酸,故答案为:将样品中的Fe2+氧化为Fe3+;H2O2;(2)由以上分析可知沉淀A为SiO2,不溶于强酸但可与一种弱酸反应,应为与HF的反应,方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2;SiO2+4HF=SiF4↑+2H2O;(3)滴加氨水,溶液呈碱性,此时不用考虑盐类水解的问题,加热的目的是防止生成胶体而难以分离,生成的沉淀主要是Al(OH)3、Fe(OH)3,故答案为:防止胶体生成,易生成沉淀;Al(OH)3、Fe(OH) 3;(4)反应的关系式为5Ca2+~5H2C2O4~2KMnO4,n(KMnO4)=0.0500mol/L×36.00mL=1.80mmol,n(Ca2+)=4.50mmol,水泥中钙的质量分数为(4.50×10—3mol×40g/mol)×100%/0.400g =45.0%,故答案为:45.0%。