焰色反应原理
- 格式:doc
- 大小:17.00 KB
- 文档页数:3

金属焰色反应原理引言:金属焰色反应是一种常见的化学现象,通过观察金属在燃烧时产生的特定颜色,可以推断出金属的存在和性质。
这种现象是基于金属原子在高温下激发电子跃迁的原理,不仅在实验室中被广泛应用,也在工业和环境监测中发挥着重要作用。
一、金属焰色反应的基本原理金属焰色反应的基本原理是基于金属原子的电子结构和能级跃迁。
当金属被加热到高温时,金属原子的外层电子会吸收能量并跃迁到较高的能级。
当电子从高能级返回到低能级时,会释放出能量,这些能量以光的形式辐射出来,形成特定的颜色。
二、金属焰色反应的应用1. 化学实验室中的应用:金属焰色反应被广泛应用于化学实验室中,用于检测金属离子的存在和浓度。
通过观察金属在燃烧时产生的颜色,可以确定金属离子的种类。
例如,钠离子会产生黄色的焰色,钾离子会产生紫色的焰色。
这种方法简单、快速,并且可以同时检测多种金属离子。
2. 工业应用:金属焰色反应在工业中也有广泛的应用。
例如,在金属冶炼过程中,通过观察金属矿石在高温下的焰色,可以判断矿石中所含的金属元素,从而指导冶炼工艺。
此外,金属焰色反应还可以用于金属材料的质量检测和控制,确保产品符合规定的标准。
3. 环境监测:金属焰色反应在环境监测中也有一定的应用。
例如,通过观察大气中金属元素的焰色,可以判断空气中金属污染物的存在和浓度。
这对于环境保护和污染治理具有重要意义。
三、金属焰色反应的局限性和注意事项1. 金属焰色反应只能检测金属离子的存在,无法确定金属的化合价和具体化学形式。
2. 不同金属离子在高温下产生的焰色可能相似,需要结合其他分析方法进行鉴定和确认。
3. 进行金属焰色反应时,需要注意安全措施,避免接触高温和有害物质。
4. 金属焰色反应的结果受到环境条件的影响,如温度、气氛等,需要进行标定和校正。
结论:金属焰色反应是一种基于金属原子电子结构的化学现象,通过观察金属在燃烧时产生的特定颜色,可以推断出金属的存在和性质。
它在化学实验室、工业和环境监测中都有广泛的应用。

硝酸钾焰色反应硝酸钾焰色反应是一种用于化学分析的常见方法,也是一种常见的化学实验。
在这个实验中,我们将观察到不同的金属离子在加热时所产生的颜色变化,从而可以确定样品中含有哪些金属离子。
以下是关于硝酸钾焰色反应的详细介绍。
一、实验原理硝酸钾焰色反应是基于激发态原子发射光谱学的原理。
当金属离子被加热到足够高温度时,它们会处于激发态,这时它们会吸收外部能量并跃迁到更高能级。
当它们回到基态时,它们会释放出光能量,并且这个能量与金属离子的电子结构有关。
由于每种元素都有不同的电子结构和能级跃迁方式,因此每种元素所产生的颜色也不同。
二、实验步骤1. 准备试剂:将硝酸钾溶液稀释至适当浓度,并准备好要测试的金属离子溶液。
2. 加热:将测试样品加入到干净无水的铂丝上,然后将铂丝加热到足够高的温度。
这可以通过使用Bunsen燃气灯或其他加热设备来实现。
3. 观察颜色:当金属离子被加热时,它们会发出特定的颜色。
观察颜色并记录下来。
4. 清理:将铂丝在酸性溶液中清洗干净,并用无水乙醇或其他溶剂清洗干净,以便下一次实验使用。
三、实验注意事项1. 确保试剂和设备是干净的,并且没有任何杂质。
2. 加热过程中要小心,以避免火灾或其他危险。
3. 在实验室中进行此类实验时要遵守安全规定,并使用适当的防护设备(如眼镜、手套等)。
四、实验结果不同金属离子所产生的颜色是不同的。
以下是一些常见金属离子所产生的颜色:1. 钠离子:黄色2. 钾离子:紫色3. 锶离子:红色4. 钙离子:橙黄色5. 铜离子:绿色6. 铁离子:黄色或橙色7. 锰离子:紫色8. 镉离子:蓝色9. 铅离子:蓝灰色10. 锌离子:无颜色或淡粉红色五、实验应用硝酸钾焰色反应在化学分析中有广泛的应用。
它可以用于确定未知样品中含有哪些金属离子,也可以用于检测环境污染物和工业废水中的金属污染物。
此外,硝酸钾焰色反应还可以用于教学实验,以帮助学生更好地理解原子结构和能级跃迁。

点燃mgcl2焰色反应MGCl2是一种常见的无机化合物,具有许多重要的应用。
其中,它还可以通过点燃实验来产生不同的焰色反应。
本文将为你详细介绍点燃MGCl2焰色反应的过程、原理和应用。
首先,我们来了解一下焰色反应的基本原理。
焰色反应是一种利用金属离子在燃烧时激发产生特定颜色的现象。
当化合物中的金属离子受到加热、激发或电子跃迁等外界能量刺激时,其电子会被激发到高能级。
当电子从高能级返回到基态时,会通过释放能量产生特定颜色的光。
每个金属离子的特定颜色由其电子的跃迁和能级结构决定,因此不同的金属离子会产生不同颜色的光。
MGCl2焰色反应是利用氯化镁(MgCl2)中的镁离子(Mg2+)产生的特定颜色的光。
当氯化镁被点燃时,镁离子的电子会被激发到高能级。
随后,电子从高能级返回到基态时,会释放出紫色的光。
这是镁离子特有的焰色反应。
接下来,我们来详细描述一下点燃MGCl2焰色反应的实验过程。
首先,我们需要准备一定量的氯化镁固体。
然后,将氯化镁固体放置在一个适当的容器中,如一个烧杯或试管。
接下来,使用火柴或火炬点燃氯化镁固体,当固体着火时,我们可以观察到呈现出明亮的紫色火焰。
这就是MGCl2焰色反应的现象。
这种焰色反应的原理可以通过量子力学解释。
在镁离子(Mg2+)的能级结构中,存在不同的能级。
当镁离子处于基态时,其电子处于低能级。
而当氯化镁被点燃并释放出能量时,电子会被激发到高能级。
这个过程中,电子吸收了外界能量,并且能量等于电子从低能级跃迁到高能级的能量差。
当电子从高能级返回到基态时,会释放出能量,而能量等于电子从高能级跃迁到低能级的能量差。
这个能量差会以光的形式释放出来,产生紫色的光。
接下来,我们来探讨一下MGCl2焰色反应的应用。
首先,这种焰色反应常用于实验教学中,用于向学生展示金属离子在燃烧时能量跃迁和光的释放过程。
通过观察并比较不同金属离子产生的颜色,学生可以学习到每个金属离子的特定焰色反应。
此外,这种焰色反应也可以用于检测金属离子的存在。

高中化学之焰色反应知识点焰色反应是高考化学选择题中常考知识点,很重要。
而目前的高考方向是原理性考核较多,当然,化学是以实验为基础的学科,操作问题,以及结论性问题也是常考点,所以,焰色反应原理,操作规范,以及常考元素焰色反应现象是学习的重点。
一、焰色反应原理我们知道,每一种原子都有自己的电子层排布,同种原子每一层的能量都不一样,由内向外,依次降低,不同原子同一电子层上即便有相同电子数,所在电子层的能量也不相同,它们对应的能层间的能量差也不一样。
处于基态的原子,若吸收足够的能量,最内层电子会从低能级跨越至高能级,但此时的原子是不稳定的,紧跟着,该电子会重新释放能量,发生从高能级向低能级的跃迁,释放出能量值等于发生跃迁的两能级能量差的光子,光子能量不同,形成的光线焰色就不一样,通过前面讲解可知,每种原子相同能层间的能量差值是不同的,比方说,氧原子中电子从M能层跃迁到K能层,和氮原子中电子从它的M能层跃迁到它的K能层,释放出的能量值是不同的,因为这两种原子,这两层间的能量差不一样,而跃迁过程中,释放的能量值和跃迁的两层间能量差相同,因此,就会释放不同能量的光线(常考的原子发出的光一般是可见光),光线能量不同,所呈现的颜色就不一样。
因此,当将某种物质在火焰上烧时,原子吸收能量后,就会发生电子跃迁,释放出不同能量光子,表现为不同颜色的光线。
二、操作规范1.材料准备样本(须为细粉末状)、铂丝2.操作流程及注意事项1)铂丝在稀盐酸中蘸洗,目的是除去表层氧化物,反应过程中,产生氯化铂,是一种易挥发物质,容易清除,若选用稀硫酸,则会产生硫酸铂,该物质沸点高,不易挥发,若清除不净,会干扰实验。
2)将上述处理过的铂丝,迅速放在酒精灯火焰中烧,至火焰颜色与原来火焰颜色一致。
3)蘸取被检验溶液,放在火焰上烧,将呈现特征颜色。
若是含K物质,须透过蓝色钴玻璃看火焰颜色,原因是现实当中,大部分钾离子溶液中,常含钠离子,而钴玻璃可以过滤钠离子的焰色。

食盐的焰色反应
食盐的焰色反应
1、原理:食盐的焰色反应是属于热反应,在物理反应中包含了放射性成分,当给定一定条件下,热能会导致原子电子结构的改变,引发诸多物理现象,如温度升高、热传导等等,其中被认为是最典型的发光行为之一便是食盐的焰色反应。
2、含盐量:焰色反应的强度与食盐的含盐量有关,食盐的含盐量低则焰色反应暗淡,含盐量高则为强烈的色彩缤纷,反应的色彩主要以棕黄红色出现。
3、反应条件:此反应的要求温度较高,达到450℃以上,最佳温度在700-800℃左右,反应过程同时需要氧等气体及少量存在着有毒物质的碱性离子溶液,另外还要有明火或是火花。
4、反应产物:当准备好反应物,给定此反应条件下,可以看到棕黄红色的火焰,实际上,这样反应产生的最终产物是氢化氯,另外还有部分氰化物、氯化氢、挥发性有机化合物以及一定量的固体残渣,这些物质都会在反应过程中以游离的状态逸出。
5、应用:有的食盐的焰色反应也有着实际用途,它可以用于检测物质中的盐量,也可以用来制备一些有用的物质,例如氰化物等,另外,这种反应的特殊的色彩也常被用作家庭趣味实验,增添着实验的趣味性,让大家在实验过程中有印象深刻的体验。

一、实验目的1. 了解焰色反应的基本原理。
2. 掌握进行焰色反应实验的操作方法。
3. 通过实验观察不同金属元素在火焰中产生的特定颜色,加深对元素性质的认识。
二、实验原理焰色反应是某些金属元素在高温火焰中燃烧时,其原子或离子被激发到较高能级,随后跃迁到较低能级时释放出特定波长的光,形成特定颜色的火焰。
这种颜色与金属元素的电子能级结构有关,是元素鉴定的一种常用方法。
三、实验仪器与材料1. 仪器:酒精灯、铁丝、镊子、玻璃片、酒精、试管夹、火柴等。
2. 材料:金属盐类(如氯化钠、氯化钾、氯化钙、氯化铜、硝酸银等)。
四、实验步骤1. 准备工作:将金属盐类分别放入不同的试管中,用镊子取适量金属盐,放入铁丝上,确保铁丝上无锈迹。
2. 焰色实验:a. 点燃酒精灯,将铁丝放入火焰中加热,待铁丝红热时,取出铁丝。
b. 用镊子夹取适量的金属盐,迅速将金属盐放在火焰上加热,观察火焰颜色。
c. 重复上述步骤,分别进行不同金属盐的焰色实验。
3. 记录实验现象:将实验过程中观察到的火焰颜色记录在实验报告表中。
五、实验现象与结果1. 氯化钠:火焰呈黄色。
2. 氯化钾:火焰呈紫色。
3. 氯化钙:火焰呈砖红色。
4. 氯化铜:火焰呈蓝绿色。
5. 硝酸银:火焰呈黄色。
六、实验分析与讨论1. 实验结果表明,不同金属元素在火焰中产生不同的颜色,这表明焰色反应可以用来鉴定金属元素。
2. 焰色反应的颜色与金属元素的电子能级结构有关,不同金属元素的电子能级结构不同,导致其焰色反应颜色不同。
3. 实验过程中,注意观察火焰颜色的变化,避免将金属盐直接投入火焰中,以免造成实验误差。
七、实验结论通过本次焰色实验,我们了解了焰色反应的基本原理,掌握了进行焰色反应实验的操作方法,并通过观察不同金属元素在火焰中产生的特定颜色,加深了对元素性质的认识。
焰色反应是元素鉴定的一种常用方法,具有简单、快速、准确的特点。
八、注意事项1. 实验过程中,注意安全,避免火灾和烫伤。

烧碱的焰色反应
摘要:
一、烧碱的定义和性质
二、焰色反应的概念和原理
三、烧碱的焰色反应实验方法
四、实验结果与分析
五、结论
正文:
烧碱,也称为氢氧化钠,是一种强碱性化合物,具有强腐蚀性和吸湿性。
它是一种白色固体,易溶于水,其水溶液呈碱性。
在化学实验中,烧碱常用作中和剂、沉淀剂等。
焰色反应是一种金属元素的定性检测方法,它利用金属离子在热的火焰中产生的特定颜色来判断金属的存在。
焰色反应的原理是金属离子在热的火焰中激发电子跃迁,产生特定波长的光,从而呈现出特定的颜色。
烧碱的焰色反应实验方法如下:
1.准备一个小火焰,将烧碱晶体置于火焰上方的铂丝上。
2.观察火焰颜色变化,如果出现黄色火焰,则说明烧碱中含有钠离子。
实验结果显示,当烧碱晶体置于火焰上方的铂丝上时,火焰颜色变为黄色,说明烧碱中含有钠离子。
这一结果与烧碱的化学性质相符,进一步证实了烧碱的焰色反应实验方法的有效性。
通过焰色反应实验,我们可以快速、准确地检测烧碱中的钠离子,为化学
实验和研究提供便利。
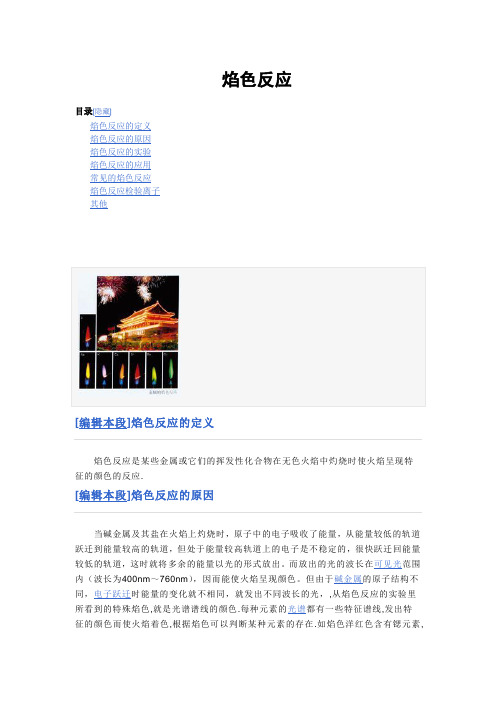
焰色反应目录[隐藏]焰色反应的定义焰色反应的原因焰色反应的实验焰色反应的应用常见的焰色反应焰色反应检验离子其他[编辑本段]焰色反应的定义焰色反应是某些金属或它们的挥发性化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应.[编辑本段]焰色反应的原因当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,,从焰色反应的实验里所看到的特殊焰色,就是光谱谱线的颜色.每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在.如焰色洋红色含有锶元素,焰色玉绿色含有铜元素,焰色黄色含有钠元素等. -------(我认为焰色反应不是碱金属自己发光,而是碱金属激发燃烧的酒精与空气混合物和燃烧产物中的气体分子或气体电离离子而发光,注意我说的是酒精与空气混合物和燃烧产物中的气体分子或气体电离离子发光,这个原理和拉曼光谱增强原理有类似之处)[编辑本段]焰色反应的实验(1)实验用品:铂丝(或铁丝)、酒精灯(或煤气灯)、稀盐酸、蓝色钴玻璃(检验钾时用)。
(2)操作过程:①将铂丝蘸稀盐酸在无色火焰上灼烧至无色;②蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧,观察火焰颜色(若检验钾要透过蓝色钴玻璃观察,因为大多数情况下制钾时需要用到钠,因此钾离子溶液中常含有钠离子,而钠的焰色反应为黄色,黄色与少量的紫色无法分别出来).③将铂丝再蘸稀盐酸灼烧至无色,就可以继续做新的实验了。
[编辑本段]焰色反应的应用焰色反应用于检验某些微量金属或它们的化合物,也可用于节日燃放焰火.[编辑本段]常见的焰色反应钠Na橘黄锂Li紫红钾K浅紫(透过蓝色钴玻璃)铷Rb紫钙Ca砖红色锶Sr洋红铜Cu绿钡Ba黄绿铯Cs 紫红铁Fe 无色稀有气体放电颜色氦He 粉红氖Ne 鲜红氩Ar 紫氙Xe 蓝氡Rn 绿[编辑本段]焰色反应检验离子钠的焰色反应本应不难做,但实际做起来最麻烦。

金属的焰色反应1. 介绍金属的焰色反应是指当金属盐在高温条件下被加热时,发生的特殊光谱现象。
这种现象可以通过观察金属盐在蜡烛火焰、酒精灯或Bunsen燃烧器等体系中的表现来实现。
每种金属离子都有其独特的焰色,这一现象被广泛应用于实验室中的科学研究和化学分析。
2. 原理金属的焰色反应基于原子与电磁辐射相互作用的原理。
当金属盐被加热时,其离子会充分激发,电子会跃迁到高能级轨道。
当这些电子从高能级轨道返回低能级轨道时,会放出特定能量的光子,形成特定的光谱线。
3. 焰色反应的应用3.1. 金属分析焰色反应广泛应用于金属离子的分析中。
通过观察金属离子在焰色反应中的涂色,可以推断金属离子的存在及浓度。
这一分析方法简单、快速,并且具有较高的准确性。
在实验室中,焰色反应常被用于金属离子的定性和定量分析。
3.2. 燃烧器的设计焰色反应在燃烧器的设计中起着重要的作用。
通过选择特定金属盐作为燃料添加剂,可以改变燃烧器的颜色。
例如,向喷气式发动机中添加特定金属盐可以产生蓝色火焰,使发动机在夜间起飞时更容易被观察到。
3.3. 艺术品制作焰色反应在艺术品制作中也有一定的应用。
通过添加金属盐到熔化的玻璃或釉料中,可以制作出具有特殊颜色的玻璃和瓷器。
这些艺术品因其美丽的色彩而备受欣赏。
4. 常见的焰色反应以下是一些常见金属盐的焰色反应及其对应的颜色:•钠离子 (Na+): 黄色•钾离子 (K+): 紫色•铜离子 (Cu2+): 绿色•锰离子 (Mn2+): 紫色•钡离子 (Ba2+): 淡黄色5. 实验步骤进行焰色反应实验时,可以按照以下步骤进行操作:1.准备金属盐溶液:取适量的金属盐溶解在蒸馏水中,制备一定浓度的溶液。
2.点燃火源:点燃蜡烛、酒精灯或Bunsen燃烧器等火源,使其产生适量的火焰。
3.将金属盐溶液挤入火焰中:使用滴管等工具,将金属盐溶液滴入火焰中。
4.观察颜色变化:观察火焰颜色的变化,并与已知的焰色进行对比。
6. 注意事项在进行焰色反应实验时,需要注意以下几点:•操作时应佩戴安全眼镜和实验手套,以防止溶液溅到眼睛或皮肤上。

各种金属焰色反应一、金属焰色反应的概述1.1 金属焰色反应的定义金属焰色反应是指当金属盐在高温条件下被加热时,金属离子因光激发而发生跃迁,从而产生不同颜色的光的现象。
1.2 金属焰色反应的原理金属焰色反应的原理基于激发态原子的发射光谱。
当金属盐被加热时,金属离子的电子吸收能量跃迁至较高的能级,然后经过较短的寿命跃迁至较低的能级,释放出能量,并通过发光来散发出这部分能量。
不同的金属离子跃迁到不同的能级会产生不同颜色的光。
二、常见金属焰色反应2.1 锂的焰色反应•焰色:淡红色•锂离子在激发态与基态之间的能级跃迁导致了红色光的发射。
•示例方程式:LiCl -> Li+ + Cl-•注意事项:锂的反应相对较弱,需要较高的温度才能观察到明显的焰色。
2.2 钠的焰色反应•焰色:黄色•钠离子在激发态与基态之间的能级跃迁导致了黄色光的发射。
•示例方程式:2NaCl -> 2Na+ + Cl2•注意事项:钠的焰色反应在实验室中经常用于演示,因其明亮的黄色光而受到广泛关注。
2.3 钾的焰色反应•焰色:紫色•钾离子在激发态与基态之间的能级跃迁导致了紫色光的发射。
•示例方程式:2KCl -> 2K+ + Cl2•注意事项:钾的焰色反应需要较高温度才能观察到明显的紫色。
2.4 铜的焰色反应•焰色:绿色•铜离子在激发态与基态之间的能级跃迁导致了绿色光的发射。
•示例方程式:CuCl2 -> Cu2+ + 2Cl-•注意事项:铜的焰色反应需要较高温度才能观察到明显的绿色。
2.5 铁的焰色反应•焰色:金黄色•铁离子在激发态与基态之间的能级跃迁导致了金黄色光的发射。
•示例方程式:4FeCl3 -> 4Fe3+ + 6Cl-•注意事项:铁的焰色反应需要较高温度才能观察到明显的金黄色。
三、金属焰色反应的应用3.1 标识金属成分通过观察金属焰色反应,可以初步确认金属成分,从而用于标识和区分不同的金属离子。
3.2 分析金属成分利用金属焰色反应,可以进行金属离子的定性和定量分析。


焰色反应是物理变化还是化学变化
焰色反应是物理变化。
焰色反应,也称作焰色测试及焰色试验,是某些
金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应。
其
原理是每种元素都有其个别的光谱。
1焰色反应是物理变化吗焰色反应是物理变化。
它并未生成新物质,焰色反应是物质原子内部电子能级的改变,通俗的说
是原子中的电子能量的变化,不涉及物质结构和化学性质的改变。
焰色反应
是某些金属或它们的挥发性化合物在无色火焰中灼烧时使火焰呈现特征的颜
色的反应。
有些金属或它们的化合物在灼烧时能使火焰呈特殊颜色。
1焰色反应的原因当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了
能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的
电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的
形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出
不同波长的光,从焰色反应的实验里所看到的特殊焰色就是光谱谱线的颜色. 每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在.如焰色洋红色含有锶元素,焰色蓝绿色含有铜元素,焰色黄色含有钠元素,焰色紫色含有钾元素,砖红色则含有钙元素等。
1焰色反应实验步骤钠离子
钠的焰色测试。

焰色反应的原理
焰色反应是一种利用物质在燃烧过程中产生的不同颜色火焰来确定其化学成分的方法。
其原理是利用金属离子在高温氧化焰中激发电子跃迁的现象。
当某种金属化合物在氧化焰中燃烧时,金属离子会吸收焰火中的能量并激发内层电子跃迁至高能级轨道。
随后,电子从高能级轨道退回到低能级轨道时,会释放出特定频率和能量的光子。
因为不同的金属离子对应不同的电子能级跃迁,所以它们释放的光的频率和波长也不同,从而呈现出不同的颜色。
通过观察金属盐溶液在火焰中的颜色变化,可以根据不同金属的特定颜色来判断其存在与否。
例如,钠离子会产生明亮的黄色火焰,钾离子产生紫色火焰,铜离子则会产生绿色火焰。
根据这些特定的颜色,我们可以对样品中的金属离子进行鉴定和定性分析。
需要注意的是,焰色反应不能用于分析非金属元素和无色金属化合物。
此外,焰色反应只能定性分析金属离子的存在,并不能精确测定其浓度。

焰色反应原子发射光谱
焰色反应是一种用来确定元素的方法,它基于元素在火焰中变成激发态并发射特定光谱的原理。
在焰色反应中,以氧化剂(常见的有氧气、空气或卤元素)作为提供氧气的来源,并用盐酸来调节溶液的酸碱度,使其更有利于元素的离子化。
当试剂溶液中含有待测元素的化合物时,加热使其在火焰中变成激发态,并通过从高能级跃迁到低能级时所发射的光子,发射出特定的光线。
这些光线经过色散后形成一个特定的光谱,称为原子发射光谱。
每个元素的光谱是独特的,因此通过观察和比较光谱,可以确定试剂溶液中含有哪些元素。
焰色反应广泛应用于化学分析和元素检测中,尤其适用于检测质量较小的金属离子。
由于其快速、简单、经济和灵敏度高的特点,它在实验室和现场分析中得到了广泛应用。

钠及其化合物焰色反应
钠的焰色反应
钠及其化合物在火焰中燃烧时,会发出特征性的黄色光芒。
这种现象被称为焰色反应,是识别钠元素及其化合物的便捷方法。
焰色反应的原理
在火焰的高温下,钠原子或离子被激发到高能态。
当它们回到基态时,释放出特定波长的光子,对应于元素的特征谱线。
钠的特征谱线位于可见光谱的黄色范围,因此它发出黄色的光芒。
影响焰色反应强度的因素
焰色反应的强度取决于多种因素,包括:
钠的浓度:钠的浓度越高,焰色反应越强烈。
火焰的温度:更高的火焰温度会导致更多的钠原子被激发,从而增强焰色反应。
其他元素的存在:某些元素,如钾和钙,也能发出黄色的光芒,从而掩盖钠的焰色反应。
钠化合物的焰色反应
钠化合物的焰色反应与游离钠的焰色反应类似。
例如,氯化钠(食盐)在火焰中燃烧时也会发出黄色的光芒。
这是因为高温下氯
化钠分解,释放出钠原子。
应用
焰色反应广泛应用于分析化学和定性分析中,用于:
识别钠元素:通过观察焰色反应的颜色,可以确定样品中是否
含有钠。
定量分析:通过比较焰色反应的强度,可以定量测定样品中钠
的浓度。
火焰光谱学:火焰光谱学是一种分析技术,利用元素的焰色反
应来鉴定和定量样品中的元素。
焰色测试:焰色测试是一种简单的定性分析方法,用于快速辨别不同金属离子的存在。
安全注意事项
在进行焰色反应时,应注意以下安全注意事项:
使用适当的个人防护装备,如安全眼镜和耐热手套。
在通风良好的区域进行实验。
避免直接接触火焰。
实验完成后,妥善处理化学废物。

焰色反应属于化学变化还是物理变化_焰色反应知识点焰色反应是物理变化。
焰色是由于金属原子或离子外围电子发生跃迁,然后回落到原位时放出的能量。
下面我给大家带来焰色反应属于化学变化还是物理变化,期望大家宠爱!焰色反应属于什么变化火焰反应,也称为火焰试验和火焰试验,是某些金属或其化合物在无色火焰中燃烧时使火焰呈现出特征颜色的反应。
原理是每个元素都有自己的光谱。
焰色反应是物理变化。
它并未生成新物质,焰色反应是物质原子内部电子能级的转变,通俗的说是原子中的电子能量的变化,不涉及物质结构和化学性质的转变。
焰色反应的缘由焰色反应试验步骤当钠离子存在于所测试的溶液中,用钴蓝玻璃过滤钠离子的焰色。
钠的焰色反应本应不难做,但实际做起来最麻烦。
焰色反应是某些金属或其挥发性化合物在无色火焰中燃烧时使火焰呈现特征颜色的反应。
一些金属或其化合物在燃烧时会赐予火焰一种特殊的颜色。
发生焰色反应的缘由当碱金属及其盐类在火焰上燃烧时,原子中的电子吸取能量并从低能轨道跳到高能轨道,但高能轨道中的电子不稳定,会快速跳回低能轨道。
能量轨道,此时多余的能量以光的形式释放。
放射光的波长在可见光范围内(波长为400nm到760nm),所以火焰可以着色。
但由于碱金属的原子结构不同,电子跃迁时的能量变化不一样,会发出不同波长的光。
焰色反应试验中看到的特殊火焰颜色就是光谱线的颜色。
每种元素的光谱都有一些特征谱线,发出特征颜色,为火焰着色。
依据火焰的颜色,可以判断出某种元素的存在。
例如,火焰色品红色含有锶元素,火焰色蓝绿色含有铜元素,火焰色含有铜元素。
黄色含钠,火焰紫色含钾,砖红色含钙。
高中化学提分技巧1、高中化学预演格外重要。
提前知道老师要教什么真的很有挂念。
在高中,有些老师为了赶进度而讲得很快,而且跟不上。
这个班的大多数人可能是无知的。
课后你要花更多的时间来弥补你不懂的部分。
2、高中化学要回到课本上。
其实,每次考试结束后,试卷中涉及的高中化学考点都能在课本上找到。

焰色反应是物理变化吗
焰色反应是物理变化。
它并未生成新物质,焰色反应是物质原子内部电子能级的改变,通俗的说是原子中的电子能量的变化,不涉及物质结构和化学性质的改变。
扩展资料
焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。
其原理是每种元素都有其个别的光谱。
样本通常是粉或小块的形式。
用一根清洁且较不活泼的'金属丝(例如铂或镍铬合金)盛载样本,再放到无光焰(蓝色火焰)中。
在化学上,常用来测试某种金属是否存在于化合物。
同时利用焰色反应,人们在在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。
物理变化,指物质的状态虽然发生了变化,但一般说来物质本身的组成成分却没有改变。
例如:位置、体积、形状、温度、压强的变化,以及气态、液态、固态间相互转化等。
还有物质与电磁场的相互作用,光与物质的相互作用,以及微观粒子(电子、原子核、基本粒子等)间的相互作用与转化,都是物理变化。

描述其原理
燃烧火焰色反应是由于原子跃迁而产生的现象,是一种珍贵的化学反应。
它通过将元素的原子从一种状态变化到另一状态来产生蓝色,从
而可以生成美丽的火焰色彩。
原子跃迁是一种过程,它可以使原子从一种能级状态切换到另一能级
状态。
这个转换过程可以获得和释放能量,当它从一种状态切换到另
一种状态时,就会发生一种对激发态能级的分光效应。
这就是原子跃迁,它将吸收可见光,并释放出紫外线能量。
在这种原子跃迁中,会
产生一种紫色的能量级。
这就是燃烧火焰色反应所产生的蓝色光谱。
这种特殊的现象还可以用来识别物质的成分和结构。
例如,燃烧火焰
测试可以用来测定一种物质的化学成分。
它的原理是,根据火焰的颜
色不同,可以大致判断出物质的化学成分。
燃烧火焰色反应不仅可以用来测试化学成分,还有工业应用,如涂料、塑料、汽车等。
通过这种化学反应的原理,把不同种类的原子组合成
一个特定的颜色。
将这些颜色混合在一起,可以产生出各种华丽的塑料、涂料和其他工业产品。
因此可以看到,燃烧火焰色反应是一种重要的化学反应,不仅可以用
来测试化学成分和结构,还可以应用于工业领域,给我们的生活带来
色彩丰富的视觉感受。

焰色反应紫色引言焰色反应是化学实验中常见的一种现象,通过观察物质燃烧产生的火焰颜色可以推测出该物质的成分。
本文将重点介绍焰色反应中产生紫色火焰的原理、过程和示例物质。
焰色反应原理焰色反应是利用物质燃烧时产生的特定颜色火焰来推断物质的成分。
当物质被加热到高温时,其原子或离子中的电子会被激发到高能级,然后再返回低能级时释放出能量,这些能量以光子的形式表现出来,产生不同颜色的火焰。
不同元素或离子释放出的能量不同,因此火焰会呈现出不同的颜色。
焰色反应紫色的原因在焰色反应中,产生紫色火焰的主要原因是气体中存在带有紫色的离子。
常见的带有紫色火焰的离子有锂(Li+), 钾(K+)和镁(Mg2+)等。
这些离子在燃烧时释放的能量对应于紫色光的波长,因此火焰呈现出紫色。
焰色反应紫色的示例物质以下是一些常见的示例物质,它们在焰色反应中会产生紫色火焰:1. 锂离子 (Li+)锂离子在焰色反应中会产生强烈的紫色火焰。
锂盐可以通过添加锂金属到火焰中或者使用锂化合物溶液来观察。
2. 钾离子 (K+)钾离子在焰色反应中也会产生紫色火焰。
钾盐可以通过添加钾金属到火焰中或者使用钾化合物溶液来观察。
3. 镁离子 (Mg2+)镁离子在焰色反应中的紫色火焰相对较弱。
镁盐可以通过添加镁金属到火焰中或者使用镁化合物溶液来观察。
除了上述示例物质外,其他含有锂、钾和镁离子的化合物也可以产生紫色火焰。
使用注意事项在进行焰色反应实验时,需要注意以下几点:1.实验室操作要小心谨慎,确保安全。
2.使用适当的防护设备,如实验手套和护目镜。
3.控制实验室环境,确保火焰安全。
4.使用小量的物质进行实验,以防止火焰过大或不受控制。
结论焰色反应紫色是由带有紫色的离子产生的特定火焰颜色。
在物质燃烧时,离子被激发到高能级,再返回低能级释放能量时,产生紫色光。
通过观察物质在焰色反应中产生的火焰颜色,可以初步判断出该物质的成分。
锂离子、钾离子和镁离子是常见的产生紫色火焰的离子。
焰色反应原理
原理:
金属和它们的盐类,在灼烧时能产生不同的颜色。
利用焰色反应,可以根据火焰的颜色鉴别碱金属元素的存在与否。
这是因为当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为
400nm~760nm),因而能使火焰呈现颜色。
由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,所以放出光的颜色也就不同。
焰色反应不是化学变化,而是物理变化。
观察钾的焰色反应颜色时,要透过蓝色钴玻璃片,以滤去黄色的光,避免钾盐里混有钠盐杂质所造成的干扰。
焰色反应之一:
是某些金属或它们的挥发性化合物在无色火焰中灼烧时使火焰呈现特征
的颜色的反应。
灼烧金属或它们的挥发性化合物时,原子核外的电子吸收一定的能量,从基态跃迁到具有较高能量的激发态,激发态的电子回到基态时,会以一定波长的光谱线的形式释放出多余的能量,从焰色反应的实验里所看到的特殊焰色,就是光谱谱线的颜色。
每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在。
如焰色洋红色含有锶元素,焰色玉绿色含有铜元素,焰色黄色含有钠元素等。
焰色反应之二:
(1)定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,这在化学上叫做焰色反应。
焰色反应用于检验某些微量金属或它们的化合物,也可用于节日燃放焰火。
(2)实验用品:铂丝、酒精灯(或煤气灯),浓盐酸、蓝色钴玻璃(检验钾时用)。
(3)操作过程:
①将铂丝蘸浓盐酸在无色火焰上灼烧至无色;
②蘸取试样在无色火焰上灼烧,观察火焰颜色(若检验钾要透过钴玻璃观察);
③将铂丝再蘸浓盐酸灼烧至无色。
(4)用途:碱金属(碱金属的盐均为可溶性盐)和其它一些金属及其相应离子所发生的焰色反应可用于分析物质的组成,进行有关物质的鉴别。
如:钠或含有的化合物焰色反应为黄色;钾或含的化合物焰色反应为浅紫色(透过钴玻璃)。
实质:离子跃迁
例:
钠:黄色锂:紫红色铷:紫色钙:砖红色锶:洋红色
钡:黄绿色铜:绿色
巧记:
看,那里坐着一个人,
带着紫红色的礼(锂)帽,(锂离子焰色反应为紫红色)
腰扎黄绿色的钡带,(钡离子焰色反应为黄绿色)
坐在含钙的红砖上,(钙离子燃烧砖红色)
正用他那刻有紫色金鱼(铷)的绿色铜剪刀,(铷离子焰色反应为紫色;铜离子焰色反应为绿色)
修理他那蜡(钠)黄蜡黄的浅指(紫)甲(钾)(钠离子焰色反应为黄色;钾离子焰色反应为浅紫色)
还不时鼓起他那洋红色的腮(锶)帮子。
(锶离子焰色反应为洋红色)
关键步骤:洗→烧→蘸→烧→洗。