芽孢显微镜检查标准操作规程 SOP09-501-00
- 格式:doc
- 大小:44.50 KB
- 文档页数:3

显微镜操作规程引言概述:显微镜是一种重要的实验工具,广泛应用于生物学、医学、材料科学等领域。
正确的操作显微镜对于获得准确的观察结果至关重要。
本文将介绍显微镜的操作规程,以匡助读者正确使用显微镜并获得高质量的观察结果。
一、准备工作1.1 清洁显微镜- 使用柔软的棉纱或者镜头纸轻轻擦拭显微镜的镜头和目镜,确保其表面干净无尘。
- 使用专用的清洁液或者酒精擦拭显微镜的外壳和底座,保持整个显微镜的清洁。
1.2 调整光源- 打开显微镜的光源,调节亮度合适的光线。
- 使用准直器或者准直镜,将光线调整为垂直于镜片的状态,确保光线均匀且稳定。
1.3 准备标本- 准备待观察的标本,并将其放置在显微镜的载物台上。
- 调整载物台的高度,使标本与目镜的焦平面相对应。
二、调整显微镜2.1 调整目镜- 调整目镜的焦距,使其与使用者的视力相匹配。
- 调整目镜的瞳孔间距,使双眼看到的图象合并成一个清晰的视野。
2.2 调整物镜- 选择合适的物镜倍数,根据需要进行切换。
- 使用物镜转盘或者旋转物镜头,将物镜对准标本,调整焦距,使标本清晰可见。
2.3 调整聚焦- 使用粗调节旋钮,将载物台挪移到与目镜焦平面相距较远的位置。
- 使用细调节旋钮,逐渐将载物台挪移到与目镜焦平面相距较近的位置,直到标本清晰可见。
三、观察标本3.1 调整照明- 根据标本的特性,调整光源的亮度和角度,以获得最佳的照明效果。
- 注意避免过度照明或者不足照明,以免影响观察结果。
3.2 调整对照度和聚焦- 使用调节孔径的光阑,调整对照度,使标本的细节更加清晰。
- 使用细调节旋钮,微调聚焦,以观察标本不同层次的细节结构。
3.3 记录观察结果- 使用合适的方法记录观察到的结果,如拍照、绘图或者书写观察报告。
- 注意记录标本的名称、倍数、观察条件等关键信息,以便日后参考和分析。
四、结束操作4.1 关闭光源- 在观察结束后,关闭显微镜的光源,以节省能源并延长灯泡的使用寿命。
4.2 清洁显微镜- 使用棉纱或者镜头纸擦拭显微镜的镜头和目镜,确保其表面干净无尘。

显微鉴别标准操作规程中药材、中药成品1 检验依据:《中华人民共和国药典》2010年版(一部)2 定义:通常是借助显微镜,应用植物细胞、组织学和矿物晶体光学等知识鉴别中药材或中成药的一种方法,3 检验操作方法(临时制片法)3.1 仪器和用具3.1.1 仪器生物光学显微镜、显微描绘器、滑走切片机或徒手圆筒生物切片器、镜台测微尺、离心机。
3.1.2 用具放大镜、刀片、解剖刀、镊子(包括粗镊及眼科弯镊与直镊)、剪(眼科剪与手术剪)、解剖针。
载玻片、盖玻片吸湿器(即玻璃干燥器改装蒸馏水加微量苯酚,潮气润湿药材样品用)培养皿或小烧杯(放切片用,切片后的处理均可在其中进行)、酒精灯、铁三角架、石棉网、滴瓶、试管、试管架、滴管、玻璃棒(粗与细)、乳钵、量筒毛笔(从刀上刷取切片用)铅笔(HB、4H、6H绘图用)带盖搪瓷盘(装切片标本用)纱布、吸水纸(滤纸)、火柴等。
3.2 试液3.2.1 水合氯醛试液:取水合氯醛50g,加水15ml与甘油10ml使溶解,即得。
此液为透化剂,可使干缩的细胞壁膨胀而透明,并能溶解淀粉粒、树脂、蛋白质及挥发油等。
3.2.2 甘油醋酸试液(斯氏液):取甘油、冰醋酸与水各等份,混合即得。
此液专用于观察淀粉形态,可使淀粉不膨胀变形,便于测量其大小。
3.2.3 甘油-乙醇溶液:取甘油1份,50%乙醇1份,混合即得。
此液为封藏液,用于保存植物材料及临时切片,有软化组织的作用。
3.2.4 苏丹Ⅲ试液取苏丹Ⅲ0.01g,加90%乙醇5ml溶解后,加甘油5ml,摇匀即得。
本液应置棕色玻璃瓶内保存,在2个月内应用。
此液可使木栓化、角质化细胞壁及脂肪油、挥发油、树脂等染成红色或淡红色。
3.2.5 钌红试液:取10%醋酸钠溶液1~2ml,加钌红适量使呈酒红色即得。
本液应临用新制。
此液可使粘液染成红色。
3.2.6 间苯三酚试液:取间苯三酚1g,加90%乙醇100ml使溶解,滤过即得。
应置棕色玻璃瓶内,在暗处保存。

生物显微镜操作规程1 目的规范生物显微镜的操作使用、保养和维护,以延长仪器设备寿命,使检验结果准确可靠。
2 适用范围本操作规程适用于本公司的生物显微镜。
3 职责3.1使用人员:应按使用说明书或操作规程正确使用,并作好记录。
3.2保管人员:进行日常管理与维护,监督仪器操作是否符合规程。
3.3计量检定员:负责生物显微镜的周期检定计划并实施。
3.4科室负责人:负责该仪器综合管理.4 仪器设备性能技术指标电源:220V/50HZ。
配有4×10×100×物镜,10×16×目镜。
5安全操作注意事项及特别提示5.1应保护好物镜,油镜用后要用二甲苯擦拭镜头,以保证清洁。
5.2本仪器必须设专人管理,实行专管共用,使用人员必须经专门培训。
5.2使用粗调时应注意镜头与载玻片的距离,以免压坏载玻片和镜头,使用微调时应轻而缓慢。
5.3如发生故障应立即报告,送专业单位检修,不得自行修理。
6 操作规程6.1设备运行步骤。
6.1.1将电源插头插入外接电源插座(插入前应检查外接电源电压是否相符)。
6.1.2先将亮度调节柄调节至最小位置,开启电源开关,滑动亮度调节柄至适合位置。
6.1.3转动物镜转化器,将10X物镜置入光路。
6.1.4转动聚光镜升降手轮,使聚光镜上升至定位位置6.1.5将标本置于载物台上,用片夹固定,并借助载物台纵横手轮,将观察物进入聚光镜的照明区域6.1.6拔动光栏拔杆,将孔径光栏开至中间位置。
6.1.7用眼观察,调焦使物像清晰6.1.8瞳距及视度调节左眼观察,并转动双目镜筒上的视度调节圈,使之成像清晰使用物镜时,应在物镜与标本、载玻片与聚光镜前片之间充满显微镜用油。
6.2.使用后的处理6.2.1关闭电源,擦拭镜头,降低载物台,盖上防尘罩6.2.2做好室内清洁,填写记录表格7支持文件:普通生物显微镜的使用说明书。
8记录表格8.1 《仪器设备使用记录》(DXC-64)8.2 《仪器设备维修记录》(DXC-67)8.3 《仪器设备日常点检表》(DXC-68)仪器设备领用申请仪器设备故障记录表仪器设备日常点检表编号:日期:年。

一、目的:建立XSD-1型生物显微镜使用与维护保养标准操作规程,规操作行为,确保仪器使用性能。
二、适用围:适用于XSD-1型生物显微镜的操作。
三、责任者:质检员负责实施,质检科负责人负责监督检查。
四、容:1、注意事项:1.1使用显微镜应避免粗暴的操作或碰击。
1.2不在直射,灰尘多和有振动的地方使用。
1.3拿镜时必须右手握紧镜臂。
左手托住镜座,不可一手提取。
1.4显微镜的机械部分,若发现转动不灵或滑丝时,不能强行扭动,必须查其原因,消除故障。
2、使用:2.1通电源,打开开关。
2.2光源调节2.2.1调节聚光器光圈手柄。
2.2.2调节亮度调节器。
2.3加滤光片。
2.4转物镜转换器,使低倍镜与镜筒成一直线,调节聚光器光圈手柄,使镜视野明暗一致。
2.5观片时,临时制片必须加盖玻片,盖片周围过多封藏液须用小纸吸拭干净。
将欲观察的制片从前方置入载物台上,使欲观察的部分置于透光孔的中心。
2.6从侧面观察物镜与载玻片的距离,慢慢转动大调节轮,使镜筒与载玻片相距5mm以上为止,切勿使其接触而损坏镜头及载片。
2.7自目镜观看(单目显微镜用左眼自目镜观看),并慢慢转动大调节器,直到模糊物象为止。
若观看部分不在视野中心,则慢慢移动载片,使之适中。
2.8看到物像后,再转动小调节器,直到看到最清楚的物像为止。
2.9高倍镜使用法:观片时,应先用低倍观察,看清物像后再换高倍镜观察。
2.9.1在低倍镜找到物像后,移至视野中央。
2.9.2从侧面注视,小心转过高倍物镜。
2.9.3调节小调节器直到看清物像为止,不能盲目使用大调节器,以防碰坏玻片,损坏物镜镜头。
2.9.4若视野转暗,可调节聚光器光圈手柄以增加亮度。
2.10使用完毕,取下观察物品,把物镜转离透光孔,将载物台降至最低,调节亮度至最暗,关闭开关,切断电源。
3、保存注意事项:3.1如需清洁显微镜,则光学部分只能用专用擦镜纸擦拭,机械部分可用绸布擦拭。
3.2切勿将载玻片上封存液体污染镜头。

微生物显微镜(Leica DM500型)1、目的规范操作程序,正确使用仪器,保证检测工作顺利进行,更好地维护保养仪器。
2、适用范围适用于微生物显微镜(Leica DM500型)的使用操作。
3、程序3.1接通电源,按下位于镜座右手侧的开关,调节位于镜座左手侧的光调节钮以调节进光强度,直到视野内的光线均匀明亮为止。
3.2放置玻片标本:取一玻片标本固定于载物台上,使有盖玻片的一面朝上,切不可放反,用推片器弹簧夹夹住,然后旋转推片器螺旋,将所要观察的部位调到通光孔的正中。
3.3调节焦距:先选择物镜的低倍镜头,左手按逆时针方向转动粗准焦螺旋,使镜台缓慢地上升至物镜距标本片约5毫米处,应注意在上升镜台时,切勿上升过多,以免造成镜头或标本玻片损坏。
然后,双眼同时睁开在目镜上观察,左手顺时针方向缓慢转动粗准焦螺旋,使镜台缓慢下降,直到视野中出现清晰的物象为止。
一定要先在低倍镜下把需进一步观察的部位调到中心,同时把物象调节到最清晰的程度,才能进行高倍镜的观察。
3.4转动转换器,调换上高倍镜头,双眼在目镜上观察,此时一般能见到一个不太清楚的物象,可将细准焦螺旋逆时针移动约0.5-1圈,即可获得清晰的物象(切勿用粗调节器)。
3.5使用油镜:转动转换器,调换上油镜。
在玻片标本的镜检部位滴上一滴香柏油,用粗准焦螺旋将载物台缓缓地上升,使油镜头浸入香柏油中,使镜头几乎与标本接触,用粗准焦螺旋将载物台徐徐下降,当出现物像一闪后改用细准焦螺旋调至最清晰为止。
3.6观察完毕后,下降载物台,将油镜头转出,先用擦镜纸擦去镜头上的油,再用擦镜纸蘸少许乙醚酒精混合液(乙醚2份,纯酒精3份)或二甲苯,擦去镜头上残留油迹,最后再用擦镜纸擦拭2-3下即可。
3.7取下玻片标本,将各部分还原,先调节左手侧光调节钮将强度调至最暗,再关掉右手侧开关,拔掉电源,盖上镜罩。
最后填写仪器使用记录表。
注意事项:1.持镜时必须是右手握臂、左手托座的姿势,不可单手提取,以免零件脱落或碰撞到其它地方。

镜检操作规程材料用具:显微镜,擦镜纸,纱布革兰氏染液香柏油,自来水,95%酒精;载玻片,插镜纸,接种环,镊子,酒精灯;金黄色葡萄球菌,枯草芽孢杆菌,未知菌12小时的液体培养液大肠杆菌和酵母菌平板1.涂片;左手持菌液试管,右手持接种环在火焰中灼烧,冷却后从试管中去菌液一滴,在洁净载玻片上做一涂膜;从固体斜面或平板上取菌时,用无菌接种环取少量菌体,涂抹均匀于玻片上预先滴有的一滴自来水中;2.干燥在空气中自然干燥或在火焰快速通过干燥(与热固定同步进行).3.热固定用镊子夹住涂片一端, 在火焰上连续通过几次;以载玻片在手背上试感觉不烫为宜.4.染色在固定的标本上加结晶紫染液1-2滴,染色1min,轻轻滴加水洗; 吸干, 加半滴水, 盖上盖玻片, 滴上半滴镜油油镜检。
(到此实际上即为细菌普通染色)5.注意标本中细菌的形态,大小,排列显微镜操作规程1、安放:右手握住镜臂,左手托住镜座,使镜体保持直立。
桌面要清洁、平稳,要选择临窗或光线充足的地方。
单筒的一般放在左侧,距离桌边3~4厘米处。
2、清洁:检查显微镜是否有毛病,是否清洁,镜身机械部分可用干净软布擦拭。
透镜要用擦镜纸擦拭,如有胶或粘污,可用少量二甲苯清洁之。
3、对光:镜筒升至距载物台1~2厘米处,低倍镜对准通光孔。
调节光圈和反光镜,光线强时用平面镜,光线弱时用凹面镜,反光镜要用双手转动。
若使用的为带有光源的显微镜,可省去次步骤,但需要调节光亮度的旋钮。
4、安装标本:将玻片放在载物台上,注意有盖玻片的一面一定朝上。
用弹簧夹将玻片固定,转动平台移动器的旋钮,使要观察的材料对准通光孔中央。
5、调焦:调焦时,先旋转粗调焦旋钮慢慢降低镜筒,并从侧面仔细观察,直到物镜贴近玻片标本,然后左眼自目镜观察,左手旋转粗调焦旋钮抬升镜筒,直到看清标本物像时停止,再用细调焦旋钮回调清晰。
操作注意:不应在高倍镜下直接调焦;镜筒下降时,应从侧面观察镜筒和标本间的间距;要了解物距的临界值。

检验科显微镜使用标准操作规程SOP文件
检验科显微镜使用操作规程 SOP文件一、使用步骤
1.观察时,应先用低倍镜开始,把镜筒粗调一定高度。
2.将标本安放在载物台上。
3.再将低倍镜下端降至快接触到标本上。
4.眼睛放在目镜上方的眼点处,先用粗调慢慢升起镜筒。
5.换高倍镜时,不须重新调焦,即可看到物象,观察时随时调节微调。
6.用油镜时,需滴高级镜油一滴在标本上,将镜筒粗调至油滴上,再调微调可看到物象。
7.使用后应将擦拭干净,把两个物镜偏到两旁,最后放入柜中。
二、注意事项
1.取放方法要正确,防止目镜,反光镜下滑损坏。
2.注意镜头的保护。
镜头脏了只能蘸一点二甲苯顺着一个方向擦,防止镜头开胶镜片脱落。
3.粗、细螺旋的使用要正确。
防止镜筒下降时砸坏物镜和玻片。
4.转换器使用时,不要手指扳着物镜,防止镜头松动,改变焦距。
影响观察的清晰度。
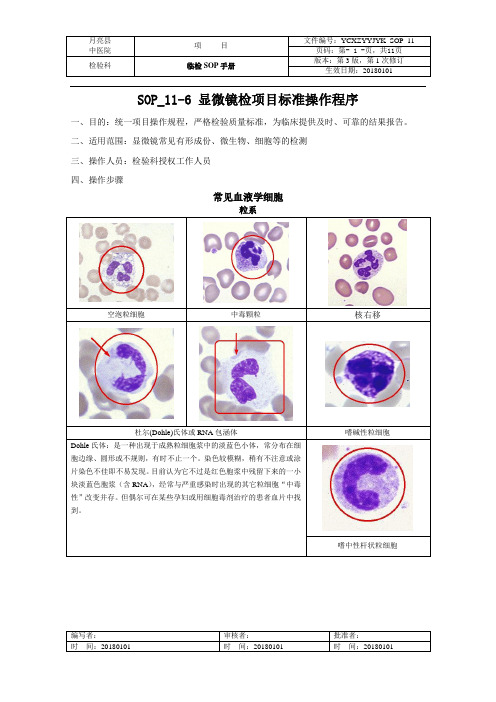
SOP_11-6 显微镜检项目标准操作程序一、目的:统一项目操作规程,严格检验质量标准,为临床提供及时、可靠的结果报告。
二、适用范围:显微镜常见有形成份、微生物、细胞等的检测三、操作人员:检验科授权工作人员四、操作步骤常见血液学细胞粒系空泡粒细胞中毒颗粒核右移杜尔(Dohle)氏体或RNA包涵体嗜碱性粒细胞Dohle氏体:是一种出现于成熟粒细胞浆中的淡蓝色小体,常分布在细胞边缘、圆形或不规则,有时不止一个。
染色较模糊,稍有不注意或涂片染色不佳即不易发现。
目前认为它不过是红色胞浆中残留下来的一小块淡蓝色胞浆(含RNA),经常与严重感染时出现的其它粒细胞“中毒性”改变并存。
但偶尔可在某些孕妇或用细胞毒剂治疗的患者血片中找到。
嗜中性杆状粒细胞红斑狼疮细胞嗜酸性粒细胞嗜中性粒细胞红系(异形红细胞)刺毛红细胞Cabot环亦称锯凿细胞。
包括刺细胞、钻细胞及距细胞。
往往见于微血管病性溶血性贫血、丙酮酸激酶缺乏症、PNH,距细胞多见于肝脏疾病,钻细胞也见于尿毒症。
在红细胞内染成紫红色的纤细的大环形或8字形物质,常出现于嗜多色性、点彩和含H-J小体的红细胞内,其确切来源尚不清楚,有人认为是人工形成的变性蛋白,也有人认为是残留的纺锤丝或融合的微管。
一般很少见到,偶见于铅中毒或恶性贫血患者血片中,但多数人认为无显著临床意义。
H-J小体靶形红细胞球形红细胞是核的残留物,表现为在成熟或晚幼红细胞胞浆内有一至数个染成深紫红色的小圆点,大小不一。
多见于巨幼细胞性贫血、溶血性贫血、脾切除后以及缺铁性贫血等的骨髓及血片红细胞中央色深,外周以苍白圈,在近红细胞边缘处又较深。
形同射击之靶,在正常情况下靶形细胞极少见。
但在黄疸、肝病、脾切除后,缺铁性贫血,尤其是在地中海贫血的血涂片上颇为常见此种红细胞直径缩短,厚度增加,细胞中心区的血红蛋白比周围多,呈小球形状。
常见于遗传形红细胞增多症、自身免疫性溶血性贫血、异常血红蛋白病(如Hb-S等)Bite Cell 红细胞双淡染区红细胞固缩红细胞由于细胞内血红蛋白变性或沉淀成块,使细胞呈半圆形,提示可能有红细胞膜的缺乏,如G-6-PD缺乏症红细胞中有一侧清晰区,而血红蛋白浓缩偏向另一侧,临床上常见于婴儿固缩红细胞增多症血红蛋白C 结晶裂红细胞口形红细胞HbC溶解度较低,高浓度时则析出棍棒状或六角形结晶,一般用较厚的血片、缓慢干燥后作罗氏染色,或在玻片上加3g/LNaCl液2滴,再加新鲜血1滴,复以盖片,四周涂凡士林,在37℃放置一小时后用油镜观察,即可见到.指红细胞碎片,包括盔形红细胞等,多见于弥散性血管内尿液、微血管病性溶血性贫血和心源性溶血性贫血等红细胞破碎综合症;其它常见于化学中毒、肾功能衰竭、血栓性血小板减少性紫癜口形红细胞的中心淡染区呈条状,这种细胞正常小于4%,增高见于口细胞增多症,急性酒精性中毒时可大于5%点彩红细胞晚幼红细胞缺铁性红细胞又名嗜碱性点彩红细胞,血片中有时可见在染色正常的或胞浆嗜多色性红细胞内出现大小不等、多少不一的深兰色颗粒者称为点彩红细胞体:直径7-10μ胞核:圆形,稍偏或居中,占细胞的1/2以下,粗糙虽不规则致密团块。

细菌室SOP文件—显微镜检查法显微镜检查是细菌鉴定工作中的一重要手段,有助于细菌的初步鉴别,同时对下一步鉴定工作起着重要的指导作用。
有时通过形态学检查可得到初步诊断,如痰中的抗酸杆菌和泌尿生殖道分泌物中的淋病奈瑟菌等。
显微镜检查有不染色标本检查法和染色标本检查法两种。
1. 不染色标本的检查:不染色标本主要用于检查细菌的动力及运动状况。
1.1压滴法:用接种环取细菌悬液2环,置于清洁载玻片中央,覆上盖玻片,于高倍镜下观察。
制片时菌液要适量,不可有气泡,不可外溢。
1.2 悬滴法:取洁净的凹窝载玻片及盖玻片各1块,将凹孔四周的平面上涂上一层凡士林,取一环菌液置盖玻片中央,将凹窝载玻片的凹面向下,对准于盖玻片的液滴上,然后迅速翻转玻片,用小镊子轻压盖玻片使之与凹孔边缘粘紧。
镜下观察时先低倍后高倍,不可压碎盖玻片。
有动力的细菌可见细菌从一处移到另一处,无动力的细菌呈布朗运动而无位置的改变。
螺旋体由于菌体纤细、透明,需用暗视野显微镜观察其形态、活动。
2. 染色标本检查法:通过对标本的制片及染色,能观察细菌的形态、大小、排列、染色特性以及荚膜、芽胞、异染颗粒等结构,有助于细菌的初步鉴定。
2.1快速革兰染色法2.1.1操作见试剂说明书2.1.2结果:革兰氏阳性菌呈紫色,革兰氏阴性菌呈红色。
2.1.3 注意事项:染色关健在于涂片和脱色,涂片不宜过厚,固定不宜过热,脱色不宜过度,菌龄为18~24小时为佳。
2.2抗酸染色法2.2.1操作见试剂说明书2.2.2结果:抗酸杆菌呈红色。
2.2.3注意事项:每一张玻片只能涂一份标本且不能在染色缸中染色,以免造成不同标本间的交互污染从而导致阴阳性结果混淆,脱色时间宁长勿短,至无红色液体流下为止。
2.3阿尔培异染颗粒染色法:2.3.1初染:涂片上滴加第一液染剂(甲苯胺蓝和孔雀绿的乙醇溶液),染3-5分钟,水洗。
2.3.2复染:第二液染剂(碘化钾溶液)染1分钟,水洗。
自然干燥后镜检。

1.8.2芽孢总数测定的标准操作规程1.8.2.1检验目的和范围对无菌操作条件下获得的样品原液,配制的样品稀释液进行芽孢总数的测定。
1.8.2.2操作程序一、样品准备1、在无菌操作条件,将10ML室温状态下的待测样品加入一个灭菌试管中,盖好棉塞。
2、在同直径的试管中加入10ML同样室温状态下的水,并插入温度计。
3、将两支试管同时放入80℃水浴中保温,当水中的温度计达到80℃时开始计时。
计时达10分钟后迅速将样品管取出,编号后记录,置于4-10℃冷水中迅速降温到室温。
无菌操作条件对降温后样品进行稀释,编号后记录于“微生物操作表”中。
原料选择10-2-10-4三个稀释度的样品稀释。
中间产品选择10-1至10-2两个稀释度的样品稀释液。
问题产品检验选取10-1至10-2两个稀释度的样品稀释液。
二、培养基准备1、检查预先经过灭菌处理的营养琼脂培养基是否处于正常。
2、将灭菌培养基用微波炉加热2分钟,或用水浴融化后,在40-45℃水浴中保温待用。
三、接种培养在无菌操作条件下,在一个灭菌平皿内倾入15ML营养琼脂培养基,并暴露至接种过程结束,标记后以做为环境对照品。
2、按照样品编号在灭菌平皿底部作相应标记,并记录在“微生物检验操作表”中。
3、在无菌操作条件下,用1ML的灭菌吸管移取1ML选定的样品稀释液或样品原样至灭菌平皿中。
4、同上对同一样品重复操作,即每个选定的样品稀释度做两个平皿。
5、按以上步骤,以1ML无菌生理盐水作为空白操作对照。
6、在无菌操作条件下,将约15ML的营养琼脂培养基倾入样品平皿中,将平皿置于操作台面上轻轻转动。
使样品和培养基混合均匀。
7、待琼脂凝固后,将平皿翻转,即保持有标记和培养基的一面朝上。
8、将所有平皿(包括空白和环境对照)置于32±1℃的恒温培养箱内,保持培养72小时。
9、在“微生物检验操作表”中记录保温时间。
四、菌落计数1、选择菌落数在30至300之间的平皿为标准,在菌落计数器上计数每个平皿上的菌落总数,记录在“微生物检验操作表中”。

生物显微镜使用及维护保养标准操作规程1目的本SOP规定了生物显微镜的操作、维护清洁及注意事项,以达到操作者正确操作及维护的目的。
2范围本SOP适用生物显微镜的操作、维护清洁及注意事项。
3职责仪器操作人员执行本SOP。
4内容4.1准备确认使用记录登记状态完好。
确认电源线路系统运行正常,无破损。
4.2操作4.2.1取下显微镜的防尘罩,接通电源,开启电源开关,根据玻片性质调整内置照明灯光亮度及光圈大小,使视野亮度处于合适范围。
4.2.2将事先准备好的玻片放到载物台上,用标本片夹持器夹好,转动调解螺旋使得观察样品大致位于物镜正下方。
4.2.3先用低倍物镜观察样品,转动粗准焦螺旋,把样品移到视野中间并调至清晰。
4.2.4转动转换器,使高倍物镜(10倍)对准样品,调节细调节螺旋,使视野清晰;如果样品稍有偏离视野中央则把样品调到中央。
4.2.5再次转动转换器,使高倍物镜(40倍)对准样品进行观察,方法同10倍物镜操作方法;此时视野亮度可能会变暗,应当调节内置照明灯光亮度或光圈大小使视野亮度处于合适范围。
4.2.6观察完样品后,取下载玻片,先将聚光器降下,再将物镜转成“八”字形,转动粗调节螺旋使载物台下降到最低处,关闭电源,罩上防尘罩,将显微镜归位。
填写设备使用记录。
5注意事项5.1长时间不使用显微镜时(如中途离开制备标本)应关闭显微镜;使用时间较长时应暂停片刻等内置光源冷却后再继续使用。
5.2取放玻片时应保证载物台处于最低处以免玻片划伤物镜。
5.3遵循先低倍后高倍的原则,先用低倍镜找寻视野,后用高倍镜观察现象。
5.4在观察玻片前要确保盖玻片擦拭干净,否则可能污染高倍物镜;当镜头污染后必须用擦镜纸擦拭,不得使用普通的卫生纸等,且擦镜头时不宜使用高浓度酒精以免破坏镜头的增透涂层。
5.5应安放于平稳、平整的台面上使用。
6清洁与维护清洁显微镜,清理工作现场,拔掉电源。
7参考文件生物显微镜说明书。

1目的建立微生物限度检查的标准操作规程,确保检验结果的准确性。
2 X围适用于本厂质监科化验室对本厂生产的固体制剂及物料进行微生物限度的检查。
3 责任化验员有责任按照本操作规程进行检验、判定,并对检验结果负责。
4 定义微生物限度检查法系指非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法,包括染菌量及控制菌的检查。
5内容5.1总则:5.1.1供试品应随机抽样。
一般抽样量为检验用量(2个以上最小包装单位)的3倍量。
5.1.2 供试品在检查前不得开启,检查全过程均应严格遵守无菌操作规程,严防再污染。
5.1.3 控制菌的污染检查应做相应的已知菌对照试验,对照菌株为大肠杆菌[CMCC(B)44102],每批试验已知菌加入量为50-100个。
5.1.4 染菌量的检查或控制菌的检查均应做空白对照试验。
5.1.5 供试品稀释成稀释液后应在均匀状态下取样,凡有抑菌成份或防腐剂的供试品应做特殊处理后进行检验。
5.1.6 供试品稀释后应在1小时内操作完毕。
第2页/共6页5.1.7 除另有规定外,细菌培养温度为30-35℃,霉菌、酵母菌培养温度为25-28℃,控制菌培养温度为36℃±1℃。
5.1.8细菌、霉菌检验结果的报告以1g、1ml或10cm2为单位;控制菌检验报告以每1g、每1ml或每10cm2为单位报告“检出”或“未检出”。
5.2仪器、用具恒温培养箱、隔水式生化培养箱、电子天平,移液管(1ml、10ml)、试管、离心管、双碟、镊子、剪刀、不锈钢吸管筒、酒精灯、取样勺、称量纸、研钵一个、不锈钢双碟筒。
5.2.1用具的包扎移液管:用纱布包住移液管,然后放入不锈钢灭菌筒内。
试管、双碟:试管在管口塞上纱布棉塞、双碟放入不锈钢双碟筒内。
无菌衣、裤、帽、口罩:用布口袋将洗净的衣裤、帽子、口罩配套后装入,扎紧袋口,再用牛皮纸包好。
5.2.2用具的灭菌将包扎好的用具,在121±0.5 ℃蒸汽灭菌柜中灭菌30 分钟,物品取出时切勿立即置冷处,以免急速冷却灭菌物品内蒸汽凝造成负压,易致染菌,应置烘箱烘干。

食品中芽孢测定操作规程1 目的对公司产品的芽孢测定制定标准操作规程,检验室操作人员按本规程操作,保证公司大肠菌群检测结果准确。
2 范围本操作规范适用于固体和半固体样品及液体样品。
食品微生物学检验芽孢测定3 定义某些细菌在其生长发育后期,在其细胞内形成一个圆形。
椭圆形、厚壁,含水量低,抗逆性强的休眠体构造。
4 仪器和设备微生物实验室常规灭菌及培养设备外,其他设备和材料如下:4.1恒温培养箱:36℃±1℃4.2 冰箱:2℃-5℃4.3 水浴箱4.4天平:感量0.1g4.5振荡器4.6无菌吸管:1m、10ml(具0.1ml刻度)及吸头4.7无菌培养皿:直径90mm5.培养基和试剂平板计数琼脂培养基6实验步骤6.1 样品的预处理6.1.1 固体和半固体样品:称取25g样品,放入盛有225ml的生理盐水的无菌均质盒内,充分混匀制成1:10的样品匀液6.1.2 液体样品:以无菌吸管吸取1ml样品,放入盛有9ml的生理盐水管内,振摇试管制成1:10的样品匀液6.1.3将稀释好的1:10样品匀液,放置于80℃水浴10分钟,放置冷水中冷却至室温,用1ml无菌吸管或微量移液器吸取1:10样品匀液1ml,沿管壁缓慢注入9ml生理盐水的无菌试管中,振摇试管,使其混合均匀,制成1:100的样品匀液。
6.1.4 按7.1.3操作,依次制成十倍递增系列稀释样品匀液,每递增稀释1次,换用1支1ml无菌吸管或吸头。
6.1.5 根据对样品污染状况的估计,选择2个-3个适宜稀释度的样品匀液(液体样品包括原液),在进行10倍递增稀释时,吸取1ml样品匀液于无菌平皿内,每个稀释度做两个平皿,同时,分别吸取1ml空白稀释液加入两个无菌平皿内做对照,6.1.6 及时将15ml-20ml冷却至46℃的平板计数琼脂培养基倾注平皿,并转动平皿使其混合均匀(禁止摇到皿盖上)。
7.2 培养7.2.1 待琼脂凝固后,将平板翻转,36℃±1℃培养48h±2h。

微生物镜检操作规范流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!微生物镜检是对微生物进行观察和鉴定的一种常用方法,主要包括微生物的制片、染色、镜检和结果判断等步骤。

目的:建立芽孢杆菌活菌数含量的测定标准操作规程范围:本方法适用于的芽孢杆菌活芽孢的测定责任人:QC内容:1.仪器与工具:电子天平、生物显微镜、摇床、18×180mm试管、500ml三角瓶、10ml刻度吸管、1ml刻度吸管2.试剂与试液:牛肉膏、蛋白胨、琼脂、氯化钠、无菌蒸馏水、吐温80等。
3.检测培养基配方:牛肉膏3g、蛋白胨10g、琼脂16g、氯化钠5g、蒸馏水1000ml,调至PH7.2,121℃灭菌30min。
4.检测步骤:4.1 菌液制备:采样量不少于500g,从所采的样品中精确称取10.00g试样,加入已灭菌的带玻璃珠(玻璃珠在80个左右)的500ml锥形瓶中,加入30ml已灭菌的无菌水,在摇床上200r/min摇动30min,再加入60ml已灭菌的无菌水,在摇床上200r/min摇动30min,即成母液的菌悬液。
4.2 用1ml无菌吸管吸取1ml上述母液的菌悬液,加入9ml无菌水混匀成1:1×101稀释的菌悬液,这样依此稀释,直至得到1:106;1:107;1:108;1:109等浓度(每个稀释度必须更换无菌吸管)。
4.3 用1ml无菌吸管分别吸取不同稀释浓度菌悬液1ml,加至已灭菌的平皿中,再加入50℃左右的培养基,向每个培养平皿中倒入约12ml培养基,混合均匀,待凝固后,倒置于36℃的恒温培养箱内培养18h—24h。
每个样品取3个连续适宜稀释度,每个稀释度重复3次,同时加入无菌水的空白对照,每个稀释度取5个到10个菌落的菌体,涂片染色,显微镜观察识别后计数菌落。
5.菌落计数: 5.1 以平板上出现30个——300个菌落数的稀释度平板为记数标准,并确定为稀释倍数。
5.2 当只有一个稀释度,其平均菌落数在30个-300个之间时,则以该平均菌落数乘以其稀释倍数。
5.3若有两个稀释度,其平均菌落数30个-300个之间时,应按两者菌落总数之比值来决定。
若其比例小于2应计数两者的平均数,若大于2则计数其中稀释较小的菌落总数。

显微镜使用操作规程[目的 ]保证显微镜工作正常,确保输血安全。
[适用范围 ]莱卡显微镜。
[职责 ]检测是否染菌,菌体生长是否正常。
[使用与操作 ]1、插上电源插头,向后转动电源开关“即亮度调节手轮”打开电源。
2、灯光照明调节:继续向后转动亮度调节手轮,灯炮越亮,直至获得所需亮度。
3、调焦:①将 10×物镜和 10×目镜安装在显微镜上;②将标本置于载物台中间;③缓慢旋转粗调焦手轮使载物台上升至标本与物镜靠近;④再反向缓慢旋转粗调焦手轮使载物台下降,同时在 10×目镜里搜索图像;⑤当 10×目镜里有模糊图像时,再用微调焦手轮精细调焦,直至观察到清晰的图像;⑥最后再根据需要旋转转换器以转换其它倍率的物镜。
4、聚光镜调节:转动聚光镜调节手轮可使聚光镜上下移动,使用高倍物镜时聚光镜可上升,使用低倍物镜时聚光镜可下降。
仪器出厂时已调节好聚光镜中心与物镜光轴共轴、聚光镜上升至最高位置时其顶端低于载物台表面 0.2mm,因此使用时不必自行调节。
5、光源调节:将仪器底座下的光源调节螺钉松开,将灯丝调节至视场中心,再拧紧光源调节螺钉,以便在最佳照明下进行观察。
6、孔径关栏调节:左右移动聚光镜可变光栏操纵杆即可调节孔径关栏大小。
通常,当孔径光栏开启到物镜出瞳的 70~80%时,就可得到足够对比度的良好图像。
7、双目镜筒调节瞳距调节:双手分别抓住双目镜筒同时轻轻向外拉伸(或向内推压),同时将双眼对准左、右目镜进行观察,当左、右目镜中的图像合并为一时即可。
视度调节:转动视度圈,使视度圈上的零刻度线与其下端的白点对齐,此时是零视度位置。
对于左右眼视度不同的操作者,调节视度,可达到双眼同时看清图像的目的。
8、油浸时的观察:使用时必须在 100×物镜的前片透镜与盖玻片间加浸油,如果有气泡进入油层,会使像质变差。
要驱出气泡,可转动转换器若干次或再加一点油。
油浸观察结束后,必须及时将物镜前片透镜和沾有油污的部件逐个用专用擦拭液清洗擦拭干净。
郑州瑞泽欣生物技术有限公司
正文
1 操作前的准备工作
1.1 分别检查无菌操作室、菌种室、培养室、镜检室、准备室是否已清洁,且不存在与本批生产无关的记录或残留物。
1.2 是否有本批的菌种制备岗位空白生产记录,状态标识、周转容器等是否足够、齐全,生产区的设备和容器是否已标示好。
如培养箱、超净工作台、显微镜、冰箱等。
1.3 检查空调和空气净化系统是否检测,是否清洁并且在合格期限内。
1.4 检查待用的物品是否准备到位,是否已灭菌并在合格的有效期之内。
如菌种(菌落或芽孢悬液)、无菌PB溶液、工作服装、纯化水、接种针、移液枪及其配套枪头、酒精灯、染色剂(孔雀绿溶液、沙黄溶液)、擦镜纸、香柏油、载玻片、计数板、盖玻片等。
1.5 有没有上批产品的清场合格证副本。
1.6 检查操作间的温度、相对湿度等环境卫生条件是否符合工艺规定的要求。
2 镜检操作
2.1 玻片染色法
2.1.1 PB溶液配制:按规定的标准操作要求配制,浓度0.2M,pH值7.2。
2.1.2 孔雀绿溶液配制:按规定的标准操作要求配制,浓度7.6%。
2.1.3 沙黄溶液配制:按规定的标准操作要求配制,浓度0.5%。
2.1.4 制标本片
芽孢菌落标本制作时,按无菌操作,先将洁净载玻片用酒精灼烧杀菌,标识出明显标本区域,在区域内滴一小滴PB溶液,用接种环刮取2--3个菌落,在滴的PB溶液内均匀涂成薄膜,晾干固定,如有必要时刻将涂片通过火焰3次温热固定,但不可使温度过高,将菌烧死或烧变形。
晾干后,滴孔雀绿溶液与菌膜上,要全部覆盖涂的菌膜区,染色15--20分钟,水洗脱色,直至流出的水无绿色为止,淋去表面水,晾干后,复染,滴上沙黄溶液,染色2--3分钟,倾去染液稍微用水冲去染液并用滤纸吸干残液,晾干。
标注清楚标本的品名、批号、编号、培养时间、日期等。
即制成芽孢菌落标本。
2.1.5 干燥后用油镜观察,芽孢呈绿色,芽孢囊及营养体为红色。
2.1.6 观察至少3个视野,计数每个视野中的芽孢数和杆菌数,记录并计算出芽孢数平均值(A)和杆菌数平均值(B)。
2.1.7 计算镜检芽孢率:按下式计算镜检芽孢率:N=A/(A+B)×100%。
式中:N:代表样品的镜检芽孢率;
A:代表样品的镜检视野中芽孢数的平均值;
B:代表样品的镜检视野中杆菌输的平均值。
2.1.8 嗜热脂肪地芽孢杆菌的镜检芽孢率达到95%以上时,方可用于制备生产用芽孢悬液。
2.2 血球计数板法
2.2.1 标本制备
2.2.2.1 镜检计数室:
在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗,自然晾干才能进行计数。
2.2.2.2 加样品:
将清洁干燥的血球计数板的计数室上加盖专用的盖玻片,用吸管吸取稀释后的芽孢悬液,滴于盖玻片边缘,让培养液自行缓缓渗入,一次性充满计数室,防止产生气泡,充入细胞悬液的量以不超过计数室台面与盖玻片之间的矩形边缘为宜。
多余培养液可用滤纸吸去;
2.2.2.3 计数。
稍待片刻(约5min),待菌体全部沉降到计数室底部后,将计数板放在载物台的中央,先在低倍镜下找到计数室所在位置后,再转换高倍镜观察、计数并记录。
2.2.2.4 计算
将所记得的数量带入下公式计算,得镜检的芽孢悬液的浓度:
每毫升原液中芽孢个数/1mL=每个小方格中芽孢平均数×4×106×稀释倍数
2.3 检定结果标准:镜检芽孢率达到95%以上时,方可用于制备生产用芽孢悬液。
2.4 做好操作记录。
3 注意事项
操作过程中应严格执行定置管理规程和标准操作规程,严格控制洁净操作在规定范围内,注意安全操作和检定。
4 结束后的操作
4.1 清场
4.1.1 镜检结束后,操作人员应按相应的清洁标准操作规程对操作间、操作台面、设备、仪器、标本等进行清洁和标识。
4.1.2 清场工作完成后班组长应对清洁情况进行检查,确认合格后方可通知质量员进行清场效果的评价,只有当质量员检查合格并开具“清场合格证”正副本时,本次操作正式完成。
4.2 及时填写清场记录
5 岗位操作人员认真检查批检验记录上各项目都填写齐全,结果都在规定范围之内,复核后由班组长签字,质量员确认无误后签字,交质保员汇总。
6 “内容”变更点简述:
7 附表、附件、附录:
附件:显微镜检查批检验记录文件编号:SOP09-501-a-00
8 “附表、附件、附录”变更点简述。