初三化学教案 8.2海水晒盐1
- 格式:doc
- 大小:30.50 KB
- 文档页数:2

第二节 海水“晒盐”第一课时 海水“晒盐”的过程教学目标【知识与技能】(1)知道海水“晒盐”的基本原理,了解海水“晒盐”的过程。
(2)知道蒸发结晶的方法,进一步认识饱和溶液与不饱和溶液相互转化的方法。
【过程与方法】通过对实验的分析研究,培养学生沿着“问题—实验—分析—结论”的思路,用科学方法解决问题的能力。
【情感态度与价值观】通过海水“晒盐”过程的学习,使学生体会从生活走向化学,从化学走向社会的科学理念。
教学重难点【重点】蒸发结晶是海水“晒盐”的基本原理。
【难点】饱和溶液与不饱和溶液相互转化的方法。
教学过程知识点一 海水“晒盐”【自主学习】阅读教材第35页的有关内容,完成下列填空:1.海水“晒盐”的方法:盐田法,也称太阳能蒸发法。
盐田通常分为蒸发池和结晶池两部分。
2.海水“晒盐”的原理:蒸发结晶。
3.海水“晒盐”的过程:先将海水(或海边地下卤水)引入蒸发池,经日晒蒸发水分到一定程度时,再导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出食盐。
4.流程:海水→蒸发池→结晶池⎩⎪⎨⎪⎧ 粗盐母液【合作探究】刚晒出来的食盐可以食用吗?为什么?答:从海水里刚晒出来的食盐不能食用,因为其中除了含有泥沙外,还含有很多其他可溶性杂质,还需要进行粗盐提纯。
【跟进训练】1.目前从海水中提取食盐的方法主要是利用海水晒盐,它所利用的物质分离方法是( C )A.溶解法B.过滤法C.结晶法D.蒸馏法2.关于海水晒盐原理的说法中,正确的是( B )A.利用阳光和风力,使氯化钠蒸发出来B.利用阳光和风力,使水分蒸发,析出盐C.降低温度使氯化钠析出D.通过化学反应产生沉淀而得到食盐3.我国有辽阔的海岸线,有充足的海水资源。
人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐。
在此过程中( B )A.溶剂的质量不变B.氯化钠的质量不变C.氯化钠的质量分数始终不变D.氯化钠的质量分数变小知识点二蒸发结晶【自主学习】阅读教材第36页的内容,并分组完成活动天地8-1,然后完成下列填空:1.氯化钠溶液从不饱和变成饱和的途径是加热蒸发;当玻璃片上出现固体颗粒时,该溶液为饱和溶液。

8.2 海水“晒盐”第一课时教课目标【知识与能力】1.知道蒸发结晶是海水“晒盐”的基根源理;2.理解溶解度的涵义。
【过程与方法】初步学习绘制和查阅溶解度曲线并掌握其意义。
【感情态度价值观】经过让学生参加粗盐提纯过程,培育学生谨言慎行、慎重科学的态度,使学生养成耐心、认真的实验操作习惯。
教课重难点【教课要点】溶解度的看法及固体物质在水中的溶解度;【教课难点】混杂物的分别方法和思路。
教课过程环节一:导入新课我们都知道由海水可以晒制食盐,但晒盐过程的原理你理解吗?本节课我们将以“海水晒盐”为载体,学习“饱和溶液、溶解度、结晶”等看法,并完成有关的实验研究。
环节二:新课讲解第一部分:海水“晒盐”的过程设疑: 1. 猜猜海水晒盐的流程。
2. 你感觉海水晒盐的主要方法是什么?利用的原理是什么?3.你说海水晒盐的过程中水为何不可以完好蒸发干呢?学生思虑谈论。
教师展现图片,讲解:海水晒盐的原理海水→蒸发池→结晶池→结晶:固体物质从它的饱和溶液中以晶体的形式析出的过程叫作结晶。
蒸发结晶是物质结晶的门路之一。
饱和溶液:在必定温度下,必定质量的溶剂里,不可以再溶解某种溶质的溶液。
不饱和溶液:在必定温度下,必定质量的溶剂里,还可以再溶解某种溶质的溶液。
理解饱和溶液和不饱和溶液的时应注意:①应明确“必定温度”和“必定量的溶剂” ,由于改变温度或溶剂量,饱和溶液和不饱和溶液可以相互转变。
②应明确“某一物质”的饱和溶NaCl NaCl液,对蔗糖来说,就是不饱和溶液了。
饱和溶液和不饱和溶液的相互转变:增添溶剂或高升温度饱和溶液降低温度、蒸发溶增剂加、溶质不饱和溶液第二部分:溶解度过渡固体物质溶于水都能达到饱和状态,为何会达到饱和呢?还与什么要素有关?二、溶解度——定量表示某种物质在某种溶剂中的溶解性。
1.实验研究:影响物质在水中溶解性的要素(1)溶质的影响(2)温度的影响2.观察老师的实验,并把结果填在空格上。
3.学生看书,发问:问 1:不一样物质在水中溶解能力能否同样?举例说明。

教学设计【教学目标】:1、知识能力:(1)学会用重结晶法提纯混有泥沙的粗盐,(2)了解食盐的用途和工业上精制食盐的方法。
2、过程与方法:通过指导学生进行粗盐提纯的实验,使学生初步学会过滤这一分离混合物的基本操作方法。
3、情感、态度与价值观:通过让学生参与粗盐提纯的过程,培养学生一丝不苟。
严肃认真的科学态度,使学生养成耐心,细致的实验操作习惯。
【教学重点】:过滤、蒸发等分离提纯物质的基本操作技能。
【教学难点】:分析粗盐提纯实验的误差。
【教学设备】:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、多媒体设施【教学过程】:一、创设情境,导入新课【提问】1、同学们观看展示的照片,上面的人物在干什么?2、海水晒盐得到的盐是不是纯净的盐?和精盐比较,会含有哪些杂质?【学生讨论】讨论,归纳总结。
【小结】海水晒盐得到的是粗盐,里面含有一些难溶的泥沙杂质。
【导入】今天我们就来学习如何把粗盐中的杂质除去。
【板书】三、粗盐提纯【设计意图】结合海水晒盐的过程以及场所,学生不难想象到粗盐中会有泥沙杂质,从而引出今天学习的内容。
二、分析整理,实验探究【展示】展示实验室中的粗盐【提问】1、利用什么方法可以将粗盐中的泥沙除去?2、说出具体的实验步骤。
【学生讨论】分小组进行思考、讨论、交流,发表自己的看法。
【师生归纳】根据食盐能溶于水,泥沙不溶于水的性质,先将混合物加入水中,使其充分溶解,然后用过滤的方法将泥沙与盐水分离开来。
【板书】(一)粗盐的简单提纯步骤:溶解过滤蒸发结晶【展示】向学生用多媒体展示以上三个实验步骤以及实验过程中的注意事项。
1、固体溶解先将固体研细,溶解时要搅拌,搅拌时玻璃棒不能碰击容器壁以防容器破损。
粗盐粗盐水2、过滤“一贴”: 滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿)“二低”: 1、滤纸的边缘低于漏斗口2、漏斗里的液体低于滤纸边缘“三靠”: 1、倾倒液体的烧杯尖口要紧靠玻璃棒,2、玻璃棒的末端轻靠在三层滤纸的一边,3、漏斗下端的管口靠烧杯内壁。

8.2 海水晒盐第1课时海水“晒盐”地过程1.海水“晒盐”地原理海水→蒸发池→结晶池→粗盐母液2.饱和溶液和不饱和溶液(1)概念:在一定温度下,在一定量地溶剂里,不能再继续溶解某种溶质地溶液,就是该溶质地饱和溶液;还能继续溶解某种溶质地溶液是该溶质地不饱和溶液。
如何配制室温下一定量地食盐地饱和溶液?答案:用量筒量取一定量地水,倒入烧杯中,向烧杯中不断加入食盐,并不断搅拌,至食盐不再溶解时即可。
(2)饱和溶液与不饱和溶液地转化:(3)结晶:固体物质从它地饱和溶液中以晶体地形式析出地过程。
饱和溶液和不饱和溶液理解饱和溶液和不饱和溶液地概念时要注意:(1)应明确“一定温度”和“一定量地溶剂”,因为改变温度或溶剂地量,饱和溶液和不饱溶液可以相互转化。
(2)饱和溶液、不饱和溶液与浓溶液、稀溶液之间没有必然地联系,它们是从两个不同地角度对溶液进行地分类。
(3)判断一种溶液是否饱和地依据是在一定温度下,有没有不能继续溶解地溶质存在,若没有剩余溶质,也不能说该溶液一定是不饱和溶液,因为该溶液可能恰好为饱和溶液,这时可向原溶液中再加入少量该溶质,观察其溶解情况,即可判断。
【例题】 2011年日本发生9.0级大地震,并引发海啸,造成大量人员伤亡。
灾区饮用水受到大面积污染,肆虐地疾病也威胁着人们地健康。
为控制疫情传播,防疫人员通过喷洒含氯消毒剂进行杀菌消毒,该含氯消毒剂为不饱和溶液。
下列对不饱和溶液描述正确地是( )。
A.一定是浓溶液B.在一定温度下,一定量地溶剂里,不能再溶解该溶质地溶液C.一定是稀溶液D.在一定温度下,一定量地溶剂里,还能再溶解该溶质地溶液思路点拨:许多同学在解题时常错误地认为,饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液,其实不饱和溶液与浓溶液、稀溶液之间没有必然地联系,因不同溶质地溶解能力不同,因此它们达到饱和状态时溶解地溶质质量也有很大不同,这就导致了饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。

初中化学海水晒盐讲解教案
课题:海水晒盐
教学内容:
1.了解海水晒盐的原理
2.学习海水晒盐的实验步骤
3.观察并记录海水晒盐的过程和结果
教学目标:
1.掌握海水晒盐的原理和实验步骤
2.培养学生动手实践的能力
3.培养学生观察和记录实验结果的能力
教学准备:
1. 海水
2. 盛海水的容器
3. 玻璃烧杯
4. 太阳能灯或台灯
5. 电子秤
实验步骤:
1.在玻璃烧杯中倒入一定量的海水
2.将玻璃烧杯放置在太阳能灯或台灯下,加热海水
3.观察海水中的变化,记录实验过程
4.等到海水蒸发完全,观察烧杯底部的盐川
实验结果:
经过海水晒盐,海水中的水分蒸发,留下盐川在玻璃烧杯底部。
延伸实验:
1.尝试不同浓度的海水进行晒盐实验,比较结果。
2.研究不同加热条件下海水晒盐的速度和产量。
3.探究海水晒盐对海水中盐川的重新溶解情况。
反思:
海水晒盐实验是一个简单而有趣的化学实验,通过该实验可以加深学生对盐的认识,培养学生动手实验和观察的能力。
在实验中,学生需要注意火源和实验工具的安全使用,并及时记录观察结果。
通过这个实验,可以引导学生思考海水中的盐从何而来以及生活中盐的应用等问题。
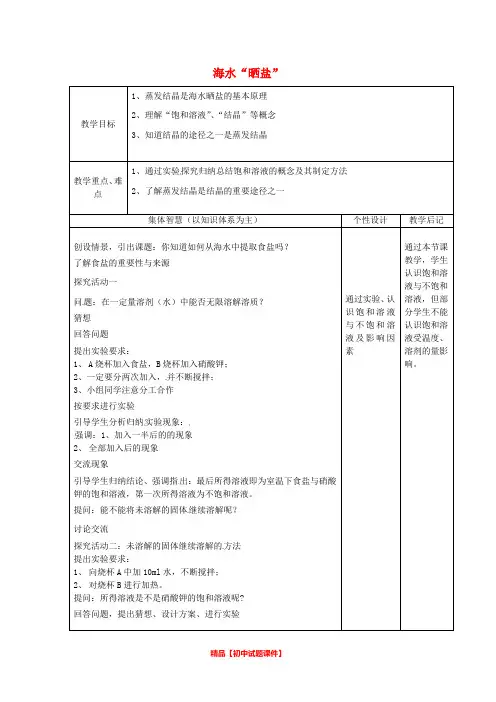
海水“晒盐”
探究归纳总结饱和溶液的概念及其制定方法题:在一定量溶剂(水)中能否无限溶解溶质?
、一定要分两次加入,并不断搅拌;
引导学生分析归纳实验现象:
强调:
引导学生归纳结论、强调指出:最后所得溶液即为室温下食盐与硝酸
提问:能不能将未溶解的固体继续溶解呢?
探究活动二:未溶解的固体继续溶解的方法
精品【初中试题课件】
演示:向食盐饱和溶液中加入高锰酸钾颗粒。
强调概念中应注意的问题:饱和溶液具有针对性
思考:从获得饱和溶液的方法来看,本实验
晒盐所得食盐饱和溶液的方法有什么区别?
思考、讨论、交流
:。



第二节海水“晒盐”教学目标:1、学会用重结晶法提纯混有泥沙的粗盐,通过指导学生进行粗盐提纯的实验,使学生初步学会过滤这一分离混合物的基本操作方法。
2、理解溶解度的涵义。
3、初步学习绘制和查阅溶解度曲线并掌握其意义。
4、通过让学生参与粗盐提纯过程,培养学生一丝不苟、严谨科学的态度,使学生养成耐心、细致的实验操作习惯。
教学重点:1、粗盐的提纯。
2、溶解度的概念及固体物质在水中的溶解度。
教学难点:溶解度的概念,固体溶解度曲线的含义与应用。
教学方法:讲解法、实验探究法、图示法教学安排:四课时第一课时实验准备:仪器准备:托盘天平、量筒、烧杯(50毫升)、药匙、胶头滴管、玻璃棒、酒精灯、蒸发皿、滤纸、漏斗药品准备:蒸馏水、粗盐、硫酸铜晶体、硝酸钾晶体、明矾晶体。
教学过程:一、板书课题,揭示目标海水中蕴藏着丰富的食盐,人们是怎样从海水中得到食盐的?海水晒盐得到的是粗盐,含有杂质,怎样使粗盐变为可食用的精盐呢?二、引导自学(一)1、内容:海水“晒盐”的过程2、方法:学生看书,完成思考题。
3、思考题:(1)目前海水“晒盐”用的是什么方法?(2)海水晒盐的过程是怎样的?刚晒出来的食盐可以食用吗?为什么?(3)什么是饱和溶液?什么是不饱和溶液?4、学生看书、思考,并回答上述问题。
5、演示实验:实验探究:饱和溶液的配制与蒸发结晶。
6、实验探究:粗盐的提纯(1)问题:怎样除去粗盐中的泥沙?(2)除去泥沙后,又怎样得到纯净是食盐?7、讨论实验方案8、演示实验:用过滤法提纯粗盐。
步骤:(1)溶解:量取15毫升水于烧杯中。
称取6克粗盐,边搅拌边将粗盐逐渐加入烧杯中,至粗盐不再溶解;(2)过滤:将粗盐溶液放在过滤器中过滤(过滤是要素、玻璃棒的用途)(3)蒸发:将滤液倒入蒸发皿中,边加热边搅拌(玻璃棒的用途)9、思考:上面所说,海水晒盐得到的粗言,除了泥沙,还有其他杂质,如氯化镁、氯化钙等,如何除去这些杂质呢?看书了解工业净化食盐的方法,并了解食盐的用途。

初三化学海水晒盐教案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第二节海水晒盐(第一课时)【学习目标】1、了解海水“晒盐”的过程;2、掌握饱和溶液和不饱和溶液的概念;3、了解结晶和蒸发结晶。
【学习重点】饱和溶液和不饱和溶液的概念;【学习过程】一、自主学习学习任务一:探究饱和溶液和不饱和溶液活动1、阅读教材P9。
交流和总结:1、从海水中提取食盐的方法主要为2、海水晒盐的过程为:先将海水引入,经日晒蒸发水分至一定程度时,再导入,继续日晒,海水成为食盐的,再晒就会逐渐析出食盐。
这时得到的晶体就是,剩余的液体为(也称)。
活动2、思考:一杯水里能不能无限的溶解食盐交流和总结:叫做这种溶质的饱和溶液。
叫做这种溶质的不饱和溶液。
活动3、完成P10实验探究.交流和总结:1、你怎样判断食盐溶液是否达到饱和状态2、从获得饱和食盐溶液的方法来看,本实验与海水“晒盐”有什么不同你认为哪些自然条件有利于海水“晒盐”反思:1、在描述饱和溶液与不饱和溶液时为什么一定要指明“一定温度”和“一定量溶剂”呢2、浓溶液一定是饱和溶液,对吗稀溶液一定是不饱和溶液,对吗3、饱和溶液转化成不饱和溶液有哪些方法不饱和溶液转化成饱和溶液有哪些方法学习任务二:认识结晶与蒸发结晶海水活动4、阅读教材P10交流和总结:1、叫结晶。
2、海水“晒盐”属于。
二、诊断评价:1、在一定温度下,某物质的饱和溶液一定()A、很浓的溶液B、含100g水的溶液C、不能再溶解该物质的溶液D、含100g该物质的溶液2、下列说法正确的是()A、浓溶液一定是饱和溶液B、稀溶液一定是不饱和溶液C、不论在什么温度下,一杯杯底有食盐固体不能再溶解的食盐水,一定是该温度下的饱和溶液D、某一温度下一杯杯底有蔗糖固体的蔗糖水,在任何温度下都是饱和溶液3、可以证明烧杯中的溶液是硝酸钾饱和溶液的方法是()A、蒸发1g水,有少量固体析出B、降低温度,有少量固体析出C、加入少量硝酸钾固体,固体不再溶解D、升高温度,没有固体析出4、室温下,向一定质量的氯化钠溶液中加入10g氯化钠固体,充分搅拌后,尚有部分固体未溶解。
初中化学海水晒盐教案
实验主题:海水晒盐
实验目的:
1. 了解海水中含有盐类的成分。
2. 理解盐水蒸发后可以得到盐。
实验材料:
1. 海水
2. 干净的容器
3. 灶台或炉子
4. 烧杯
5. 火柴或打火机
实验步骤:
1. 将海水倒入干净的容器中,容器中海水的量约为1/4满。
2. 将容器放在灶台或炉子上小心加热,使海水蒸发,留下盐。
3. 当海水完全蒸发后,用火柴或打火机点燃容器内残留的物质,观察并记录观察结果。
实验结果与讨论:
1. 经过蒸发后,发现容器内残留了白色的晶体状的物质,这是盐。
2. 通过观察燃烧时的火焰颜色和燃烧声音等现象,可以进一步确认残留物质是盐。
3. 通过这个实验,我们了解到海水中含有盐类成分,而海水蒸发后可以得到盐。
拓展实验:
1. 可以用不同的水源进行实验,比较不同水源中盐的含量。
2. 可以将实验过程进行视频记录,展示给同学们观看。
实验安全提示:
1. 在实验过程中注意火源安全,避免发生火灾。
2. 烧杯在加热过程中会变热,注意小心操作,避免烫伤。
实验总结:
通过这个实验,我们了解了海水中含有盐类成分,并且学会了如何通过海水蒸发得到盐。
希望同学们在实验中能够认真操作,注意安全,并且能够从实验中获取更多的知识。
海水“晒盐”教学目标1、蒸发结晶是海水晒盐的基本原理2、理解“饱和溶液”、“结晶”等概念3、知道结晶的途径之一是蒸发结晶教学重点、难点1、通过实验探究归纳总结饱和溶液的概念及其制定方法2、了解蒸发结晶是结晶的重要途径之一集体智慧(以知识体系为主)个性设计教学后记创设情景,引出课题:你知道如何从海水中提取食盐吗?了解食盐的重要性与来源探究活动一问题:在一定量溶剂(水)中能否无限溶解溶质?猜想回答问题提出实验要求:1、A烧杯加入食盐,B烧杯加入硝酸钾;2、一定要分两次加入,并不断搅拌;3、小组同学注意分工合作按要求进行实验引导学生分析归纳实验现象:强调:1、加入一半后的的现象2、全部加入后的现象交流现象引导学生归纳结论、强调指出:最后所得溶液即为室温下食盐与硝酸钾的饱和溶液,第一次所得溶液为不饱和溶液。
提问:能不能将未溶解的固体继续溶解呢?讨论交流探究活动二:未溶解的固体继续溶解的方法提出实验要求:1、向烧杯A中加10ml水,不断搅拌;2、对烧杯B进行加热。
提问:所得溶液是不是硝酸钾的饱和溶液呢?回答问题,提出猜想、设计方案、进行实验引导学生分析归纳饱和溶液与不饱和溶液的判断方法交流、讨论通过实验、认识饱和溶液与不饱和溶液及影响因素通过本节课教学,学生认识饱和溶液与不饱和溶液,但部分学生不能认识饱和溶液受温度、溶剂的量影响。
提问:食盐的饱和溶液是否能再溶解其它物质?演示:向食盐饱和溶液中加入高锰酸钾颗粒。
强调概念中应注意的问题:饱和溶液具有针对性观察现象,得出结论提问:结合上述活动谈一谈你对饱和溶液的认识?引导学生归纳饱和溶液的定义。
回答问题交流与讨论提问:你有哪些方法把盐水中的食盐提取出来?阐述结晶的涵义交流、讨论设计实验方案分组实验播放视频,了解海水晒盐的过程观看视频并思考两者之间的异同思考:从获得饱和溶液的方法来看,本实验所得食盐饱和溶液与海水晒盐所得食盐饱和溶液的方法有什么区别?哪些自然条件有利于海水“晒盐”?思考、讨论、交流课堂小结:通过本节课的学习,你有哪些收获,还有哪些问题需要和大家交流讨论呢?反思、自我检查通过谈论、交流、认识海水晒盐的过程作业布置完成课时作业相关练习板书设计第二节海水“晒盐”海水晒盐的过程1、有海水晒盐得到粗盐的基本过程。
年级学科 初三 化学
课题 海水“晒盐”(1) 备课人 顾建刚
教 学 目 标
知识与技能:
(1)理解饱和溶液和不饱和溶液的概念;
(2)能区分溶液的饱和与不饱和跟溶液浓、稀这两组概念,培养分析能力和思维能力。
过程与方法:举例讲解,讲练结合
情感态度与价值观:进一步增强学生了解海洋资源
重难点 重点:建立饱和溶液的概念;
难点:分析溶液“浓”“稀”跟溶液饱和与不饱和这两组概念之间的关系和区别。
课时
1 时间 45分钟
【温故知新 】
1、海洋资源主要有______________、_____________、____________、______________
2、说出海水提镁的主要流程及化学方程式 教学过程:
【引导阅读】教材P 9内容 1、海水晒盐
海水 蒸发池 结晶池
2、饱和溶液的配置与蒸发结晶(P 10“实验探究”)
【思考】 怎样判断食盐溶液是否达到饱和状态?
3、饱和溶液和不饱和溶液 【演示实验一 】 在各盛有10mL 水的2支试管里,分别缓缓地加入氯化钠和硝酸钾的固体。
边加入,边振荡,直到试管里有剩余固体不能再溶解为止。
这个实验说明了什么问题?
_______________________________________________________叫这种溶质的饱和溶液。
___________________________________________________叫做这种溶质的不饱和溶液。
【演示实验二】给实验一里盛有硝酸钾溶液和剩余硝酸钾固体的试管缓缓加热,边加热,边振荡,观察试管里剩余的硝酸钾固体有什么变化。
【演示实验三】给实验一里盛有氯化钠溶液和氯化钠固体的试管缓缓加入水,边加边振荡,观察试管里剩余的氯化钠固体有什么变化。
继续加水,直至氯化钠固体完全溶解。
由实验一和二得到的结论是: ①只有指明“_________”“__________”,“饱和”和“不饱和”才有意义。
( ) ( )
②饱和溶液 不饱和溶液 ( ) ( ) ( )
【演示试验四】将实验二中最终得到的硝酸钾溶液冷却,观察现象;用玻璃棒蘸取实验一中饱和的氯化钠溶液,在酒精灯上加热,观察现象。
◆___________________________________________________________叫做结晶。
粗盐
母液
3、饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
【巩固练习】
一、判断正误
1、在同一温度下,饱和溶液一定比不饱和溶液浓。
()
2、饱和溶液是浓溶液。
()
3、对于同一种溶质的溶液来说,在一定温度下,饱和溶液比不饱和溶液浓。
()
4、在一定温度下,向硝酸钾溶液中加入少量硝酸钾,如果溶液质量不变,则该溶液是饱
和溶液。
()
5、一定温度下,溶质的质量不改变,则无法使不饱和溶液变成饱和溶液。
()
6、一定温度下的氯化钠饱和溶液,一定不能继续溶解硝酸钾。
()
7、两种不同溶质的饱和溶液混和,依然是饱和溶液。
()
二、选择题
1、在一定温度下,一杯KNO3溶液底部存有少量的固体KNO3,则这杯溶液()
A、一定是饱和溶液
B、不能肯定是不是饱和溶液
C、一定是不饱和溶液
2、A克溶质溶于B克水中,取出一半溶液后,余下溶液中
溶质质量:溶剂质量=()溶质质量:溶液质量=()
A、A/B
B、<A/B
C、A/(A+B)
D、(A+B)/A
3、将ag食盐投入到bg水中,搅拌,所得溶液的质量是()
A、等于(a+b)g
B、小于(a+b)g
C、小于或等于(a+b)g
D、大于或等于(a+b)g
4、将40℃的硝酸钾饱和溶液冷却到20℃,在温度变化前后,溶液中保持不变的是()
A、溶质质量
B、溶剂质量
C、溶液质量
D、溶液浓
度
5、含有蔗糖晶体的溶液A,从冰箱冷藏室中取出放置一段时间后,晶体慢慢消失,形成
溶液B。
对溶液A和B,下列说法中一定正确的是()
A、溶液A、B均饱和
B、溶液A、B均不饱和
C 、溶液A一定饱和,浓度A<B D、溶液A一定饱和,浓度A>B
6、我们已经知道这样的事实:①食盐易溶于水难溶于植物油②硝酸钾易溶于水,碳酸
钙难溶于水③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的多。
以上事实表明,
固体物质的溶解能力与____________________________、________________________、
_____________________________三个因素有关。
板书设计
教学反思。