中考化学总复习专项练习04微观模型题
- 格式:docx
- 大小:940.89 KB
- 文档页数:5

重难点05质量守恒定律化学方程式微观模型质量守恒定律重点考查定义的理解及其应用,主要以选择题题型考查推断物质的元素组成、化学式和反应类型、根据微粒结构示意图考查质量守恒定律的微观含义及质量变化曲线等。
以简答题考查根据质量守恒定律解释有关化学反应现象;以研究质量守恒定律为内容的探究性试题。
化学方程式的书写是中考的高频考点,主要以填空题或选择题的形式出现;在选择题中结合微观示意图考查化学方程式书写或判断正误。
在综合题中结合物质的转化、气体制备原理考查化学方程式的书写、反应类型的判断,结合题给信息判断反应物、生成物和反应条件。
根据化学方程式计算的考查是中考的必考内容之一,由物质的单一计算逐渐向混合物的计算、溶液的计算、化学式的计算综合考查。
主要命题点有:①已知一种反应物或生成物的质量,计算恰好完全反应时另一种反应物或生成物的质量;②含杂质(杂质不参加反应)的反应物或生成物质量的计算;③溶液中溶质质量分数的计算。
质量守恒定律1.参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
这个规律叫质量守恒定律。
化学变化都遵循质量守恒定律,质量守恒定律不适用于解释物理变化。
定律只适用于质量守恒,不包括体积守恒、分子数守恒等。
2.从微观角度看,化学反应前后,原子种类、数目、质量不变。
故化学反应前后各物质的质量总和必然相等,符合质量守恒定律。
3.在化学反应前后,一定不会变化的是①③⑤⑥,一定会变化的是④,可能改变的是②①原子的数目②分子的数目③元素的种类④物质的种类⑤原子的种类⑥物质的总质量4.验证质量守恒定律的实验要求:必须发生化学反应且有明显现象。
如有气体参加或生成,则必须在密闭容器中进行。
5.质量守恒定律的应用(1)解释判断一些现象,依据反应前后物质总质量不变。
(2)定性判断物质的元素组成,依据化学反应前后,元素种类和质量不变。
(3)根据质量守恒定律进行简单计算,依据化学反应前后总质量不变。
(4)微观示意图,依据原子种类、数目不变,反应物的总质量=生成物的总质量。

2021届中考化学复习专题训练第四单元自然界的水一、单选题1.菱铁矿的主要成分是FeCO3。
下列说法正确的是( )A. FeCO3中Fe、C、O元素的质量比是1∶l∶3B. FeCO3中Fe、C、O的原子个数比是56∶12∶16C. FeCO3的相对分子质量是56+12+16D. FeCO3中Fe元素的质量分数是×100%2.下列物质的名称、俗名、化学式表示正确的是( )A.氧化钙、石灰石、CaOB.氧化铁、铁、FeOC.二氧化碳、干冰、CO2D.氢氧化钠、纯碱、NaOH3.下列污染因素中,不会对水资源造成重大污染的是( )A.工业生产中废液、废渣的任意排放B.城市生活污水的任意排放C.农业生产中化肥、农药的任意使用D.频频发生的沙尘暴4.为了探究水电解的微观过程,阿梅同学做了许多分子、原子模型,其中能说明保持水的化学性质的粒子的模型是( )A.B.C.D.5.在电解水的实验中,如何检验电极正极产生的气体是氧气( )A.将气体通过灼热的氧化铜B.将气体通过红热的铜丝C.将气体通入澄清的石灰水里D.用带火星的木条进行检验6.关于水的净化过程描述错误的是( )A.加入明矾使小颗粒凝聚B.通入氯气杀菌消毒C.通过沙滤装置除去可溶性杂质D.通过活性炭吸附部分有害物质7.2013年“世界水日”和“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”。
下列说法正确的是( )A.保护水资源,禁止使用化肥、农药B.利用沉降的方法,将硬水转化成软水C.工业废水的任意排放,不会污染水体D.城市浇花,使用喷灌、滴灌技术8.下列有关物质所含元素质量比的数值正确的是( )A.水(H2O) m(H)∶m(O)=1∶8B.乙炔(C2H2) m(C)∶m(H)=2∶1C.氨气(NH3) m(N)∶m(H)=14∶1D.二氧化硫(SO2) m(S)∶m(O)=1∶29.在100个C2H2和100个H2O2分子中,含量相同的是( )A.氢元素B.含氢的质量分数C.氢原子D.氢分子10.下列叙述中,不能说明氢气的密度比空气的小的是( )A.氢气可用向下排空气法收集B.氢气吹的肥皂泡往上飞C.氢气填充的彩色气球往上飞D.氢气可用排水法收集11.集气瓶中装有某气体,经检验只含有氧元素。
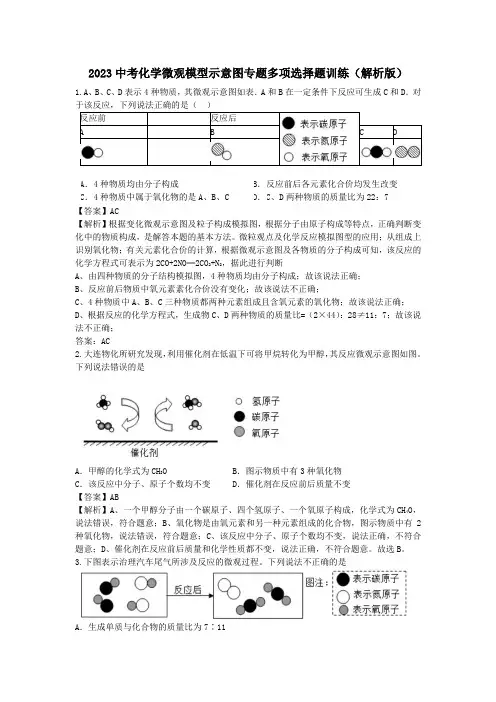
2023中考化学微观模型示意图专题多项选择题训练(解析版)1.A、B、C、D表示4种物质,其微观示意图如表.A和B在一定条件下反应可生成C和D.对A B CD【解析】根据变化微观示意图及粒子构成模拟图,根据分子由原子构成等特点,正确判断变化中的物质构成,是解答本题的基本方法。
微粒观点及化学反应模拟图型的应用;从组成上识别氧化物;有关元素化合价的计算,根据微观示意图及各物质的分子构成可知,该反应的化学方程式可表示为2CO+2NO═2CO2+N2,据此进行判断A、由四种物质的分子结构模拟图,4种物质均由分子构成;故该说法正确;B、反应前后物质中氧元素素化合价没有变化;故该说法不正确;C、4种物质中A、B、C三种物质都两种元素组成且含氧元素的氧化物;故该说法正确;D、根据反应的化学方程式,生成物C、D两种物质的质量比=(2×44):28≠11:7;故该说法不正确;答案:AC2.大连物化所研究发现,利用催化剂在低温下可将甲烷转化为甲醇,其反应微观示意图如图。
下列说法错误的是A.甲醇的化学式为CH3O B.图示物质中有3种氧化物C.该反应中分子、原子个数均不变D.催化剂在反应前后质量不变【答案】AB【解析】A、一个甲醇分子由一个碳原子、四个氢原子、一个氧原子构成,化学式为CH4O,说法错误,符合题意;B、氧化物是由氧元素和另一种元素组成的化合物,图示物质中有2种氧化物,说法错误,符合题意;C、该反应中分子、原子个数均不变,说法正确,不符合题意;D、催化剂在反应前后质量和化学性质都不变,说法正确,不符合题意。
故选B。
3.下图表示治理汽车尾气所涉及反应的微观过程。
下列说法不正确的是A.生成单质与化合物的质量比为7∶11B.图中所示有三种氧化物的分子C.图中所示单质的化学式为N2D.此反应发生后,分子总数增加【答案】AD【解析】由反应的微观过程可知,该处理尾气的化学方程式为:2CO+2NO2CO2+N2。
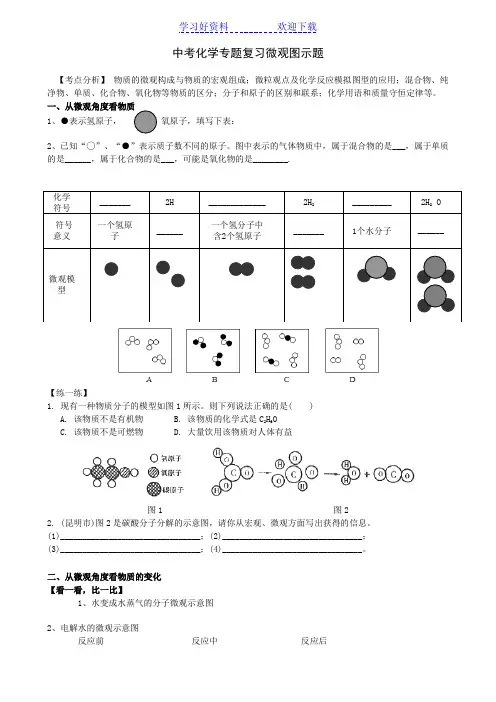
中考化学专题复习微观图示题【考点分析】物质的微观构成与物质的宏观组成;微粒观点及化学反应模拟图型的应用;混合物、纯净物、单质、化合物、氧化物等物质的区分;分子和原子的区别和联系;化学用语和质量守恒定律等。
1、●表示氢原子,氧原子,填写下表:2、已知“◯”、“●”表示质子数不同的原子。
图中表示的气体物质中,属于混合物的是___,属于单质的是______,属于化合物的是___,可能是氧化物的是________.【练一练】1.现有一种物质分子的模型如图1所示。
则下列说法正确的是( )A. 该物质不是有机物B. 该物质的化学式是C2H6OC. 该物质不是可燃物D. 大量饮用该物质对人体有益图1 图22. (昆明市)图2是碳酸分子分解的示意图,请你从宏观、微观方面写出获得的信息。
(1)________________________________;(2)________________________________;(3)________________________________;(4)________________________________。
二、从微观角度看物质的变化【看一看,比一比】1、水变成水蒸气的分子微观示意图2、电解水的微观示意图反应前反应中反应后【试一试】双氧水的分解的微观示意图反应前 反应中 反应后【想一想】1、下图体现了稀盐酸和氢氧化钠溶液反应的实质,请回答有关问题:A B C D⑴ 在上图C 、D 中的圆圈内填入适当的化学式或离子符号:C 中_______、_______,D 中_______,其中C 中所构成的物质属于__________(填写物质所属类别);⑵用化学方程式表示图中所体现的化学反应__________________________________; ⑶以上变化的基本反应类型是__________________。
2、宏观与微观相结合是化学学习的重要观念之一。

专项04 化学观念、科学思维、科学态度一、单选题1.构建化学基本观念是学好化学的基础。
下列对化学基本观念的认识,不正确的是A.结构观:金刚石和石墨的物理性质不同,因为它们碳原子的排列方式不同B.分类观:根据组成元素的异同,可将纯净物分为单质和化合物C.变化观:在一定条件下,CO2和O2可以相互转化D.微粒观:所有原子的原子核都是由质子和中子构成2.化学观念可以让我们更全面的认识物质。
以下说法正确的是A.微粒观:氧气和氯化钠都是由分子构成B.能量观:化学反应中不通过燃烧也能获得热量C.结构观:石墨转化成金刚石改变了碳原子的排列方式,是物理变化D.元素观:大麻酚是一种毒品,化学式为C21H26O2,它由3个元素组成3.构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是A.元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的B.微粒观:保持水化学性质的最小粒子是水分子C.转化观:氧化汞在一定条件下可生成金属汞D.守恒观:4g氢气和16g氧气反应,应该生成20g水4.下列涉及的化学观点,说法错误的是A.微粒观:保持硫酸铜化学性质的最小微粒是铜离子和硫酸根离子B.结构观:金刚石、石墨、C60的碳原子排列方式不同,决定其性质也不同C.守恒观:镁条在空气中燃烧,所得固体质量增重,遵守质量守恒定律D.转化观:氧气和二氧化碳在一定条件下可以相互转化5.化学观念是核心素养的重要组成部分。
下列有关叙述中,不正确的是A.物质是由元素组成的B.物质的结构决定物质的性质C.物质发生化学变化时会伴随能量变化D.只含有一种元素的物质是纯净物6.构建化学基本观念是学好化学的基础,下列对化学基本观念的认识不正确的是A.元素观:水、过氧化氢都是由氢元素和氧元素组成的B.微粒观:金刚石和石墨都是由碳原子直接构成的单质C.守恒观:1L氢气和1L氧气反应生成2L水D.转化观:在一定条件下,二氧化碳和碳酸可以相互转化7.构建化学基本观念是学好化学的基础。



易错类型04 质量守恒定律化学方程式微观模型目录一、易错知识梳理二、易错陷阱(六大陷阱)易错陷阱1:对质量守恒定律认识易错点易错陷阱2:质量守恒定律探究易错点易错陷阱3:质量守恒定律的应用易错点易错陷阱4:化学方程式书写和应用易错点易错陷阱5:依据化学方程式计算易错点易错陷阱6:微观模型易错点三、易错题通关(真题+模拟)1.质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
①“化学反应”是前提。
任何化学变化都遵循质量守恒定律。
质量守恒定律应用于化学变化,不能应用于物理变化。
①“参加反应”是基础。
只计算“参加反应”的各物质的质量总和。
①“质量总和”是核心。
质量总和包括参加反应的物质的质量和反应后生成的物质的质量。
如沉淀、肉眼看不见的气体也应考虑。
①“质量守恒”是目的。
定律只适用于质量守恒,不包括体积守恒、分子数守恒等。
2. 从宏观和微观角度理解质量守恒定律(1)宏观:化学反应前后,元素的质量和元素的种类都不变,所以化学反应前后参加反应的各物质的质量总和等于反应生成的各物质的质量总和。
(2)微观:化学反应的本质是分子的破裂、原子的重组,反应过程中原子的种类、数目和质量均不变,所以化学反应前后参加反应的各物质的质量总和与反应生成的各物质的质量总和相等。
3.化学反应前后的宏观微观实质:(1)一定不变:(宏观)反应物和生成物的总质量、元素的种类和质量。
一定不变:(微观)原子的种类、数目、质量。
(2)一定改变:(宏观)物质的种类。
一定改变:(微观)分子的种类。
(3)可能改变:分子总数,化合价,物质状态。
4. 验证质量守恒的实验要点①所选的化学反应,现象要明显;①若利用有气体参加或生成的反应来进行实验,反应必须在密闭容器中进行。
若用气球作为压强缓冲,还应考虑到浮力的影响。
注意:有些化学实验尽管不能验证质量守恒定律,但是所有化学变化均遵守质量守恒定律!5.化学方程式的含义(以C+O2===== CO2为例)(1)反应物为C、O2生成物为CO2反应条件为点燃。

专题04 构成物质的基本微粒(测试)班级姓名学号分数【满分:100分时间:60分钟】一、选择题(本题共16个小题,每小题3分,共48分。
每小题给出的四个选项中,只有一个最符合题意)1.(2022•淮安)“端午到,粽香飘”。
对闻到粽子香气的解释合理的是()A.分子的数目变多B.分子的体积变大C.分子在不断运动D.分子发生了分解2.(2022•无锡)1911年,卢瑟福用带正电的α粒子轰击金箔后发现:绝大多数α粒子穿过金箔后仍沿原来方向前进,少数α粒子发生较大偏转,极少数α粒子偏转几乎达到180°。
由该实验可得出的结论是()A.原子是实心球体B.原子的质量主要集中在原子核上C.原子核不带电D.原子核在原子中占的体积很大3.(2022•哈尔滨)下列粒子在化学反应中易得到电子的是()A.B.C.D.4.下列物质中含有氢分子的是()A.H2B.H2O C.H2O2D.H2CO35.(2022•荆州)6000L氧气在加压情况下可装入40L的钢瓶中。
从分子角度解释合理的是()A.氧分子体积变小B.氧分子质量变小C.氧分子间隔变小D.氧分子数目变少6.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。
核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子()A.含有2个质子B.核电荷数为1C.相对原子质量为4 D.质子数和中子数相等7.(2022•安顺)下列认识和描述正确的是()A.分子、原子、离子、元素都能构成物质B.原子核一定是由质子和中子构成C.与元素化学性质关系最密切的是原子的核外电子数D.原子是化学变化中的最小粒子8.含有“氚”的核废水直接排放会对人类生存环境造成一定的影响。
氚原子的原子核内含有1个质子和2个中子,其核外电子数是()A.1 B.2 C.3 D.69.如图,是水的微观层次结构,图中右侧“O”表示()A.氢元素B.氢原子C.氧元素D.氧原子10.(2022•福建)某海水淡化系统(如图)工作时,蒸发腔中的水在光热作用下变为水蒸气,太阳能风扇将水蒸气吹到冷凝腔冷凝,实现海水淡化。
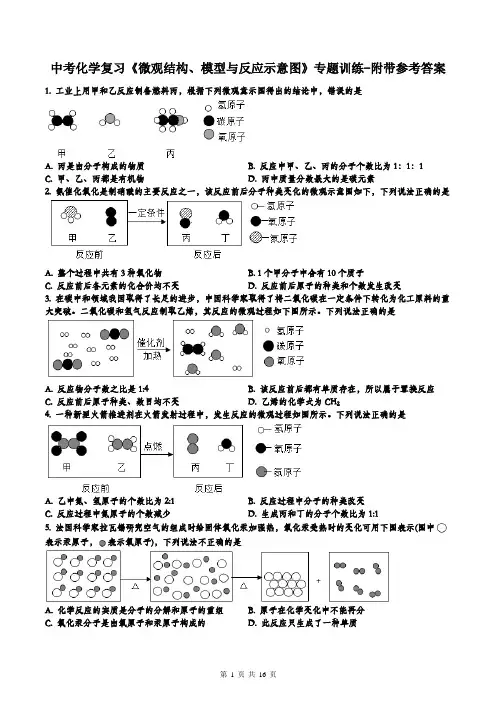
中考化学复习《微观结构、模型与反应示意图》专题训练-附带参考答案1. 工业上用甲和乙反应制备燃料丙,根据下列微观意示图得出的结论中,错误的是A. 丙是由分子构成的物质B. 反应中甲、乙、丙的分子个数比为1:1:1C. 甲、乙、丙都是有机物D. 丙中质量分数最大的是碳元素2. 氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如下,下列说法正确的是A. 整个过程中共有3种氧化物B. 1个甲分子中含有10个质子C. 反应前后各元素的化合价均不变D. 反应前后原子的种类和个数发生改变3. 在碳中和领域我国取得了长足的进步,中国科学家取得了将二氧化碳在一定条件下转化为化工原料的重大突破。
二氧化碳和氢气反应制取乙烯,其反应的微观过程如下图所示。
下列说法正确的是A. 反应物分子数之比是1:4B. 该反应前后都有单质存在,所以属于置换反应C. 反应前后原子种类、数目均不变D. 乙烯的化学式为CH24. 一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如图所示。
下列说法正确的是A. 乙中氮、氢原子的个数比为2:1B. 反应过程中分子的种类改变C. 反应过程中氮原子的个数减少D. 生成丙和丁的分子个数比为1:15. 法国科学家拉瓦锡研究空气的组成时给固体氧化汞加强热,氧化汞受热时的变化可用下图表示(图中表示汞原子,表示氧原子),下列说法不正确的是A. 化学反应的实质是分子的分解和原子的重组B. 原子在化学变化中不能再分C. 氧化汞分子是由氧原子和汞原子构成的D. 此反应只生成了一种单质6. 中科院大连化学物理研究所的研究队成功实现电催化一氧化碳高选择性直接制备乙烯。
该发应的微观过程如图所示。
下列有关该反应说法正确的是A. 该反应属于置换反应B. 反应后分子总数减少C. 参加反应的两种物质的分子个数比为3:2D. 反应前后涉及到的物质均为化合物7. 甲酸(HCOOH)在一定条件下会脱水分解,下图是其分解前后的微观示意图,下列说法正确的是A. 一个甲酸分子中含有一个一氧化碳分子B. 生成物的质量比是1:1C. 该反应前后元素种类改变了D. 23g甲酸中氧元素的质量为16g8. 我国学者开发促进CO2和H2反应生成甲醇(CH3OH)和水的一种新型催化剂,催化过程微观示意图如图,下列说法不正确的是A. 反应前后原子种类没有发生变化B. 两种反应物的分子个数比为1:3C. 反应前后催化剂的性质不变D. 该反应有利于实现“碳中和”9. 将宏观、微观及化学符号联系在一起是化学学科的特点。

备战2020中考化学考题专项训练——微观示意图1.(2019平凉)宏观、微观、符号相结合是化学学科特有的思维方式。
工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:的是下列说法不正确...A.物质C是由碳、氧两种元素组成的;B.该反应前后原子的种类没有发生变化C.该反应前后各元素化合价都没有变化D.该反应的化学方程式为C+H2O高温CO+H22.(2019东营)“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。
某化学反应的微观示意图如图所示,下列说法不正确的是()A.从反应价值看:该反应能获取清洁能源,延缓温室效应B.从物质分类看:该反应涉及到2种氧化物C.从微观构成看:四种物质均由分子构成D.从表示方法看:该反应的化学方程式为2CO2+4H2O2CH4+4O23.(2019永州)甲烷燃烧的微观示意图如下,其中方框中需要补充的是4.(2019毕节)右图是汽车“尾气催化转换器”将尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。
下列说法错误的是A.此反应中有单质生成B.原子在化学变化中是不可分的C. 极易与人体血液中的血红蛋白结合D.参加反应的与个数比为2:35.(2019本溪)下列各斟中“”和“○”分别表示不同元素的原子,其中表示混合物的是6.(2019益阳)某化学反应的微观示意图如图所示,其中相同的球代表同种原子。
(1)该化学反应中,发生变化的是(选填“分子”或“原子”),参加反应的两种分子的个数比为。
(2)该反应的生成物是(选择序号填空)。
A.化合物B.单质C.混合物(3)该反应的微观示意图说明,化学反应遵守质量守恒定律的原因是。
7.(2019眉山)天然气可以在一定条件下合成甲醇,其微观过程如图所示:回答下列问题:(1)把如图反应物的微观示意图补画齐全。
(2)该反应的化学方程式为,基本反应类型为。
8.(2019兰州)类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。
专练04 微观粒子题1.(2021•华师附中一模)化学与生活、生产密切相关。
(1)氯化钠是重要的工业原料。
工业氯化钠中常混有有毒的亚硝酸钠,其中氮元素的化合价为+3,亚硝酸钠的化学式为________。
(2)工业上通过氯气与消石灰反应制备漂白粉。
漂白粉主要成分是氯化钙和次氯酸钙(Ca(ClO)2)。
使用漂白粉时,将它与水混合配成溶液,吸收空气中的二氧化碳,便会产生具有漂白作用的次氯酸(HClO)。
①Ca(ClO)2中氯元素的化合价为________;②写出上述操作中使漂白粉溶液转化为次氯酸的反应的化学方程式________;③次氯酸是一种弱酸,溶于水时部分次氯酸分子会发生解离。
HCl溶于水时能全部解离出离子(如下图所示)。
在下图中画出次氯酸溶液中的微观粒子组成示意图(不用画水分子)。
________2.(2021•广大附中一模)符号和模型是表征和探析微观世界的重要工具。
(1)硫元素可以形成多种硫单质,图所示为“皇冠硫”分子,其构成单质的化学式为______。
(2)图中能反映水在空气中放置发生变化的微观示意图是______(填字母序号)3.(2021•荔湾区一模)氨气(NH3)是极易溶于水的无色气体,其水溶液叫氨水.(1)在充满氨气的试管中,放入用紫色石蕊浸染过的干燥纸条,无明显现象;再向试纸上滴水,现象是____________。
(2)向盛有氯化铁粉末的试管中通入氨气,无明显现象;停止通气,再加入适量水,产生红褐色沉淀,则发生复分解反应的化学方程式是______________________。
(3)画出氨气(NH3)和氨水的微观粒子组成示意图,并进行必要的标注(水分子不用画出______4.(2021•增城区一模)氮化镓(GaN)是支撑5G、人工智能、工业互联网等“新基建”的核心材料,以氮化镓和碳化硅(SiC)为首的第三代半导体及以氧化镓和金刚石为代表的第四代半导体材料,近年来愈发受到关注。
(1)GaN是由Ga3+和_______构成,写出Ga的氧化物化学式_______。
专项(四) 微观模型题
1.[2019·株洲]过氧乙酸对细菌和病毒具有高效、快速杀灭作用,广泛应用于环境的消毒。
如图G4-5为过氧乙酸的分子结构图(其中代表碳原子,代表氢原子,代表氧原子),下列有关说法正确的是( )
图G4-5
A.过氧乙酸的化学式是CH3COOOH(或C2H4O3)
B.过氧乙酸是由碳、氢、氧三种元素构成的
C.过氧乙酸中碳、氢、氧元素的质量比是12∶1∶16
D.过氧乙酸中碳元素的质量分数是40%
2.如图G4-6所示,为某化学反应的微观示意图,其中“”表示氧原子,“”表示碳原子,“”表示氢原子。
则该化学反应中不存在的物质种类是( )
图G4-6
A.单质
B.氧化物
C.盐
D.有机物
3.[2019·陕西]“宏观—微观—符号”是学习化学的重要内容和方法。
甲、乙、丙是三个变化过程的微观示意图,下列各项分析正确的是( )
图G4-7
A.三个过程发生的均是化学变化
B.图示的所有物质均为化合物
C.三个变化前后原子、分子、离子数目均发生了改变
D.三个变化后的物质中均含有同一种分子
4.[2019·江西样卷]最近,关于中美“中兴公司芯片”进口贸易战平息。
芯片中硅的制取微观示意图如图G4-8所示,下列说法正确的是( )
图G4-8
A.反应前后,各元素的化合价不变
B.该反应是置换反应
C.物质甲的原子种类是4种
D.X的化学式为
5.[2019·上饶模拟]甲和乙在一定条件下恰好完全反应生成丙和丁。
结合图G4-9所示的微观示意图分析,下列结论正确的是( )
图G4-9
A.甲的化学式为H2O
B.若32 g乙参加反应,则生成36 g丁
C.反应中甲、乙、丁的分子个数比为1 2 1
D.
6.[2019·黔东南]工业上使用一种国产低温催化剂生产氢气的反应过程如图G4-10所示。
图G4-10
(1)该微观反应过程中出现了种氧化物。
(2)参加反应的与分子个数比为。
(3)该反的化学方程式为。
7.[2018·乌鲁木齐]明确宏观现象的微观本质是学习化学的重要思想方法。
(1)图G4-11甲是钾原子和硫原子的结构示意图,请回答:
图G4-11
Ⅰ.x的数值是。
Ⅱ.钾原子在化学反应中易(填“得到”或“失去”)电子。
Ⅲ.钾元素和硫元素形成的化合物硫化钾的化学式是。
(2)图乙是硫酸铜溶液与锌粒反应前后溶液中主要离子变化示意图。
Ⅰ.锌与硫酸铜溶液发生反应过程中变化的微观粒子是。
Ⅱ.反应中过量的物质是(写化学式)。
Ⅲ.该反应的化学方程式为,反应现象为。
8.[2018·湖州改编]人们常用模型来进行认知,因为这种方式形象直观。
图G4-12甲是水分子和乙炔分子的模型,图乙是原子核转变的模型。
图G4-12
(1)乙炔中氢元素的化合价为+1,请结合模型判断乙炔中碳元素的化合价为。
(2)请画出“碳和氧气反应生成二氧化碳”的化学反应模型图:(碳原子和氧原子的画法参照上述图例)。
(3)图乙的变化(填“属于”或“不属于”)化学变化,判断的依据是。
【参考答案】
1.A [解析]从结构图中可以看出过氧乙酸的化学式是CH3COOOH(或C2H4O3);过氧乙酸是由碳、氢、氧三种元素组成的;过氧乙酸中碳、氢、氧三种元素质量比为6 1 12;过氧乙酸中碳元素的质量分数是
12×2
×100%≈31.6%。
12×2+1×4+16×3
2.C [解析]根据小球分别代表的原子种类可知,该反应可表示为C2H6O+3O22CO2+3H2O,分别为有机物、单质和氧化物,没有盐。
3.D [解析]甲变化过程中没有新物质生成,属于物理变化,而乙、丙变化过程中均有新物质生成,属于化学变化;由图可知,甲、丙中的物质均为化合物,乙中有化合物和单质,故图示的所有物质不均为化合物。
在化学反应前后原子的种类、数目均不发生改变;三个变化后的物质中都含有水分子。
4.B HCl
5.B 丁是氧化物(合理即可)
[解析]由微观示意图可知,该反应是硫化氢燃烧生成了硫和水,反应的化学方程式是2H2S+O22S+2H2O。
由上述分析可知,甲的化学式应是H2S;由化学方程式可知,若32 g乙参加反应,则生成36 g丁;反应中甲、乙、丁的分子个数比为2:1:2;丁是氧化物。
6.(1)3 (2)1:1
(3)CO+H2O H2+CO2
[解析]由信息可知,该反应的化学方程式为CO+H2O H2+CO2。
氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,所以一氧化碳、水和二氧化碳均属于氧化物。
由化学方程式可知,参加反应的水分子与一氧化碳分子的个数比为1 1。
7.(1)Ⅰ.8Ⅱ.失去Ⅲ.K2S
(2)Ⅰ.锌原子和铜离子(或Cu2+和Zn)
Ⅱ.CuSO4
Ⅲ.Zn+CuSO4Cu+ZnSO4有红色固体析出,蓝色溶液逐渐变浅
[解析](1)根据原子中质子数等于核外电子数,16=2+x+6,x=8;钾原子的最外层电子数为1,小于4,在化学变化中容易失去电子,形成阳离子;钾原子在化学反应中易失去一个电子,其化合价常显+1价,硫原子最外层有6个电子,在化学变化中容易得到2个电子,因此化合价常为-2价,因此二者形成化合物的化学式为K2S。
(2)从图中看出,反应前主要是锌原子和溶液中的硫酸根离子和铜离子,反应后是铜原子、铜离子、锌离子、硫酸根离子,故变化的是锌原子和铜离子;因为反应后溶液中还含有铜离子,故过量的物质是硫酸铜;该反应的化学方程式是Zn+CuSO4Cu+ZnSO4,由于此反应置换出铜,故有红色固体析出,硫酸铜过量,故蓝色溶
液变浅。
8.(1)-1 (2)
(3)不属于反应前后元素种类发生改变(合理即可)
[解析](1)乙炔的化学式为C2H2,H为+1价,则C为-1价。