第四章 酸碱滴定法
- 格式:doc
- 大小:148.00 KB
- 文档页数:10





第四章 酸碱滴定法教学目的、要求:掌握各种酸碱溶液中氢离子浓度的计算;熟悉酸碱指示剂的变色原理和变色范围;了解混合指示剂的原理。
掌握各类酸碱滴定中滴定突越范围、影响因素、准确滴定的条件及指示剂的选择;熟悉各类滴定过程中氢离子浓度的计算。
掌握滴定误差的计算方法;熟悉标准溶液的配臵方法;了解酸碱滴定法的应用。
教学重点及难点:酸碱溶液中氢离子浓度的计算,酸碱指示剂的变色原理和变色范围。
各类酸碱滴定误差. §4.1酸碱溶液中氢离子浓度的计算 一、强酸(碱)溶液的pH 计算(1)当强酸(碱)C >10-6mol/L 时,可忽略水的离解,用最简式计算:[H +]= C 酸(或[OH -]= C 碱) (4-1)pH = -lg[H +] = -lg C 酸 pOH = -lg[OH -] = -lg C 碱 (2)当强酸(碱)C≤10-6mol/L 时,不可忽略水的离解,可用精确式计算:[]H +=对于强碱可按同样的处理方法。
二、一元弱酸(碱)溶液的pH 计算1.质子条件式:设弱酸为HA ,浓度为C a mol/L [][][]H A O H +--=+ 2.精确式:利用离解常数式将上式中各项写成[H +]的函数得:2[][]a W H K HA K +=+ (4-2)由分布系数得:[][][]a a C H HA K H ++=+ 代入上式得: 32[][]()[]0a a a W a W H H K C K K H K K ++++-+-= 上式为精确式。
3.近似式和最简式 (1)当C a K a ≥20K W 时,(4-2)式中可忽略K W 项。
[HA]=C a —[H +],代入(4-2)整理得:[]H += (近似式) (4-2b )(2)当C a K a <20K W ,且C a /K a >500时,酸的离解可忽略,水的离解不可忽略。
由(4-2)式得:[]H += (近似式) (4-2c ) (3)当CK a ≥20K w ,且C/K a ≥500时, 可用最简式计算:[]H +=弱碱:处理方式一样。




第四章酸碱滴定法1.基本概念(1)混合指示剂:两种或两种以上指示剂相混合,或一种指示剂与另一种惰性染料相混合。
利用颜色互补原理,使终点颜色变化敏锐。
(2)滴定反应常数(K t):是滴定反应平衡常数。
强碱(酸)滴定强酸(碱):K t=1/K w=1014;强碱(酸)滴定弱酸(碱):K t=K a(b) /K w。
K t值越大,该滴定反应越完全,滴定突跃越大。
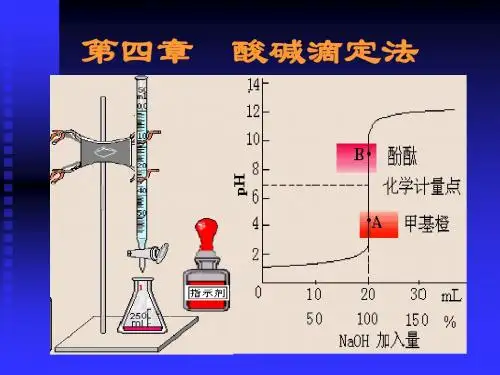
(3)滴定曲线:以滴定过程中溶液pH值的变化对滴定体积(或滴定百分数)作图而得的曲线。
(4)滴定突跃:化学计量点附近(±0.1%)pH的突变。
(5)滴定误差:滴定终点与化学计量点不一致引起的误差,与指示剂的选择有关。
(6)质子溶剂:能给出质子或接受质子的溶剂。
包括酸性溶剂、碱性溶剂和两性溶剂。
(7)无质子溶剂:分子中无转移性质子的溶剂。
包括偶极亲质子溶剂和惰性溶剂。
(8)均化效应和均化性溶剂:均化效应是指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平;具有这种作用的溶剂称为均化性溶剂。
(9)区分效应和区分性溶剂:区分效应是指不同的酸或碱在同一溶剂中显示不同的酸碱强度水平;具有这种作用的溶剂称为区分性溶剂。
2.基本原理(1)酸碱指示剂的变色原理:指示剂本身是一类有机弱酸(碱),当溶液的pH改变时,其结构发生变化,引起颜色的变化而指示滴定终点。
酸碱指示剂的变色范围:pH=pK HIn±1;理论变色点:pH=pK HIn(2)选择指示剂的原则:指示剂变色的pH范围全部或大部分落在滴定突跃范围内,均可用来指示终点。
(3)影响滴定突跃范围的因素:①酸(碱)的浓度,c a(b)越大,滴定突跃范围越大。
②强碱(酸)滴定弱酸(碱),还与K a(b)的大小有关。
K a(b)越大,滴定突跃范围越大。
(4)酸碱滴定的可行性:强碱(酸)滴定一元弱酸(碱):c a(b)K a(b)≥10-8,此酸、碱可被准确滴定。
多元酸(碱):c a1(b1)K a1(b1)≥10-8,c a2(b2)K a2(b2)≥10-8,则两级离解的H+均可被滴定。
第四章 酸碱滴定法 思考题1. 从质子理论来看下面各物质对分别是什么? 哪个是最强酸?哪个是最强碱?试按强弱顺序把他们排列起来 答:HAc (Ac-)Ka=1.75×10-5; H3PO4(H2PO4-)Ka1=7.52×10-3; NH3(NH4+)Ka=5.7×10-10; HCN (CN-)Ka=6.2×10-10HF (F-)Ka=6.8×10-4; (CH2)6N ((CH2)6NH+)Ka=1.4×10-9 HCO3-(CO3-)Ka2=5.61×10-11 酸的强弱顺序:H3PO4 > HF > HAc> (CH2)6N4H+ > HCN > NH4+ > HCO3- 碱的强弱顺序:CO3- > NH3 > CN- >(CH2)6N4 >Ac- > F- > H2PO4- 2. 写出下列物质在水溶液中的质子条件式答:(1)NH4CN [HCN] + [H3O+] = [NH3] + [OH-] (2)Na2CO3 2[H2CO3] + [HCO3-] + [H3O+] = [OH-](3)(NH4)2HPO4 2[H3PO4] + [H2PO4-] + [H3O+] = [NH3] + [OH-]īśPO Ĵij-]č(4) (NH4)3PO4 3[H3PO4] + 2[H2PO4-] +[HPO42-]+[H3O+] = [NH3] + [OH-] (4) (NH4)3PO4 3[H3PO4] + 2[H2PO4-] +[HPO42-]+[H3O+] = [NH3] + [OH-] (5) NH4H2PO4 [H3PO4] + [H3O+] = [NH3] + [HPO42-] +2[PO43-]+[OH-]3. 欲配制pH 为3的缓冲溶液,应选下列何种酸及其共轭碱二氯乙酸(1.30)二氯乙酸(2.86) 甲酸(3.74) 乙酸(4.76) 苯酚(9.95) 答:选二氯乙酸(缓冲溶液pH ≈pKa=2.86)5. NaOH 标准溶液吸收了空气中的CO2,当用于滴定(1)强酸;(2)弱酸时,对滴定的准确度各有何影响?答:滴定强酸时:(1) 若用甲基橙为指示剂,终点pH ≈4,消耗2mol 强酸,即2molNaOH 与CO2反应生成1molNaCO3仍消耗2mol 强酸,基本无影响 ; (2)若用酚酞作指示剂,终点pH ≈9,生成NaHCO3,即2molNaOH 与CO2反应生成1molNaCO3只消耗1mol 强酸,有显著影响。
滴定弱酸时:只能用酚酞作指示剂,有显著影响。
由HclNaOHNaOH Hcl V V c c得:用NaOH 滴定HCl ,VNaOH ↑,cHcl 偏高;用HCl 滴定NaOH ,VHcl ↓,cHcl 偏高。
6. 标定HCl 溶液浓度时,若采用(1)部分风化的Na2B4O7·10H2O;(2)部分吸湿的Na2CO3;(3)在110℃烘过的Na2CO3,则标定所得的浓度偏低、偏高还是准确?为什么? 答:(1)偏低 (2)偏高 (3)不影响7. 下列各酸,哪些能用NaOH 溶液直接滴定?哪些不能?如能直接滴定,应采用什么指示剂? ⑴蚁酸(HCOOH ) Ka = 1.8×10-4 ⑵硼酸(H3BO3) Ka1 = 5.4×10-10⑶琥珀酸(H2C4H4O4) Ka1 = 6.9×10-5 , Ka2 = 2.5×10-6⑷柠檬酸(H3C6H5O7) Ka1 = 7.2×10-4 , Ka2 = 1.7×10-5 , Ka3 = 4.1×10-7 ⑸顺丁烯二酸 Ka1 = 1.5×10-2 , Ka2 = 8.5×10-7 解:设Cb = Ca = 0.10 mol/L ,V a = 20.00 ml (1) 甲酸(HCOOH ) Ka = 1.77×1İĭ4 ĠĠ Ġ Ca ·Ka > 10-8,能被准确滴定 计量点产物:HCOO — 一元弱碱[]64141068.1210.01077.110----⨯=⨯⨯=⋅=b a W C K K OH()77.568.1lg 61068.1lg 6=-=⨯-=-pOH23.877.500.14=-=pH 选酚酞指示剂(2) 硼酸H3BO3 Ka1 = 5.8×10-10,Ka2 = 1.8×10-13,Ka3 = 1.6×10-14, Ca Ka1< 10-8,Ca Ka2< 10-8,Ca Ka3< 10-8无滴定突跃,指示剂在终点无明显颜色变化,不能用NaOH 准确滴定。
(3) 琥珀酸(H2C4H4O4)Ka1 = 6.4×10-5,Ka2 = 2.7×10-6Ca Ka1 > 10-8,Ca Ka2 > 10-8,Ka1 / Ka2 < 104 只有一个滴定突跃,两级离解的H+被同时滴定。
计量点产物:Na2C4H4O4 二元弱碱[]05.995.4/1011.1310.0107.210561421==⨯=⨯⨯=⋅=⋅=----pH pOH L mol C K K C K OH b a Wb b选酚酞指示剂 ???????????????????????????? ??????柠檬酸(H??C??H??O??)Ka????????????×????,Ka????????????×??Ka??????????×????????????????????Ca??Ka??????????,Ca??Ka??????????,Ca??Ka??????????,Ka??????Ka??????????,Ka??????Ka?????????? ????????????????????只有一个滴定突跃,三级离解的H 被同时滴定。
????????????????????计量点产物:Na??C??H??O????????三元弱碱 ????????????????????用最简式计算: ????????????????????[]05.995.4/1011.1310.0107.210561421==⨯=⨯⨯=⋅=⋅=----pH pOH L mol C K K C K OH b a Wb b?????????????? ??????顺丁烯二酸????Ka??????????×??Ka????????????×???? ????????????????????????????????????????????????Ca??Ka??????????,Ca??Ka????≈????,Ka??????Ka??????????????????????????????????可准确分步滴定,有两个滴定突跃。
????????????????????????第一计量点:产物NaHA????两性物质[]选甲基橙指示剂13.4742.0lg 4/10742.0105.5100.147221=-=⨯=⨯⨯⨯=⋅=---+pH Lmol K K H a a第二计量点:产物Na2AĠ侌元弱禱čĠ[]选酚酞指示剂39.961.446.2lg 5/1046.2310.0105.51057142==-=⨯=⨯⨯=⋅=----pH pOH L mol C K K OH b a WĠ []选酚酞指示剂39.961.446.2lg 5/1046.2310.0105.51057142==-=⨯=⨯⨯=⋅=----pH pOH L mol C K K OH b a W11. 试设计测定下列混合物中各组分的方法原理、指示剂、操作步骤及计算公式答: 解:(1)HCl + H3PO413. 混合碳酸盐有时采用等质量的两分试样进行分析,一份用酚酞作指示剂,另一份用甲基橙作指示剂。
如果Vp等于用酚酞作指示剂时的酸体积,Vm等于用甲基橙作指示剂时的酸体积,试回答下列问题:(1)设混合物含有等物质量的NaOH和Na2CO3,Vp和Vm间的关系怎样(2)如果混合物中NaHCO3物质的量2倍于Na2CO3,Vp和Vm间的关系怎样答:(1)nNaOH 酚酞NaCl 消耗HCl体积:VnNa2CO3 Vp NaHCO3 消耗HCl 体积:V Vp = 2VnNaOH 甲基橙NaCl 消耗HCl体积:VnNa2CO3 Vm CO2+H2O 消耗HCl体积:2V Vm = 3V∴nNaOH = nNa2CO3 Vm = 3/2Vp(2)nNa2CO3 酚酞NaHCO3 消耗HCl体积:V2nNaHCO3 Vp NaHCO3 消耗HCl 体积:0 Vp = VnNa2CO3 甲基橙CO2+H2O 消耗HCl体积:2V2nNaHCO3 Vp CO2+H2O 消耗HCl体积:2V Vm = 4V∴nNa2CO3 = 2nNaHCO3 Vm = 4Vp15. 试用酸碱质子理论解释水分对非水溶液滴定酸或碱的影响。
答: 失去质子:SH + H2O = S- + H3O+ 接受质子:B + H2O = BH+ + OH-水可以接受质子,也可以给出质子,从质子论的角度看,水既是酸性杂质,又是碱性杂质。
在非水滴定中,无论滴定的物质是酸还是碱,水均消耗标准溶液。
16. 在下列何种溶剂中冰醋酸、苯甲酸、盐酸及高氯酸的酸碱强度都相同?(1)纯水(2)浓硫酸(3)液氨(4)甲基异丁酮答:在液氨中相同。
18. 指出下列溶剂中何为质子性溶剂?何为非质子性溶剂?若为质子性溶剂,是酸性溶剂还是碱性溶剂?若为非质子性溶剂,是偶极亲质子溶剂还是惰性溶剂?答:质子性酸性溶剂:冰醋酸质子性碱性溶剂:乙二胺、丁胺质子性两性溶剂:水、异丁醇非质子偶极亲质子性溶剂:乙醚、丙酮、甲基异丁基酮非质子惰性溶剂:二氧六环、苯19. 若对HClO4、H2SO4、HCl 、HNO3的混合水溶液能否进行区分滴定?为什么?在何种溶剂中能进行区分滴定? 答:水中不可以区分滴定,均为强酸,都被均化到H3O+水平;在甲基异丁基酮中即可区分滴定。
20. 若要对苯酚、HAc 、水杨酸、HCl 、HClO4进行区分滴定,应选用何种溶剂、滴定剂。
答:选甲基异丁酮作溶剂,用四丁基氢氧化铵做滴定剂。
习题答案1. 已知琥珀酸(以H2A 表示)的pKa1=4.19, pKa2=5.57,计算在pH 为4.88和5.00时,H2A 、HA-、A2-的δ0、δ1、δ2。