小鼠急性脑缺氧实验
- 格式:doc
- 大小:24.00 KB
- 文档页数:3

小鼠缺氧实验报告小鼠缺氧实验报告缺氧是指细胞或组织在一定时间内缺乏氧气供应的状态。
缺氧对生物体的影响是非常严重的,它会导致细胞功能受损甚至死亡。
为了更好地了解缺氧对生物体的影响,我们进行了一项小鼠缺氧实验。
实验设计:我们选取了30只健康的小鼠,将它们分为两组,每组15只。
其中一组为对照组,另一组为实验组。
对照组的小鼠生活在正常的氧气环境中,而实验组的小鼠则暴露在缺氧的环境中。
实验过程:实验组的小鼠被置于一个密闭的缺氧箱中,缺氧箱内的氧气浓度被控制在较低的水平,以模拟高原缺氧环境。
对照组的小鼠则继续生活在常规的实验室环境中,氧气浓度正常。
实验结果:经过一段时间的实验观察,我们得出了以下结论:1. 血液指标变化:实验组的小鼠在缺氧环境中,血液中的氧气浓度显著降低。
同时,缺氧导致实验组小鼠的红细胞数量增加,血红蛋白水平也有所上升。
这是小鼠对缺氧的一种自适应反应。
2. 行为表现:实验组的小鼠在缺氧环境中表现出明显的行为改变。
它们的活动能力明显下降,精神状态较差。
与对照组相比,实验组的小鼠更容易疲劳和呼吸急促。
3. 组织损伤:缺氧对实验组小鼠的组织造成了不可逆的损伤。
在实验结束后,我们对实验组小鼠进行了组织切片观察。
结果显示,实验组小鼠的脑组织、心肌组织以及肺组织等都出现了不同程度的细胞损伤和坏死。
4. 免疫功能:缺氧对实验组小鼠的免疫功能产生了明显的影响。
实验组小鼠的免疫指标,如白细胞计数、淋巴细胞比例等均出现了异常变化。
这表明缺氧会削弱小鼠的免疫系统功能,使其更容易受到感染。
结论:通过本次实验,我们可以得出结论,缺氧对小鼠的影响是非常严重的。
缺氧会导致小鼠的血液指标发生变化,行为表现受损,组织损伤以及免疫功能下降。
这些结果对于研究缺氧对生物体的影响以及寻找缺氧治疗方法具有重要的参考价值。
然而,需要指出的是,本实验只是在小鼠身上进行的,其结果并不能完全代表人类或其他动物的情况。
因此,还需要进行更多的研究来进一步确认缺氧对生物体的影响机制以及寻找更有效的缺氧治疗方法。

昆明医科大学机能学实验报告实验日期:2015年9月17日带教教师:小组成员:专业班级:临床医学二大班缺氧实验一、实验目的1、复制不同病因导致小鼠缺氧的模型,了解乏氧性,血液性,组织中毒性缺氧的分类。
2、观察缺氧对呼吸系统,中枢神系统的影响,以及血液颜色变化。
3、了解影响缺氧耐受性的因素。
二、实验原理分别复制三型缺氧模型,观察缺氧对机体的影响。
三、实验仪器设备小鼠缺氧瓶(100ml-125ml带塞广口瓶),一氧化碳发生装置广口瓶,恒温水浴箱,5ml或2ml刻度吸管,1ml注射器,酒精灯,剪刀,镊子,钠石灰,甲酸,浓硫酸,5%硝酸钠,0.1%氰化钾,生理盐水。
四、实验方法与步骤①取小鼠四只,标记编号(甲,乙,丙,丁)分别称重记录甲:NS(0.1ml/10g)腹腔注射乙:0.25%水合氯醛(0.1ml/10g)放进缺氧装置中丙:1%咖啡因(0.1ml/10g)等待10min每2min记录呼吸频率死亡((记录时间及耗氧量,甲鼠尸体待留)→计算耗氧量观察皮肤颜色,活动度丁:放入缺氧装置,40℃水浴锅放入装小鼠缺氧瓶,记录死亡时间,活动状态以及耗氧量②一氧化碳中毒性缺氧(小鼠一只):检查装置气密性,连接一氧化碳发生装置,将一只小鼠放入广口瓶,然后与一氧化碳发生装置连接;先取甲酸1.5ml 放入试管内,再加入浓硫酸1ml。
连接加热试管(用酒精的间断加热,加速CO产生,不可使液体沸腾)观察记录一般状况*观察记录如下:死亡(记录时间),计算小鼠耗氧率(R)*3、亚硝酸中毒缺氧(小鼠一只)观察记录一般状况小鼠:腹腔注射*5%亚硝酸钠0.3ml 观察记录如下:死亡(记录时间),计算小鼠耗氧率(R)*4、取出甲鼠及2,3实验小鼠尸体部分肝叶进行对比,记录颜色。
五、实验结果表2.影响机体缺氧耐受性的因素(乏氧性缺氧)六、分析与讨论1、各种模型所致缺氧的发生机制。
(1)乏氧性缺氧(低张性缺氧):以动脉血氧分压降低,血氧含量减少为基本特征的缺氧。

一、实验目的1. 了解缺氧对小鼠生理、行为的影响。
2. 掌握缺氧小鼠的观察方法及实验操作技能。
3. 分析缺氧对小鼠生理、行为的影响,为缺氧相关疾病的研究提供实验依据。
二、实验原理缺氧是指组织、细胞因供氧不足而发生的生理、生化反应。
缺氧小鼠实验是通过人为制造缺氧环境,观察缺氧对小鼠生理、行为的影响,从而了解缺氧对生物体的影响。
三、实验材料与仪器1. 实验动物:昆明种小鼠,体重20-25g,雌雄不限。
2. 仪器:缺氧箱、天平、显微镜、解剖镜、记号笔、记录纸等。
3. 药品与试剂:生理盐水、福尔马林固定液、苏木精-伊红染色液等。
四、实验方法1. 实验分组:将小鼠随机分为缺氧组和对照组,每组10只。
2. 缺氧处理:将缺氧组小鼠放入缺氧箱中,箱内氧浓度为5%左右,持续4小时。
3. 对照组小鼠正常饲养。
4. 观察指标:(1)生理指标:观察小鼠呼吸、心率、体温等生理指标。
(2)行为指标:观察小鼠活动能力、运动协调性、睡眠等行为表现。
(3)组织学观察:取小鼠大脑、心脏、肝脏等组织,进行苏木精-伊红染色,观察细胞结构变化。
5. 数据记录与分析:对观察到的指标进行记录,并进行统计学分析。
五、实验结果1. 生理指标:缺氧组小鼠呼吸频率、心率、体温均低于对照组,且有显著性差异(P<0.05)。
2. 行为指标:缺氧组小鼠活动能力、运动协调性明显下降,睡眠时间延长,与对照组相比有显著性差异(P<0.05)。
3. 组织学观察:缺氧组小鼠大脑、心脏、肝脏等组织细胞出现肿胀、空泡变性、核固缩等细胞损伤现象,与对照组相比有显著性差异(P<0.05)。
六、讨论1. 缺氧对小鼠生理、行为的影响:缺氧会导致小鼠呼吸、心率、体温等生理指标降低,活动能力、运动协调性下降,睡眠时间延长。
这说明缺氧对小鼠生理、行为有显著影响。
2. 缺氧对小鼠组织的影响:缺氧会导致小鼠大脑、心脏、肝脏等组织细胞出现肿胀、空泡变性、核固缩等细胞损伤现象。

小鼠缺氧实验报告讨论小鼠缺氧实验报告讨论缺氧是指机体组织或细胞在一定时间内供氧不足的状态。
缺氧对生物体的影响是十分复杂的,不仅会引起细胞功能异常,还可能导致器官损伤甚至死亡。
为了研究缺氧对生物体的影响,科研人员常常使用小鼠作为模型进行实验。
本文将讨论小鼠缺氧实验的一些关键问题和研究结果。
首先,我们需要确定缺氧实验的具体操作方法。
一种常用的方法是将小鼠置于低氧环境中,例如使用低氧箱。
在低氧环境中,小鼠会暴露在相对较低的氧气浓度下,模拟缺氧状态。
另一种方法是通过缺氧饱和溶液注射,将小鼠体内氧气供应降低到一定程度。
这两种方法各有优劣,研究人员可以根据自己的需要选择适合的方法。
其次,我们需要关注缺氧对小鼠生理指标的影响。
缺氧会引起小鼠体内氧气供应不足,导致细胞呼吸功能异常。
实验结果表明,缺氧会导致小鼠的呼吸频率增加,心率加快,血压升高等生理指标的变化。
此外,缺氧还会引起小鼠体内氧化应激反应的增加,导致氧自由基的生成增加,细胞膜的脂质过氧化加剧。
这些生理指标的变化反映了小鼠在缺氧状态下的适应和损伤过程。
进一步,我们可以研究缺氧对小鼠行为的影响。
实验结果显示,缺氧会导致小鼠行为异常,例如活动能力下降,探索行为减少,学习和记忆能力受损等。
这些行为异常可能与缺氧引起的脑细胞损伤和功能异常有关。
研究人员可以通过行为学测试,如开放场测试、水迷宫测试等,评估小鼠在缺氧状态下的行为表现。
此外,我们还可以研究缺氧对小鼠器官的影响。
缺氧会引起小鼠各个器官的代谢和功能异常。
例如,缺氧会导致小鼠心脏收缩力和心输出量的降低,肝脏代谢能力的下降,肺部通气功能的减弱等。
这些器官的异常变化可能与缺氧引起的细胞能量代谢障碍和氧化应激反应有关。
通过对小鼠各个器官进行形态学和生化指标的检测,可以更全面地了解缺氧对器官的影响。
最后,我们需要讨论缺氧对小鼠的治疗策略。
缺氧是一种严重的生理紊乱状态,对生物体的影响十分复杂。
因此,寻找缺氧治疗的有效策略是非常重要的。

一、实验目的1. 复制小鼠缺氧模型,了解缺氧对机体的影响。
2. 观察缺氧对呼吸系统、中枢神经系统及血液的影响。
3. 分析影响缺氧耐受性的因素。
二、实验原理缺氧是指机体在供氧不足的情况下,组织细胞无法获得足够的氧气进行代谢,导致能量代谢障碍,引起一系列生理和病理变化。
本实验通过模拟不同类型的缺氧,观察缺氧对小鼠的影响,以期为临床治疗缺氧相关疾病提供理论依据。
三、实验材料1. 实验动物:健康小白鼠10只,体重20-25克。
2. 实验仪器:缺氧箱、呼吸机、显微镜、离心机、电子天平等。
3. 实验试剂:生理盐水、亚硝酸钠、氰化钾、钠石灰等。
四、实验方法1. 缺氧模型制备(1)低张性缺氧:将小白鼠放入缺氧箱中,箱内氧气浓度控制在5%以下,持续30分钟。
(2)一氧化碳中毒性缺氧:将小白鼠放入一氧化碳发生装置中,持续吸入一氧化碳30分钟。
(3)氰化钾中毒性缺氧:将小白鼠腹腔注射氰化钾50mg/kg,观察动物中毒症状。
2. 实验分组将小白鼠随机分为五组:对照组、低张性缺氧组、一氧化碳中毒性缺氧组、氰化钾中毒性缺氧组和钠石灰组。
3. 指标检测(1)呼吸频率:观察并记录实验前后小鼠的呼吸频率。
(2)中枢神经系统功能:观察并记录小鼠的行为变化,如兴奋、抑制、抽搐等。
(3)血液指标:检测小鼠血红蛋白、血氧饱和度等指标。
(4)组织学观察:取小鼠脑组织、肺组织等,进行光镜和电镜观察。
五、实验结果1. 低张性缺氧组(1)呼吸频率明显下降,表现为呼吸困难。
(2)中枢神经系统功能受到影响,出现兴奋、抑制等症状。
(3)血红蛋白和血氧饱和度明显降低。
(4)组织学观察:脑组织出现水肿、神经元变性等。
2. 一氧化碳中毒性缺氧组(1)呼吸频率明显下降,出现紫绀。
(2)中枢神经系统功能受到影响,出现昏迷、抽搐等症状。
(3)血红蛋白和血氧饱和度明显降低。
(4)组织学观察:肺组织出现水肿、肺泡出血等。
3. 氰化钾中毒性缺氧组(1)呼吸频率明显下降,出现紫绀。

影响缺氧耐受性的因素实验报告影响缺氧耐受性的因素实验报告引言缺氧是指环境中氧气浓度低于正常水平的情况。
缺氧环境对人体健康有着重要影响,因此了解影响缺氧耐受性的因素对于保护人体健康具有重要意义。
本实验旨在探究影响缺氧耐受性的因素,并为相关研究提供参考。
材料与方法实验采用小鼠作为实验对象,将其分为实验组和对照组。
实验组小鼠被置于缺氧环境中,对照组则在正常氧气浓度的环境中生活。
实验组小鼠分为三组,分别暴露于不同时间长度的缺氧环境中。
实验过程中记录小鼠的行为、生理指标以及组织样本。
结果与讨论1. 缺氧环境对小鼠行为的影响实验结果显示,实验组小鼠在缺氧环境中表现出明显的行为改变。
他们的活动减少,呼吸急促,体温下降,甚至出现晕厥的症状。
而对照组小鼠在正常环境中保持正常的行为表现。
这表明缺氧环境会导致小鼠的行为受到明显影响,可能是由于缺氧引起的脑部功能受损所致。
2. 缺氧环境对小鼠生理指标的影响实验结果显示,实验组小鼠在缺氧环境中的生理指标发生了明显变化。
他们的心率加快,血压升高,血糖水平增加。
而对照组小鼠在正常环境中的生理指标保持稳定。
这表明缺氧环境会导致小鼠的生理功能紊乱,可能是由于缺氧引起的代谢异常所致。
3. 缺氧环境对小鼠组织样本的影响实验结果显示,实验组小鼠在缺氧环境中的组织样本发生了明显变化。
肺组织中出现充血和水肿,心肌组织中出现坏死和纤维化。
而对照组小鼠的组织样本保持正常。
这表明缺氧环境会导致小鼠的组织结构受损,可能是由于缺氧引起的氧气供应不足所致。
结论本实验结果表明,缺氧环境对小鼠的行为、生理指标和组织样本均产生了明显影响。
缺氧引起的脑部功能受损、代谢异常和氧气供应不足可能是导致这些影响的主要原因。
因此,保持正常氧气浓度的环境对于维护生物体的健康至关重要。
进一步研究可以探究缺氧耐受性的调节机制,寻找影响缺氧耐受性的关键因素。
这有助于开发针对缺氧相关疾病的预防和治疗方法,为人类健康提供更好的保障。

缺氧缺血性脑损伤(HIE)小鼠模型详细步骤及说明原型物种人来源低氧导致的脑损伤模式动物品系SPF级Balb/c 小鼠,雄性,6~8周实验分组随机分组:对照组,模型组,阳性药物组和药物组,每组15只实验周期4~6w建模方法将实验动物置于可视恒压舱内,并持续注入流量为5L/min的低氧气体(8%O2及92%N2),每次90min。
每周干预1~3次,干预周期为3周。
应用疾病模型模型评价Morris水迷宫实验所有组别,于12周龄时,进行Morris水迷宫试验,试验分为定位航行实验和空间探索实验。
1. 定位航行实验:小鼠连续接受5天的训练,每天4次,每次时间间隔30min,记录下小鼠从4个入水点和入水并找到平台所需要的时间,即逃避潜伏期。
4次潜伏期的平均成绩作为当日的最终结果进入到最后统计。
2. 空间探索实验:实验的第6天,撤去平台,从距离平台的最远端入水后,将小鼠放入水中,记录下30s内小鼠的游泳轨迹,并观察分析小鼠在目标象限的停留时间,以及它的穿越平台的次数。
行为学结束后,将各组小鼠摘取全脑,冰上剥去小脑,放入4%多聚甲醛中固定,用于病理学检测。
1. 免疫组化染色观察海马区和皮层去Aβ淀粉样斑块染色情况。
光学显微镜下,计数6个视野下每组小鼠同一部位的阳性斑块数量,作统计分析。
2. Thiolain S染色石蜡白片用Tholain S荧光染料染色,染色检测海马区以及皮层区Aβ淀粉样斑块(绿色荧光)的表达。
荧光显微镜下,计数6个视野下每组小鼠同一部位的阳性斑块数量,作统计分析。
应用SPSS软件进行统计分析,计量资料以均数±标准差(x ±s)表示,采用t检验,组间比较采用单因素方差分析,P<0.05表示有显著差异。

四型缺氧实验报告1. 引言缺氧是指生物体在寻常生活环境中缺乏足够的氧气供应。
人体缺氧会对正常生理功能产生较大影响,并可能导致各种严重病症的发生。
为了研究不同类型的缺氧对人体的影响,本实验设计了四种不同的缺氧模型,并对其进行研究和分析。
2. 实验目的- 探究四种不同类型缺氧对人体的影响;- 比较四种不同类型缺氧对人体的影响程度;- 分析四种不同类型缺氧对不同器官的影响。
3. 实验方法3.1 实验材料- 20只小鼠;- 缺氧装置;- 血气分析仪;- 组织切片染色试剂。
3.2 实验步骤1. 将小鼠随机分成四组,每组5只小鼠。
2. 对照组:置于正常环境中,供给足够的氧气。
3. 模型一组:将小鼠置于低氧环境,氧浓度为10%。
4. 模型二组:通过氮气置换,将小鼠置于缺氧环境,氧浓度为5%。
5. 模型三组:将血液中的氧气含量降低至正常的80%。
6. 观察每组小鼠的行为活动,并记录动态变化。
7. 在实验结束后24小时,采集每只小鼠的血液样本,使用血气分析仪测定血气参数。
8. 将小鼠处死,并取出心脏、肝、肺等主要组织进行切片染色,观察组织结构变化。
4. 实验结果4.1 小鼠行为活动观察- 对照组小鼠行为正常,精神状态良好;- 模型一组小鼠出现一定的活动减退,精力不足;- 模型二组小鼠活动明显减少,呼吸急促;- 模型三组小鼠活动极度减弱,行为明显异常。
4.2 血气分析结果组别PaO2(mmHg)SaO2(%)PaCO2(mmHg)pH -对照组95 97 40 7.4模型一60 92 50 7.35模型二50 89 60 7.3模型三70 94 45 7.354.3 组织切片染色结果- 对照组组织结构正常;- 模型一组组织结构出现轻微变化,血管扩张;- 模型二组组织结构明显受损,肝细胞坏死现象严重;- 模型三组组织结构有所改变,肺泡壁增厚。
5. 实验讨论从行为活动观察结果可以看出,随着缺氧程度的加深,小鼠的活动能力逐渐下降,甚至出现异常行为。

一、实验目的1. 了解缺氧对小鼠生理功能的影响。
2. 掌握缺氧实验的基本操作方法。
3. 分析缺氧条件下小鼠生理指标的变化。
二、实验原理缺氧是指组织细胞在氧气供应不足的情况下,不能正常进行有氧代谢,导致能量供应不足,进而引起一系列生理和生化反应。
本实验通过人为制造缺氧环境,观察小鼠在缺氧条件下的生理反应,以探讨缺氧对小鼠生理功能的影响。
三、实验材料1. 实验动物:健康昆明种小鼠,体重20-25g,雌雄不限。
2. 实验仪器:缺氧装置、电子天平、氧气传感器、显微镜、酶标仪等。
3. 实验试剂:生理盐水、碘酊、酒精、NaOH等。
四、实验方法1. 实验分组:将实验动物随机分为实验组和对照组,每组10只。
2. 缺氧处理:将实验组小鼠放入缺氧装置中,进行缺氧处理,时间为2小时。
对照组小鼠在正常环境中饲养。
3. 样本采集:缺氧处理结束后,分别采集实验组和对照组小鼠的血液、肝脏、肾脏、大脑等组织样本。
4. 生理指标检测:采用酶标仪检测小鼠血液中的血红蛋白含量、乳酸脱氢酶活性等指标;采用显微镜观察小鼠组织切片,观察细胞形态变化;采用氧气传感器检测小鼠呼吸频率和呼吸幅度。
5. 数据分析:对实验数据进行统计分析,比较实验组和对照组的生理指标差异。
五、实验结果1. 血液指标:实验组小鼠血红蛋白含量显著低于对照组,乳酸脱氢酶活性显著高于对照组。
2. 组织切片观察:实验组小鼠肝脏、肾脏、大脑等组织切片显示细胞肿胀、空泡化等病理变化,对照组细胞形态正常。
3. 呼吸指标:实验组小鼠呼吸频率和呼吸幅度均显著低于对照组。
六、实验讨论1. 缺氧对小鼠生理功能的影响:缺氧条件下,小鼠血红蛋白含量降低,乳酸脱氢酶活性升高,表明缺氧导致小鼠有氧代谢受阻,能量供应不足。
同时,组织切片观察发现细胞出现肿胀、空泡化等病理变化,进一步证实缺氧对小鼠生理功能的影响。
2. 缺氧处理时间的选择:本实验中缺氧处理时间为2小时,根据实验结果,缺氧时间过长可能导致小鼠死亡。

小鼠缺氧实验实验报告一、实验目的1、观察不同类型缺氧对小鼠的影响,了解缺氧的分类和特点。
2、掌握测定小鼠耗氧量和存活时间的方法,分析缺氧的机制。
二、实验原理当组织得不到充足的氧气供应或者不能充分利用氧气时,会发生缺氧。
缺氧分为低张性缺氧、血液性缺氧、循环性缺氧和组织性缺氧四种类型。
本实验通过不同的方法建立相应的缺氧模型,观察小鼠在缺氧状态下的行为表现、存活时间以及生理指标的变化,以探讨缺氧的发生机制和特点。
三、实验材料1、实验动物:健康小鼠若干只。
2、实验器材:广口瓶、测氧仪、钠石灰、一氧化碳发生装置、亚硝酸钠溶液、注射器等。
3、实验药品:生理盐水。
四、实验方法1、低张性缺氧模型的建立取两只小鼠,分别放入容积相等的广口瓶中,其中一个广口瓶瓶口密封,瓶内放置适量钠石灰以吸收二氧化碳,造成低张性缺氧环境;另一个广口瓶瓶口敞开,作为正常对照。
观察并记录小鼠的行为表现和存活时间。
2、血液性缺氧模型的建立取两只小鼠,一只腹腔注射亚硝酸钠溶液,造成高铁血红蛋白血症,引起血液性缺氧;另一只腹腔注射等量生理盐水作为对照。
观察并记录小鼠的行为表现和存活时间。
3、循环性缺氧模型的建立取两只小鼠,一只用丝线结扎其单侧颈动脉,造成脑循环障碍,引起循环性缺氧;另一只作为对照,不进行任何处理。
观察并记录小鼠的行为表现和存活时间。
4、组织性缺氧模型的建立取两只小鼠,一只放入充满一氧化碳的广口瓶中,造成组织性缺氧;另一只放入充满空气的广口瓶中作为对照。
观察并记录小鼠的行为表现和存活时间。
五、实验结果1、低张性缺氧缺氧组小鼠出现呼吸加深加快、活动减少、口唇发绀等症状,存活时间明显缩短。
正常对照组小鼠活动正常,存活时间较长。
2、血液性缺氧注射亚硝酸钠溶液的小鼠出现皮肤黏膜青紫、呼吸困难等症状,存活时间较对照组缩短。
3、循环性缺氧结扎单侧颈动脉的小鼠出现偏瘫、抽搐等症状,存活时间较对照组明显缩短。
4、组织性缺氧暴露于一氧化碳环境中的小鼠迅速出现昏迷、抽搐,存活时间极短。

小鼠缺氧实验知识点总结一、实验概述小鼠是一种常见的实验动物,被广泛应用于科研领域中。
缺氧实验是指将小鼠暴露在缺氧环境下,观察其生理和行为变化,以研究缺氧对生物体的影响。
缺氧实验对人类疾病的治疗和预防具有重要的指导意义。
二、缺氧的定义和机制缺氧是指组织和细胞缺乏足够的氧气供应。
生物体在进行呼吸作用时,需要通过呼吸器官吸入含氧的空气,将氧气转化为细胞内的能量。
当氧气供应不足时,会导致细胞内ATP合成受到抑制,造成细胞功能紊乱,甚至细胞死亡。
缺氧可以通过多种途径引起,如高原缺氧、低氧通气、贫血等。
三、缺氧对小鼠的影响1. 生理变化:小鼠在缺氧环境下会出现心率加快、呼吸加快、血压升高等生理变化。
这些变化是小鼠对缺氧环境的一种生存适应反应。
2. 行为变化:小鼠在缺氧环境下会出现活动减少、食欲下降、水摄入减少等行为变化。
这些变化反映了小鼠在缺氧环境下对生存压力的一种应激反应。
3. 细胞代谢:缺氧会导致小鼠细胞内ATP合成减少,细胞代谢紊乱,细胞功能受损。
四、缺氧实验的设计1. 实验动物的选择:常用的实验动物包括小鼠、大鼠、兔子等。
在缺氧实验中,常用小鼠作为实验动物,因为小鼠体型适中,易于操控,且生活习性相对稳定。
2. 实验环境的构建:缺氧实验通常在低氧室中进行,通过调节氧气浓度和通风系统,可以控制缺氧环境的程度和持续时间。
3. 实验组和对照组的设置:实验组是暴露于缺氧环境下的小鼠,对照组是暴露于正常氧气环境下的小鼠。
通过对比实验组和对照组的数据,可以评估缺氧对小鼠的影响。
五、缺氧实验中的指标1. 血氧饱和度:血氧饱和度是评估缺氧程度的重要指标,常用脉搏血氧饱和度仪进行监测。
2. 生理指标:包括心率、呼吸频率、血压等生理参数的监测,可以反映小鼠在缺氧环境下的生理变化情况。
3. 行为表现:观察小鼠在缺氧环境下的活动量、食欲、水摄入等行为表现,可以评估小鼠对缺氧的应激反应。
4. 细胞代谢:通过检测小鼠组织和血液中的ATP含量、乳酸水平等指标,可以评估细胞代谢的变化。

昆明医科大学机能学实验报告实验日期:2014年10月11日带教教师:金会艳专业班级:2012级麻醉班缺氧实验一、实验目的1、复制不同病因导致小鼠缺氧的模型,了解乏氧性,血液性,组织中毒性缺氧的分类。
2、观察缺氧对呼吸系统,中枢神系统的影响,以及血液颜色变化。
3、了解影响缺氧耐受性的因素。
二、实验原理分别复制三型缺氧模型,观察缺氧对机体的影响。
三、实验仪器设备小鼠缺氧瓶(100ml-125ml带塞广口瓶),一氧化碳发生装置广口瓶,恒温水浴箱,5ml或2ml刻度吸管,1ml注射器,酒精灯,剪刀,镊子,钠石灰,甲酸,浓硫酸,5%硝酸钠,0.1%氰化钾,生理盐水。
四、实验方法与步骤1、乏氧性缺氧1取小鼠四只,标记编号(甲,乙,丙,丁)每2min记录死亡(记录时间及耗氧量,甲鼠尸体待留)计算小鼠耗氧率(r)一般情况* 2、一氧化碳中毒性缺氧(小鼠一只)观察记录如上死亡(记录时间)计算小鼠耗氧率(r)* 3、亚硝酸中毒缺氧(小鼠一只)观察记录一般状况*观察记录如上小鼠腹腔注射*5%亚硝酸钠死亡(记录时间,)2计算小鼠耗氧率(r)* 4、取出甲鼠及2,3实验小鼠尸体部分肝叶进行对比,记录颜色。
备注:(1)一般状况*,呼吸频率,精神状态,皮肤黏膜颜色。
(2)缺氧瓶*,一定要密封,可用凡士林涂在瓶塞外面,且可以加入钠石灰吸收水汽。
(3)腹腔注射,正确拿握小鼠,左下腹,45°进针,回抽。
(4)耗氧率计算:r[ml/(g·min)]=a(ml)÷w(g)÷t(min) a,耗氧量;w,体重;t,死亡时间。
五、实验结果表1.各型缺氧对机体的影响3表2.影响机体缺氧耐受性的因素(乏氧性缺氧) 4注:从左至右依次为,亚硝酸钠中毒,乏氧性缺氧,一氧化碳中毒。
5篇三:小鼠缺氧模型及其分析课程名称:机能实验学教研室:病理生理学教研室任课教师:张彩华授课章节:缺氧与普鲁卡因对神经干的作用授课专业和年级:2005级医疗授课学时:8学时授课时间:2007年3-7月实验题目:缺氧实验目的:1.观察原因和条件在疾病发生发展中的作用2.复制几种类型缺氧的模型,观察血液颜色的特点,分析其机制根据大纲要求:掌握概念:缺氧、低张性缺氧、血液性缺氧、循环性缺氧和组织性缺氧,紫绀、肠源性紫绀。

小鼠缺氧实验报告总结(共6篇)1. 实验目的分析小鼠缺氧对其器官和组织的影响,研究不同缺氧程度对小鼠的影响差异,探究相关治疗手段的有效性。
2. 实验方法将小鼠随机分为3组,分别进行正常供氧、缺氧15分钟和缺氧30分钟的实验,采用HE染色观察肝脏、肾脏、心脏和肺组织的形态学变化,使用ELISA测定血浆中的TNF-α、IL-1β和IL-6水平,应用脑功能评估仪对小鼠进行神经行为学评估。
3. 实验结果3.1 形态学变化与正常组相比,缺氧15分钟和缺氧30分钟组小鼠的肝脏、肾脏和心脏组织出现不同程度的细胞肿胀、坏死和炎症反应,肺组织出现明显的肺泡壁增厚。
缺氧30分钟组小鼠脏器组织损伤更为明显。
3.2 水平变化ELISA结果显示,与正常组相比,缺氧15分钟和缺氧30分钟组小鼠的血浆TNF-α、IL-1β和IL-6水平均明显升高,其中,缺氧30分钟组上升最为显著。
3.3 神经行为学评估缺氧30分钟组小鼠在神经行为学评估中表现出较低的活跃水平和运动能力,神经反应时间延长。
小鼠缺氧对其器官和组织造成了不同程度的损伤和炎症反应,在缺氧30分钟的情况下,损伤更为明显。
缺氧引起了血浆中炎症因子的水平升高,表明缺氧引起的器官和组织损伤可能与炎症反应有关。
缺氧也对小鼠的神经功能造成了影响。
针对小鼠缺氧造成的损伤和影响,有必要研究相应的治疗手段。
5. 实验启示缺氧对动物的影响是复杂的,需要采用多种评估方法进行综合评估。
炎症反应可能是缺氧造成的器官和组织损伤的机制之一。
在研究缺氧治疗手段时,需要考虑多个方面,包括药物、物理治疗和营养支持等。

小鼠缺氧实验报告缺氧是指由于各种原因使人体内氧气供应不足的情况,一定程度上有害于生命健康。
在科学研究中,通过对小鼠进行缺氧实验,可以更好地了解缺氧的生理学效应以及应对方法。
本文将介绍一个小鼠缺氧实验的基本流程和结果分析。
实验方法1. 实验动物本实验使用12只2-3月龄的小鼠,体重在20-25g之间。
小鼠是实验动物中最为常用的种类之一,其生理特征与人体较为接近,这也是选择小鼠作为实验动物的原因之一。
2. 组织样本制备将小鼠放置在缺氧室中,实行8小时长期缺氧训练,然后立即用三氯乙酸酚麻醉动物。
随后,取出小鼠大脑、心脏和肝脏等器官,将其冰冻保存,以备后续组织样本制备。
3. RT-PCR分析通过RT-PCR反应体系,提取所需组织样本中的RNA。
随后运用高保真度反转录酶进行反转录,获得相应的cDNA模板。
根据所需基因及其引物调整试剂体系,进行PCR扩增反应。
扩增结束后,取样本进行凝胶电泳检测,分析其PCR扩增产物的特征和大小,以判断该基因的表达情况。
实验结果1. 缺氧训练引起小鼠组织缺氧损伤缺氧训练后,小鼠被发现缺氧受损明显,心脏等器官出现不同程度的缺氧损伤,包括细胞膜破损,线粒体肿胀、减少和形态改变等。
同时,高浓度染料染色显示,组织细胞核周围空隙的体积显著增大,这也表明缺氧训练引起了细胞凋亡和坏死。
2. 缺氧训练重构小鼠的基因表达谱RT-PCR分析结果显示,在缺氧训练后,小鼠的基因表达谱出现了显著变化。
在实验中选择的神经元特异性烯化酶(NeuN)和中性粒细胞介素-1β(IL-1β)基因的表达水平均有所变化。
其表达水平明显下降,表明大脑和心脏细胞缺氧损伤后,神经元的表达产物发生异常变化,进而影响了细胞内环境进一步发生的改变。
3. 缺氧训练影响小鼠免疫系统实验后,采用血清免疫学试验探究缺氧训练对小鼠免疫系统的影响,结果表明,缺氧训练对小鼠免疫系统造成了一定程度的负面影响,如分泌免疫球蛋白(IgG)的水平显著下降。


缺氧的类型及影响缺氧耐受性的因素浙江中医药大学中七一班沈维 201212201501009 摘要:【目的】:复制小鼠乏氧性缺氧模型,观察温度、中枢神经系统机能状态对小鼠缺氧耐受性的影响。
复制小鼠血液性缺氧模型,观察还原剂对小鼠缺氧耐受性影响.【方法】:乏氧性缺氧中,分别腹腔注射生理盐水和氯丙嗪作为对照,计算耗氧量。
亚硝酸钠中毒中,注射亚硝酸钠溶液后,分别注射生理盐水和美蓝作为对照,取肝脏和肺脏观察血液颜色。
【结果】:乏氧性缺氧中,注射生理盐水的小鼠耗氧率为26.73;注射氯丙嗪的小鼠耗氧率为1.56。
亚硝酸钠中毒实验中,注射生理盐水的小鼠在14分36秒死亡,耳尾唇颜色出现青石板色。
小鼠死亡后解剖观察肝脏的其颜色为深咖啡色,肺脏为咖啡色;注射美兰的小鼠在32分30秒处死,耳尾唇颜色出现较浅的青石板色。
小鼠死亡后解剖观察肝脏的颜色为紫黑色,肺脏为淡咖啡色。
【结论】:给小鼠注射氯丙嗪、冰浴降温可显著降低总耗氧率,延长其存活时间。
亚硝酸盐可显著缩短小鼠存活时间,降低呼吸频率。
美兰可以缓解亚硝酸盐对小鼠的作用,已定程度延长小鼠存活时间,延缓呼吸频率的下降。
关键词:乏氧性缺氧;亚硝酸钠中毒;死亡时间引言:当供应组织的氧不足,或组织利用氧障碍时,机体的机能和代谢可发生异常变化,这种病理过程称之为缺氧。
缺氧是多种疾病共有的病理过程。
许多原因都能使机体发生缺氧。
不同类型的缺氧,其机体的代偿适应性反应[1]和症状有所不同。
1.材料1.1 实验对象:小鼠4只1.2 器材:广口瓶(带有橡皮管及橡皮塞)2 个,1ml 注射器,剪刀,镊子;1.3 实验试剂:0.25%氯丙嗪;生理盐水,5%亚硝酸钠溶液;1%美蓝溶液,冰块,钠石灰。
2.方法2.1 乏氧性缺氧实验2.1.1 取两只老鼠先编号,再进行称重,1号小鼠18.7g,2号小鼠16.7g。
2.1.2 对1 号鼠按0.1ml/10g 进行腹腔注射0.187ml的生理盐水,将它放在室温下10分钟,记录呼吸频率。

一、实验背景缺氧是指机体组织在氧气供应不足的情况下,导致细胞代谢和功能受到影响的一种病理状态。
为了研究缺氧对小鼠生理和生化过程的影响,本实验通过人为制造缺氧环境,观察小鼠在不同缺氧条件下的生理反应和生化指标变化,从而分析缺氧的机制。
二、实验目的1. 复制不同类型的缺氧模型,如乏氧性缺氧、血液性缺氧和组织中毒性缺氧。
2. 观察缺氧对小鼠呼吸系统、中枢神经系统的影响。
3. 分析缺氧对小鼠血液颜色、耗氧量等生化指标的影响。
4. 探讨影响缺氧耐受性的因素。
三、实验方法1. 缺氧模型的复制:- 乏氧性缺氧:将小鼠放入密闭容器中,逐渐降低容器内的氧气浓度。
- 血液性缺氧:通过腹腔注射亚硝酸钠或氰化钾等物质,降低血液中氧合血红蛋白的含量。
- 组织中毒性缺氧:通过注射一氧化碳等物质,阻断组织细胞对氧气的利用。
2. 观察指标:- 呼吸频率和深度- 中枢神经系统功能(如翻正反射、肌肉紧张度等)- 血液颜色变化- 耗氧量3. 数据分析:- 通过记录小鼠在不同缺氧条件下的生理和生化指标变化,分析缺氧的机制。
四、实验结果1. 呼吸系统:- 乏氧性缺氧和血液性缺氧条件下,小鼠呼吸频率和深度明显增加,以增加氧气摄入和二氧化碳排出。
- 组织中毒性缺氧条件下,小鼠呼吸频率和深度无明显变化。
2. 中枢神经系统:- 乏氧性缺氧和血液性缺氧条件下,小鼠出现翻正反射减弱、肌肉紧张度降低等中枢神经系统功能障碍。
- 组织中毒性缺氧条件下,小鼠中枢神经系统功能无明显变化。
3. 血液颜色:- 乏氧性缺氧和血液性缺氧条件下,小鼠血液颜色变暗,呈紫红色,提示血液中氧合血红蛋白含量降低。
- 组织中毒性缺氧条件下,小鼠血液颜色无明显变化。
4. 耗氧量:- 乏氧性缺氧和血液性缺氧条件下,小鼠耗氧量明显增加,以维持生命活动。
- 组织中毒性缺氧条件下,小鼠耗氧量无明显变化。
五、机制分析1. 呼吸系统:- 缺氧条件下,呼吸中枢兴奋,导致呼吸频率和深度增加,以提高氧气摄入和二氧化碳排出。
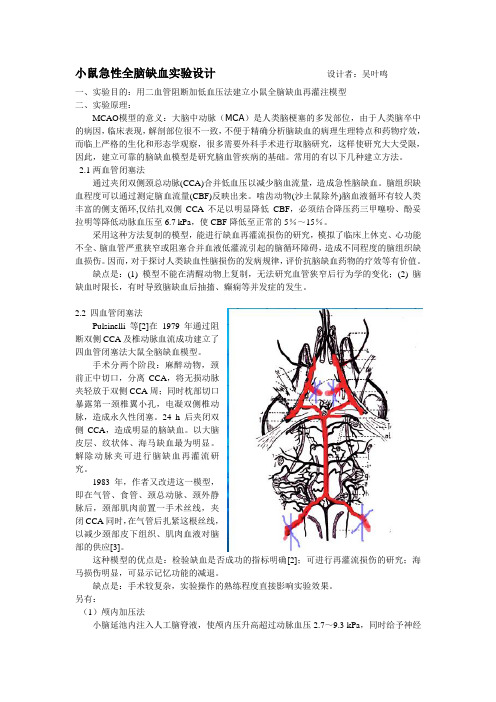
小鼠急性全脑缺血实验设计设计者:吴叶鸣一、实验目的:用二血管阻断加低血压法建立小鼠全脑缺血再灌注模型二、实验原理:MCAO模型的意义:大脑中动脉(MCA)是人类脑梗塞的多发部位,由于人类脑卒中的病因,临床表现,解剖部位很不一致,不便于精确分析脑缺血的病理生理特点和药物疗效,而临上严格的生化和形态学观察,很多需要外科手术进行取脑研究,这样使研究大大受限,因此,建立可靠的脑缺血模型是研究脑血管疾病的基础。
常用的有以下几种建立方法。
2.1两血管闭塞法通过夹闭双侧颈总动脉(CCA)合并低血压以减少脑血流量,造成急性脑缺血。
脑组织缺血程度可以通过测定脑血流量(CBF)反映出来。
啮齿动物(沙土鼠除外)脑血液循环有较人类丰富的侧支循环,仅结扎双侧CCA不足以明显降低CBF,必须结合降压药三甲噻吩、酚妥拉明等降低动脉血压至6.7 kPa,使CBF降低至正常的5%~15%。
采用这种方法复制的模型,能进行缺血再灌流损伤的研究,模拟了临床上休克、心功能不全、脑血管严重狭窄或阻塞合并血液低灌流引起的脑循环障碍,造成不同程度的脑组织缺血损伤。
因而,对于探讨人类缺血性脑损伤的发病规律,评价抗脑缺血药物的疗效等有价值。
缺点是:(1) 模型不能在清醒动物上复制,无法研究血管狭窄后行为学的变化;(2) 脑缺血时限长,有时导致脑缺血后抽搐、癫痫等并发症的发生。
2.2 四血管闭塞法Pulsinelli 等[2]在1979年通过阻断双侧CCA及椎动脉血流成功建立了四血管闭塞法大鼠全脑缺血模型。
手术分两个阶段:麻醉动物,颈前正中切口,分离CCA,将无损动脉夹轻放于双侧CCA周;同时枕部切口暴露第一颈椎翼小孔,电凝双侧椎动脉,造成永久性闭塞。
24 h后夹闭双侧CCA,造成明显的脑缺血。
以大脑皮层、纹状体、海马缺血最为明显。
解除动脉夹可进行脑缺血再灌流研究。
1983年,作者又改进这一模型,即在气管、食管、颈总动脉、颈外静脉后,颈部肌肉前置一手术丝线,夹闭CCA同时,在气管后扎紧这根丝线,以减少颈部皮下组织、肌肉血液对脑部的供应[3]。

\篇二:缺氧缺氧动物模型复制及中枢神经系统功能抑制和低温对缺氧的影响【摘要】目的:本实验学习复制乏氧性缺氧和血液性缺氧的动物模型方法,观察缺氧过程中呼吸的反应及血液色泽和全身一般情况的变化,并了解温度和中枢神经系统机能状态对缺氧耐受的影响以及对照实验和控制实验条件重要性。
方法:通过复制缺氧动物模型,观察不同类型缺氧过程中呼吸、黏膜和血液色泽的变化。
通过测定耗氧量和小鼠的存活时间来观察中枢神经系统机能抑制和低温对缺氧的影响。
结果:中枢神经系统功能抑制和低温对动物耐受缺氧的影响与对照组相比,存活时间和总耗氧率有显著性差异;复制不同原因造成的不同缺氧类型小鼠都表现出了不同的呼吸频率和存活时间的变化。
结论:给小鼠注射氯丙嗪、冰浴降温可显著降低总耗氧率,延长其存活时间(p<0.01)。
co中毒、亚硝酸盐可显著缩短小鼠存活时间,降低呼吸频率。
美兰可以缓解亚硝酸盐对小鼠的作用,已定程度延长小鼠存活时间,延缓呼吸频率的下降。
【关键词】缺氧氯丙嗪总耗氧率 co 亚硝酸盐美兰存活时间当供应组织的氧不足,或组织利用氧障碍时,机体的机能和代谢可发生异常变化,这种病理过程称为缺氧。
根据缺氧的原因不同可将缺氧分为低张性缺氧、血液性缺氧、循环性缺氧和组织中毒性缺氧四种类型,不同类型的缺氧,机体的代偿适应性反应和症状表现有所不同。
1.材料和方法1.1实验动物:小白鼠(雌性)。
1.2 药品:氯丙嗪(chlorpromazine) 、钠石灰(soda lime),亚硝酸钠( sodium nitrite ) 、亚甲基蓝(美蓝)(methylene blue,mb)、 0.9%nacl (physiological saline solution) 、co(carbon monoxide)。
1.3 器材:100、500ml广口瓶和测耗氧装置。
1.4 方法1.4.1 中枢神经系统功能抑制和低温对缺氧的影响取2只性别相同体重相近的小鼠,准确称取体重,并随机分为生理盐水组和氯丙嗪组。
本文通过小鼠急性脑缺氧实验、大鼠大脑中动脉栓线法局灶性脑缺血(MCAO)损伤模型、对脑血流量影响实验、抑制血小板聚集及血栓形成实验、小鼠不完全脑缺血模型、沙土鼠全脑缺血再灌注损伤等实验和模型,分别从扩张脑血管、抑制血小板聚集及血栓形成、抗水肿、抗缺血再灌注损伤、抗自由基和兴奋性氨基酸损伤等角度,系统的研究了三七中人参三醇皂苷(PTS)对缺血性脑中风的防治作用及其机制。
方法1.小鼠急性脑缺氧实验小鼠i.p.给药,每天一次,共3次,末次给药后30min 将小鼠逐只断头,立即按秒表记录小鼠断头后至张口喘气停止时间作为耐缺氧指标。
2.大鼠大脑中动脉栓线法局灶性脑缺血(MCAO)损伤模型雄性SD大鼠,i.p.预防给药两次,每天一次,造模前O.5h i.v.给药1次,造模后4h和10h i.p.给药两次。
模型建立:分离、结扎右侧颈总动脉,参照Berdson法用4-0尼龙线阻断大脑中动脉。
造模成功能够存活24h的大鼠确定为最后实验对象,并进行行为学评分后,快速取右脑,并切成三片,将脑前部用于脑含水量测定,中部用于脑梗死面积测定,后部用于病理组织学检查。
3.对脑血流量影响实验犬静脉滴注给药,分别在给药前和给药后5、10、15、30、60、120以及180min测定平均动脉血压(MAP)、心率(HR)、脑血流量(CBF)和脑血管阻力(CVR)等指标。
4.抑制血小板聚集及血栓形成实验抑制血小板聚集:大鼠i.p.给药,共3次,每天1次。
于末次给药30min后,分别自颈总动脉放血,在血样中加入5μl已稀释的ADP(终浓度为50μmol/L)反应5min后测定最大聚集度。
抑制血栓形成:大鼠经4%戊巴比妥钠i.p.麻醉,舌下静脉给药后20min,分离右侧颈总动脉和左侧颈外静脉。
把插入丝线的聚乙烯管的两端分别插入右侧颈总动脉和左侧颈外静脉,打开动脉夹开放血液15min后,中断血流,迅速取出聚乙烯管中的血栓,在分析天平上称重,求出血栓抑制率。
5.双侧颈总动脉结扎的不完全脑缺血模型给小鼠i.p.给药,共3次,每天1次;于末次给药后30min,麻醉后分离双侧颈总动脉,各组经尾静脉注射1%伊文思蓝溶液,并分别在注射10min后结扎双侧颈总动脉。
在结扎3h后断头取出脑组织,称重后测脑组织内伊文思蓝含量并计算脑指数。
6.沙土鼠全脑缺血再灌注损伤模型采用结扎沙土鼠双侧颈总动脉15min再灌注24h制备全脑缺血再灌注损伤模型,动物随机分成假手术组、模型组、PTS 30mg/kg组、PTS 60mg
/kg组、PTS120mg/kg组和阳性对照药血栓通注射液组。
观察造模24h后PTS 对沙土鼠脑组织超氧化物歧化酶(SOD)、丙二醛(MDA)、兴奋性氨基酸及病理组织学的影响。
结果1.小鼠急性脑缺氧实验结果提示,PTS注射液30mg/kg以上剂量组给药后均能显著延长小鼠断头喘息时间,提示PTS注射液可提高小鼠脑耐急性缺氧的能力以增强对抗脑中风的能力。
2.大鼠大脑中动脉栓线法局灶性脑缺血(MCAO)损伤模型实验提示:一定剂量的PTS注射液能改善MCAO大鼠的偏瘫体征,缩小脑内梗死面积,减轻脑水肿和神经元细胞的继发性损害,对MCAO大鼠具有良好的防治作用。
3.脑血流量实验表明:12.3mg/kg、24.6mg/kg和49.6mg/kg剂量的PTS注射液在给药后30分钟内均能明显降低犬脑血管阻力,使脑血流量显著增加,而对血压无明显影响,对心率影响也不明显,机制可能与扩张脑血管有关。
4.抑制血小板聚集及血栓形成实验提示,41.54 mg/kg和83.08mg/kg剂量的PTS注射液对ADP诱导的大鼠血小板聚集有明显的抑制作用,且随着剂量的增大抑制作用逐渐增强;抗血栓形成实验提示,PTS注射液各剂量组能明显抑制大鼠血栓形成。
5.小鼠双侧颈总动脉结扎不完全脑缺血模型实验表明:与模型组比较,PTS注射液各组脑指数和脑伊文思蓝含量显著降低,提示一定剂量的PTS注射液可以抑制小鼠脑缺血引起的脑血管通透性增加,从而降低脑指数,减轻脑水肿。
6.PTS对沙土鼠全脑缺血再灌注损伤的保护作用组织病理学检查表明,同模型组比较,PTS中、高剂量组对沙土鼠脑缺血再灌注致脑组织和神经细胞的病理损伤有较好的改善作用。
脑缺血再灌注24小时后沙土鼠脑组织SOD活性明显降低,MDA含量明显提高,与假手术相比较均有显著性差异。
PTS 给药组的SOD活性与与模型组相比显著升高,MDA含量与模型组相比显著降低,提示PTS对沙土鼠全脑缺血再灌脑组织的自由基损伤有明显保护作用。
造模后模型组G1u和Asp明显升高,PTS各组升高值明显低于模型组,提示PTS可抑制兴奋性氨基酸的释放,保护脑神经细胞。
结论综合以上分析,结果提示一定剂量的PTS对缺血性脑中风有明显的防治作用,其作用机制可能是扩张脑血管、抑制血小板聚集及血栓形成、减轻脑水肿以恢复脑血流的供应,以及抵抗自由基和兴奋性氨基酸损伤以保护脑神经细胞。