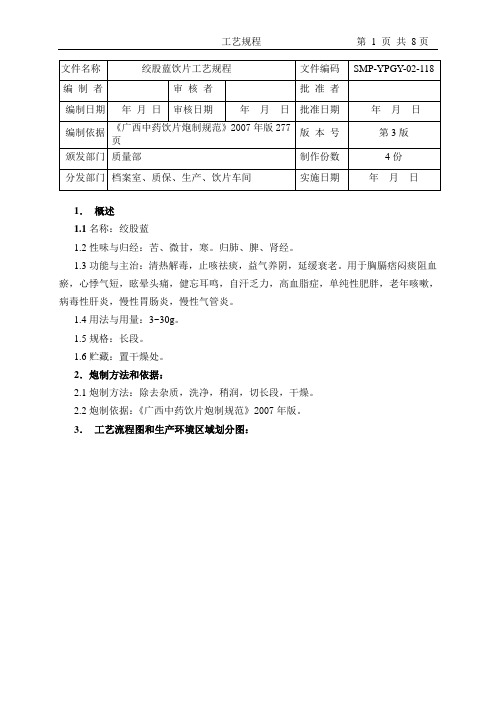
饮片工艺规程
- 格式:doc
- 大小:168.50 KB
- 文档页数:12

江西臻药堂药业股份有限公司1.产品概述1.1 品名:浮萍,成品代码CP30401。
1.2 性状: 本品为扁平叶状体,呈卵形或卵圆形,体轻,手捻易碎。
气微,味淡。
1.3 性味与归经:辛,寒。
归肺经。
1.4 功能主治:宣散风热,透疹,利尿。
用于麻疹不透,风疹瘙痒,水肿尿少。
1.5 用法用量3~9g。
1.6规格与包装规格: 1kg/包、2kg/包、5kg/包。
1.7贮存:置阴凉干燥处。
2.处方依据及制法2.1 依据:《中国药典》2015年版一部;《江西中药炮制规范》(2008年版)。
2.2 处方浮萍2.3 批量每批按100kg进行换算物料消耗定额。
2.4制法取原药材,净制。
3.生产工艺流程图4.饮片生产过程、工艺条件及质量风险控制点和风险控制措施4.1生产准备4.1.1 文件准备4.1.1.1中药饮片批生产指令明确了饮片批品种名称、批号、生产批量、检验单号、投料量等。
4.1.1.2中药饮片批包装指令明确了包装品种名称、规格、批号、包装批量、包装用量等。
4.1.1.3生产品种应有质量标准、工艺规程、岗位标准操作程序。
4.1.1.4生产地点应有卫生要求的文件规定和卫生清洁标准操作程序。
4.1.1.5使用设备应有相应的设备操作、维护保养、清洁标准操作程序。
4.1.1.6容器具清洁应有相应的标准操作程序。
4.1.1.7应有岗位所需生产记录(含清场),工序运行状态标志、设备运行状态标志、物料领料单等空白表格。
4.1.1.8其他有关执行文件。
4.1.1.9上述文件均应为现行文件。
4.1.2物料准备4.1.2所用物料与中药饮片批生产指令或中药饮片批包装指令或工艺规程相符。
4.1.2.1核对领(配)料单或物料标签等内容,如物料名称、批号、合格证或检验报告书(检验单号)等,应准确无误。
4.1.2.2检查物料外包装或容器,应完好、清洁、物料无污染,并称量、复核。
4.1.3现场检查4.1.3.1检查生产场所清洁、卫生、应符合该区卫生要求,有清洁、清场合格证。
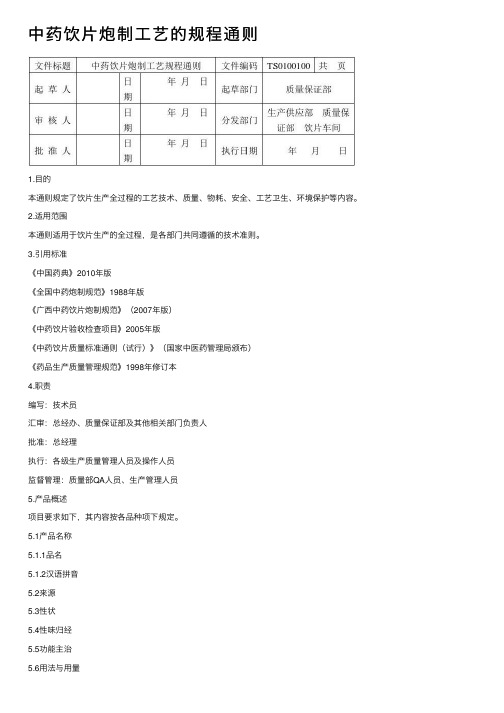
中药饮⽚炮制⼯艺的规程通则1.⽬的本通则规定了饮⽚⽣产全过程的⼯艺技术、质量、物耗、安全、⼯艺卫⽣、环境保护等内容。
2.适⽤范围本通则适⽤于饮⽚⽣产的全过程,是各部门共同遵循的技术准则。
3.引⽤标准《中国药典》2010年版《全国中药炮制规范》1988年版《⼴西中药饮⽚炮制规范》(2007年版)《中药饮⽚验收检查项⽬》2005年版《中药饮⽚质量标准通则(试⾏)》(国家中医药管理局颁布)《药品⽣产质量管理规范》1998年修订本4.职责编写:技术员汇审:总经办、质量保证部及其他相关部门负责⼈批准:总经理执⾏:各级⽣产质量管理⼈员及操作⼈员监督管理:质量部QA⼈员、⽣产管理⼈员5.产品概述项⽬要求如下,其内容按各品种项下规定。
5.1产品名称5.1.1品名5.1.2汉语拼⾳5.2来源5.3性状5.4性味归经5.5功能主治5.6⽤法与⽤量5.7贮藏5.8规格6.⼯艺流程图6.1清炒⼯艺流程图6.2加辅料炒⼯艺流程图6.3炙制⼯艺流程图6.4燀制⼯艺流程图6.5煮制⼯艺流程图6.6蒸制⼯艺流程图6.7烫制⼯艺流程图6.8煨制⼯艺流程图6.9⽔飞⼯艺流程图6.10煅制⼯艺流程图7. 操作过程及⼯艺条件7.1净制: 按照领料程序从库房领出原料,根据《中国药典》2005年版、《全国中药炮制规范》1988年版、《⼴西中药饮⽚炮制规范》2007年版及该品种《炮制⼯艺规程》进⾏净制⽣产。
7.1.1净选操作⼈员严格按照净制SOP进⾏操作。
7.1.1.1操作⼈员选⽤不锈钢筛⽹,筛除泥沙、杂质,⼿选去⾮药⽤部份及霉变药材。
7.1.1.2操作⼈员将净选后的药材在QA监控下转⼊洗药区。
7.1.2.1洗药前的检查,洗药间不得有上次⽣产剩余的物料,洗药池洁净度应符合⽣产要求。
7.1.2.2洗药操作:7.1.2.1检查为正常后⽅可将药材放⼊洗药池内,先打开排⽔阀,再打开进⽔阀将清洁⽔喷⼊洗药池内,使药材得到充分清洗(冲5分钟),清洗⼲净后起料,起料后放⼊洗药⽤料盘内滤去余⽔。

中药饮片净制工序流程
中药饮片的净制工序流程主要包括以下步骤:
1. 挑选:将药材中非药用部分挑出,保留药用部分;或将药材按大小、粗细分类,以便下一道工序的制作和处理。
2. 风选:根据药物和杂质的重量不同,利用风力,除去药物中的杂质。
3. 水洗:用清水洗去药材附着的泥土和杂质。
水洗时应注意掌握时间,不能让药材在水中浸泡太久,除需要切制外,应及时将药物干燥。
4. 切制:采用人工或机械的方法,将干净的药物切成片、段、块等一定规格的饮片。
切制后的饮片需经水润软化,要求“少泡多润”“药透水尽”,防止药材内在水溶药效成分的丢失。
切制的方法有切、剪、刨、铹、劈、捣、制绒等。
切制要求一定规格的厚薄度、粒度,切制后的饮片加以干燥,以利保存、保证质量。
5. 炮炙:取用净制或切制后的净药材、净片,根据中医药理论制定的炮制法则,采用规定的炮制工艺制成药物的过程。
炮炙方法有加热处理的如炒制、烫制、煅制、制炭、蒸制、煮制、煨制等;加入特定辅料再经加热处理的如酒制、醋制、盐制、姜汁炙、蜜炙、药汁制等;另外还有采用制霜、水飞等工艺处理的。
以上信息仅供参考,如需获取更具体的信息,建议咨询中医药领域专业人士。

目的制定姜竹茹饮片工艺规程,使其生产操作规范化、标准化,符合本公司生产实际和GMP的管理要求,保证生产出的产品质量均一、稳定。
保证产品在生产、储存、销售过程中符合质量标准要求。
范围适用于姜竹茹饮片的全过程。
责任人生产部人员、质量部人员、生产车间人员、检测中心人员。
内容1.产品概述1.1产品名称:姜竹茹1.2产品代码:1.3来源:本品为禾本科植物青秆竹Bambusa tuldoides Munro、大头典竹Sinocalamus beecheyanus (Munro) McClure var.pubescens P.F.Li 或淡竹Phyllostachys nigra (Lodd.) Munrovar. henonis ( Mitf. ) Stapf ex Rendle 的茎秆的干燥中间层。
全年均可采制,取新鲜茎,除去外皮,将稍带绿色的中间层刮成丝条,或削成薄片,捆扎成束,阴干。
前者称“散竹茹”,后者称“齐竹茹”。
1.4性状1.4.1竹茹:本品为卷曲成团的不规则丝条或呈长条形薄片状。
宽窄厚薄不等,浅绿色、黄绿色或黄白色。
纤维性,体轻松,质柔韧,有弹性。
气微,味淡。
1.4.2姜竹茹饮片:本品形如竹茹,表面黄色。
微有姜香气。
1.5性味与归经:甘,微寒。
归肺、胃、心、胆经。
1.6功能主治:清热化痰,除烦,止呕。
用于痰热咳嗽,胆火挟痰,惊悸不宁,心烦失眠,中风痰迷,舌强不语,胃热呕吐,妊娠恶阻,胎动不安。
1.7饮片规格:短段5~10mm。
1.8包装规格:1.9贮藏:置干燥处,防霉,防蛀。
2.生产依据:整理炮制依据及炮制方法见《中华人民共和国药典》2015版第139页。
3.工艺流程图检验4.加工炮制操作过程4.1生产前的检查和准备:生产前各工序班组长确认各工序人员着装应符合要求;工作场所有《清场合格证》,并在有效期内;各工序设备处于完好状态,已清洁并在有效期内;计量器具、仪表在检定周期内;工器具已清洁并在有效期内;公用介质应符合规定;核对物料标识卡与实物一致,且符合生产要求;核对内包装材料与标准样张相符;生产前,收回《清场合格证》附于本批《批生产记录》上,同时做好《生产状态标识》。

江西臻药堂药业股份有限公司1.产品概述1.1 品名:川芎,成品代码CP10161。
1.2 性状: 本品为不规则厚片。
质坚实。
气浓香,味苦、辛,微甜。
1.3 性味与归经:辛,温。
归肝、胆、心包经。
1.4 功能与主治:活血行气,祛风止痛。
用于胸痹心痛,胸胁刺痛,跌扑肿痛,月经不调,经闭痛经,癥瘕腹痛,头痛,风湿痹痛。
1.5 用法用量:3〜10g。
1.6 规格与包装规格:1kg/包、2kg/包、5kg/包。
1.7贮存:置阴凉干燥处,防蛀。
2.处方依据及制法2.1 依据:《中国药典》2015年版一部;《江西中药炮制规范》(2008年版)。
2.2 处方川芎2.3 批量每批按100kg进行换算物料消耗定额。
2.4制法取原材料,除去杂质,分开大小,洗净,润透,切厚片,干燥。
3.生产工艺流程图4.饮片批过程、工艺条件及质量风险控制点和风险控制措施4.1生产准备4.1.1 文件准备4.1.1.1中药饮片批生产指令明确了饮片批品名、批号、生产批量、炮制加工基本流程、原药材进厂编号及检验单号、投料量等。
4.1.1.2中药饮片批包装指令明确了包装品种名称、规格、批号、包装规格、包装批量、包材用量等。
4.1.1.3生产品种应有质量标准、工艺规程、岗位标准操作程序等相关文件。
4.1.1.4生产场所应有卫生要求的文件规定和卫生清洁标准操作程序。
4.1.1.5使用设备应有相应的设备操作、维护保养、清洁标准操作程序。
4.1.1.6容器具清洁应有相应的标准操作程序。
4.1.1.7应有岗位所需生产记录(含清场),工序运行状态标志、设备运行状态标志、物料领料单、工序操作记录等空白表格。
4.1.1.8其他有关执行文件。
4.1.1.9上述文件均应为现行文件。
4.1.2物料准备4.1.2所用物料与中药饮片批生产指令或中药饮片批包装指令或工艺规程相符。
4.1.2.1核对领(配)料单或物料标签等内容,如物料名称、批号、检验报告书(检验单号)等,应准确无误。

中药饮片最标准工艺规程党参1 目的2 范围3 责任者4 产品概述5 炮制依据6 工艺流程图7 操作过程及工艺条件8 质量控制要点9 成品检查方法10 包装材料和包装规格、质量标准11 产品包装标签12 工艺卫生要求、工艺用水质量标准13 主要生产设备与生产能力14 技术安全及劳动保护15 劳动组织、岗位定员、工时定额与产品生产周期16 原辅材料消耗定额17 包装材料消耗定额18 动力消耗定额19 综合利用和环境保护1 目的制定出党参生产加工的工艺规程2 范围适用于本公司党参的生产加工3 责任者生产部、质保部一车间4 产品概述4.1 产品名称:党参DangShen4.2 来源:本品为桔梗科植物党参、素花党参或川党参的干燥根。
秋季采挖,洗净,干燥,以根条肥大粗壮,质柔润.香气浓.嚼之无渣者为佳4.3 成品性状:本品为类圆形或椭圆形的厚片,片面淡黄白色至淡黄棕色,有裂隙或发射状纹理,中央有黄色圆心,周边黄棕色至灰棕色,有纵皱纹。
质稍硬或略带韧性,有特殊香气,味微甜。
4.4 功能与主治:补中益气、健脾益肺、养血生津。
用于脾肺虚弱、气短心悸、食少便溏、嘘喘咳嗽、内热消渴。
4.5 用法与用量:9~12g 4.6 饮片规格:党参 4.7 有效期:二年4.8 贮藏:置通风干燥处,防蛀。
4.9 批准文号:5 炮制依据《中华人民共和国药典》20XX年版一部6 工艺流程图7 操作过程及工艺条件7.1 净制取原药材,去净残茎及杂质,除去泥沙,洗净。
7.2 软化7.2.1 取净党参,再以清水洗净后,放入润药机,按润药机操作SOP操作(SMP-EM1-008),时间约1小时。
7.2.2 至润透为度。
将党参竖向切开,中间无干心既为已透,备切。
7.3 片型规格厚片,厚度2~4mm。
7.4 切制7.4.1 将个装入剁刀式切片机的固定器内,铺平、压紧,以保推进速度一致,切片符合要求。
调整速度后,启动机器切片。
7.5 干燥7.5.1 烘干按DW-1.2-8带式干燥机SOP开起干燥机进行干燥,直至符合规定要求为止。

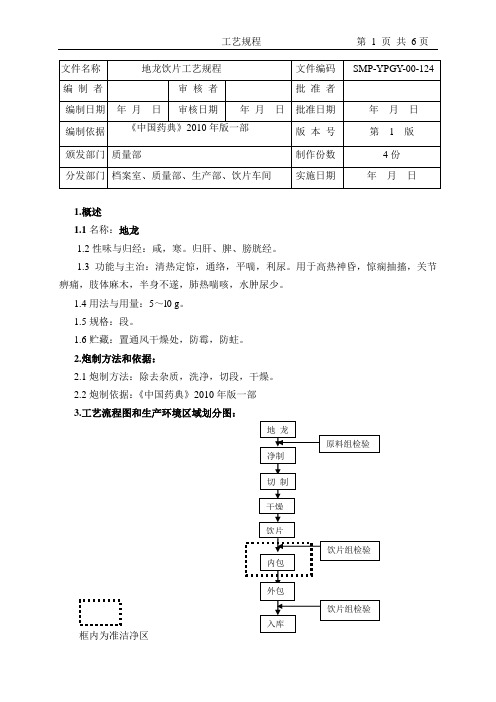
1.目的:规范甘草饮片、炙甘草的生产工艺,使甘草饮片、炙甘草相关SOP 的制定有章可循,确保产品质量。
2.范围:适用于甘草饮片、炙甘草的整个生产过程。
3.职责:车间工艺质量管理人员、各工序操作人员及QA监督员对本规程的实施负责。
4.产品概述4.1 产品名称:甘草4.2 汉语拼音:Gancao4.3 来源:本品为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza infata Bat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
4.4 性状:甘草呈类圆形或椭圆形厚片。
切面略显纤维性,黄白色,粉性,中间有一明显的环(形成层)及放射状纹理,有裂隙。
表面红棕色或灰棕色。
气微,味甜而特殊。
炙甘草切面黄色至深黄色,微有光泽,质稍黏。
具焦香气,叶甜。
4.5 性味与归经:甘,平。
归心、肺、脾、胃经。
4.6 功能与主治:甘草补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药。
用于脾胃虚弱,倦怠乏力,心悸气短,咳嗽痰多,脘腹、四肢挛急疼痛,痈肿疮毒,缓解药物毒性、烈性。
炙甘草补脾和胃,益气复脉。
用于脾胃虚弱,倦怠乏力,心动悸,脉结代。
4.7.甘草饮片用于提取维C 银翘片所使用的浸膏。
5. 工艺流程6.生产场所及设备6.1.主要操作间的名称和要求6.2.主要生产设备型号和编号6.3.关键设备的操作方法7. 生产步骤及工艺参数7.1.净选:将甘草置挑选台上除去杂质、筛去灰屑及非药用部分。
7.2.淘洗:将净选好的甘草投入到XY-900洗药机中,按照《XY-900洗药机标准操作程序》(SOP PO2001)开启洗药机,将甘草反复翻洗至药材无泥沙、土,出水管水质澄清,方可放出药材。
7.3.切制:7.3.1按照《WQ-500万能型切药机标准操作程序》(SOP PO2005)调节传送带速度,使药材切制长度为1-2cm(用于多功能提取)或3-4cm(用于普通提取)的药材段。

文件制修订记录目的:建立本公司黄芩饮片工艺规程,使之有法可依。
范围:本公司黄芩饮片工艺规程责任:前处理提取车间具体执行内容:1.领取黄芩原药材车间物料员凭领料单到药材库领取检验合格的原药材黄芩230㎏,放入药材暂存间,挂物料状态卡,注明品名、重量、规格、数量、编号、领料人、领料日期。
2.挑选:从药材暂存间领取黄芩入在挑选台上,挑选除非药材部分和杂质。
将挑选后的药材和非药用部分,分别称重并附有标签,标明品名、批号规格、生产者、生产日期、挑选结束,按挑选取工序清场SOP进行清场,并添写清场记录。
3.清洗:将上工序传入的挑选后的黄芩,按每次40kg放入洗药机内,按洗药机操作SOP进行清洗,至药材无泥沙,表面清洁后转入润药工序。
不同品种药材不能同时洗,用过的水不得用于洗涤其它药材。
清洗结束按洗药机清洁工序SOP对本工序进行清场。
4.润药:润药的具体过程,将清洗后的黄芩,大小,粗细分开放在浸润槽内,摆放整齐,喷淋饮用水,为药材总量的10%,边喷淋边翻动。
并加盖闷润至透药透水尽,润药时间在10小时左右,并每2小时翻动一次,视药材大小,粗细。
润药季节和润药时间略有不同,同时根据药材粗细、大小及软硬程度,灵活淋水,至药材软化易切割。
润药结束按润药工序清场SOP对本工序进行清场。
5.切制:将润软的黄芩,用往复式切药机,按其操作SOP进行切制2mm-4mm片,转入干燥工序。
切制结束按工序清场SOP对其进行清场。
6.干燥:用热风循环烘箱,按其操作SOP将切制饮片工序转入的黄芩上盘干燥,铺盘厚度2~3cm,烘干温度60-70℃,每两小时翻一次。
干燥时间6小时,到干燥时间停止干燥,待温度降至20℃下盘,用洁净塑料袋收集,外套帆布袋,称重附标签,标明品名、批号、规格、数量、生产日期、操作者,放入净药室待验区,请验水分,水分应控制在≤5%。
合格后入净药库,净药收率95%,物料物料平衡要求98%~100%。
上料,下料程序:上料宜自上而下,下料宜向下后上,防止异物落入盘中。
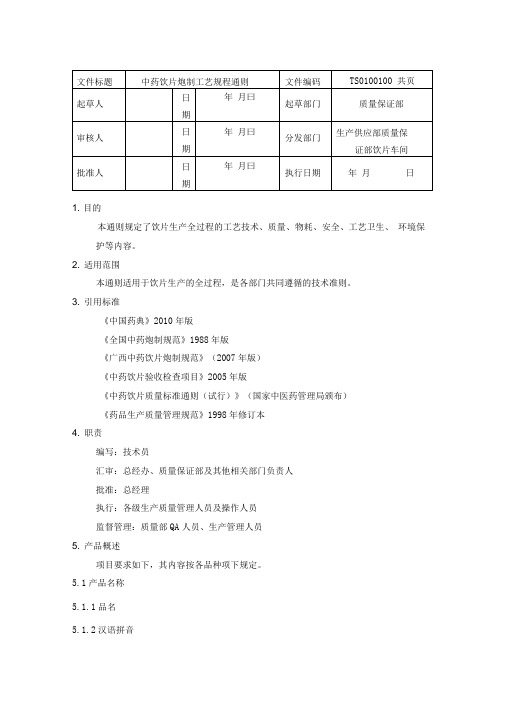
1. 目的本通则规定了饮片生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容。
2. 适用范围本通则适用于饮片生产的全过程,是各部门共同遵循的技术准则。
3. 引用标准《中国药典》2010年版《全国中药炮制规范》1988年版《广西中药饮片炮制规范》(2007年版)《中药饮片验收检查项目》2005年版《中药饮片质量标准通则(试行)》(国家中医药管理局颁布)《药品生产质量管理规范》1998年修订本4. 职责编写:技术员汇审:总经办、质量保证部及其他相关部门负责人批准:总经理执行:各级生产质量管理人员及操作人员监督管理:质量部QA人员、生产管理人员5. 产品概述项目要求如下,其内容按各品种项下规定。
5.1产品名称5.1.1品名5.1.2汉语拼音5.2来源5.3性状5.4性味归经5.5功能主治5.6用法与用量5.7贮藏5.8规格6. 工艺流程图6.1清炒工艺流程图6.2加辅料炒工艺流程图中药百净1F切i1净缶材纟■炙制(蜜炙、酒炙、醋炙、盐水炙、姜炙、药炙)6.4憚制工艺流程图成品库检验合6.5煮制工艺流程图6.6蒸制工艺流程图中药原1理净&1 Array透心即1 F一6.7烫制工艺流程图净药材投入已包装1检验F成品库检验合6.8煨制工艺流程图中药原湿面包I草纸间H置入已炒I投入已I星烘房I念入已炒加热挥发油—[^加热至规摊6.9水飞工艺流程图中药原] [-净-干1E研磨成―*包装1检验^T成品库A ―».Jt >6.10煅制工艺流程图7. 操作过程及工艺条件7.1 净制: 按照领料程序从库房领出原料,根据《中国药典》2005 年版、《全国中药炮制规范》1988年版、《广西中药饮片炮制规范》2007 年版及该品种《炮制工艺规程》进行净制生产。
7.1.1净选操作人员严格按照净制SOP进行操作。
7.1.1.1 操作人员选用不锈钢筛网,筛除泥沙、杂质,手选去非药用部份及霉变药材。

post]1、目的:建立半夏饮片生产工艺规程,规范、指导生产操作,确保半夏饮片质量合格。
2、适用范围:本规范适用于半夏饮片的生产全过程。
3、职责:生产部、质量部、设备部及操作人员。
4、内容:4.1编制依据:4.1.1《中华人民共和国药典》2005年版一部,《四川省中药饮片炮制规范》2002年版。
4.1.2本公司工艺规程编制管理规程。
4.2产品名称及规格:产品名称生半夏清半夏姜半夏法半夏规格生半夏清半夏片姜半夏片法半夏4.3产品概述:4.3.1【来源】本品为天南星科半夏属植物半夏Pinellia ternate(Thunb.)Breit.的干燥块茎经炮制加工而成。
4.3.2【性味与归经】辛,温;有毒。
归脾、胃、肺经。
4.3.3【功能与主治】燥湿化痰,降逆止呕、消痞散结。
用于痰多咳喘、痰饮眩悸、风痰眩晕、痰厥头痛、呕吐反胃、胸脘痞闷、梅核4.3.4【用法与用量】3~9g。
外用适量,磨汁涂或研末以酒调敷患处。
4.3.5【贮藏】置通风干燥处,防蛀。
4.3.6【包装规格】0.5㎏、1㎏、2㎏。
4.4工艺流程图:4.4.1生半夏(净半夏)工艺流程图:4.4.2清半夏工艺流程图:4.4.3姜半夏工艺流程图:4.4.3法半夏工艺流程图:注:※为质量控制要点。
4.5操作过程与工艺条件:4.5.1生半夏(净半夏)操作过程与工艺条件:4.5.1.1领料:根据《批生产指令》,填写《领料单》,从物料库领取半夏。
4.5.1.2净制:在净制间拣选台上除去半夏中的杂质,称重,装入洁净周转袋中,填写《请验单》,通知取样检验,填写记录和《物料流转卡》,并将生半夏(净半夏)送交中间站称量、复核并办理交接手续,统一定置存放。
4.5.2清半夏操作过程与工艺条件:4.5.2.1领料:根据《批生产指令》,从中间站领取净半夏;填写《领料单》,从物料部领取白矾(每100㎏半夏,用白矾20㎏)。
4.5.2.2浸泡:取净半夏,大小分开,用8%白矾溶液浸泡至内无干心,口尝微有麻舌感,取出,填写《物料流转卡》交下工序。

1.产品概述1.1 品名: 盐泽泻, 成品代码CP10792。
1.2 性状: 本品呈圆形或椭圆形厚片。
外表皮黄白色或淡黄棕色, 可见细小突起旳须根痕。
切面黄白色, 有焦斑, 有多数细孔。
气微, 味微苦。
1.3 性味与归经:甘、淡, 寒。
归肾、膀胱经。
1.4 功能主治:利水渗湿, 泄热, 化浊降脂。
用于小便不利, 水肿胀满, 泄泻尿少, 痰饮眩晕, 热淋涩痛, 高脂血症。
1.5 使用方法用量: 6~10g。
1.6规格与包装规格: 厚片、1kg/包、2kg/包、5kg/包。
1.7贮存:置干燥处, 防蛀。
2.处方根据及制法2.1 根据: 《中国药典》2023年版一部;《江西中药炮制规范》(2023年版)。
2.2 处方泽泻食盐2.3 批量每批按100kg进行换算物料消耗定额。
2.4制法取原药材, 除去杂质。
润透, 切厚片, 干燥, 盐水炙。
3.生产工艺流程图4.饮片批过程、工艺条件及质量风险控制点和风险控制措施4.1生产准备4.1.1 文献准备4.1.1.1中药饮片批生产指令明确了饮片批品名、批号、生产批量、炮制加工基本流程、原药材进厂编号及检查单号、投料量等。
4.1.1.2中药饮片批包装指令明确了包装品种名称、规格、批号、包装规格、包装批量、包材用量等。
4.1.1.3生产品种应有质量原则、工艺规程、岗位原则操作程序等有关文献。
4.1.1.4生产场所应有卫生规定旳文献规定和卫生清洁原则操作程序。
4.1.1.5使用设备应有对应旳设备操作、维护保养、清洁原则操作程序。
4.1.1.6容器具清洁应有对应旳原则操作程序。
4.1.1.7应有岗位所需生产记录(含清场), 工序运行状态标志、设备运行状态标志、物料领料单、工序操作记录等空白表格。
4.1.1.8其他有关执行文献。
4.1.1.9上述文献均应为现行文献。
4.1.2物料准备4.1.2所用物料与中药饮片批生产指令或中药饮片批包装指令或工艺规程相符。
4.1.2.1查对领(配)料单或物料标签等内容, 如物料名称、批号、检查汇报书(检查单号)等, 应精确无误。

目的建立白芍生产工艺规程,使其生产操作规范化、标准化,符合本公司生产实际和GMP 的管理要求,保证生产出的产品质量均一、稳定。
范围白芍生产的全过程。
责任生产副总经理、质量保证部部长、生产管理部部长、化验室主任、生产车间主任、质量保证部监控员、化验员、各工序班长及操作人员内容1 品名1.1 产品名称:白芍饮片1.2 汉语拼音:Baishao1.3 拉丁语:RADIX ANGELICAE DAHURICAE2 产品概述2.1 性状:呈类圆形的薄片(出口品为直片)。
表面淡棕红色或类白色,平滑。
切面类白色或微带棕红色,形成层环明显,形成层明显,可见稍隆起的筋脉纹呈放射状排列。
气微,味微苦、酸。
2.2 功能与主治:养血调经,敛阴止汗,柔肝止痛,平抑肝阳。
用于血虚萎黄,月经不调,自汗,盗汗,胁痛,腹痛,四肢挛痛,头痛眩晕。
2.3 用法与用量:6~15g。
2.4 贮藏:置干燥处、防蛀。
3 法定制法和依据3.1 法定制法3.1.1 白芍:除去杂质,洗净,润透,切薄片,干燥。
3.1.2 依据:《中华人民共和国药典》(2010年版一部)。
4 工艺过程4.1 领料:领料人员凭领料单领料,领料时严格复核,准确乘量。
4.2 拣选:执行《净选岗位标准操作规程》,拣出杂质,如虫蛀、霉变部分,并按大小分档,放洁净周转容器中,称量。
4.3 洗药:执行《洗药岗位标准操作规程》及《洗药机标准操作规程》,洗药岗位操作工将白芍放进洗药机中,用符合饮用水标准的水洗涤3遍至洁净、无泥沙,装入洁净塑料周转容器。
4.4 润制:执行《润药岗位标准操作规程》4.4.1不用润药机:闷润时间10-15小时。
4.4.2用润药机:把洗净的白芍按档次分别放入润药机内,执行《润药机标准操作规程》,抽真空压力-0.07Mpa,保持20分钟,压力0.08Mpa,温度70ºC,润制1小时,润透后取出。
4.5 切制:执行《切制岗位标准操作规程》,执行《直线往复式切药标准操作规程》切薄片,厚度在1~2mm。

文件名称百部饮片生产工艺规程文件编号WKL-TS-GY-019起草人起草日期年月日审核人审核日期年月日批准人批准日期年月日执行日期年月日颁发部门质管科版本号 2 分发号019分发部门质管化验生产车间营销办公室财务分发数量 1 0 1 0 0 1 0目的建立百部饮片生产工艺规程,使其生产操作规范化、标准化,符合本公司生产实际和GMP 的管理要求,生产出的产品质量均一、稳定。
范围百部饮片生产的全过程责任质量受权人、质管科科长、生产科科长、营销科科长、生产车间主任、质量监控员、化验员、仓库保管员、各工序工艺员及操作人员内容1品名1.1 产品名称:百部饮片1.2 汉语拼音:Bai bu yin pian1.3 拉丁语:STEMONAE RADIX2.1 性状:直立百部呈纺锤形,上端较细长,皱缩弯曲,长5~12cm,直径0.5~lcm。
表面黄白色或淡棕黄色,有不规则深纵沟,间或有横皱纹。
质脆,易折断,断面平坦,角质样,淡黄棕色或黄白色,皮部较宽,中柱扁缩。
气微,味甘、苦。
蔓生百部两端稍狭细,表面多不规则皱褶和横皱纹。
对叶百部呈长纺锤形或长条形,长8~24cm,直径0.8~2cm。
表面浅黄棕色至灰棕色,具浅纵皱纹或不规则纵槽。
质坚实,断面黄白色至暗棕色,中柱较大,髓部类白色。
2.2 功能与主治:润肺下气止咳,杀虫灭虱。
用于新久咳嗽,肺痨咳嗽,顿咳;外用于头虱,体虱,蛲虫病,阴痒。
蜜百部润肺止咳。
用于阴虚劳嗽。
2.3 用法与用量:3~9g。
2.4 包装规格:药用聚乙烯塑料薄膜包装袋或编织袋装,3g/袋、5g/袋、6g/袋、9g/袋、10g/袋、12g/袋、15g/袋、0.5Kg/袋、1Kg/袋、2Kg/袋、5Kg/袋、10Kg/袋、20kg/袋。
2.5 有效期:暂定三年。
2.6 贮藏:置通风干燥处,防潮。
3 制法和依据3.1 制法3.1.1 百部:除去杂质,洗净,润透,切厚片,干燥。
3.1.2 蜜百部:取百部净药材,照蜜炙法炒至不粘手。
1 制定目的中药饮片生产各部门提供必须共同遵守的技术准则,以保证生产的中药饮片批与批之间尽可能地与原设计吻合,保证每一中药饮片在整个有效期内保持预定的质量。
2 适用范围规程适用于公司泽兰的生产和技术管理,是本品生产各部门必须共同遵守的技术准则,是组织与指导泽兰生产的主要依据。
3 职责要求生产各部门对实施本规程负责,QA 人员、生产部部长负责监督检查,质量部部长负责抽查执行情况。
4 规程内容 4.1 生产处方4.1.1 产品名称和产品代码 4.1.1.1产品名称:泽兰 4.1.1.2 产品代码:YP-79 4.1.2 处方依据《中国药典》2010年版一部 4.2 生产工艺流程图除去杂质图1 泽兰饮片生产工艺流程图4.3 生产操作要求4.3.1 对生产场所和所用主要设备的说明4.3.1.1 生产场所说明生产场所按《生产厂房房间编号管理规程》进行编号,其生产环境按《药品生产质量管理规范》(2010年版)进行设置,其具体说明见下表:4.3.1.2 所用主要设备说明生产本品主要设备包括泽兰饮片生产各工序的设备及部分公用设备或设施,均按《设备(设施)编号管理规程》进行了编号,符合《药品生产质量管理规范》(2010年版)的要求,其具体说明见下表:4.3.2 关键设备的准备所采用的方法或相应规程的编号4.3.2.1净选台准备确认设备在清洁有效期内,否则按净选台规定的清洁方法重新清洁,并经过QA人员复核,满足生产工艺卫生要求的,再按净选台做好设备启用准备,待用。
4.3.2.2 电子秤准备确认需用电子秤已经校验,并在有效期内,再按《电子称校准、使用标准操作规程》对电子称进行使用前的校准,待用。
4.3.2.3 变频式复式切药机准备确认设备在清洁有效期内,否则按《QY-300变频式复式切药机清洁规程》规定的清洁方法重新清洁,并经过QA人员复核,满足生产工艺卫生要求的,再按《《QY-300变频式复式切药机清洁规程》做好设备启用准备,待用。
4.3.2.4干燥箱确认设备在清洁有效期内,否则按《JZ干燥箱清洁规程》规定的清洁方法重新清洁,并经过QA人员复核,满足生产工艺卫生要求的,再按《JZ干燥箱清洁规程》做好设备启用准备,待用。
4.3.3 详细的生产步骤和工艺参数说明4.3.3.1 原料材的净制4.3.3.1.1 备料岗位作业人员和车间有关管理人员按《备料标准操作规程》到仓库领取生产所需中药材,完成中药材领用后,按《物料进出车间标准操作规程》有关进入步骤完成中药材转移,进入拣选间。
4.3.3.1.2 生产前检查按《生产前检查标准操作规程》中的有关要求做好文件、物料、现场、安全等方面的检查工作,并予以记录。
4.3.3.1.3 作业前准备(1)作业前先将上次的清场合格证(副本)取下,纳入本次批生产记录中,并挂上生产状XXXXXXXXXXX有限公司GMP文件态标识卡,注明岗位、品名、规格、批号、日期等;需用的设备、容器具等的状态标识也应根据《操作间、设备、容器标识标准操作规程》进行更换或标识。
(2)检查已清洁的生产用具是否齐全。
4.3.3.1.4 中药材挑选(1)生产操作前再认真核对所领用中药材的名称、代码、批号和标识,确保生产所用中药材正确且符合要求。
(2)将需挑选的中药材以适宜的量倒入挑选台中,将中药材拣去杂质、非药用部分。
(3)将已挑选好的中药材装入周转桶中。
4.3.3.1.5 生产过程质量控制外观:不得有虫蛀、发霉、其他物质污染等异常现象。
4.3.3.1.6 作业结束(1)按《清场标准操作规程》的要求对生产现场进行清场。
(2)生产用容器具按《容器具清洁规程》进行清洁。
(3)按《一般生产区清洁规程》对挑选间等进行清洁。
(4)清场、清洁结束后清洁工具按《清洁工具清洁规程》进行清洁。
(5)QA人员检查合格后,发放并挂上“清场合格证”。
(6)按“特别说明的注意事项”的要求做好收率统计与计算、结料与退料、批生产记录和其他生产记录等工作。
4.3.3.2 原料材的净制4.3.4 所有中间控制方法及标准4.3.4.1 净制XXXXXXXXXXX有限公司GMP文件4.3.5 预期的最终产量限度,以及物料平衡的计算方法和限度4.3.5.1 预期的最终产量限度4.3.5.2 物料平衡计算方法和限度4.3.5.2.1净制工序实际值物料平衡(%)= ×100% ;限度:95.0 %~99.9%理论值挑选前所领用中药材的重量为理论值,挑选后中药材重量及能收集的残料为实际值。
4.3.6需要说明的注意事项4.3.6.1 一般生产区工艺卫生和环境卫生4.3.6.1.1 环境清洁、消毒(1)环境清洁、消毒应依据《一般生产区清洁规程》、《清洁剂、消毒剂配制使用标准操作规程》中的步骤进行相应的操作,以确保生产区的卫生符合生产工艺要求。
(2)为防止产生耐药菌株,非空气用消毒剂每月更换一次。
4.3.6.1.2 人员卫生管理(1)进入一般生产区人员应满足《个人卫生管理规程》的要求。
(2)进入一般生产区必须严格执行《人员进出一般生产区标准操作规程》的规定。
(3)一般生产区环境卫生管理依据《一般生产区管理规程》的有关规定进行管理。
4.3.6.2 收率统计与计算4.3.6.2.1在关键工序计算收率,进行物料平衡检查是避免或及时发现差错与混药的有效方法。
4.3.6.2.2 净制等工序加工结束后,岗位作业人员应及时统计物料使用情况、产量,并计算收得率等,QA人员审查在合格范围内或有偏差但确认无潜在质量事故后,方可流入下工序。
XXXXXXXXXXX有限公司GMP文件4.3.6.2.3每批产品在生产作业完成之后应及时进行物料平衡检查。
如有显著差异,必须查明原因,在得出合理解释、确认无潜在质量事故后,方可按正常产品处理。
4.3.6.2.4发生超限偏差时,须填写《偏差调查处理表》,写明品名、批号、规格、批量、工序、偏差内容、发生的过程及原因、地点、填表人签字、日期等,并交生产部有关人员。
4.3.6.2.5 生产部负责人及管理人员会同有关人员进行调查,根据调查结果提出处理建议:(1)继续加工,(2)重新加工,(3)回收或采用其他补救措施;如确认可能影响产品质量者,应作报废或销毁处理。
4.3.6.2.6 生产部负责人将上述处理建议(必要时应验证)写入《偏差调查处理表》,报质量部,由质量部负责人会同有关部门负责人审核、批准。
4.3.6.2.7 生产部按批准的文件组织实施,同时将《偏差调查处理表》调查报告、处理措施、实施结果等归档纳入批记录中,备查。
4.3.6.2.8 若发现偏差批次与该批前后批次产品有关联时,必须立即通知质量部作出相应处理。
4.4需要说明的注意事项4.4.1 工艺卫生和环境卫生(1)进入一般生产区(包装)必须严格执行《人员进出一般生产区标准操作规程》的规定。
(2)每周擦洗门窗、顶棚、贮器、地漏及对墙裙进行清洁。
4.4.2 现场检查4.4.2.1 检查生产场所清洁卫生状况,应符合该区卫生要求,有清场、清洁合格证,并在有效期内。
否则需重新清场或清洁。
4.4.2.2 需用的设备、设施应完好,有完好等状态标识。
4.4.2.3 容器具应符合清洁要求,并有清洁合格标识,并在有效期内。
4.4.2.4 计量器具测试范围符合生产要求,应经校验合格,并在有效期内,对生产用的测试仪器、仪表按要求进行必要的调试。
4.4.2.5 操作人员检查后填写检查记录,并签名。
4.4.2.6 工序负责人对检查结果进行复核,符合要求后签名确认。
4.4.2.7 检查记录纳入批生产记录。
4.4.2.8 检查水、电、气生产介质供应应正常。
4.4.3包装操作步骤的说明,包括重要的辅助性操作和所用设备的注意事项、包装材料使用前的核对XXXXXXXXXXX有限公司GMP文件4.4.3.1备料岗位作业人员和车间有关管理人员按《备料标准操作规程》到仓库领取合格证、泽兰饮片编织袋等,完成包装材料领用后,进行包装。
4.4.3.2生产前检查《生产前检查标准操作规程》中的有关要求做好文件、物料、现场、安全等方面的检查工作,并予以记录。
4.4.3.3 作业前先将上次的清场合格证(副本)取下,纳入本次批生产记录中,并挂上生产状态标识卡,注明岗位、品名、规格、批号、日期等;需用的设备、容器具等的状态标识也应根据《操作间、设备、容器标识标准操作规程》进行更换或标识。
4.4.3.4 生产操作前再认真核对所领用合格证的名称、代码、规格、编码和标识等,确保合格证材料正确且符合要求。
4.4.3.6 工艺要求(1)物料标示卡上应标明产品名称、规格、生产日期、批号、重量。
(2)不同品种的产品在没有采取隔离措施的情况下不得在同一操作室内同时进行包装作业;若须同时进行包装时,须用隔栏隔开后才能同时进行包装,以杜绝混药事故的发生。
4.4.3.7 生产过程质量控制(1)包装要求:严密、整齐、美观、无差错。
4.4.3.8 产品放行(1)每批包装结束后,由工序负责人填写请验单,通知质量部取样检验。
(2)已包装好的饮片置饮片库待验区待验。
(3)饮片检验合格后,车间即应办理饮片入库手续。
4.4.3.9 本岗位操作生产过程存在风险及其预防控制措施GMP4.4.3.10 作业结束(1)按《清场标准操作规程》的要求对生产现场进行清场。
(2)生产用容器具按《容器具清洁规程》进行清洁。
(3)清场、清洁结束后清洁工具按《清洁工具清洁规程》进行清洁。
(4)QA人员检查合格后,发放并挂上“清场合格证”。
(7)按4.4.5.5~4.4.5.6的要求做好结料与退料、生产记录等工作。
4.4. 4 收率统计与计算4.4.4.1 在包装工序进行物料平衡检查是避免或及时发现差错与混药的有效方法。
4.4.4.2 在包装结束后,岗位作业人员应及时统计包装材料使用情况、待包装产品收得率等,QA人员审查在合格范围内或有偏差但确认无潜在质量事故后,方可放行。
4.4.4.3 每批产品在包装作业完成之后应及时进行批物料平衡检查。
如有显著差异,必须查明原因,在得出合理解释、确认无潜在质量事故后,方可按正常产品处理。
4.4.4.4 发生超限偏差时,须填写《偏差调查处理表》,写明品名、批号、规格、批量、工序、偏差内容、发生的过程及原因、地点、填表人签字、日期等,并交生产部有关人员。
4.4.4.5 生产部和质量部负责人及管理人员会同有关人员进行调查,根据调查结果提出处理建议:(1)重新加工,(2)采用其他补救措施;如确认可能影响产品质量者,应作报废或销毁处理。
4.4.4.6 生产部负责人将上述处理建议(必要时应验证)写入《偏差调查处理表》,报质量部,由质量部负责人会同有关部门负责人审核、批准。
4.4.4.7 生产部按批准的文件组织实施,并将《偏差调查处理表》、调查报告、处理措施、实施结果等归档备查。