化学平衡图像题_(含答案)
- 格式:doc
- 大小:725.51 KB
- 文档页数:5

高考化学复习-化学平衡图像问题详解在教辅资料或模拟题中经常会出现下列经典图像对于化学反应mA(g)+nB(g)=pC(g)+qD(g)图1 图2设置的问题及解释如下:M点前,表示从反应物开始,v正>v逆;M点为刚达到平衡点(如下图);M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。
思考M点一定就是平衡点吗?M点后一定是平衡移动吗?先来看几道高考题:1、(2019江苏)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0B.图中X点所示条件下,延长反应时间能提高NO转化率C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率D.380℃下,c起始(O2)=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K>2000【思考】最高点是平衡点吗?分析实线和虚线变化的原因是什么?从题目信息可以看出,最高点不是平衡点,相同时间,转化率减低,可能是催化剂降低活性(注意区别失活与减低活性)【答案】BD【解析】A.随温度升高NO的转化率先升高后降低,说明温度较低时反应较慢,一段时间内并未达到平衡,分析温度较高时,已达到平衡时的NO 转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆方向移动,根据勒夏特列原理分析该反应为放热反应,∆H<0,故A错误;B.根据上述分析,X 点时,反应还未到达平衡状态,反应正向进行,所以延长反应时间能提高NO的转化率,故B正确;C.Y点,反应已经达到平衡状态,此时增加O2的浓度,使得正反应速率大于逆反应速率,平衡向正反应方向移动,可以提高NO的转化率,故C错误;D.设NO起始浓度为amol/L,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5amol/L、(5×10-4-0.25a)mol/L、0.5amol/L,根据平衡常数表达式K=>=2000,故D正确;故选BD。

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。

高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。

2021届高考化学易错题练习化学平衡图像【错题纠正】例题1、合成氨工业涉及固体燃料的气化,需要研究CO 2与CO 之间的转化。
为了弄清其规律,让一定量的CO 2与足量碳在体积可变的密闭容器中反应:C(s)+CO 2(g)2CO(g)ΔH ,测得压强、温度对CO 、CO 2的平衡组成的影响如图所示:回答下列问题:(1)p 1、p 2、p 3的大小关系是________,欲提高C 与CO 2反应中CO 2的平衡转化率,应采取的措施为_____________。
图中a 、b 、c 三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa 时,1 mol CO 2与足量碳反应达平衡后容器的体积为V ,CO 2的转化率为________,该反应的平衡常数K =________。
【解析】(1)正反应是气体体积增大的反应,增大压强,CO 的含量降低,根据图像可知,在温度相等时p 1对应的CO 含量最高,则p 1、p 2、p 3的大小关系是p 1<p 2<p 3。
升高温度CO 的含量升高,说明正反应是吸热反应,所以欲提高C 与CO 2反应中CO 2的平衡转化率,应采取的措施为升高温度、降低压强。
平衡常数只与温度有关系,升高温度平衡右移,平衡常数增大,则图中a 、b 、c 三点对应的平衡常数大小关系是K a =K b <K c 。
(2)900 ℃、1.013 MPa 时CO 的含量是80%,则C(s)+CO(g) 2CO(g)起始量(mol) 1 0转化量(mol) x 2x平衡量(mol) 1-x 2x因此2x 1+x=0.8,解得x =23, 则CO 2的转化率为66.7%,反应的平衡常数K =⎝⎛⎭⎫43V 213V =163V。
【答案】(1)p1<p2<p3升高温度、降低压强K a=K b<K c(2)66.7%16 3V例题2、(1)活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:①A、B、C三点中NO2的转化率最高的是__________(填“A”“B”或“C”)点。
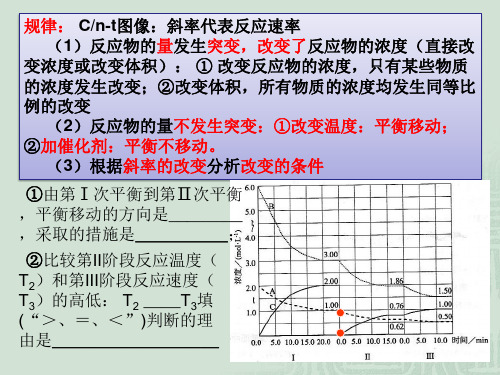

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。


【高二专题】化学反应原理之平衡图像分析专题(提高版)一、单选题1.化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是A.图①可以表示某化学平衡体系改变温度后,反应速率随时间的变化B.图②中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0未使用和使用催化剂时,反应过程中的能量变化C.图③表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,且甲的压强大D.图④中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0逆反应的平衡常数K随温度的变化【答案】D【解析】【分析】【详解】A、升高温度正逆反应速率均增大,同样降低温度正逆反应速率均降低,A不正确;B、催化剂能降低反应的活化能,所以a曲线表示的是使用催化剂,B不正确;C、乙达到平衡的时间的少,压强高反应速率快,达到平衡的时间少,因此乙曲线表示的压强大,C不正确;D、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数降低,因此逆反应的平衡常数增大,D正确;答案选D。
2.在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
下列推断正确的是A.升高温度,平衡常数增大B.W点X的正反应速率等于M点X的正反应速率C.Q点时,Y的转化率最大D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大【答案】C【解析】【分析】反应开始时没有达到平衡,反应向正向进行,X的量减少,到Q点时达到最小,则这一点是反应的最大限度,Q点后平衡向逆向移动X的量逐渐增加。
【详解】A、温度升高平衡向逆向移动,平衡常数减小,A错误;B、W、M两点X的浓度相同但是温度不相同,故反应速率不相等,B错误;C、Q点X的量最少,转化率最大,C正确;D、平衡时充入Z,相当于增大压强,反应两边气体的化学计量数相等,改变压强对平衡没有影响,达到新平衡时Z 的体积分数与原平衡一样,D错误;答案选C。
高(Gao)考化学专题复习:化学平衡图像专题1.对反(Fan)应2A(g)+2B(g)3C(g)+D(?),下列图象的描述(Shu)正确的是A. 依(Yi)据图①,若(Ruo)t1时升高温度,则ΔH<0B. 依据图①,若t1时增大压强,则D是固体或液体C. 依据图②,P1>P2D. 依据图②,物质D是固体或液体【答案】B2.下列图示与对应的叙述相符的是A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOHD. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大【答案】B3.—定条(Tiao)件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往(Wang) 2L 恒容密(Mi)闭容器中充入 1 mol CO2和(He)3 mol H2,在不同催化剂作(Zuo)用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是A. a 点 v(正)>v(逆)B. b点反应放热53.7 kJC. 催化剂效果最佳的反应是③D. c点时该反应的平衡常数K=4/3(mol-2.L-2)【答案】A4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A. 正反应是放热反应B. A、B一定都是气体C. D一定不是气体D. C可能是气体【答案】B5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是A. 升高温(Wen)度B. 增大(Da)压强C. 增大反应(Ying)物浓度D. 加入(Ru)催化剂【答(Da)案】C6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。

冠夺市安全阳光实验学校高考化学考点总动员系列专题15 化学平衡图像问题(含解析)【母题再现】题型介绍:化学反应速率与化学平衡图像是高考常考题型,一般考查速率(浓度)——时间图像、含量(转化率)—时间—温度(压强)图像、恒温线(或恒压线)图像等。
图像作为一种思维方法在解题过程中也有着重要作用,可以将一些较为抽象的知识,转化为图像,然后进行解决。
高考选题:(2013安徽卷)11.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO3(s) + CO(g)MgO(s) + CO2(g) +SO2(g) △H>0。
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是选项x yA 温度容器内混合气体的密度B CO的物质的量CO2与CO的物质的量之比C SO2的浓度平衡常数KD MgSO4的质量(忽略体积)CO的转化率解题技巧:化学反应速率与化学平衡图像解题步骤与技巧1、解题步骤2、解题技巧(1)先拐先平在含量(转化率)—时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
(2)定一议二当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(3)三步分析法一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
【考点揭秘】高频考点一:浓度(速率)—时间图像【典例】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。
图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且改变的条件均不同。
已知,t3~t4阶段为使用催化剂。
下列说法正确的是 ( )A.若t1=15 s,生成物C在t0~t1时间段的反应速率为0.004 mol·L-1·syx-1B.t4~t5阶段改变的条件为降低反应温度C.B的起始物质的量为0.02 molD.t5~t6阶段可能是增大压强【答案】A高频考点二:含量(转化率)—时间—温度(压强)图像【典例】密闭容器中进行的可逆反应:a A(g)+b B(g) c C(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。

高中化学平衡图像练习题一、化学平衡常数与图像1. 已知反应:N2(g) + 3H2(g) ⇌ 2NH3(g),在某温度下,平衡常数K为50。
若反应物和物的初始浓度分别为0.1 mol/L和0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:2SO2(g) + O2(g) ⇌ 2SO3(g),在不同温度下,平衡常数K分别为200和400。
请分别画出两个温度下,SO2和SO3的浓度随时间变化的图像。
二、勒夏特列原理与图像1. 对于反应:H2(g) + I2(g) ⇌ 2HI(g),在体积固定的条件下,向体系中加入一定量的H2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:N2O4(g) ⇌ 2NO2(g),在温度固定的条件下,增大体系的压强。
请画出反应物和物的浓度随时间变化的图像。
三、化学平衡移动与图像1. 对于反应:CaCO3(s) ⇌ CaO(s) + CO2(g),在温度固定的条件下,向体系中通入一定量的CO2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:Fe3O4(s) + 4H2(g) ⇌ 3Fe(s) + 4H2O(g),在温度和压强固定的条件下,移除部分Fe。
请画出反应物和物的浓度随时间变化的图像。
四、化学平衡与反应速率1. 对于反应:2NO(g) + O2(g) ⇌ 2NO2(g),在温度固定的条件下,改变反应物的初始浓度。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:A(g) + 2B(g) ⇌ 3C(g),在温度和压强固定的条件下,加入催化剂。
请画出反应物和物的浓度随时间变化的图像。
五、化学平衡计算与图像1. 对于反应:2FeCl3(aq) + H2S(g) ⇌ 2FeCl2(aq) + 2HCl(aq)+ S(s),平衡常数K为100。
已知初始浓度为FeCl3 0.1 mol/L,H2S 0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。

专题27 化学平衡图像专练1.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。
在肯定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。
则下列说法正确的是A.图甲中11ω>B.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C.温度T1、2ω=, Cl2的转化率约为33.3%D.图乙中,线A表示正反应的平衡常数【答案】C【解析】A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;B.该反应在反应前后气体分子数不变,依据图甲上升温度丙烯的体积分数增大,即上升温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度上升,依据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,依据三段式进行计算:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)起始(mol) a 2a 0 0转化(mol) x x x x平衡(mol) a-x 2a-x x x则(xV)2÷(a xV-×2a xV-)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,故C正确;D.由图甲可知,ω肯定时,温度上升,φ增大,说明正反应是放热反应,故温度上升,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
2.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A.B.C.D.【答案】A【解析】A.该反应为放热反应,温度上升平衡向逆反应方向移动,C的质量分数减小,故A正确;B.依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C.催化剂同等程度地变更正逆反应速率,平衡不发生移动,故C错误;D.该反应为放热反应,温度上升平衡向逆反应方向移动,A的转化率降低,依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误。

化学平衡图像练习题1.下图是可逆反应A+2B ⇌2C+3D的化学反应速率和化学平衡,随外界条件改变而变化的情况。
由图可推断:⑴正反应是______________反应,(填放热或吸热)⑵若A、B是气体, D的状态是___________________。
2.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) ⇌2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S 是对应区域的面积)()3.反应A(g)+B(g) ⇌ C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为()4.(双选)下列各图是温度或压强对反应2A(s)+2B(g)⇌ 2C(g)+D(g)(正反应为吸热反应)的正逆反应速率的影响,其中正确的图象是()5.在可逆反应mA(g)+nB(g)⇌ pC(g) △H<0,其中m、n、p为系数,且m+n>p。
分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是()A SB SC SD SaOb aOb abdO bOd....2121----6.可逆反应mA(s)+nB(g) ⇌ pC(g)+qD(g)。
反应中,C的质量分数与温度(T)和压强(P)的关系如下图,判断下列叙述中正确的是()A.达到平衡后,若使用催化剂,C的质量分数增大B.平衡后,若升高温度,则平衡向逆反应方向移动C.平衡后,增大A的量,有利于平衡正向移动D.化学方程式中一定有n>p+q7.可逆反应2A+B ⇌ 2C(g)(正反应放热),气体平均摩尔质量随温度变化如图所示,则下列叙述正确的是()A.A和B可能都是固体B.A和B一定都是气体C.若B为固体,则A一定是气体D.A和B不可能都是气体E.A和B可能都是气体8.已知mA(g)+nB(g) ⇌ pC(g)+qD(g)有下图情况,则m+n p+q(填“>”、“<”或“=”);正反应是________反应(填“吸热”或者“放热”)。

高中化学高考总复习---化学平衡图像知识讲解及巩固练习题(含答案解析)【高考展望】图像题是化学反应速率和化学平衡部分的重要题型。
这类题可以全面考查各种条件对化学反应速率和化学平衡的影响,具有很强的灵活性和综合性。
该类题型的特点是:图像是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象,易于考查学生的观察能力、类比能力和推理能力。
当某些外界条件改变时,化学反应速率或有关物质的浓度(或物质的量、百分含量、转化率等)就可能发生变化,反映在图像上,相关的曲线就可能出现渐变(曲线是连续的)或突变(出现"断点")。
解答化学平衡图像题必须抓住化学程式及图像的特点。
析图的关键在于对“数”、“形”、“义”、“性”的综合思考,其重点是弄清“四点”(起点、交点、转折点、终点)及各条线段的化学含义,分析曲线的走向,发现图像隐含的条件,找出解题的突破口。
【方法点拨】一、解答化学平衡图像题的一般方法:【高清课堂:ID:363520解答化学平衡图像题的一般方法】化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
①确定横、纵坐标的含义。
②分析反应的特征:正反应方向是吸热还是放热、气体体积是增大还是减小或不变、有无固体或纯液体物质参与反应等。
③分清因果,确定始态和终态;必要时可建立中间态以便联系始、终态(等效模型)。
④关注起点、拐点和终点,分清平台和极值点,比较曲线的斜率,把握曲线的变化趋势,抓住“先拐先平数值大”。
⑤控制变量:当图像中有三个变量时,先确定一个量不变,再讨论另外两个量之间的关系。
⑥最后检验结论是否正确。
二、常见化学平衡图像归纳:例:对于反应mA(g)+nB(g)pC(g)+qD(g),若m+n>p+q且ΔH>0。

化学平衡图像课堂练习1.01?106Pa1.01?107PaA的转化率时间0t1t21、下列图像是否正确?时间35℃25℃产率0mA(g)+nB(g)pC(g)+qD(g)ΔHt1t2先拐先平衡数值大课堂练习0T2,P1T1,P2T1,P1C%tP1P2正反应是热反应<吸T1T2<2A(g)+B(g)2C(g)看图技巧:(1)看清横纵坐标含义(2)先拐先平衡数值大(3)平衡移动课堂练习01.01?107Pa1.01?106PaA的转化率时间m+n=p+qmA(g)+nB(g)pC(g)+qD(g)ΔH课堂练习3、已知4NH3(g)+5O2(g)4NO(g)+6H2(g);△H=-1025kJ/mol该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是()1200℃1000℃tNO%10×105Pa1×105PatNO%NO%1000℃有催化剂t1000℃无催化剂t1t2A1200℃1000℃tNO%CDBC课堂练习4.在某恒容的密闭容器,可逆反应:A(g)+B(g)xC(g);△H<0,符合下列图像(I)所示关系,由此推断对图(II)的正确说法是()A.p3>p4,Y轴表示A的转化率B.p3<p4,Y轴表示B的百分含量C.p3>p4,Y轴表示混合气体的密度D.p3>p4,Y轴表示混合气体的平均摩尔质量AD200?C300?C100?CP△H____0压强0A%m+n____p+q<<等压线①百分含量——压强/温度图像mA(g)+nB(g)pC(g)+qD(g)ΔH看图技巧:(1)看图形趋势(2)“定一议二”2.含量——压强/温度曲线二、化学平衡图像m+n_____p+qA的转化率温度01.01?107Pa1.01?106Pa1.01?105PaT>△H____0等温线<②转化率——压强/温度图像mA(g)+nB(g)pC(g)+qD(g)ΔH看图技巧:(1)看图形趋势(2)“定一议二”2.含量——压强/温度曲线二、化学平衡图像m+n___p+qm+n___p+qm+n___p+q正反应为_____反应正反应为_____反应正反应为_____反应>><放热吸热吸热1、对于反应mA(g)+nB(g)pC(g)+qD(g),根据图象填空:课堂练习2、反应X(g)+3Y(g)2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的体积分数随温度变化曲线为()CABCD………..等温线TZ%TZ%P2P1Z%TP1P2P1P2TZ%P2P1课堂练习03、下图是在其它条件一定时,反应2NO+O22NO2;ΔH<0)中NO的最大转化率与温度的关系曲线。
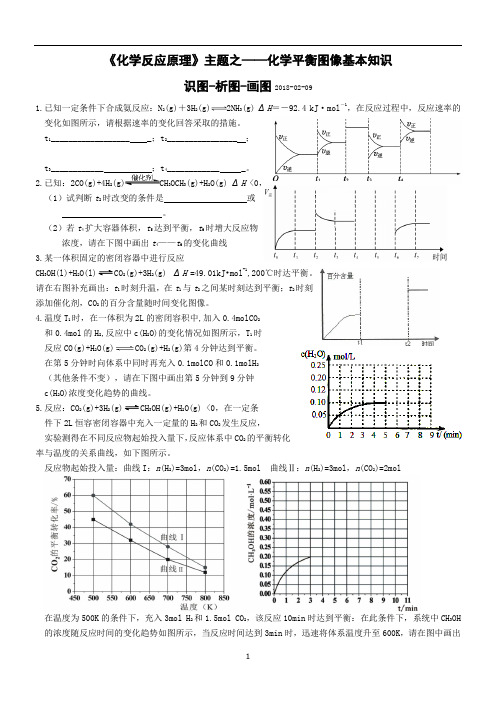
《化学反应原理》主题之——化学平衡图像基本知识识图-析图-画图2018-02-091.已知一定条件下合成氨反应:N 2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1__________________ _;t2________________ ;t3____________ ;t4____________ _。
2.已知:2CO(g)+4H 2(g)CH3OCH3(g)+H2O(g) ΔH <0,(1)试判断t2时改变的条件是或。
(2)若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在下图中画出t4——t6的变化曲线3.某一体积固定的密闭容器中进行反应CH3OH(l)+H2O(l)2(g)+3H2(g) ΔH=49.01kJ•mol-1,200℃时达平衡。
请在右图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。
4.温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g)CO2(g)+H2(g)第4分钟达到平衡。
在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在下图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
5.反应:CO2(g)+3H2(g)3OH(g)+H2O(g) <0,在一定条件下2L恒容密闭容器中充入一定量的H2和CO2发生反应,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。
反应物起始投入量:曲线I:n(H2)=3mol,n(CO2)=1.5mol 曲线Ⅱ:n(H2)=3mol,n(CO2)=2mol在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:在此条件下,系统中CH3OH 的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线。
化学反应速率化学平衡之图像题
一、选择题
1.(2012·武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t 1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是( )
A .4NH 3(g)+5O 2
(g)4NO(g)+6H 2O(g) ΔH <0 B .2SO 2(g)+O 2
(g)2SO 3(g) ΔH <0 C .H 2(g)+I 2(g)2HI(g) ΔH >0 D .C(s)+H 2
O(g)
CO(g)+H 2(g) ΔH >0
2.可逆反应m A(g)n B(g)+p C(s) ΔH =Q ,温度和压强的变化对正、逆反应速率的影响分
别符合下图中的两个图象,以下叙述正确的是( )
A .m >n ,Q >0
B .m >n +p ,Q >0
C .m >n ,Q <0
D .m <n +p ,Q <0 3.在密闭容器中进行如下反应:H 2(g)+I 2(g)
2HI(g),在温度T 1和T 2时,产物的量与反
应时间的关系如下图所示,符合图示的正确判断是 ( )
A .T 1>T 2,ΔH >0
B .T 1>T 2,ΔH <0
C .T 1<T 2,ΔH >0
D .T 1<T 2,ΔH <0
4.(2011·陕西四校联考)在一密闭容器中有如下反应:L(s)+a G(g)
b R(g),温度和压强
对该反应的影响如图所示,其中压强p 1<p 2,由此可判断 ( )
A .正反应为放热反应
B .化学方程式中的计量数a >b
C .G 的转化率随温度升高而减小
D .增大压强,容器内气体质量不变
第1题图
第2题图
第3题图
第4题图
5.下图是表示外界条件(温度和压强)变化对反应的影响,L (s )+G (g )2R (g ),
△H >0,在图中y 轴是指 ( )
A.平衡混合物中R 的质量分数
B. 平衡混合物中G 的质量分数
C.G 的转化率
D. L 的转化率
6.在一定条件下,固定容积的密闭容器中反应:2NO 2(g )
O 2(g )+ 2NO (g );
△H >0,达到平衡。
当改变其中一个条件X ,Y 随X 的变化符合图中曲线的是
A 、当X 表示温度时,Y 表示NO 2的物质的量
B 、当X 表示压强时,Y 表示NO 2的百分含量
C 、当X 表示反应时间时,Y 表示混合气体的密度
D 、当X 表示NO 2的物质的量时,Y 表示O 2的物质的量 7.今有反应X (g )+Y (g )
2Z (g )(正反应放热),左下图表示该反应在t 1时达到平衡,在
t 2时因改变某个条件而发生变化的曲线。
则下图中的t 2时改变的条件是( )
A . 升高温度或降低Y 的浓度
B . 加入催化剂或增大X 的浓度
C . 降低温度或增大Y 的浓度
D . 缩小体积或降低X 的浓度
8.(2010·潍坊模拟)现有右上图两个图象,下列反应中符合右上图图象的是( )
A .N 2(g)+3H 2(g) 2NH 3(g) ΔH <0
B .2SO 3(g) 2SO 2(g)+O 2(g) ΔH >0
C .4NH 3(g)+5O 2(g)
4NO(g)+6H 2O(g) ΔH <0
Z
X
时间
t 2
t 3
温
第5题图
题图
第8题图
D .H 2(g)+
CO(g) C(s)+H 2O(g) ΔH >0
9.在密闭容器中进行下列反应:M(g)+N (g)==R(g)+2L 。
此反应符合下列图象,R%为R 在平衡混合物中的体积分数,该反应是
A.正反应为吸热反应 L 是气体
B.正反应为放热反应 L 是气体
C.正反应为吸热反应 L 是固体
D.正反应为放热反应 L 是固体或液体
10.已知:CO 2(g)+3H 2(g)
CH 3OH(g)+H 2O(g) ΔH =-49.0 kJ·mol -1。
一定条件下,向体
积为1 L 的密闭容器中充入1 mol CO 2和3 mol H 2,测得CO 2和CH 3OH(g)的浓度随时间的变化曲线如下图所示。
下列叙述中正确的是
A. 欲增大平衡状态时c (CH 3OH)/ c (CO 2)的比值,可采用升高温度的方法
B. 3 min 时,CO 2的消耗速率等于CH 3OH 的生成速率,且二者浓度相同
C. 欲提高H 2的平衡转化率只能加压减小反应容器的体积
D. 从反应开始到平衡,H 2的平均反应速率v (H 2)=0.075 mol ·L -1·min -1 11.在密闭容器中,反应X 2(g)+Y 2
(g)
2XY(g) ΔH <0,达到甲平衡。
下面的三个图形表
示了在仅改变某一条件后,达到乙平衡的情况,对此过程的分析正确的是(
)
A .图Ⅰ是加入适当催化剂的变化情况
B .图Ⅱ是扩大容器体积的变化情况
C .图Ⅲ是增大压强的变化情况
D .图Ⅲ是升高温度的变化情况 12.(2012·济宁联考)合成氨反应:N 2(g)+3H 2
(g)
2NH 3(g)ΔH =-92.4 kJ·mol -1,在反应过程
中,正反应速率的变化如图,下列说法正确的是( )
A .t 1时升高了温度
B .t 2时使用了催化剂
C .t 3时增大了压强
D .t 4时降低了温度
第9题图
第10题图
13.(2011福建高考12)25℃时,在含有Pb 2+、Sn 2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb 2+(aq)Sn 2+(aq)+Pb(s),体系中c(Pb 2+)和c(Sn 2+)变化关系如下图所示。
下列判断正确的是
A .往平衡体系中加入金属铅后,c(Pb 2+)增大
B .往平衡体系中加入少量Sn(NO 3)2固体后,c(Pb 2+)变小
C .升高温度,平衡体系中c(Pb 2+)增大,说明该反应△H >0
D .25℃时,该反应的平衡常数K =2.2
二、非选择题
14.硫酸工业生产中涉及如下反应:2232SO (g)+O (g)
2SO (g)。
(1)一定条件下,SO 2的平衡转化率和温度的关系如右图所示。
该反应的ΔH O (填“>”或“<”)。
反应进行到状态D 时, v 正 v 逆(填“>”、“<”或“=”)。
(2)某温度时,将4molSO 2和2molO 2通入2L 密闭容器中,10min 时反应达到平衡状态,测得SO 3的浓度为1.6mol·L -1,则0至10min
内的平均反应速率v (SO 2)= ,该温度下反应2SO 2(g)+O 2(g )=2SO 3(g)的平衡常数K= 。
15.(1)已知反应 CH 4(g )+H 2O (g )= CO (g )+ 3H 2(g ),在一定条件下CH 4的平衡转化率与温度、压强的关系如左下图所示,则P 1 P 2(填“>”、“<”或“=”,下同),A 、B 、C 三点处对应平衡常数(K A 、K B 、K C )的大小顺序为 (2)右下列图像符合反应Fe (s )+H 2O (g )
FeO (s )+H 2(g )的是 (填序
号)(图中v 是速率,φ为混合物中H 2的体积百分含量)。
第12题图
第13题图
ACDBB ACBBB DBD
14.(1)<(2分)>(2分)(写成汉字不得分)
(2)0.16mol·L-1·min-1(2分)(不带单位、单位写错均不得分)80L·mol-1(2分)(不带单位不扣分,单位写错不得分)
15.(1)<、K C>K B>、K A(2)BCD。