上海市华东师范大学第二附属中学高三化学一轮复习第10章镁铝第1节镁和铝的性质习题详解(含解析)(实验班
- 格式:doc
- 大小:514.00 KB
- 文档页数:9

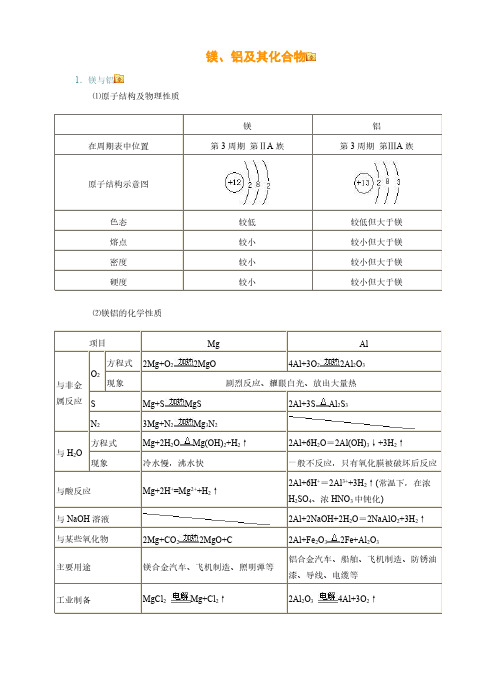
镁、铝及其化合物1.镁与铝⑴原子结构及物理性质镁铝在周期表中位置第3周期第ⅡA 族第3周期第ⅢA 族原子结构示意图色态较低较低但大于镁熔点较小较小但大于镁密度较小较小但大于镁硬度较小较小但大于镁⑵镁铝的化学性质项目Mg Al 与非金属反应O 2方程式2Mg+O 22MgO4Al+3O 22Al 2O 3现象剧烈反应、耀眼白光、放出大量热SMg+S MgS 2Al+3SAl 2S 3N 23Mg+N 2Mg 3N 2与H 2O方程式Mg+2H 2OMg(OH)2+H 2↑2Al+6H 2O =2Al(OH)3↓+3H 2↑现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应与酸反应Mg+2H +=Mg 2++H 2↑2Al+6H +=2Al 3++3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)与NaOH 溶液2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑与某些氧化物2Mg+CO 22MgO+C 2Al+Fe 2O 32Fe+Al 2O 3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl 2Mg+Cl 2↑2Al 2O 34Al+3O 2↑2.镁和铝氧化物的对比氧化物MgO Al 2O 3属类碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H 2OMgO+H 2O =Mg(OH)2↓(反应缓慢进行)不溶解也不反应酸液MgO+2H +=Mg 2++H 2OAl 2O 3+6H +=2Al 3++3H 2O NaOH 溶液不溶解也不反应Al 2O 3+2NaOH =2NaAlO 2+H 2O 重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3属类碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2Mg 2++2OH-H 2O+AlO 2-+H +Al(OH)3Al 3++3OH-与HCl 等酸溶液Mg(OH)2+2HCl=MgCl 2+2H 2O (可溶于NH 4Cl 等强酸弱碱盐)Al(OH)3+3HCl =AlCl 3+3H 2O 与NaOH 溶液不反应Al(OH)3+NaOH=NaAlO 2+2H 2O 热不稳定性Mg(OH)2MgO+H 2O2Al(OH)3Al 2O 3+3H 2O实验室制法可溶性镁盐加NaOH 溶液Mg 2++2OH -=Mg(OH)2↓可溶性铝盐加氨水Al 3++3NH 3·H 2O =Al(OH)3↓+3NH +44.铝及其化合物间相互转化、铝三角及相关图象实验操作实验现象图象离子方程式①向可溶性铝盐溶液中滴加NaOH 溶液至过量先生成沉淀又溶解Al 3++3OH -=Al(OH)3↓;Al(OH)3+OH -=AlO 2-+2H 2O②向可溶性铝盐溶液中滴加稀氨水至过量出现白色沉淀Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+③向NaOH 溶液中滴加可溶性铝盐溶液至过量开始无明显变化,一段时间后出现沉淀Al 3++4OH -=AlO 2-+2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H ++AlO 2-+H 2O =Al(OH)3↓;Al(OH)3+3H +=Al 3++3H 2O⑤向可溶性偏铝酸盐溶液中逐渐通入CO 2气体至过量先无明显变化,后出现沉淀AlO -2+2H 2O+CO 2(过量)=Al(OH)3↓+HCO -32AlO 2-+3H 2O+CO 2(少量)=Al(OH)3↓+CO 2-3⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量出现白色沉淀4H ++AlO 2-=Al 3++2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓知识拓展:⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。



第10讲 镁、铝及其重要化合物考点一 镁、铝单质的性质与应用[知识梳理]一、镁及其重要化合物的性质与应用1.镁的性质(1)物理性质:银白色、具有金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。
(2)化学性质①与N 2反应:3Mg +N 2=====点燃Mg 3N 2;②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ; ③与热水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑;④与稀硫酸反应:Mg +H 2SO 4===MgSO 4+H 2↑。
Mg 在CO 2中能燃烧,所以Mg 着火时不能用二氧化碳灭火器和泡沫灭火器灭火。
2.海水提镁从MgCl2溶液中得到无水MgCl2固体需要两步。
第一步:将MgCl2溶液用浓盐酸酸化,经蒸发浓缩、冷却结晶、过滤后得到MgCl2·6H2O;第二步:在干燥的HCl气流中加热MgCl2·6H2O晶体使其脱水得到无水MgCl2。
3.镁的用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物物质主要性质及反应方程式氧化镁碱性氧化物MgO+2H+===Mg2++H2O氢氧化镁中强碱Mg(OH)2+2H+===Mg2++2H2O溶解度小于碳酸镁MgCO3+H2O=====△Mg(OH)2+CO2↑氮化镁盐Mg3N2+6H2O=== 3Mg(OH)2+2NH3↑二、铝单质的性质与应用1.铝的结构和存在形式(1)铝位于元素周期表的第三周期ⅢA族,原子结构示意图为(2)铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态的形式存在。
2.铝的物理性质铝是银白色、具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
3.铝的化学性质根据上图写出以下序号对应的有关反应的方程式(能写离子方程式的写离子方程式):4.铝的用途纯铝可用作导线,铝合金可用于制造汽车、飞机、生活用品等。
[自主检测]1.判断正误(正确的打“√”,错误的打“×”)。


高三化学综合复习第一轮:金属元素—镁与铝人教实验版【本讲教育信息】一. 教学内容:高三综合复习第一轮:金属元素—镁与铝二. 重点、难点1. 重点掌握铝及其化合物的化学性质,了解铝的化合物之间的相互转化;2. 了解镁及其化合物的性质;3. 了解铝和镁的天然资源和用途三. 具体内容(一)镁铝的化学性质1. 与非金属反应2. 与水反应3. 与氧化物反应4. 与酸反应5. 与强碱反应6. 与盐溶液反应7. 单质的制备(二)氧化镁和氧化铝的化学性质1. 物理性质2. 重要用途3. 主要化学性质(三)氢氧化镁和氢氧化铝1. 氢氧化镁的化学性质2. 氢氧化铝的化学性质3. 生成氢氧化铝的基本图像4. 可溶性铝盐与强碱溶液反应的计算(四)铝盐、偏铝酸盐1. 铝盐:明矾(1)电离(2)水解 (3)与碱反应 (4)与盐反应(5)泡沫灭火器工作原理 2. 偏铝酸盐:偏铝酸钠 (1)水解 (2)与酸反应 (3)与盐反应【典型例题】[例1] a ml 0.5mol/L AlCl 3溶液与b ml c mol/LNaOH 溶液混合后,得到3.9g 沉淀,则下列说法正确的是( )A. 若a 、b 均为1000时,c 的值只有一个B. 若a 为1000、c 为1时,b 的值只有一个C. 若b 为1000、c 为1时,a 的值只有一个D. 以上说法均不正确 答案:C解析: 考查氢氧化铝两性的应用。
[例2] 把0.2mol 铝投入100mL 3mol/L 的NaOH 溶液中充分反应后,再加入1mol/L 的H 2SO 4溶液bmL ,其结果是( )A. 若b=400充分反应后还剩余H 2SO 4B. 若b=60反应结束后的铝元素存在的形式是AlO 2-和Al (OH )3 C. 若b=50反应结束后的铝元素存在的形式是Al 3+和Al (OH )3 D. 反应结束后要得到澄清溶液则必需b ≥300 答案:B解析:考查铝元素某些物质的两性的应用。
第十讲镁、铝及其化合物1、掌握镁铝及其重要化合物的主要性质和应用。
2、掌握镁铝及其化合物之间的相互转化关系。
3、掌握镁铝及其化合物的探究性实验4、了解镁铝图像的基本原理,掌握其中的量的关系,并运用于解题。
5、掌握镁铝有关的实验问题。
一、镁铝的性质1、铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅,是地壳中含量最多的金属元素。
自然界中的铝全部以化合态存在;镁位于元素周期表中第三周期第ⅡA族。
2、金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3、金属铝的化学性质图中有关反应的化学方程式或离子方程式: ①Al O 2⎩⎨⎧――——→ 常温形成致密的氧化膜――——→ 点燃 4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al 酸⎩⎨⎧――――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4、对比记忆镁的化学性质5纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【典型例题1】【内蒙古巴彦淖尔一中2020届9月月考】将5.1g 镁铝合金,投入到500mL2.0mol/L 的盐酸中,金属完全溶解,再加入4.0mol/LNaOH 溶液,若要生成的沉淀最多,则NaOH 溶液的体积是( )A .200mLB . 250mlC . 425mLD . 560mL 【答案】B考点:考查镁铝反应的有关计算【点评】熟练镁铝的主要性质及应用,特别是镁铝的特性,如铝能发生铝热反应,铝能与强碱溶液反应生成氢气,镁能在二氧化碳中燃烧生成碳单质和氧化镁,为常考知识点。
【迁移训练1】现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: 实验设计1:铝镁合金测定生成的气体在标准状况下的体积实验设计2:铝镁合金测定生成的气体在标准状况下的体积 实验设计3:铝镁合金溶液过滤、洗涤、干燥后测定得到沉淀的质量则能测定出镁的质量分数的是 ( ) A .都能 B .都不能 C .①不能,其它都能 D .②③不能,①能 【答案】A 【解析】试题分析∶理论上都能测出合金中Mg 的质量分数。




第二节 镁和铝的重要化合物一、选择题1.化学在生产和日常生活中有着重要的应用。
下列说法不正确的是( )。
A .明矾水解形成的()3Al OH 胶体能吸附水中悬浮物,可用于水的净化 B .在海轮外壳上镶入锌块,可减小船体的腐蚀速率 C .MgO 的熔点很高,可用于制作耐高温材料 D .电解2MgCl 饱和溶液,可制得金属镁 解答:本题考查化合物的应用。
解:明矾净水的原理是()323Al 3H O Al OH ++ƒ(胶体)3H ++,利用()3Al OH (胶体)的吸附性进行净水,选项A 正确。
轮船外壳的主要成分是钢铁,铁在海水中易被腐蚀。
镶入比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率,选项B 正确。
氧化镁的熔点是2852℃,可用于制作耐高温材料,选项C 正确。
电解2MgCl 饱和溶液,发生化学反应:()22222MgCl 2H O Mg OH H Cl +−−−→+↑+↑通电,不会产生金属镁,电解熔融的2MgCl 能制取单质镁,发生的反应22MgCl Mg Cl −−−→+↑通电。
所以选项D 错误。
本题答案为选项D 。
2.甲、乙两烧杯中分别装有相同体积、相同pH 的氨水和NaOH 溶液,各加入10mL 0.1mol L /3AlCl 溶液,两烧杯中都有沉淀生成。
下列判断正确的是( )。
A .甲中沉淀一定比乙中的多B .甲中沉淀可能比乙中的多C .甲中沉淀一定比乙中的少D .甲中和乙中的沉淀可能一样多解答:本题考查()3Al OH 的两性。
解:根据氢氧化铝的性质,能溶于氢氧化钠但不溶于氨水,所以两烧杯中生成的都是氢氧化铝沉淀;相同体积相同pH 的两溶液中的溶质氨水大于氢氧化钠,当两者均不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠恰好时,生成的沉淀一样多;氨水和氢氧化钠都过量时,生成的沉淀氨水多;可知选项B 、D 正确。
第一节镁和铝的性质一、选择题1.下列有关金属铝及其化合物的叙述中正确的是()。
A.铝在常温下不能与氧气反应B.铝不能与氯气反应C.铝既能溶于酸,又能溶于碱D.氧化铝只能与酸反应,不与碱反应解答:本题考查铝的单质及其化合物的性质。
解:铝在常温下可和O反应生成致密的氧化膜,选项A错误;2铝与氯气反应生成氯化铝,选项B错误;铝在元素周期表中位于金属与非金属的分界线上,既能与酸又能与强碱反应,选项C正确;氧化铝是两性氧化物,既能与酸反应又能与碱反应,选项D错误。
本题答案为选项C。
2.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是()。
A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na SO晶体24解答:本题考查外界条件对化学反应速率的影响。
解:盐酸的浓度越大反应速率越大,选项A错误。
铝与酸接触的表面积越大,反应速率越大,选项B错误。
溶液的温度越大,反应速率越大,选项C错误。
加少量Na SO不影响氢离子浓度,对反应速率无影响,选项D正确。
24本题答案为选项D。
3.镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图10-5所示。
反应中镁和铝的()。
A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3解答:本题考查镁铝与酸反应的简单计算。
解根据图像分析镁铝与酸反应放出的氢气一样多。
根据化学方程式可知:Mg~H;2Al~23H;物质的量之比为3∶2;选项A正确。
2质量之比(243)(272)43∶∶,选项B错误。
=⨯⨯=摩尔质量之比为24∶27=8∶9,选项C 错误。
由图像可知生成相等体积的氢气所需时间之比为2∶3,所以反应速率之比为3∶2,选项D 错误。
本题答案为选项A 。
4.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )。
A .2mol /L 24H SO 溶液 B .18mol L /24H SO 溶液 C .6mol /L KOH 溶液D .3mol /L 3HNO 溶液解答:本题考查镁铝与各种酸的反应。
解:因浓24H SO 和3HNO 与镁铝反应都不放出2H ,所以先将选项B 、D 排除,在稀24H SO 和KOH 溶液都过量的前提下,因Al 与KOH 溶液反应而镁不能,所以等物质的量的镁铝合金分别加到过量的稀24H SO 和KOH 溶液中应是前者放出的2H 多。
本题答案为选项A 。
5.用铝粉和四氧化三铁粉末配成的铝热剂,分成两等份:一份在高温下恰好反应,再与足量稀硫酸反应,生成氢气L a ;另一份直接放入足量的氢氧化钠溶液中充分反应,在相同条件下生成氢气L b ,则a b ∶为( )。
A .1∶1 B .3∶4 C .4∶3 D .8∶9 解答:本题考查铝热反应的计算。
解:铝粉和四氧化三铁粉末组成的铝热剂,在高温下恰好反应,反应的化学方程式为34238Al 3Fe O 4Al O 9Fe +−−−→+高温,设现有8mol Al ,则可以生成9mol 单质Fe ,一份在高温下恰好反应,产物与足量稀硫酸反应,9mol Fe 生成9mol 2H ,另一份与足量氢氧化钠溶液反应,8mol Al 可以生成12mol 2H ,所以91234a b ==∶∶∶。
本题答案为选项B 。
6.实验室将9g 铝粉跟一定量的金属氧化物粉末混合形成铝热剂。
发生铝热反应后,所得固体中含金属单质为18g ,则该氧化物粉末可能是( )。
A .23Fe O 和2MnO B .2MnO 和25V O C .23Cr O 和25V OD .34Fe O 和FeO解答:本题考查铝热反应的计算。
解:()91Al mol 273n ==,可以失去电子的物质的量1mol =, 当全部为23Fe O ,生成()1Fe 56g 18.67g 3m =⨯=,当全部为2MnO ,生成()1Mn 55g 13.75g 4m =⨯=,13.751818.67<<,选项A 正确;当全部为2MnO ,生成()1Mn 55g 13.75g 4m =⨯=,当全部为25V O ,生成()1V 51g 10.2g 5m =⨯=,所得金属单质的质量都不到18,选项B 错误;当全部为23Cr O ,生成()1Cr 52g 17.3g 3m =⨯=,当全部为25V O ,生成()1V 51g 10.2g 5m =⨯=,所得金属单质的质量都不到18,选项C 错误;当全部为34Fe O ,生成()1Fe 356g 21g 8m =⨯⨯=,当全部为FeO ,生成()1Fe 56g 28g 2m =⨯=,当铝粉不足时,可生成金属单质18g ,选项D 正确。
本题答案为选项A 、D 。
7.向g m 镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体L b 。
向反应后的溶液中加入mol L c /氢氧化钾溶液mL V ,使金属离子刚好沉淀完全,得到的沉淀质量为g n 。
再将得到的沉淀灼烧至质量不再改变为止,得到固体g p 。
则下列关系中不正确...的是( )。
A .100011.2bc V= B .125Vcp m =+C .17n m Vc =+D .51739m p m <<解答:本题考查镁铝化合物的有关计算。
解:根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即322.410/2b cV -=⨯⨯,1000/11.2c b V =,选项A 正确;p 为生成的氧化物的质量,31610/2/125p cV m m cV -=⨯⨯+=+,选项B 正确;n =得到的氢氧化镁和氢氧化铝的质量=镁铝的质量和与氢氧根离子的质量之和,所以31017171000n m cV m Vc -=+⨯⨯=+/,选项C 错误;用极值法计算,若g m 全是镁,得到的氧化物为氧化镁,则质量为/24405/3p m m =⨯=;若g m 全是铝,得到的氧化物为氧化铝,则质量为1/2710217/92p m m m =⨯⨯=;所以质量介于两者之间:51739m p m <<,选项D 正确。
本题答案为选项C 。
8.将一定质量的镁和铝混合物投入200mL 硫酸中,固体全部溶解后,向所得溶液中加入NaOH 溶液,生成沉淀的物质的量(n )与加入NaOH 溶液的体积(V )的变化如图10-6所示。
则下列说法中不正确的是( )。
A .镁和铝的总质量为9gB .最初20mL NaOH 溶液用于中和过量的硫酸C .硫酸的物质的量浓度为2.5mol L /D .生成的氢气在标准状况下的体积为11.2L解答:本题的解题关键是分析图像,分析清楚每段所发生的反应。
解:由图像可知,从开始至加入NaOH 溶液20mL ,没有沉淀生成,说明原溶液中盐酸溶解Mg 、Al 后盐酸有剩余,此时发生的反应为:2HCl NaOH NaCl H O +→+。
当V (NaOH 溶液)200mL =时,沉淀量最大,此时为()2Mg OH 和()3Al OH ,溶液中溶质为24Na SO 。
从200mL 到240mL ,NaOH 与()3Al OH 反应:()223NaOH Al OH NaAlO 2H O +→+,当V (NaOH 溶液)240mL =时,沉淀不再减少,此时全部为()2Mg OH ,物质的量为0.15mol 。
由元素守恒可知()()3Al [Al OH ]0.2mol n n ==,()()2Mg Mg OH 0.15mol n n ⎡⎤==⎣⎦,所以镁和铝的总质量为0.2mol 27g /mol 0.15mol 24g mol 9g ⨯+⨯=/,故选项A 正确;由图像可知,从开始至加入NaOH 溶液20mL ,没有沉淀生成,说明原溶液中盐酸溶解Mg 、Al 后盐酸有剩余,此时发生的反应为:2HCl NaOH NaCl H O +→+,故选项B 正确;沉淀达到最大值时,溶液中溶质只有24Na SO ,根据钠元素守恒可得,此时()24Na SO n 等于200mL 氢氧化钠溶液中含有的()24Na SO n 的12倍,所以()241Na SO 0.2L 5mol L 0.5mol 2n =⨯⨯=/,所以硫酸的浓度为0.52.5mol /L 0.2=,故选项C 正确;由A 中可知()Al 0.2mol n =,()Mg 0.15mol n =,根据电子转移守恒可知()()()22H 3Al 2Mg 30.2mol 20.15mol 0.9mol n n n =+=⨯+⨯=,所以()2H 0.45mol n =,得氢气体积为0.45mol 22.4mol /L 10.08L ⨯=,故选项D 错误。
本题答案为选项D 。
9.由锌、铁、铝、镁四种金属中的两种组成的混合物10g ,与足量的盐酸反应产生的氢气在标准状况下的体积为11.2L ,则混合物中一定含有的金属是( )。
A .锌 B .铁 C .铝 D .镁 解答:本题考查混合物的计算。
解:标准状况下11.2L 氢气的物质的量0.5mol =,10g 金属需要提供的电子为0.5mol 21mol ⨯=, 选项A 中,提供1mol 电子需要Zn 的质量为16532.5g 2⨯=, 选项B 中,提供1mol 电子需要Fe 的质量为15628g 2⨯=, 选项C 中,提供1mol 电子需要Al 的质量为1279g 3⨯=,选项D 中,Mg 在反应中表现2+价,提供1mol 电子需要Mg 的质量为12412g 2⨯=,四种金属中只有Al 的质量小于10g ,所以金属混合物中一定含有Al 。
本题答案为选项C 。
10.甲、乙两烧杯中各盛有100mL 2mol L /的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2(同温同压),则加入的铝粉的质量为( )。
A .3.6gB .2.7gC .5.4gD .1.8g解答:本题考查铝与强酸强碱的反应的计算。
解:盐酸和氢氧化钠溶液中溶质的物质的量均相等,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,可知酸中铝过量,碱中铝不足。
设铝与酸反应时生成的氢气的物质的量为x , 则322Al 6HCl 2AlCl 3H +→+↑6 3 0.2mol x解得:0.1mol x =,则碱与金属铝反应生成的氢气的物质的量为0.1mol 20.2mol ⨯=, 设与碱反应的铝的物质的量为y , 则2222Al 2NaOH 2H O 2NaAlO 3H ++→+↑ 2 3 y 0.2mol 解得:0.4mol 3y =, 则铝的质量为0.4mol 27g /mol 3.6g 3⨯=, 本题答案为选项A 。