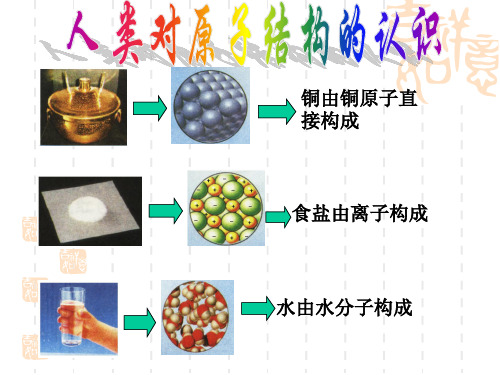
卢瑟福原子结构模型波尔原子结构模型
- 格式:ppt
- 大小:3.82 MB
- 文档页数:24

原子结构演变的5个阶段原子结构是材料科学重要的基础概念之一。
从19世纪末到20世纪初,科学家们开始探索原子的结构。
在不断的探索、研究和实验中,人们逐渐认识到了原子结构的复杂性和演变历程。
本文将介绍原子结构演变的5个阶段。
第一阶段:罗瑟福的阿尔法粒子散射实验1909年,英国科学家罗瑟福通过研究阿尔法粒子散射实验得出了原子模型。
这个模型认为原子由带正电的原子核和负电子组成,而电子分布在原子核之外。
这个模型为后来的原子核模型打下了基础。
第二阶段:卢瑟福-玻尔原子模型1913年,丹麦物理学家玻尔在研究氢原子光谱时提出了一个新的原子模型,被称为卢瑟福-玻尔原子模型。
这个模型认为原子是由带电质子和不带电的中性粒子组成的。
电子围绕原子核旋转,每条轨道对应不同的能量水平。
第三阶段:量子力学的发展随着量子力学的发展,原子的结构变得更加复杂。
量子力学认为原子的能量是量子化的,而不是连续分布的。
通过研究原子的波函数和能量状态,科学家们得出了原子的电子云结构,即一个原子中电子分布的概率密度分布。
这为化学分子和材料科学的研究奠定了基础。
第四阶段:原子核模型的发展在量子力学理论基础上,原子核模型得到发展,并确定了元素周期表。
原子核由带正电荷的质子和中性的中子组成。
质子数量不同的原子称为不同的元素。
不同的元素具有不同的化学性质和同位素。
第五阶段:超越原子的研究随着科学技术的发展,人们开始研究原子以外的更小、更基本的粒子。
通过加速器、探测器等尖端设备,科学家们研究了粒子物理学、核能等领域,揭示了一些重大问题,如弱相互作用、暗物质、暗能量等,为人类认识宇宙提供了新的契机。
总之,原子结构演变是一个在不断探索中不断发展的过程。
每个阶段都有其重要性,并且为后来的研究和探索奠定了基础。
我们应该把握历史机遇,用科学的方法深入研究原子结构,为未来的人类文明和科技进步做出贡献。

7 卢瑟福模型与玻尔模型在物理学史上,人类对微观世界的探索经历了宏观现象的观察和分析、通过科学研究建立假说、以回到实践中验证假说的正确性,并最终形成理论的这一科学的认知过程。
7。
.1卢瑟福原子结构模型1897年汤姆逊发现电子后,他本人曾经在1904年提出一个“面包加葡萄干”的原子模型,认为原子是一个带正电的球体,有一定数量的带负电的电子均匀地镶嵌在原子中,但这一模型很快被卢瑟福的原子有核模型所取代。
大约在1901年,卢瑟福与他的两个学生盖革和马斯敦做了历史上著名的“α粒子散射实验”。
结果发现,绝大多数α粒子穿过金箔后仍沿原来的方向前进,少数α粒子发生了较大的偏转,(有极少数α粒子的偏转角超过了900),甚至有极个别的α粒子被反向弹回,这一实验结果,是汤姆逊原子模型根本无法解释的。
下面提供的就是对“α粒子散射实验”进行的估算。
①用回旋加速器加速α粒子时,所加匀强磁场的磁感应强度B =0.5T ,回旋加速器D 盒的半径R =0.67m ,已知α粒子的质量276.6410m kg -=⨯,求被加速后α粒子获得的最大速度V α多大?其能量等于多少电子伏特?②设某次实验中,有一初速为V α的α粒子正对着金箔中某一金原子核运动,结果被反向弹回,试估算金原子的直径。
根据回旋加速器原理,最终α粒子被 从D 形盒的外缘处引出时,其最大速度qBR V m α=,它动能()22122k qBR E mV mα==。
将α粒子的量192 3.210q e C -==⨯等数据代入后,可以求得71.610/V m s α=⨯,138.610k E J -=⨯(约为5.4MeV )。
在“α粒子散射实验”中,α粒子动能与电势能的总和保持不变,设α粒子从零势能位置以速度V α正对着金原子核运动,能够到达离原子核最近的距离为r ,由212QqmV k rα=得22kQq r mV α=,式中金原子核的电荷量为92279,9.010/Q e k N m C ==⨯⋅为静电力常 量,由此法示求出114.310r m -≈⨯,于是可以近似地认为金原子核的直径1428.610d r m -≈=⨯。


卢瑟福原子模型与玻尔原子模型的区别卢瑟福原子模型和玻尔原子模型就像两位科学家之间的“明争暗斗”。
说到卢瑟福,他可真是个聪明的家伙。
他发现原子中有个小小的“核心”,就像个“蛋黄”,周围环绕着电子。
这种想法可是颠覆性的哦,原本大家都以为原子是个“粥状”的东西,结果人家卢瑟福一出手,就告诉我们,嘿,里面有个“原子核”,真是让人大开眼界。
不过,问题来了,卢瑟福只给了我们一个初步的框架,没告诉我们这些电子是怎么“运转”的。
这就像你看到一辆跑车,知道它能跑,但却不知道它怎么启动一样。
玻尔就像是“救火队员”,来给这个模型“添砖加瓦”。
他在卢瑟福的基础上,提出了电子在特定轨道上运动的想法,真是“点睛之笔”。
玻尔把电子想象成在“轨道”上转的“小飞行员”,每个轨道都有自己的能量级。
就像一层层的“洋葱”,剥开来越剥越精彩。
玻尔的模型还引入了量子化的概念,意思是说,电子只能在某些特定的轨道上飞行,不能随便跑来跑去。
这简直就是给电子穿上了“安全带”,让它们不至于“乱飞”。
可卢瑟福的模型也不是“省油的灯”。
虽然他没有深入描述电子的轨道,但他的原子核概念确实为后来的研究奠定了基础。
就像你在沙滩上堆沙堡,先得有个基础,才能建得更高更稳。
卢瑟福还做了一些很酷的实验,用α粒子轰击金箔,结果大多数粒子都能穿过去,少数才会反弹,说明原子其实是个“大空壳”,这也为后来的原子研究铺平了道路。
玻尔的模型更进一步,虽然在现代看来,有些地方显得“有点幼稚”,比如说他把电子看作在固定轨道上转的“小球”,这可与我们现在的量子力学大相径庭。
但当时的科学界可对他刮目相看,毕竟他的模型成功地解释了氢原子的光谱线。
这就像你终于找到了能解开难题的“钥匙”,真是让人拍手叫好。
这两种模型的区别就像是两种不同的“风格”。
卢瑟福的模型偏向于描述原子的“结构”,而玻尔的模型则像是讲述电子的“行为”。
一是扎根于“实心”的原子核,另一个则飞翔在“轨道”的电子之间。
这也反映了科学探索的两个方向:一方面是探寻“物质”的本质,另一方面是理解“运动”的规律。

原子结构模型发展史原子结构模型发展史是物理学领域的一个重要研究方向。
它的发展经历了多位科学家的研究和贡献,最终形成了现代原子理论。
接下来,我们将按照时间顺序分步骤阐述原子结构模型的发展史。
1.道尔顿原子模型:1799年,英国科学家道尔顿提出了原子组成物质的理论。
他认为原子是各种元素的基本微粒,具有不同的质量和大小,且不可分割。
这是原子理论的起点。
2.汤姆逊原子模型:1897年,英国物理学家汤姆逊发现电子,证明了原子内存在电子的存在。
他提出了“西瓜切片”原子模型,认为原子是由一个带正电的球体和分布在球体内的带负电的电子构成的。
这种模型为后来的研究打下了基础。
3.卢瑟福原子模型:1911年,英国物理学家卢瑟福提出了原子核模型。
他通过阿尔法粒子轰击金箔实验,证实了原子核的存在,并指出原子核具有正电荷,电子则在原子核外绕行。
这是目前仍然被广泛接受的模型。
4.玻尔原子模型:1913年,丹麦物理学家玻尔发表了有关原子结构的文章,提出了玻尔原子模型。
他认为原子由电子围绕着原子核旋转,且电子只能沿着特定轨道运动。
这种模型为后来的原子结构理论提供了重要的参考依据。
5.量子力学理论:20世纪20年代,量子理论的发展引起了物理学界的广泛关注。
量子力学理论认为粒子具有波动性质,且只有在特定的能量状态下才能存在。
这种理论得到了广泛验证和应用,成为了现代原子结构理论的基础。
总之,原子结构模型的发展经历了多位科学家的研究和贡献,最终形成了现代原子理论。
每一次的突破都离不开前人的积累和启发,也为后人提供了宝贵的经验和思路。
只有通过不断的探索和研究,才能深入理解原子结构的本质,为未来的科学发展铺平道路。






卢瑟福提出原子核式结构模型的依据卢瑟福提出了原子核式结构模型,这一发现是科学界的重大突破,不仅为原子物理领域的研究提供了新的阐释,还为后来的核物理学和其他物理学研究提供了借鉴。
卢瑟福所提出的原子核式结构模型是基于他的实验研究和理论分析得出的。
下面将分别从实验数据和理论分析两个方面阐述卢瑟福提出原子核式结构模型的依据。
一、实验数据卢瑟福的实验研究主要是基于阿尔法粒子的射线衍射实验。
在突破传统的玻尔模型之前,科学界认为原子的结构是一个波浪的系统,在外部电子云的控制下,原子核应该是弱的、分散的和不稳定的。
但是,通过实验发现了一些迹象,这些迹象开始倾向于一个电子云和一个中央的原子核的存在。
为了证明这一点,卢瑟福利用了他的一种经典实验,即阿尔法粒子的射线衍射实验。
在这个实验中,卢瑟福把经过电离器产生的高能阿尔法粒子来轰击金箔。
而根据科学家对金的了解及之前的模型,阿尔法粒子的散射应该是一个平滑和均匀的过程。
然而,事实证明,阿尔法粒子在金箔内会受到异常的散射,这一点使卢瑟福感到了惊讶。
通过转盘薄膜会发现,在角度较小时,散射阿尔法粒子的轨迹非常纤细,然而在更大的角度上,散射阿尔法粒子的轨迹又是短而厚的。
这表明散射过程涉及到一个高度紧凑和重要的中心区域,该中心区域是足够独立的而且具有序列性质。
这个中心实体就是人们今天所了解的原子核。
二、理论分析卢瑟福还通过理论分析支持了他的实验数据。
他利用卢瑟福模型,型是→型→型的轨迹,并且证明了这种轨迹说明金原子中存在核。
这一模型依据库仑力的原理,即中心的电荷会吸引周围的带电粒子,但是较短的距离是足以抵抗电荷的排斥的。
这种轨迹可以用二维空间中的一个圆来表示,同时每一个圆心代表金原子核仪的中心点。
那么,轨迹的开端是因为一个短距离的力可以克服静电排斥,并且由于原子核的瞄准间隔小于受电子云影响的瞄准间隔,因此轻子在与原子核相互作用之前会经过一些相当难看的弯曲。
值得注意的是,卢瑟福提出的原子核式结构模型虽然很早就被发现,但却是科学界的一个重大突破。

原子结构的三种模型
原子结构是一个涉及微观粒子的领域,从科学家们成功地揭示了原子的存在以来,原子的结构理论便成为物理、化学、材料科学等领域中非常重要的一项研究课题。
在历史上,曾经有过几种关于原子结构的模型,而本文将简要介绍其中最著名的三种模型。
1. 汤姆逊模型:
汤姆逊模型是在1897年被英国科学家汤姆逊提出,它提出了原子具有一个球形的正电荷基质和散布在其周围的负电子。
这个模型也称为“葡萄干蛋糕模型”,因为他将原子想象成一个带正电载体的葡萄干,并散布着小的带负电的球形电子。
2. 卢瑟福模型:
1911年,卢瑟福提出了一个不同于汤姆逊模型的原子结构模型。
在这个模型里,原子由一个带有正电荷量的核心和围绕着核心运转的负电子组成。
卢瑟福的实验表明,带正电的粒子(即核心)主要集中在原子的中心处,而电子则在核外运行。
他的模型被称为“太阳系模型”,因为原子的结构被比喻成了太阳和围绕它旋转的行星。
3. 波尔模型:
在卢瑟福模型之后,丹麦物理学家尼尔斯·玻尔提出了他的原子结构模型,即“波尔模型”。
在这个模型中,玻尔认为电子运行在确定的轨道上,而轨道周围则是带有正电荷的核心。
波尔模型解释了为
什么原子只会发出特定的能量光子(即光谱线),电子的能量水平是量子化的,即只有在某些固定的能级上才可以停留,而其他能量状态是不允许的。
综上所述,汤姆逊模型、卢瑟福模型和波尔模型在原子结构的研究领域中都占据了重要的地位,它们各自提出了原子的不同结构和性质,并对后来的原子研究奠定了基础。


卢瑟福的原子结构和玻尔模型卢瑟福的原子结构和玻尔模型是两种关于原子内部结构的理论,对于我们理解原子的组成和性质起到了重要作用。
本文将分别介绍卢瑟福的原子结构和玻尔模型,并探讨它们的意义和应用。
卢瑟福的原子结构卢瑟福的原子结构理论是由英国物理学家欧内斯特·卢瑟福于1911年提出的。
他的实验基于阿尔法粒子的散射,通过观察散射角度的变化来研究原子结构。
卢瑟福的实验结果表明,原子具有一个非常小而且带正电荷的核心,周围环绕着负电子云。
这一理论被称为“卢瑟福模型”。
卢瑟福实验的关键在于发现了阿尔法粒子的散射现象。
他将放射性物质放置在一个金箔薄片上,当阿尔法粒子经过金箔时,大部分粒子会直线通过,但也有一小部分粒子会被散射。
通过观察散射角度的变化,卢瑟福得出结论:原子核是非常小而且带正电荷的,而电子则分布在核外围形成电子云。
卢瑟福的原子结构理论对于我们理解原子内部的组成和性质具有重要意义。
它揭示了原子核和电子之间的相互作用,解释了原子的稳定性和化学性质。
此外,卢瑟福的实验结果还为后来的量子力学理论奠定了基础。
玻尔模型玻尔模型是由丹麦物理学家尼尔斯·玻尔于1913年提出的,它是对卢瑟福模型的进一步发展和完善。
玻尔模型基于卢瑟福的原子结构理论,提出了电子在原子内部的能级和轨道运动的概念。
根据玻尔模型,电子绕核心旋转在特定的轨道上,每个轨道对应一个特定的能级。
电子在较远离核心的轨道上具有较高的能量,而在较靠近核心的轨道上具有较低的能量。
当电子吸收或释放能量时,它们会在不同的能级之间跃迁,这解释了原子光谱中的谱线现象。
玻尔模型的核心思想是量子化,即电子只能处于特定的能级上,而不能处于中间的能级。
这一概念为后来的量子力学奠定了基础,并在解释原子光谱、化学键形成等方面发挥了重要作用。
卢瑟福的原子结构和玻尔模型的意义和应用卢瑟福的原子结构和玻尔模型为我们理解原子的内部结构和性质提供了重要的理论基础。
它们不仅帮助我们解释了原子的基本组成,还揭示了原子的稳定性、化学性质和光谱现象等重要特性。