9-水蒸汽蒸馏和减压蒸馏
- 格式:ppt
- 大小:10.84 MB
- 文档页数:28





而毛细管的作用,则是作为气化中心,使蒸馏平稳,避免液体过热而产生暴沸冲出现象。
毛细管口距瓶底约1~2mm,为了控制毛细管的进气量,可在毛细玻璃管上口套一段软橡皮管,橡皮管中插入一段细铁丝,并用螺旋夹夹住。
1、用毛细管起气化中心的作用, 用沸石起不到什么作用. 当然对于那些易氧化的物质, 毛细管也可以通氮气, 二氧化碳起保护2、也可以用磁力搅拌油浴锅,很方便,加热稳定,搅拌还可以控制速度3、简单的减压蒸馏直接在后面加一个液氮冷阱就行,复杂的就如上所说,需要加氯化钙塔、氢氧化钠碱塔、石蜡塔以保护抽虑泵4、减压蒸馏提纯过程中碰到蒸馏过程中馏分温度持续上升,无法提纯,可以采用加分馏柱,如果不行的话换精馏柱;要控制升温的速度,梯度升温;蒸馏前先拉真空,真空稳定后再慢慢升温。
实验3 减压蒸馏(4学时)一、实验目的:(1)了解减压蒸馏的原理和应用范围。
(2)认识减压蒸馏的主要仪器设备。
(3)掌握减压蒸馏仪器的安装和操作方法。
二、减压蒸馏的意义减压蒸馏是分离和提纯高沸点和性质不稳定的液体以及一些低熔点固体有机物的常用方法。
应用这一方法可将沸点高的物质以及在普通蒸馏时还没达到沸点温度就已分解,氧化或聚合的物质纯化。
三、减压蒸馏原理已知液体的沸点是指它的蒸气压等于外界大气压时的温度。
所以液体沸腾的温度是随外再压力的降低而降低的。
因而用真空泵连接盛有液体的容器,使液体表面上的压力降低,即可降低液体的沸点。
这种在较低压力下进行蒸馏的操作称为减压蒸馏,减压蒸馏时物质的沸点与压力有关。
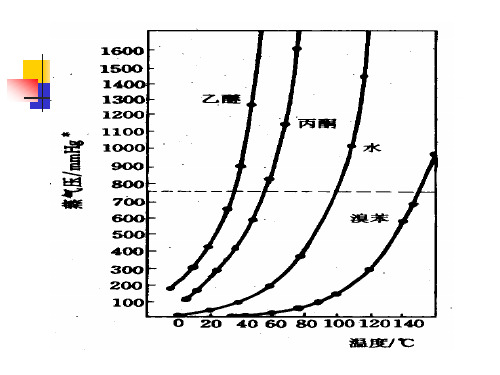
获得沸点与蒸气压关系的方法:①查文献手册,(见P209水的饱和蒸气压与沸点)②经验关系式,压力每相差133.3Pa(1mmHg),沸点相差~1℃③压力—温度关系图查找:(图2-28)四、减压蒸馏的装置通常认为有四部分组成:蒸馏部分、安全保护装置、测压装置、抽气(减压)装置。
主要仪器设备:①双颈蒸馏烧瓶②接收器③吸收装置④压力计⑤安全瓶⑥减压泵1.双颈蒸馏烧瓶或用克氏蒸馏头配园底烧瓶代替。

关于有机实验中蒸馏方法和操作的讨论摘要:液体有机化合物的分离和提纯中最重要的方法是蒸馏,本文结合本学期已经完成实验,从基本原理以及应对具体实验条件的操作原则入手,对蒸馏方法与操作进行了讨论,详细分析说明了实验中一些易被忽略的细节操作,并在原有实验方案基础上提出并讨论了一些改进措施。
关键词:常压蒸馏 减压蒸馏 水蒸气蒸馏 分馏1.常压蒸馏1.1用途:常压蒸馏用于挥发性液体与不挥发物质的分离,也可用于分离两种或两种以上沸点相差较大(一般为30℃以上)的液体混合物。
1.2原理:液体混合物在沸腾时液面上方蒸气组成与液体混合物的组成不同,蒸气富集了易挥发组分。
这时如果将蒸气冷却收集得到的应是组成与蒸气相同的低沸点组分富集成分。
随着易挥发组分蒸出,混合物的沸点会稍有升高,因此只有在沸腾温度相对稳定时收集到的才是混合体系中的某一组分。
1.3意外情况与处理方法:[1].蒸馏前期在液体沸腾后,无法收集到产品,且温度计的示数仍然接近室温。
原因分析:蒸馏时加热功率不足,仅能够使少量蒸气逸出液相,无法维持稳定的大量的沸腾蒸气产生,此时上升的蒸气遇到上方较冷的蒸馏头会重新凝结为液体形成回流,由于蒸馏头暴露在空气中的体积较大,有较好的散热作用,因此在一定程度上起到了冷凝蒸气的效果。
这种现象一般在实验室温度较低的冬季出现,有时,当蒸馏液体沸点较高且摩尔蒸发焓较大时,由于蒸气本身量少且与外界温差较大,因此极易散失自身的热量在蒸馏头冷凝,造成无法蒸馏出产品的后果。
解决方法:一般情况下,使用锡纸覆盖包裹电热套与烧瓶之间的空隙,减少了电热套本身直接向环境热辐射散失的热量。
另外可以采取石棉布包裹蒸馏头的方法减少蒸馏头的散热,在温度较低的情况下,也可以使用实验室易得的线手套包裹。
[2].蒸馏结束后在冷凝管和蒸馏头中仍然残余部分液体解决方法:蒸馏结束后,容器内不可避免的会残余部分液体,这部分液体的成分会因实验不同而异。
当待分离混合物为一种液态物质及其溶解的难挥发杂质,此时残余液体为纯净的该物质,可以进行回收;当待分离混合物为两种或多种液体物质混合物,一般情况下不回收。

蒸馏、分馏、精馏和减压蒸馏蒸馏和分馏都是利用有机物沸点不同,在蒸馏过程中将低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1-2℃)得到分离和纯化。
蒸馏:是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程的联合操作。
通过蒸馏可除去不挥发性杂质,可分离沸点差大于30 o C的液体混合物,还可以测定纯液体有机物的沸点及定性检验液体有机物的纯度。
分馏:如果将两种挥发性液体混合物进行蒸馏,在沸腾温度下,其气相与液相达成平衡,出来的蒸气中含有较多量易挥发物质的组分,将此蒸气冷凝成液体,其组成与气相组成等同(即含有较多的易挥发组分),而残留物中却含有较多量的高沸点组分(难挥发组分),这就是进行了一次简单的蒸馏。
如果将蒸气凝成的液体重新蒸馏,即又进行一次气液平衡,再度产生的蒸气中,所含的易挥发物质组分又有增高,同样,将此蒸气再经冷凝而得到的液体中,易挥发物质的组成当然更高,这样我们可以利用一连串的有系统的重复蒸馏,最后能得到接近纯组分的两种液体。
应用这样反复多次的简单蒸馏,虽然可以得到接近纯组分的两种液体,但是这样做既浪费时间,且在重复多次蒸馏操作中的损失又很大,设备复杂,所以,通常是利用分馏柱进行多次气化和冷凝,这就是分馏。
在分馏柱内,当上升的蒸气与下降的冷凝液互凝相接触时,上升的蒸气部分冷凝放出热量使下降的冷凝液部分气化,两者之间发生了热量交换,其结果,上升蒸气中易挥发组分增加,而下降的冷凝液中高沸点组分(难挥发组分)增加,如果继续多次,就等于进行了多次的气液平衡,即达到了多次蒸馏的效果.这样靠近分馏柱顶部易挥发物质的组分比率高,而在烧瓶里高沸点组分(难挥发组分)的比率高。

减压蒸馏一、基本原理很多有机化合物,特别是高沸点的有机化合物,在常压下蒸馏往往发生分解、氧化或聚合的物质。
在这种情况下,采用减压蒸馏方法最为有效。
液体的沸点是指它的蒸气压等于外界压力时的温度,因此液体的沸点是随外界压力的变化而变化的;从另一个角度来看,由于液体表面分子逸出所需的能量随外界压力的降低而减少。
因此,降低蒸馏体系的压力,则液体的沸点下降,这种在减压下的蒸馏操作称为减压蒸馏或真空蒸馏。
一般的高沸点有机化合物,当压力降低到20mmHg时,沸点比常压沸点要低100~120℃。
可利用图1的沸点-压力的经验计算图,近似地找出高沸点物质在不同压力下的沸点。
例如,水杨酸乙酯常压下的沸点为234℃,现欲找其在20mmHg的沸点为多少度,可在图1的b线上找出相当于234℃的点,将此点与c线上20mmHg处的点联成一直线,把此线延长与a线相交,其交点所示的温度就是水杨酸乙酯在20mmHg时的沸点,约为118℃。
图1. 沸点-压力的经验计算图二、减压蒸馏装置减压蒸馏装置主要由蒸馏、抽气(减压)、安全保护和测压四部分组成。
简单的减压蒸馏装置如图2所示。
蒸馏部分由蒸馏瓶、克氏蒸馏头、毛细管、温度计及冷凝管、接受器等组成。
蒸馏烧瓶内蒸馏的液体约占其容量1/3~1/2,不可超过1/2。
克氏蒸馏头可减少由于液体暴沸而溅入冷凝管的可能性;而毛细管的作用,则是导入空气,不断形成小气泡作为气化中心,使蒸馏平稳,避免液体过热而产生暴沸冲出现象,这对减压蒸馏是非常重要的。
毛细管口距瓶底约1~2mm,为了控制毛细管的进气量,可在毛细玻璃管上口套一段软橡皮管,橡皮管中插入一段细铁丝,并用螺旋夹夹住。
蒸出液接受部分(图2中16和17),通常用多尾接液管连接两个或三个厚壁梨形或圆形烧瓶,在接受不同馏分时,只需转动接液管,使不同的馏分流入指定的接受器中,而不中断蒸馏。
在减压蒸馏系统中切勿使用有裂缝或薄壁的玻璃仪器,尤其不能用不耐压的平底瓶(如锥形瓶、平底烧瓶等),以防止内向爆炸。


实验三、蒸馏、分馏和减压蒸馏(2006-10-22)一、实验目的(1)理解蒸馏、分馏和减压蒸馏的基本原理和适用条件;(2)熟练掌握蒸馏、分馏装置的安装和使用方法;掌握减压蒸馏仪器的安装和操作方法。
二、基本原理(一)蒸馏和分馏蒸馏和分馏都是利用有机物沸点不同,在蒸馏过程中将低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1-2℃)得到分离和纯化。
液体的分子由于分子运动有从表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。
当分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,液面上的蒸气达到饱和,称为饱和蒸气。
它对液面所施加的压力称为饱和蒸气压。
实验证明,液体的蒸气压只与温度有关。
即液体在一定温度下具有一定的蒸气压。
当液态物质受热时蒸气压增大,到与外界施于液面的总压力(通常是大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。
这时的温度称为液体的沸点。
蒸馏:是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程的联合操作。
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5o C)。
利用这一点,我们可以测定纯液体有机物的沸点。
又称常量法。
但是具有固定沸点的液体不一定都是纯粹的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
通过蒸馏可除去不挥发性杂质,可分离沸点差大于30o C的液体混合物,还可以测定纯液体有机物的沸点及定性检验液体有机物的纯度。
分馏:如果将两种挥发性液体混合物进行蒸馏,在沸腾温度下,其气相与液相达成平衡,出来的蒸气中含有较多量易挥发物质的组分,将此蒸气冷凝成液体,其组成与气相组成等同(即含有较多的易挥发组分),而残留物中却含有较多量的高沸点组分(难挥发组分),这就是进行了一次简单的蒸馏。






有机合成心得总结有机合成心得-后处理的问题在有机合成中,后处理的问题往往被大多数人所忽略,认为只要找对了合成方法,合成任务就可以事半功倍了,这话不错,正确地合成方法固然重要,但是有机合成的任务是拿到相当纯的产品,任何反应没有100%产率的,总要伴随或多或少的副反应,产生或多或少的杂质,反应完成后,面临的巨大问题就是从反应混合体系中分离出纯的产品。
后处理的目的就是采用尽可能的办法来完成这一任务。
为什么对后处理的问题容易忽视呢?我们平时所看到的各种文献尤其是学术性的研究论文对这一问题往往重视不够或者很轻视,他们重视的往往是新的合成方法,合成试剂等。
专利中对这一问题也是轻描淡写,因为这涉及到商业利润问题。
有机教科书中对这一问体更是没有谈论到。
只有参加过工业有机合成项目的人才能认识到这一问题的重要性,有时反应做的在好,后处理产生问题得不到纯的产品,企业损失往往巨大。
这时才认识到有机合成不光是合成方法的问题,还涉及到许多方面的问题,那一方面的问题考虑不周,都有可能前功尽弃。
后处理问题从哪里可以学到?除了向有经验的科研人员多多请教外,自己也应处处留心,虽说各种文献中涉及较少,但是还有不少论文是涉及到的,这就要求自己多思考,多整理,举一反三。
另外,在科研工作中,应注意吸取经验,多多磨练。
完成后处理问题的基本知识还是有机化合物的物理和化学性质,后处理就是这些性质的具体应用。
当然,首先要把反应做的很好,尽量减少副反应的发生,这样可以减轻后处理的压力。
因此,后处理还是考验一个人的基本功问题,只有化学学好了才有可能出色的完成后处理任务。
后处理根据反应的目的有不同的解决办法,如果在实验室中,只是为了发表论文,得到纯化合物的目的就是为了作各种光谱,那么问题就简单了,得到纯化合物的方法不外就是走柱子,TLC,制备色谱等方法,不用考虑太多的问题,而且得到的化合物还比较纯;如果是为了工业生产的目的,则问题就复杂了,尽量用简便、成本低的方法,实验室中的那一套就不行了,如果您还是采用实验室中的方法则企业就亏损了。

水蒸气蒸馏和减压蒸馏的原理水蒸气蒸馏和减压蒸馏,这两个听起来有点高大上的词,其实说白了就是两个用水和压力来分离物质的小妙招。
就像厨房里的烹饪法一样,都是为了让我们能吃到更美味的东西。
咱们先聊聊水蒸气蒸馏。
想象一下,你在炊烟袅袅的厨房里,锅里煮着水,水面上冒出阵阵热气。
这个热气其实就是水蒸气,温度一高,它就跑得飞快。
水蒸气蒸馏就是利用这种水蒸气来把某些物质“抓”出来。
比如说,你想提取某种植物的精油,咱们可以把植物放在水里,然后开火加热。
水蒸气带着植物里的香气上升,经过冷却,水蒸气变成水,精油就被留在了分离器里。
就像把花的香味“吸”出来,真是神奇。
说到这里,有没有觉得这过程跟做汤似的?锅里的水煮得咕咕响,香味四溢,嘴巴都开始流口水了。
再想象一下,那个蒸馏器就像是汤锅旁边的小碗,专门用来接“汤”里的精华。
水蒸气蒸馏的好处就是,能提取到比较纯的精油,而且操作起来也不复杂。
只要有锅、有水、还有点耐心,就能做出“美味”的精油,绝对是懒人和小白们的福音。
然后咱们再来聊聊减压蒸馏,这个就有点儿技术含量了,听起来像是在高科技实验室里进行的魔法仪式。
这个过程就像是给液体减轻压力,让它在较低的温度下蒸发。
是不是听起来很酷?想象一下,普通的水在常压下,100度就开始冒泡,而在减压的情况下,水可能在50度就能变成蒸汽。
这样一来,就能避免一些热敏性物质被高温破坏。
这种方式在制药和化学工业中尤其常用,真是专业人士的“拿手好戏”。
减压蒸馏的过程就像是在为你的材料开一扇窗,轻轻一推,低温的环境就让它们可以轻松挥发。
想想你在高温下煮牛奶,常常会担心牛奶变得浓稠或糊底。
而用减压蒸馏,就可以在较低温度下轻松提取出想要的成分,根本不用担心“火候”问题。
就像在压力山大时,给自己放个假,放松心情,轻松愉快地完成任务。
再说减压蒸馏的设备,看上去就像一套科学实验的玩具。
各种管子、接头、阀门,像是魔法师的道具。
整套设备虽然复杂,但工作起来可流畅得很。