高二化学《糖类》知识点归纳+典例导析
- 格式:doc
- 大小:224.01 KB
- 文档页数:5

化学糖类的知识点总结一、糖类的基本概念糖类是一类含有可溶性羟基的碳水化合物,它们通常是由碳、氢、氧三种元素组成的,化学式一般为(CH2O)n,其中 n 为大于或等于 3 的整数。
糖类在自然界中广泛存在,包括蜂蜜、水果、蔬菜、奶制品等食物中,在生物体内则广泛存在于细胞膜、核酸、蛋白质等生物大分子中。
根据其分子结构和性质,糖类可以分为以下几类:1. 单糖:是由一个具有多个羟基的碳链所组成的糖类,最简单的单糖是三碳的甘油醛(Glyceraldehyde)和四碳的醣醇(Erythrose);2. 双糖:是由两个单糖分子通过糖苷键连接而成的化合物,如蔗糖(麦芽糖、大葡萄糖)、乳糖等;3. 多糖:是由多个单糖分子通过糖苷键连接而成的多聚糖,如淀粉、纤维素、糖原等。
在糖类中,单糖是最基本的单位,其他复杂的糖类都是由单糖经过酶催化反应而形成。
同时,单糖也是生物体内最重要的糖类之一,如葡萄糖、果糖、半乳糖等,它们是细胞内能量的重要来源,也是构成生物大分子如核酸、蛋白质等的基本结构单元。
二、糖类的结构特点糖类的结构特点主要体现在其碳骨架、立体构型和环结构上。
1. 碳骨架:糖类的碳骨架通常是由连续的碳原子所组成的,每个碳原子上都含有一个羟基和一个醛基或酮基,由于羟基和醛基/酮基的特性,糖类具有较强的亲水性,因此可以在水溶液中自发形成环状结构。
2. 立体构型:糖类分子的碳原子上的羟基与醛基或酮基之间的空间排列方式不同,导致糖类分子具有不同的立体构型,常见的有 D 型和 L 型两种构型,它们之间的转化是通过酶的催化反应来完成的。
3. 环结构:糖类在水溶液中通常以环状结构存在,环状结构常见的有六元环和五元环两种类型,其中六元环的糖称为吡喃糖,五元环的糖称为呋喃糖。
糖类的结构特点决定了它们的生物学功能和化学性质,同时也为糖类的合成、分离和分析提供了重要的依据。
三、糖类的代谢途径糖类在生物体内主要通过糖酵解、糖异生和糖原合成三种途径进行代谢。

糖类知识点总结框架第一部分:糖的基础知识1. 糖的定义和分类- 糖的基本定义- 单糖、双糖、多糖的区别和举例- 复杂糖类的特点和举例2. 糖的功能和作用- 能量来源- 构建细胞结构- 保护细胞- 作为信号分子- 对人体健康的影响第二部分:主要糖类及其特点1. 单糖- 葡萄糖- 化学结构和特点- 在人体内的代谢途径- 用途和重要性- 果糖- 化学结构和特点- 来源和用途- 对人体健康的影响- 半乳糖- 化学结构和特点- 在食物中的存在- 在人体内的代谢2. 双糖- 蔗糖- 化学结构和特点- 生产和用途- 对人体健康的影响- 乳糖- 化学结构和特点- 在乳制品中的存在- 对人体的影响3. 多糖- 淀粉- 化学结构和特点- 来源和用途- 对人体健康的影响- 纤维素- 化学结构和特点- 在食物中的存在- 对人体健康的影响- 聚卡拉胶- 化学结构和特点- 用途和重要性- 对人体健康的影响第三部分:糖的在食物和生产中的应用1. 食物中的糖- 主要食物中的糖类含量和类型- 糖在食物中的作用- 世界各地著名的糖类食品2. 工业生产中的糖- 提取糖的方法和流程- 精炼和加工过程- 精制糖和非精制糖的区别第四部分:糖类与健康1. 糖类摄入量与健康- 世界卫生组织关于糖摄入的建议 - 糖对健康的影响- 过量糖摄入与慢性疾病的关系2. 糖的替代品- 人工甜味剂的特点和应用- 天然甜味剂的特点和应用- 替代品对健康的影响和争议第五部分:未来发展趋势1. 糖的定制与个性化- 基因工程在糖生产中的应用- 客制化糖类产品的发展趋势2. 可持续发展的糖产业- 绿色生产糖的技术和方法- 循环利用糖生产废弃物的发展方向3. 糖与生态环境- 糖产业对环境的影响- 环保型糖产品的研究及应用结论:总结糖类的重要性、应用前景和安全健康问题。
展望糖类产业的未来发展方向。

第一节 糖类一、糖类的组成和分类(一)来源和用途1、来源:绿色植物光合作用的产物。
6CO 2+6H 2O −−−→光能纤维素C 6H 12O 6(葡萄糖)+6O 2 2、用途:供能:C 6H 12O 6 + 6O 2→6CO 2+6H 2O+2804kJ/mol(二)组成结构1、组成元素:C 、H 、O2、结构特点:多个羟基、醛基、羰基。
碳水化合物:糖类大多数符合通 式C n (H 2O)m 。
注:(1)符合通式C n (H 2O)m 的物质不一定都是糖类,如甲醛(CH 2O)、乙酸(C 2H 4O 2)等;有些糖的组成并不符合C n (H 2O)m ,如脱氧核糖(C 5H 10O 4)(2)①有甜味的物质不一定是糖,如甘油、木糖醇等;②没有甜味的物质也可能是糖,如淀粉、纤维素等。
因此,糖类物质不等于碳水化合物,也不等于甜味物质。
(三)定义:多羟基醛、多羟基酮和他们的脱水缩合物(四)分类:1、根据能否水解以及水解后的的产物划分(1)单糖:不能水解的糖。
例:葡萄糖、果糖、核糖、脱氧核糖(2)寡糖或低聚糖:1mol 糖水解后能产生2-10mol 单糖。
例:二糖包括:麦芽糖、蔗糖、乳糖(3)多糖:1mol 糖水解后能产生10mol 以上单糖。
例:淀粉、纤维素、糖原2、根据能否发生银镜反应划分(1)还原性糖:能发生银镜反应的糖,如葡萄糖、果糖、麦芽糖(2)非还原性糖:不能发生银镜反应的糖,如蔗糖、淀粉、纤维素二、单糖(一)葡萄糖1、存在:葡萄糖是自然界中分布最广的单糖,因最初是从葡萄汁中分离得到而得名。
葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。
动物的血液和淋巴液中也含有葡萄糖。
2、物理性质:易溶于水的无色晶体,熔点为146℃, 有甜味,但甜度不如蔗糖。
3、组成和结构:分子式:;C 6H 12O 6 结构简式:CH 2OH-(CHOH)4-CHO 多羟基醛(5个羟基、1个醛基)4、化学性质:还原性糖(1)醛基:①与银氨溶液反应,有银镜产生;和新制Cu(OH)2反应产生砖红色沉淀②与H 2加成(2)多个羟基:①与新制的Cu(OH)2反应:生成绛蓝色溶液(可用于检验多个羟基) ②酯化反应③与活泼金属反应(3)氧化反应:①人体内−−−→−酶的催化发生氧化反应→热量→能量:C 6H 12O 6 +6O 2−→−酶6CO 2+6H 2O ;−−→−酸或酶 ②被酸性高锰酸钾氧化 葡萄糖(4)分解反应:C 6H 12O 6−−→−酒化酶2C 2H 5OH+2CO 2↑5、用途:制镜业、糖果制造业;低血糖患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养(二)果糖:1、存在和应用:果糖在水果和蜂蜜中含量较高,它比蔗糖的甜度高,广泛应用于食品和医药的生产中。

《高中化学糖类知识点全解析》糖类,作为生命活动中重要的有机化合物,在高中化学的学习中占据着重要的地位。
它不仅与我们的日常生活息息相关,更是在生物化学、有机化学等领域有着广泛的应用。
一、糖类的定义与分类糖类,又称为碳水化合物,是多羟基醛、多羟基酮以及它们的脱水缩合物。
根据糖类能否水解以及水解后的产物,可将糖类分为单糖、二糖和多糖。
1. 单糖单糖是不能再水解的糖,如葡萄糖、果糖等。
葡萄糖的分子式为 C₆H₁₂O₆,它是一种多羟基醛,具有还原性,能与银氨溶液发生银镜反应,也能与新制的氢氧化铜悬浊液反应生成砖红色沉淀。
果糖的分子式也为 C₆H₁₂O₆,它是一种多羟基酮,同样具有还原性。
2. 二糖二糖是能水解生成两分子单糖的糖,如蔗糖、麦芽糖等。
蔗糖的分子式为 C₁₂H₂₂O₁₁,它是由一分子葡萄糖和一分子果糖脱水缩合而成,无还原性。
麦芽糖的分子式也为 C₁₂H₂₂O₁₁,它是由两分子葡萄糖脱水缩合而成,具有还原性。
3. 多糖多糖是能水解生成多个分子单糖的糖,如淀粉、纤维素等。
淀粉的分子式为(C₆H₁₀O₅)ₙ,它是由多个葡萄糖分子脱水缩合而成,无还原性。
纤维素的分子式也为(C₆H₁₀O₅)ₙ,它也是由多个葡萄糖分子脱水缩合而成,但与淀粉不同的是,纤维素中的葡萄糖分子是以β-1,4-糖苷键连接的,而淀粉中的葡萄糖分子是以α-1,4-糖苷键连接的。
二、糖类的性质1. 物理性质糖类一般为白色晶体,有甜味,但甜度不同。
单糖和二糖易溶于水,多糖不溶于水,但在一定条件下可与水形成胶体。
2. 化学性质(1)氧化反应单糖中的葡萄糖和果糖具有还原性,能与银氨溶液、新制的氢氧化铜悬浊液等氧化剂发生氧化反应。
(2)水解反应二糖和多糖在一定条件下能发生水解反应。
蔗糖在稀硫酸的作用下,水解生成一分子葡萄糖和一分子果糖;麦芽糖在稀硫酸的作用下,水解生成两分子葡萄糖;淀粉和纤维素在稀硫酸的作用下,水解生成葡萄糖。
(3)酯化反应糖类中的羟基可以与酸发生酯化反应。


糖类知识点总结化学一、糖的种类1. 单糖单糖是由3至7个碳原子连接在一起形成的分子,最常见的单糖有葡萄糖、果糖和半乳糖等。
单糖按照分子构造可以分为直链式单糖和环状单糖两类,其中环状单糖又可分为葡萄糖型和果糖型两类。
单糖还可以根据光学活性分为D-型和L-型两类。
2. 双糖双糖由两个单糖分子通过糖苷键连接在一起形成,常见的双糖有蔗糖、乳糖和麦芽糖等。
双糖的生成是通过两个单糖分子的缩合反应形成的。
3. 多糖多糖是由多个单糖分子经过缩合反应形成的大分子,常见的多糖有淀粉、纤维素和糖原等。
多糖的结构复杂,可以分为直链多糖和支链多糖两类。
多糖在生物体内有重要的生理作用,是植物细胞壁的主要组成部分,也是动物体内储存能量的主要形式。
二、糖的性质1. 化学性质糖类化合物是碳水化合物的一种,具有醇、醛或酮官能团。
单糖可以发生还原反应,产生醛糖和酮糖,而双糖和多糖则不具有还原性。
2. 物理性质糖类化合物大多为白色结晶性固体,溶解于水后呈甜味。
双糖和多糖在水溶液中能够产生旋光性,而单糖可以通过酶的作用将直链构象转变为环状构象。
三、糖的结构1. 单糖的结构单糖的一般式为(CH2O)n,n为3至7之间的整数。
单糖的结构中含有羟基和半乳糖基,不同的单糖之间在立体结构上存在差异,因此它们会呈现出不同的化学性质和生物作用。
2. 双糖和多糖的结构双糖和多糖是由多个单糖分子通过糖苷键连接在一起形成的大分子,它们的结构复杂,包括直链式和支链式两类。
双糖和多糖的结构决定了它们的生理功能和生物活性。
四、糖的生物作用糖类是生物体内的主要能量来源,通过代谢过程,葡萄糖可以被分解为丙酮酸和丙酸,产生大量的ATP分子,为细胞提供能量。
2. 糖原和淀粉的储存糖原是动物体内的主要能量储备物质,存储在肝脏和肌肉组织中,当体内需要能量时,糖原可以迅速被分解为葡萄糖进行能量代谢。
而淀粉是植物体内的能量储备物质,主要储存在种子、根茎和果实等部位。
3. 结构组成糖类是植物细胞壁的主要组成部分,纤维素是由葡萄糖分子通过β-1,4-糖苷键连接而成,它赋予植物细胞壁良好的稳定性和结构支撑。

糖类知识点总结归纳一、知识概念1、糖类概述糖是一类碳水化合物,是维持生命活动所必需的营养素,也是维持生活和保持健康的重要物质。
糖类可以分为单糖、双糖和多糖三种类型。
其中,单糖是由单一分子组成的碳水化合物,最简单的单糖包括葡萄糖、果糖和半乳糖等。
双糖是由两个单糖分子通过糖苷键相连而成,最常见的双糖是蔗糖和乳糖。
多糖则是由多个单糖分子通过糖苷键相连而成,如淀粉、糖原和纤维素等。
2、糖类的分类根据单糖的不同,糖类可以分为葡萄糖类、果糖类、半乳糖类和氨基葡萄糖类四大类。
其中,葡萄糖类的代表物质是葡萄糖,它是动植物细胞中最常见的单糖。
果糖类主要包括果糖和蔗糖,它们在水果和甘蔗中含量较高。
半乳糖类主要包括半乳糖和乳糖,它们主要存在于乳制品中。
氨基葡萄糖类的代表物质是氨基葡萄糖,它是构成细胞壁的重要成分。
3、糖的生物学功能糖是细胞内外能量储备和供应的主要物质,它通过新陈代谢过程,转化为ATP分子,为人体提供能量。
此外,糖还是维持生命活动所必需的营养物质,可以调节人体的体温、维持酸碱平衡、促进细胞的生长和发育等。
二、糖类的代谢1、糖的吸收和消化体内的糖类主要是通过消化道吸收的,消化道主要吸收三种糖类:葡萄糖、果糖和半乳糖。
糖在消化道内主要经过淀粉酶和蔗糖酶的作用而变成葡萄糖,再通过肠道上皮细胞的运输蛋白进入血液循环,最终被肝脏和其他组织细胞所利用。
此外,糖类还可以经过代谢过程,被储存为糖原。
2、糖的利用和合成糖类被摄入后,主要是被细胞利用,转化成ATP分子为人体提供能量。
糖的代谢主要分为糖酵解和糖酵解两大过程。
糖酵解是指糖分子被分解成丙酮酸和磷酸酯化合物,再转化成乳酸或乙酸,最终转化成ATP分子。
糖异生是指糖分子通过多道途被合成成脂肪和蛋白质。
3、糖的储存体内的糖类主要通过两种形式储存:一种是以糖原的形式储存在肝脏和肌肉组织中;另一种是以脂肪的形式储存在脂肪细胞内。
当机体需要能量时,肝脏和肌肉组织可以通过糖原来合成葡萄糖,进而供给身体需要的能量。

糖类【学习目标】1、了解糖类的组成和分类以及糖类在工农业生产和社会生活中的广泛方法应用和重要意义;2、掌握糖类中重要的代表物葡萄糖、蔗糖、淀粉、纤维素的组成和主要性质||,它们之间的相互转化关系以及与烃的衍生物的关系||。
【要点梳理】要点一、糖类的组成和分类1.糖类的组成||。
(1)糖类是由碳、氢、氧三种元素组成的一类有机化合物||,大多数糖类的分子组成可用通式C m(H2O)n来表示(m、n可以相同||,也可以不同)||。
注意:对糖类的通式的理解应注意两点:①该通式只表明糖类由C、H、O三种元素组成||,并未反映糖类的结构特点||。
②有些属于糖类的物质不符合该通式||,如脱氧核糖C5H10O4;而有些符合该通式的物质却不属于糖类||。
如乙酸CH3COOH、乳酸||。
(2)从结构上看||,糖类可定义为多羟基醛或多羟基酮||,以及水解后可以生成多羟基醛或多羟基酮的化合物||。
2.糖类的分类||。
(1)根据能否水解以及水解后的产物||,糖类可分为单糖、低聚糖和多糖||。
单糖是不能水解的糖||,一般为多羟基醛或多羟基酮||,如葡萄糖、果糖、核糖及脱氧核糖等||。
低聚糖是1 mol糖水解后能产生2 mol~10 mol单糖的糖类||。
其中以二糖最为重要||,常见的二糖有麦芽糖、蔗糖和乳糖等||。
多糖是1 mol糖水解后能产生很多摩尔单糖的糖类||。
如淀粉、纤维素等||。
多糖属于天然高分子化合物||。
(2)单糖、低聚糖、多糖之间的相互转化关系为:(3)糖类是绿色植物光合作用的产物||,是一切生命体维持生命活动所需能量的主要来源||。
要点二、糖类的结构和性质1.葡萄糖的结构、性质和用途||。
葡萄糖是自然界中分布最广的单糖||,主要存在于葡萄及其他带有甜味的水果、蜂蜜中||,植物的种子、叶、根、花中||,动物的血液、脑脊液和淋巴液中||。
(1)分子结构||。
葡萄糖的分子式为C6H12O6||,结构简式为CH2OH(CHOH)4CHO||。

糖类化学知识点总结糖类是一类重要的有机化合物,其化学结构和性质的研究对于生物学和食品工业具有重要的意义。
糖类包括单糖、双糖、多糖等多种类型,它们具有不同的分子结构和特性。
本文将对糖类的化学结构、命名方法、性质以及在生物体内和食品工业中的应用进行系统的总结和阐述。
一、单糖的化学结构和命名方法1. 单糖的分类单糖是由碳、氢、氧三种元素组成的糖类化合物,它们的分子结构中含有一个或多个羟基和一个或多个醛基或酮基。
根据它们的化学结构,单糖可分为醛糖和酮糖两类。
醛糖的分子中含有一个醛基,酮糖的分子中含有一个酮基。
2. 单糖的化学结构单糖的化学结构可以用希尔德-奥斯特公式来表示,其中n代表碳原子数,希尔德-奥斯特公式的结构为(CH2O)n。
单糖的分子结构包括直链结构和环状结构两种形式。
直链结构是单糖分子直接相连形成的链状结构,而环状结构是由直链结构转变而来的,其中含有环氧醇化合物。
3. 单糖的命名方法根据单糖分子中羟基的位置不同,可以分为各种不同的单糖,比如葡萄糖、果糖、半乳糖等,并且还可以根据立体构型的不同将它们分为L-型和D-型两种立体异构体。
二、双糖和多糖的化学结构和性质1. 双糖的化学结构和性质双糖是由两个单糖分子通过糖苷键连接而成的化合物,根据单糖分子的组成不同,双糖可分为蔗糖、麦芽糖、乳糖等多种类型。
双糖具有不同的甜度和溶解度,它们在食品工业中具有广泛的应用。
2. 多糖的化学结构和性质多糖是由多个单糖分子通过糖苷键连接而成的化合物,它们的分子结构复杂,包括淀粉、纤维素、半乳聚糖等多种类型。
多糖在生物体内具有重要的功能,如淀粉是植物体内储存能量的重要物质,而纤维素是植物细胞壁结构的主要组成部分。
三、糖的生物合成和降解1. 糖的生物合成糖类在生物体内是通过一系列酶促反应进行合成的,主要包括糖异生和糖原合成两个过程。
糖异生是指通过葡萄糖及其衍生物的代谢途径来合成其他单糖,而糖原合成是指通过多糖合成反应来合成淀粉和糖原。

糖类知识点的总结归纳一、糖类的分类糖类是由碳、氢、氧三种元素组成的碳水化合物。
根据其分子结构和代谢途径,糖类可以分为单糖、双糖、多糖和醇类四类。
1. 单糖:单糖是由一个分子结构的糖分子组成的,包括葡萄糖、果糖和半乳糖等。
单糖是生物体内的主要能量来源,也是其他糖类的基础单元。
2. 双糖:双糖是由两个分子结构的糖分子组成的,包括蔗糖、乳糖和麦芽糖等。
双糖需要在体内被分解成单糖,才能够被人体有效吸收利用。
3. 多糖:多糖是由多个分子结构的糖分子组成的,包括淀粉、纤维素和糖原等。
多糖是人类主要的膳食来源,可以提供较为稳定的能量。
4. 醇类:醇类是一种含有羟基的碳水化合物,包括山梨醇、甘露醇等。
醇类可以被人体吸收,但不会引起血糖升高,因此常被用于特定人群的食品添加剂。
二、糖类的生物学作用糖类在人体内有着重要的生物学作用,包括提供能量、维持血糖平衡、促进脑部功能等。
1. 提供能量:糖类是人体主要的能量来源之一,它在体内被代谢成葡萄糖后,可以提供给身体各个组织细胞所需要的能量。
2. 维持血糖平衡:糖类可以通过体内的代谢途径,调节血糖的水平,保持在一个稳定的范围内,以保证身体各项功能的正常运转。
3. 促进脑部功能:脑部是人体对能量需求最大的器官之一,而糖类是脑部的主要能量来源,它可以促进大脑的正常功能,维持思维清晰和运动协调。
三、糖类的来源人类获得糖类的主要来源包括天然食物和加工食品两种。
1. 天然食物:天然食物是指自然生长而成的食物,包括水果、蔬菜、谷物等。
这些食物中含有丰富的单糖、双糖和多糖,可以提供人体所需的糖类。
2. 加工食品:随着食品加工技术的发展,人们制备了各种加工食品,其中包括糖果、饼干、饮料等。
这些食品中往往添加了大量的糖类,使得其口感更佳,但也增加了糖类的摄入量。
四、糖类与健康的关系糖类与健康有着密切的关系,适当的摄入可以为身体提供所需的能量,但长期过量摄入会导致一系列的健康问题。
1. 过量摄入糖类会导致肥胖:过量的糖类摄入会导致体内能量储备过多,进而导致肥胖。
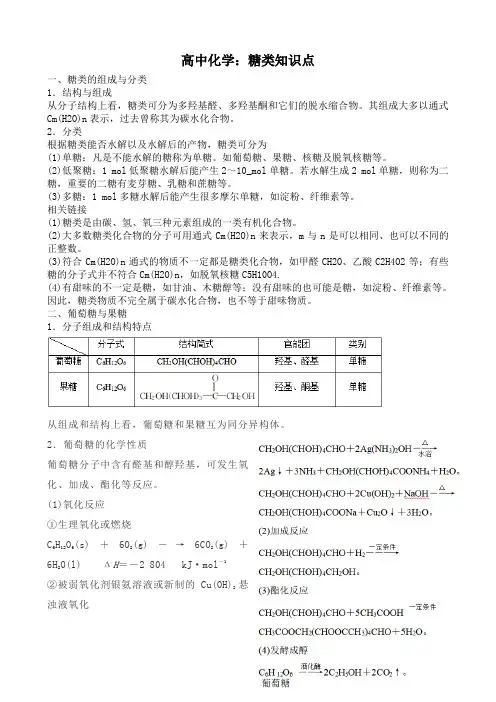
高中化学:糖类知识点一、糖类的组成与分类1.结构与组成从分子结构上看,糖类可分为多羟基醛、多羟基酮和它们的脱水缩合物。
其组成大多以通式Cm(H2O)n表示,过去曾称其为碳水化合物。
2.分类根据糖类能否水解以及水解后的产物,糖类可分为(1)单糖:凡是不能水解的糖称为单糖。
如葡萄糖、果糖、核糖及脱氧核糖等。
(2)低聚糖:1 mol低聚糖水解后能产生2~10_mol单糖。
若水解生成2 mol单糖,则称为二糖,重要的二糖有麦芽糖、乳糖和蔗糖等。
(3)多糖:1 mol多糖水解后能产生很多摩尔单糖,如淀粉、纤维素等。
相关链接(1)糖类是由碳、氢、氧三种元素组成的一类有机化合物。
(2)大多数糖类化合物的分子可用通式Cm(H2O)n来表示,m与n是可以相同、也可以不同的正整数。
(3)符合Cm(H2O)n通式的物质不一定都是糖类化合物,如甲醛CH2O、乙酸C2H4O2等;有些糖的分子式并不符合Cm(H2O)n,如脱氧核糖C5H10O4.(4)有甜味的不一定是糖,如甘油、木糖醇等;没有甜味的也可能是糖,如淀粉、纤维素等。
因此,糖类物质不完全属于碳水化合物,也不等于甜味物质。
二、葡萄糖与果糖1.分子组成和结构特点从组成和结构上看,葡萄糖和果糖互为同分异构体。
2.葡萄糖的化学性质葡萄糖分子中含有醛基和醇羟基,可发生氧化、加成、酯化等反应。
(1)氧化反应①生理氧化或燃烧C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(l) ΔH=-2 804 kJ·mol-1②被弱氧化剂银氨溶液或新制的Cu(OH)2悬浊液氧化相关链接葡萄糖分子结构的探究三、二糖和多糖1.蔗糖和麦芽糖(1)蔗糖和麦芽糖的结构与性质(2)蔗糖的水解反应①蔗糖水解反应实验需用稀硫酸(1∶5)作催化剂,水浴加热。
水解反应的化学方程式为:②水解产物中葡萄糖的检验:欲要检验水解产物中的葡萄糖,必须先加入NaOH溶液中和多余的硫酸,再加入银氨溶液或新制Cu(OH)2悬浊液进行检验。
高二化学糖类【本讲主要内容】糖类1. 葡萄糖和蔗糖的重要性质2. 淀粉和纤维素的重要性质【知识掌握】【知识点精析】1. 了解糖的组成和分类:糖含义:碳水化合物并不是所有的糖均符合此式如鼠李糖符合此式的也未必是糖如甲醛(故该名称早已失去原来的意义)分类(根据能否水解及水解产物多少决定)单糖:葡萄糖果糖二糖:蔗糖麦芽糖多糖:淀粉纤维素C H OC H OCH On m()261252⎧⎨⎪⎪⎩⎪⎪⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪2. 掌握葡萄糖的结构(多羟基、醛基)和性质(还原性),了解葡萄糖的用途:葡萄糖分子式C6H12O6结构简式官能团化学性质(1)氧化反应①生理氧化反应C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)+放热②与银氨溶液反应③与新制氢氧化铜反应(2)还原反应(3)酯化反应(4)在酒化酶的催化作用下的反应主要用途①营养物质②制药③制糖果④制镜或热水瓶胆镀银制法3. 蔗糖、麦芽糖性质的比较:(1)蔗糖和麦芽糖4. 了解淀粉和纤维素的重要性质,重点掌握淀粉和纤维素的水解反应。
【解题方法指导】例1. 对于糖类化合物的概念叙述正确的是()A. 含有碳、氢、氧三种元素的有机化合物B. 是碳和水的化合物,又称碳水化合物C. 有甜味的物质D. 一般是多羟基的醛或多羟基的酮及能水解生成它们的物质解析:由碳、氢、氧三种元素组成的有机化合物,应是烃类的含氧衍生物,烃类的含氧衍生物有许多种,如醇、醛、羧酸、酯等,从糖类化合物的分子组成分析,糖类化合物属于有机化合物,含碳、氢、氧三元素组成的化合物中的一类,所以,A的说法不正确。
糖类也叫碳水化合物,但是,碳水化合物绝对不是碳和水的化合物,虽然糖类化合物分子式通式可表示为C n(H2O)m这只是说明了这类化合物的组成,并不能表示这类化合物的结构。
B不正确。
有甜味的物质不一定是糖类,有的物质属于糖类,但不一定有甜味。
例如淀粉和纤维素。
化学糖类知识点总结一、基本概念糖是指含有醛基或酮基的碳水化合物。
它们通常是多元醇,也就是含有多个羟基的化合物。
根据碳水化合物的结构特点,糖类可分为单糖、双糖、寡糖和多糖四大类。
1. 单糖单糖是由3-7个碳原子组成的简单碳水化合物,通式为(CH2O)n。
根据其醛基或酮基的位置和数量,单糖又可分为醛糖和酮糖两类。
常见的单糖包括葡萄糖、果糖、半乳糖等。
2. 双糖双糖是由两个单糖分子经由缩合反应形成的碳水化合物,通常由α-1,4-糖苷键或β-1,4-糖苷键连接。
蔗糖、乳糖、麦芽糖等均为常见的双糖。
3. 寡糖寡糖是由3-10个单糖分子经由糖苷键连接而成的碳水化合物,它们具有较复杂的结构和多样的生物活性。
低聚果糖、低聚葡萄糖等都是寡糖的代表。
4. 多糖多糖是由数十至上百个单糖分子经由糖苷键连接而成的碳水化合物,是生物体内最广泛的一类糖类。
淀粉、纤维素、糖原等都属于多糖。
二、分类根据单糖的类型和数量,糖类可分为脱氧糖、醛糖和酮糖三大类。
1. 脱氧糖脱氧糖是指在单糖分子中某些羟基被氢或其他基团所取代,从而形成一种脱氧的糖类。
常见的脱氧糖包括脱氧核糖、脱氧賖和氨基葡萄糖等。
2. 醛糖醛糖是指单糖分子中含有醛基的糖类,通常以醛基为末端。
葡萄糖、半乳糖等都属于醛糖。
3. 酮糖酮糖是指单糖分子中含有酮基的糖类,通常以酮基为末端。
果糖就是一种典型的酮糖。
三、生物学功能糖类在生物体内具有多种重要的生物学功能,主要包括提供能量、构建细胞壁、储存能量和作为通讯信号等。
1. 提供能量糖类是生物体内主要的能量来源之一。
通过细胞代谢途径,单糖分子可以氧化分解成ATP,从而为细胞提供能量。
葡萄糖是最重要的能量来源之一,它在有氧条件下可以完全被氧化分解,释放出大量的能量。
2. 构建细胞壁在植物细胞和真菌细胞中,糖类起着构建细胞壁的重要作用。
纤维素是由葡萄糖分子通过β-1,4-糖苷键连接而成的多糖,在细胞壁中起着支撑和保护细胞的作用。
3. 储存能量动物体内的肝脏和肌肉组织中可以储存糖原,植物体内的叶绿器中可以储存淀粉。
第二节糖类学习目标核心素养1.了解糖类的概念、分类及结构特点。
2.掌握糖类重要代表物葡萄糖、蔗糖、淀粉和纤维素的组成和重要性质。
3.知道糖类在食品加工和生物质能源开发上的应用。
1.通过宏观实验认识糖类的性质,结合糖类的分子结构,从微观化学键的变化理解糖类性质的本质。
(宏观辨识与微观探析)2.从蔗糖、淀粉的性质出发,依据探究目的,改进实验装置,优化探究方案,运用化学实验对水解反应产物减产和水解程度进行探究。
(科学探究与创新意识)3.通过葡萄糖的氧化反应、淀粉的水解反应,认识糖类在生产生活中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)一、糖类的组成和分类1.概念:糖类是多羟基醛或多羟基酮和它们的脱水缩合物。
2.组成:由C、H、O三种元素组成。
3.通式:大多数糖可用通式C n(H2O)m表示。
4.分类类别单糖二糖多糖概念不能水解的糖1 mol糖水解后能产生2 mol单糖的糖1 mol糖水解后能产生n(n>10)摩尔单糖的糖代表物及分子葡萄糖、果糖蔗糖、麦芽糖淀粉、纤维素C6H12O6C12H22O11(C6H10O5)n式【教材二次开发】从教材资料卡片“糖的相对甜度”的表格数据思考,是不是所有的糖都有甜味,有甜味的物质是糖?提示:不是。
糖类不一定有甜味,如纤维素属于糖类但没有甜味。
有甜味的物质不一定是糖,如甜蜜素、糖精有甜味。
二、葡萄糖和果糖类别葡萄糖果糖分子式C6H12O6C6H12O6物理性质白色晶体,有甜味,易溶于水无色晶体,有甜味,易溶于水、乙醇和乙醚结构简式CH2OH(CHOH)4CHO化学性质①能和酸发生酯化反应②能和银氨溶液发生银镜反应③能与新制的氢氧化铜悬浊液反应产生红色沉淀④与H2加成生成醇①能和酸发生酯化反应②与H2加成生成醇相互关系互为同分异构体用途用于制镜、糖果、医药等行业主要用于食品工业【情境思考】糖是人体三大主要营养素之一,是人体热能的主要来源。
糖类物质及其产物广泛存在,在生产、生活中用途广泛,例如葡萄糖在糖果制造业、制镜业和医药领域有着广泛应用。
高中糖类知识点总结一、糖类的基本知识糖类是一类由碳、氢、氧三种元素构成的有机化合物。
糖类的主要成分是碳、氢、氧三种元素,通式为(CH2O)n ,其中 n 可以是 3,4,5,长度不等。
根据醛基的位置,糖类又可分为醇糖和醛糖两大类。
醇糖是以羟基取代醣原原子而形成的化合物,醛糖是以羰基为基团的糖类。
根据分子结构的不同,糖类可分为单糖、双糖、多糖三大类。
1. 单糖:单糖又称为简单糖,是由一个糖分子组成的碳水化合物。
单糖根据分子结构的不同,可分为三种常见的单糖,分别是葡萄糖、果糖和半乳糖。
葡萄糖是一种最简单的单糖,它是所有糖类物质的“基石”。
果糖是一种既得到自然界中广泛存在又可由葡萄糖合成的糖。
半乳糖是由乳糖分解后获得的。
2. 双糖:双糖又称为二糖,由两个单糖分子通过糖苷键结合而成。
双糖是由两个单糖分子经缩合合成的糖,主要有蔗糖、麦芽糖、乳糖等。
3. 多糖:多糖又称为复合糖,是由多个单糖分子通过糖苷键结合而成,分子量较大。
多糖类包括淀粉、糖原、纤维素和半乳聚糖。
二、糖类的作用糖类是人体必需的营养素,它是人体内最重要的能量来源之一。
糖类的主要作用如下:1. 能量供给:糖类是人体内主要的能量来源,人体内糖类的代谢就是人体内能量供应的一部分。
人体内的葡萄糖主要是通过食物中的碳水化合物吸收所得。
2. 组织功能:糖类是机体细胞的原料,构成各种细胞组分,对生命活动有重要影响。
例如,糖可以合成各种生物分子,如脂肪酸、胆固醇、激素等。
3. 调节代谢:糖类还是人体内的主要快速能源,血糖水平的维持对人体内的生理代谢有着重要作用。
人体的血液中的葡萄糖浓度越低,人体紧急需要能量,或者未来预料到紧急需要能量的情况越强时,血糖分解的活动越强。
三、糖类的分类糖类的分类主要是根据其分子结构不同、化学性质差异、来源、功能不同来进行分类的。
1. 单糖:单糖是由一个糖分子组成的碳水化合物。
单糖根据分子结构的不同,可分为三种常见的单糖,分别是葡萄糖、果糖和半乳糖。
从组成和构造上看,葡萄糖和果糖互为同分异构体。
2.葡萄糖的化学性质 葡萄糖分子中含有醛基和醇羟基,可发生氧化、加成、酯化等反响。
(1) 氧化反响 ①生理氧化或燃烧 6H O(l) 2 ΔH =- 2 804kJ·mol - 1 ②被弱氧化剂银氨溶液或制的Cu(OH) 悬 2浊液氧化 高中化学:糖类学问点一、糖类的组成与分类1.构造与组成从分子构造上看,糖类可分为多羟基醛、多羟基酮和它们的脱水缩合物。
其组成大多以通式Cm(H2O)n 表示,过去曾称其为碳水化合物。
2.分类依据糖类能否水解以及水解后的产物,糖类可分为(1) 单糖:但凡不能水解的糖称为单糖。
如葡萄糖、果糖、核糖及脱氧核糖等。
(2) 低聚糖:1 mol 低聚糖水解后能产生 2~10_mol 单糖。
假设水解生成 2 mol 单糖,则称为二糖,重要的二糖有麦芽糖、乳糖和蔗糖等。
(3) 多糖:1 mol 多糖水解后能产生很多摩尔单糖,如淀粉、纤维素等。
相关链接(1) 糖类是由碳、氢、氧三种元素组成的一类有机化合物。
(2) 大多数糖类化合物的分子可用通式 Cm(H2O)n 来表示,m 与 n 是可以一样、也可以不同的正整数。
(3) 符合 Cm(H2O)n 通式的物质不肯定都是糖类化合物,如甲醛 CH2O 、乙酸 C2H4O2 等;有些糖的分子式并不符合 Cm(H2O)n ,如脱氧核糖 C5H10O4.(4) 有甜味的不肯定是糖,如甘油、木糖醇等;没有甜味的也可能是糖,如淀粉、纤维素等。
因此,糖类物质不完全属于碳水化合物,也不等于甜味物质。
二、葡萄糖与果糖1.分子组成和构造特点C H O (s) + 6O (g) ― → 6CO (g) +6 12 6 2 2相关链接葡萄糖分子构造的探究三、二糖和多糖1.蔗糖和麦芽糖(1)蔗糖和麦芽糖的构造与性质(2)蔗糖的水解反响①蔗糖水解反响试验需用稀硫酸(1∶5)作催化剂,水浴加热。
水解反响的化学方程式为:②水解产物中葡萄糖的检验:欲要检验水解产物中的葡萄糖,必需先参加 NaOH 溶液中和多余的硫酸,再参加银氨溶液或制 Cu(OH)2 悬浊液进展检验。
糖类【学习目标】1、了解糖类的组成和分类以及糖类在工农业生产和社会生活中的广泛方法应用和重要意义;2、掌握糖类中重要的代表物葡萄糖、蔗糖、淀粉、纤维素的组成和主要性质,它们之间的相互转化关系以及与烃的衍生物的关系。
【要点梳理】要点一、糖类的组成和分类1.糖类的组成。
(1)糖类是由碳、氢、氧三种元素组成的一类有机化合物,大多数糖类的分子组成可用通式C m(H2O)n来表示(m、n可以相同,也可以不同)。
注意:对糖类的通式的理解应注意两点:①该通式只表明糖类由C、H、O三种元素组成,并未反映糖类的结构特点。
②有些属于糖类的物质不符合该通式,如脱氧核糖C5H10O4;而有些符合该通式的物质却不属于糖类。
如乙酸CH3COOH、乳酸。
(2)从结构上看,糖类可定义为多羟基醛或多羟基酮,以及水解后可以生成多羟基醛或多羟基酮的化合物。
2.糖类的分类。
(1)根据能否水解以及水解后的产物,糖类可分为单糖、低聚糖和多糖。
单糖是不能水解的糖,一般为多羟基醛或多羟基酮,如葡萄糖、果糖、核糖及脱氧核糖等。
低聚糖是1 mol糖水解后能产生2 mol~10 mol单糖的糖类。
其中以二糖最为重要,常见的二糖有麦芽糖、蔗糖和乳糖等。
多糖是1 mol糖水解后能产生很多摩尔单糖的糖类。
如淀粉、纤维素等。
多糖属于天然高分子化合物。
(2)单糖、低聚糖、多糖之间的相互转化关系为:(3)糖类是绿色植物光合作用的产物,是一切生命体维持生命活动所需能量的主要来源。
要点二、糖类的结构和性质1.葡萄糖的结构、性质和用途。
葡萄糖是自然界中分布最广的单糖,主要存在于葡萄及其他带有甜味的水果、蜂蜜中,植物的种子、叶、根、花中,动物的血液、脑脊液和淋巴液中。
(1)分子结构。
葡萄糖的分子式为C6H12O6,结构简式为CH2OH(CHOH)4CHO。
它是一种多羟基醛。
(2)物理性质。
葡萄糖是无色晶体,熔点为146℃,有甜味,但甜度不如蔗糖,易溶于水,稍溶于乙醇,不溶于乙醚。
(3)化学性质。
葡萄糖分子中含有醛基和醇羟基,可发生氧化、加成、酯化等反应。
①氧化反应。
a.燃烧。
C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(1)ΔH=-2804kJ·mol-1b.被银氨溶液或新制的Cu(OH)2氧化。
−−→CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2OCH2OH(CHOH)4CHO+2Ag(NH3)2OH∆−−→CH2OH(CHOH)4COOH+Cu2O↓+2H2OCH2OH(CHOH)4CHO+2Cu(OH)2∆②加成反应。
−−→CH2OH(CHOH)4CH2OH(己六醇)CH2OH(CHOH)4CHO+H2Ni∆③酯化反应。
特别提示:葡萄糖是单糖,不能发生水解反应。
(4)主要用途。
葡萄糖用于糖果制造业,还可用于医药工业。
2.果糖简介。
(1)果糖是最甜的糖,广泛分布在植物中,在水果和蜂蜜中含量较高。
(2)果糖的分子式为C6H12O6,结构简式为,它是一种多羟基酮。
果糖与葡萄糖互为同分异构体。
(3)纯净的果糖为无色晶体,熔点为103~105℃,它不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚。
果糖是最甜的糖。
(4)果糖分子中含有酮基和醇羟基,能发生加成、酯化反应。
3.蔗糖与麦芽糖。
蔗糖与麦芽糖都是重要的二糖,蔗糖为白色晶体,麦芽糖为无色晶体,两者都易溶于水,都有甜味。
4.淀粉与纤维素。
淀粉和纤维素是最重要的多糖。
两者具有相同的分子通式(C6H10O5)n。
它们都是由许多个单糖单元(C6H10O5)构成的天然高分子化合物。
但由于n值不同,两者不是同分异构体关系,又由于结构不同,两者也不是同系物关系。
(2)淀粉和纤维素的主要化学性质。
①都无还原性。
淀粉和纤维素都不能被银氨溶液或新制的Cu(OH)2氧化,因而都没有还原性。
②都能水解,其水解的最终产物都是葡萄糖,但纤维素比淀粉更难水解。
(C 6H 10O 5)n +nH 2O H+∆−−−→nC 6H 12O 6 (淀粉或纤维素) (葡萄糖)③淀粉遇碘单质变蓝色,纤维素遇碘单质不变色,因此可用碘单质来鉴定淀粉的存在或区分淀粉和纤维素。
④纤维素分子的每个单糖单元有3个醇羟基,其分子通式可表示为[C 6H 7O 2(OH)3]n ,能表现出醇的性质。
如能与HNO 3、CH 3COOH 等发生酯化反应。
要点三、糖类之间的相互转化关系注:C 6H 12O 6−−−−→酒化酶2C 2H 5OH+2CO 2。
【典型例题】类型一:糖类的结构和性质例1美国科学家最近发明了利用眼泪来检测糖尿病的装置,其原理是利用氯金酸钠(NaAuCl 4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20nm-60nm ),下列说法中错误的是() A .葡萄糖具有还原性B .葡萄糖的结构简式为CH 2OH(CHOH)4CHOC .检测时NaAuCl 4发生氧化反应D .纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应【思路点拨】葡萄糖的官能团是醛基,醛基具有还原性。
【答案】C【解析】A 项葡萄糖中含有醛基,醛基具有还原性,故A 正确;B 项葡萄糖的结构简式为CH 2OH-CHOH-CHOH-CHOH-CHOH-CHO ,故B 正确;C 项氯金酸钠变为金化合价降低,发生还原反应,故C 错误;D 纳米金单质颗粒直径为20nm-60nm ,分散在水中所得的分散系为胶体,故D 正确。
故选C 。
【总结升华】糖类曾经被认为“碳水化合物”很长时间,后来研究发现,并不是所有的糖类符合碳水化合物的组成;糖类的定义和有甜味并没有必然联系;单糖不能发生水解,二糖、多糖才可以发生水解,其产物是单糖。
举一反三:【变式1】下列各糖能发生水解,且属于还原性糖自是() A .葡萄糖 B .蔗糖 C .麦芽糖 D .纤维素【答案】C【变式2】关于淀粉和纤维素的下列说法中,正确的是() A .两者都能水解,且水解的最终产物相同 B .两者实验式相同,且互为同分异构体 C .两者都属于糖类,且都没有甜味D .两者都属于高分子化合物,且遇碘单质都显蓝色 【答案】A 、C类型二:糖类的水解及产物的检验例2 向淀粉溶液中加少量稀H 2SO 4,加热使淀粉水解,为测其水解程度,需要的试剂是() ①NaOH 溶液 ②银氨溶液 ③新制的Cu(OH)2悬浊液 ④碘水 A .④ B .②④ C .①③④ D .③④【思路点拨】解答时注意“测其水解程度”的意义,有两层含义,一是测其是否水解,二是测其是否完全水解。
再分析具体的检验方法。
【答案】C【解析】测定淀粉的水解程度应分为三种情况:(1)完全水解,(2)部分水解,(3)没有水解。
若完全水解,证明没有淀粉,可用碘水检验;若部分水解,证明既有淀粉又有葡萄糖,可用碘水检验淀粉的存在,可用银氨溶液或新制的Cu(OH)2悬浊液检验葡萄糖的存在,不过在检验之前要先用NaOH中和多余的酸;若没有水解,证明没有葡萄糖,可用银氨溶液或新制的Cu(OH)2悬浊液,仍应先用NaOH中和多余的酸。
【总结升华】检验糖类的水解产物除可用银氨溶液外,还可使用新制的Cu(OH)2悬浊液,和银镜反应一样,使用Cu(OH)2之前也要先加入NaOH中和作为催化剂的酸,同时所配制的Cu(OH)2中NaOH必须过量,配制的方法是:在洁净的试管中加入10%的NaOH溶液2 mL,然后滴入5%的CuSO4溶液5滴,振荡后即可使用。
举一反三:【变式1】将蔗糖溶于水,配成10%的溶液,分装在两个试管中,在第一支试管中加入银氨溶液,在水浴中加热,没有变化,原因是蔗糖分子中________;在第二支试管中,加入几滴稀H2SO4,再在水浴中加热,加NaOH中和酸后也加入银氨溶液,现象________,原因是________,稀硫酸的作用是________。
【答案】无醛基有光亮的银镜产生蔗糖发生水解,生成葡萄糖催化剂类型三:糖类之间的相互转化例3 如右图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。
A、B、C都可以被强还原剂还原成为D(C6H14O6)。
已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,最难。
请在下列横线上填写A、B、C、D的结构简式。
A:________;B:________;C:________;D:________。
【思路点拨】本题以淀粉水解产物为主线,考查有机化学中的氧化反应、还原反应。
分析解答时,注意题目中给出的被氧化的难易的顺序。
【答案】A:CH2OH(CHOH)4CHO B:CH2OH(CHOH)4COOHC:HOOC(CHOH)4COOH D:CH2OH(CHOH)4CH2OH【解析】淀粉水解产物为葡萄糖(A),其结构简式为CH2OH(CHOH)4CHO。
由题给信息可知其中的—CHO 先被氧化,然后再是—CH2OH被氧化。
看官能团变化前后原子数目的多少,若是—CHO被氧化,则相当于增加了一个氧原子,其他原子没变,则B(C6H12O7)是—CHO被氧化的产物。
分析C(C6H10O8),则多了两个氧原子,少了两个氢原子,则是—CHO与—CH2OH都被氧化成了—COOH。
再分析D(C6H14O6)与原物质A(C6H12O6)相比较,多了两个氢原子,可认为是醛基被还原了(与H2加成)。
【总结升华】注意总结一些有机物中被氧化(还原)的规律:能被连续氧化的物质,一般为醇类;能与不同氧化剂氧化成不同物质,一般含有两种以上的官能团;醛类与氢气的加成反应也可以视为还原反应等。
举一反三:【变式1】现有通式为(CH2O)n的六种有机物,性质如下:①甲是无色有刺激性气味的气体,可以发生银镜反应;②乙、丙、丁的相对分子质量均为甲的2倍,戊的相对分子质量是甲的3倍,己的相对分子质量是甲的6倍;③乙、戊的水溶液可使甲基橙试剂变红,还可以与乙醇在一定条件下酯化,乙和戊间也能酯化;④戊结构中含有—CH3,两分子戊可形成环状酯;⑤丙不溶于水;丁、己两种物质的水溶液均呈中性;丙既能水解,又能发生银镜反应;丁能与钠反应放出H2;己能发生银镜反应,它可由淀粉水解制得。
推断各物质的结构,写出其结构简式。
甲________,乙________,丙________,丁________,戊________,己________。
【答案】HCHO CH3COOH HCOOCH3HOCH2CHO CH2OH(CHOH)4CHO【变式2】根据转化关系判断下列说法正确的是()A.(C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体B.可以利用银镜反应证明反应①的最终产物为葡萄糖C.酸性高锰酸钾可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸D.在反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯【答案】B【解析】A项,(C6H10O5)n可以是淀粉或纤维素,但是二者的n值不同,不是同分异构体,错误;B项,葡萄糖可以发生银镜反应,正确;C项,烧黑的铜丝趁热插入乙醇中得到的是乙醛,错误;D项,分离乙醇、乙酸和乙酸乙酯应用饱和碳酸钠溶液,错误。