MDA的测定
- 格式:ppt
- 大小:135.00 KB
- 文档页数:10


丙二醛(MDA)的测定方法一、实验原理植物在逆境下遭受伤害(或衰老)与活性氧积累诱发的膜脂过氧化作用密切相关,膜脂过氧化的产物有丙二醛、二烯轭合物、乙烷等。
其中丙二醛(MDA:Malondialdehyde)是膜脂过氧化最重要的产物之一,因此可以通过检测MDA了解膜脂过氧化程度,以间接测定膜脂受损程度以及植物的抗逆性。
丙二醛在高温条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑2,4-二酮),该物质在532nm处有一吸收高峰,并且在660nm处有较小光吸收。
根据其532nm处的消光值可计算出溶液中丙二醛的含量。
醛、可溶性糖对此反应有干扰,在450nm处有以吸收峰,可用双组分分光光度法加以排除。
二、仪器设备紫外可见分光光度计;离心机;电子天平;研钵;恒温水浴锅;试管;剪刀。
三、主要试剂1、10%三氯乙酸(TCA)2、0.5%硫代巴比妥酸(用10%的三氯乙酸溶解);3、石英砂。
四、实验材料正常生长以及受逆境胁迫的小麦叶片五、实验步骤1. 取小麦不同部位的叶片3~5片,洗净擦干,剪成0.5 cm长的小段,混匀。
2. 称取叶片切断0.3 g,放入冰浴的研钵中,加入2 ml 10%TCA和少量石英砂,研磨至匀浆,4. 然后在 4℃,12, 000 g 离心 15 min,取上清。
5. 吸取离心的上清液1.5 ml(对照加1.5 ml 10% TCA),加同体积0.5% TBA溶液,混匀物于沸水浴上反应30 min,迅速冷却后再离心。
6. 取上清液测定532nm、450nm和600nm波长下的消光度。
六、计算含量根据植物组织的重量计算测定样品中MDA的含量:MDA浓度(μmol L-1) = 6.45*(OD535-OD600)-0.56*OD450MDA含量(μmol/g FW)= (MDA浓度(umol/L)*提取液体积(ml)) /植物组织鲜重(g)七、注意事项1. MDA-TBA显色反应的加热时间,最好控制沸水浴15-30 min之内。
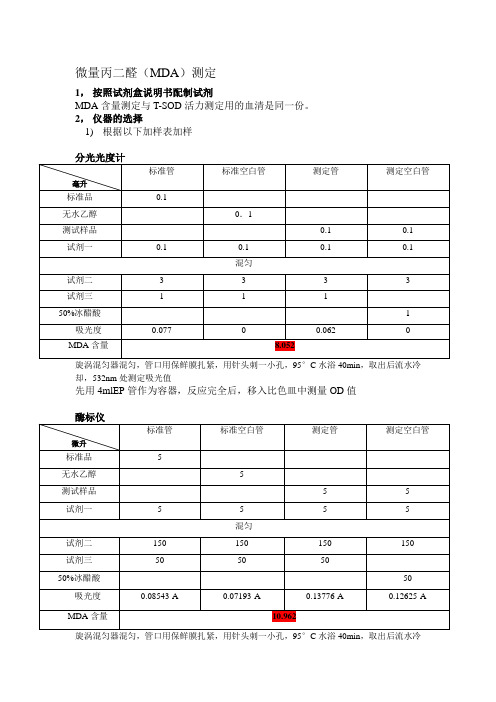
微量丙二醛(MDA)测定
1,按照试剂盒说明书配制试剂
MDA含量测定与T-SOD活力测定用的血清是同一份。
2,仪器的选择
1)根据以下加样表加样
旋涡混匀器混匀,管口用保鲜膜扎紧,用针头刺一小孔,95°C水浴40min,取出后流水冷却,532nm处测定吸光值
先用4mlEP管作为容器,反应完全后,移入比色皿中测量OD值
旋涡混匀器混匀,管口用保鲜膜扎紧,用针头刺一小孔,95°C水浴40min,取出后流水冷
却,532nm处测定吸光值(A蒸馏水=A)
先用0.5mlEP管作为容器,反应完全后,移取200μl至96T板中测量OD值
*实验部分结数据见表中红色数据
2)结果分析;1,与T-SOD活力检测结果类似,酶标仪所测得的MDA含量的值要稍微大一些,但都相差不大,所以可以选择酶标仪
2,20μl血清量过大,需要进一步摸索取样的量。
3,最佳取样量第二次预试
不利于比较
3)总结:统一选择5μl的原血样做为加样量
3,血样按照以上方法处理后分装,取出一份待测,其余的先放入4℃后放入-80℃冷冻。
再按以下加样表加样。

丙二醛(MDA)含量的测定
(一)、设备及试剂
设备分光光度计、离心机、铝锅、电炉、研钵、剪刀、试管
试剂 10%三氯醋酸(TCA)、0.5%硫代巴比妥酸(TBA以10%三氯醋配制)
(二)、操作方法
1.MDA的提取
取叶片数片剪成0.5cm2左右的小块,称取1g置研钵中。
加2ml 10%TCA和少许石英砂,研磨成匀浆,加入8ml 10%TCA继续研磨均匀。
匀浆在3000×g下离心10min,上清液即为提取液。
2.显色测定
10ml刻度试管2支,一支加入上清液3ml,另一支加水3ml(空白),各加0.5%的TBA溶液3ml,摇匀,在沸水浴中煮沸10min(溶液出现小气泡开始计时),立即在冷水中冷却。
如有沉淀,应离心。
以空白作参比,在分光光度计450cm、532nm、600nm下测定样品反应液的消费值(用1cm光径的比色杯)
(三)、实验结果
C(μmol · L-1)=6.45(OD532– OD600)–0.56 OD450
MDA的含量(μmol · g-1 FW)= C×V×10-3 / W
OD532 OD600 OD450 :450nm、532nm、600nm波长下的光密度
C:提取液中MDA的浓度(μmol · L-1)
V:提取液的总体积(ml)
W:样品鲜重(g)。

植物体内丙二醛含量的测定一、目的通过实验,掌握植物体内丙二醛含量测定的原理及方法。
二、原理丙二醛(MDA)是由于植物官衰老或在逆境条件下受伤害,其组织或器官膜脂质发生过氧化反应而产生的。
它的含量与植物衰老及逆境伤害有密切关系。
测定植物体内丙二醛含量,通常利用硫代巴比妥酸(TBA)在酸性条件下加热与组织中的丙二醛产生显色反应,生成红棕色的三甲川(3、5、5-三甲基恶唑2、4-二酮),三甲川最大的吸收波长在532nm。
但是测定植物组织中MDA时受多种物质的干扰,其中最主要的是可溶性糖,糖与硫代巴比妥酸显色反应产物的最大吸收波长在450nm处,在532nm处也有吸收。
植物遭受干旱、高温、低温等逆境胁迫时可溶性糖增加,因此测定植物组织中丙二醛与硫代巴比妥酸反应产物含量时一定要排除可溶性糖的干扰。
此外在532nm波长处尚有非特异的背景吸收的影响也要加以排除。
低浓度的铁离子能显著增加硫代巴比妥酸与蔗糖或丙二醛显色反应物在532、450nm处的吸光度值,所以在蔗糖、丙二醛与硫代巴比妥酸显色反应中需要有一定的铁离子,通常植物组织中铁离子的含量为100-300μg·g-1Dw,根据植物样品量和提取液的体积,加入Fe3+的终浓度为0.5nmol· L-1。
在532nm、600nm和450nm波长处测定吸光度值,即可计算出丙二醛含量。
三、材料、仪器设备及试剂1. 材料:植物叶片。
2. 试剂:100%三氯乙酸:在装有500g TCA的瓶中加入227ml水,形成的溶液含有100%(M/V)TCA,4℃避光保存;10%三氯乙酸:用100%TCA稀释10倍为10%TCA,4℃避光保存;0.6%硫代巴比妥酸(TBA)溶液:称0.6g TBA,先用少量1M NaOH溶解,然后用10%的TCA定容;石英砂。
四、实验步骤1. 丙二醛的提取称取受干旱、高温、低温等逆境胁迫的植物叶片1g,加入10%三氯乙酸5ml,研磨至匀浆,再加5ml10%三氯乙酸进一步研磨,分成2等份倒入10ml离心管中,匀浆以5000r/min 离心10min,其上清液转入10ml离心管中,为丙二醛提取液。

膜脂过氧化水平(MDA)的测定植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化的最终分解产物。
丙二醛的积累可能对膜和细胞造成一定的伤害。
研究中常以MDA含量来反映植物膜脂过氧化的水平和对细胞膜的伤害程度。
1、实验原理丙二醛(MDA)是常用的膜脂过氧化指标,在酸性和高温度条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑-2,4-二酮),其最大吸收波长在532nm。
但是测定植物组织中MDA时受多种物质的干扰,其中最主要的是可溶性糖,糖与TBA显色反应产物的最大吸收波长在450nm,但532nm 处也有吸收。
植物遭受干旱、高温、低温等逆境胁迫时可溶性糖增加,因此测定植物组织中MDA-TBA反应物质含量时一定要排除可溶性糖的干扰。
低浓度的铁离子能够显著增加TBA与蔗糖或MDA显色反应物在532、450nm处的消光度值,所以在蔗糖、MDA与TBA显色反应中需一定量的铁离子,通常植物组织中铁离子的含量为每克干重100~300μg/g,根据植物样品量和提取液的体积,加入Fe3+的终浓度为0.5μmol/L。
双组分分光光度计法据朗伯一比尔定律:D=kCL,当液层厚度为1cm时,k=D/C,k称为该物质的比吸收系数。
当某一溶液中有数种吸光物质时,某一波长下的消光度值等于此混合液在该波长下各显色物质的消光度值之和。
已知蔗糖与TBA显色反应产物在450nm和532nm波长下的比吸收系数分别为85.40和7.40。
MDA在450nm波长下无吸收,故该波长的比吸收系数为0,532nm波长下的比吸收系数为155,根据双组分分光度计法建立方程组,求解方程得计算公式:C1=11.71D450 (①)C2=6.45(D532-D600)-0.56D450 (②)式中C1:可溶性糖的浓度(mmol/L);C2:MDA的浓度(μmol/L);D450、D532、D600分别代表450、532和600nm波长下的消光度值。

实验26植物细胞膜脂过氧化产物MDA含量的测定一、目的植物器官衰老或在逆境下遭受伤害时,往往发生膜脂过氧化作用。
膜脂过氧化作用的产物比较复杂,包括一些醛类、烃类等。
其产物之一丙二醛(MDA)从膜上产生的位置释放出后,可以与蛋白质、核酸反应,改变这些大分子的构型,或使之产生交联反应,从而丧失功能,还可使纤维素分子间的桥键松驰,或抑制蛋白质的合成。
因此,研究中常以MDA含量来反映植物膜脂过氧化的水平和对细胞膜的伤害程度。
通过本实验,使学生加深对细胞膜脂过氧化作用的认识,掌握丙二醛测定的原理与技术。
二、原理丙二醛(MDA)是常用的膜脂过氧化指标,在酸性和高温度条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑-2,4-二酮),其最大吸收波长在532nm。
但是测定植物组织中MDA时受多种物质的干扰,其中最主要的是可溶性糖,糖与TBA显色反应产物的最大吸收波长在450nm,但532nm处也有吸收。
植物遭受干旱、高温、低温等逆境胁迫时可溶性糖增加,因此测定植物组织中MDA-TBA反应物质含量时一定要排除可溶性糖的干扰。
低浓度的铁离子能够显著增加TBA与蔗糖或MDA显色反应物在532、450nm处的消光度值,所以在蔗糖、MDA与TBA显色反应中需一定量的铁离子,通常植物组织中铁离子的含量为每克干重100~300μg·g1,根据植物样品量和提取液-的体积,加入Fe3的终浓度为0.5μmol·L-1。
+1.直线回归法MDA与TBA显色反应产物在450nm波长下的消光度值为零。
不同浓度的蔗糖(0~25mmol·L-1)与TBA显色反应产物在450nm的消光度值与532nm和600nm处的消光度值之差成正相关,配制一系列浓度的蔗糖与TBA显色反应后,测定上述三个波长的消光度值,求其直线方程,可求算糖分在532nm处的消光度值。
UV-120型紫外可见分光光度计的直线方程为:Y532=—0.00198+0.088D450(8.3-1)2.双组分分光光度计法据朗伯一比尔定律:D=kCL,当液层厚度为1cm时,k=D/C,k称为该物质的比吸收系数。


植物组织 MDA 含量测定一、目的要求1.掌握植物组织 MDA 含量测定的原理及具体测量步骤;2.深化理解 MDA 与逆境和衰老的关系,理解植物组织MDA 含量测定的意义;3.了解膜脂过氧化、氧自由基和MDA 形成的关系;4.能够根据待测材料的具体情况设计实验步骤测定MDA 含量;5.学习分光光度计,低温离心机等仪器的使用方法。
二、实验原理植物遭受逆境胁迫或衰老时,体内会发生一系列生理生化变化,如核酸和蛋白质含量下降、叶绿素降解、光合作用降低,活性氧平衡失调及内源激素平衡失调等。
活性氧代谢失调直接导致植物体内活性氧的大量积累,从而引发或加剧膜脂过氧化作用,造成细胞膜系统的损伤,严重时会导致植物细胞死亡。
膜脂过氧化的产物有二烯轭合物、脂类过氧化物、丙二醛、乙烷等。
其中丙二醛( Malondialdehyde, MDA )是膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤。
因此在植物衰老生理和抗性生理研究中, MDA 含量是一个常用指标,可通过测定 MDA 了解膜脂过氧化的程度,以间接测定膜系统受损程度以及植物的抗逆性。
MDA 在高温及酸性环境下可与2-硫代巴比妥酸( TBA )反应,产生红棕色的产物 3,5,5-三甲基恶唑 2,4-二酮(Trimet —nine),又名三甲川,该物质在 532nm 处有最大光吸收,在 600nm 处有最小光吸收。
由于TBA 也可与其它物质反应,并在 532nm 处有吸收,为消除硫代巴比妥酸与其它物质反应的影响,同时测定600nm 下的吸光度,利用 532nm 与 600nm 下的吸光度的差值计算MDA 的浓度。
即: A532-A 600=ε·CL式中,A 532和 A 600分别表示 532nm 和 600nm 处的吸光度值,C 是 MDA 浓度,-1-1。
L 为比色杯厚度,ε =155L· mmol·cmO O OHO O O2H N+100 C H N NHHS NOH S N OHO NSH H HTBA MDA3,5,5-三甲基恶唑 2,4-二酮需要指出的是,植物组织中糖类物质可能对 MDA-TBA 反应有干扰作用。


MDA含量的测定植物组织中丙二醛(TBARS-硫代巴比妥酸产物)含量的测定---(TBA)法一、仪器设备紫外可见分光光度计1台;离心机1台;电子天平1台;10ml离心管4支;研钵2套;试管4支;刻度吸管:10ml 1支,2ml 1支;剪刀1把。
二、试剂10%三氯乙酸(TCA);0.6%硫代巴比妥酸(TBA):先加少量的氢氧化钠(1mol/L)溶解,再用10%的三氯乙酸定容;石英砂。
三、方法1.实验材料受干旱、高温、低温等逆境胁迫的植物叶片或衰老的植物器官。
2.MDA的提取称取剪碎的试材1g,加入2ml l0%TCA和少量石英砂,研磨至匀浆,再加8mlTCA进一步研磨,匀浆在4000r·min-1离心10min,上清液为样品提取液。
3.显色反应和测定吸取离心的上清液2ml(对照加2ml蒸馏水),加入2ml 0.6%TBA 溶液,混匀物于沸水浴上反应15min,迅速冷却后再离心。
取上清液测定532nm、600nm和450nm波长下的消光度。
四、计算含量1.直线方程法按公式[Y532=-0.00198+0.088D450]求出样品中糖分在532nm 处的消光度值Y532,用实测532nm的消光度值减去600nm非特异吸收的消光度值再减去Y532,其差值为测定样品中MDA-TBA反应产物在532nm的消光度值。
按MDA在532nm处的毫摩尔消光系数为155换算求出提取液中MDA浓度。
2.双组分分光光度法按公式[C2(μmol/L)=6.45(D532-D600)-0.56D450]可直接求得植物样品提取液中MDA的浓度。
[C1=11.71D450C1:可溶性糖的浓度(mmol/L)]用上述任一方法求得MDA的浓度,根据植物组织的重量计算测定样品中MDA的含量。
:MDA含量(umol·g-1)=MDA浓度(umol·L-1)x提取液体积(ml)/植物组织鲜重(g)。

主要目的:——为了测定样品中的MDA含量,作为机体内脂质过氧化的程度的一个指标。
主要原理:——测定原理为过氧化脂质降解产物中的丙二醛可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm 波长下有最大吸收峰[100]。
用酶标仪在532 nm处测定吸光度(OD值),计算样品浓度。
因底物为硫代巴比妥酸,所以此法称为TBA 法。
实验室签章一、试剂——无水乙醇(分析纯)——硫代巴比妥酸——冰醋酸——双蒸水——丙二醛(MDA)测定试剂盒(南京建成生物研究所)二、仪器设备——96孔酶标板——UV-Vis可见多功能酶标仪——旋涡混匀器——水浴锅——移液枪及相应量程枪头三、实验方法根据试剂盒说明书具体操作步骤如下:1.向标准管0.1 mL标准品,空白管加入0.1 mL无水乙醇,测试管和对照管加入稀释后的血清或组织上清液0.1 mL,然后各管中再分别加入0.1 mL试剂一,摇动几下试管架晃匀,向各管中分别加入3 mL的试剂二和1ml的试剂三,同时只向对照管中加入50%冰醋酸1 mL。
2.旋涡混匀器混匀,试管口用保险薄膜扎紧,用针头刺一小孔,95℃水浴40分钟,取出后流水冷却,然后4000转/分,1cm光径,双蒸水调零,测定各管吸光度值。
3.血清中MDA含量计算公式MDA 含量(nmol/mL)--=测定OD值对照OD值标准OD值空白OD值×标品浓度×样本前稀释倍数组织中MDA含量计算公式MDA 含量(nmol/mgprot)--=测定OD值对照OD值标准OD值空白OD值×标品浓度÷样品蛋白浓度(mgprot/mL)Lu T C, Ko Y Z, Huang H W, et al. Analgesic and anti-inflammatory activities of aqueous extract from Glycine tomentella root in mice[J]. Journal of ethnopharmacology, 2007, 113(1): 142-148.。

植物组织中SOD活性MDA含量的测定方法超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量是评价植物细胞的氧化应激程度和损伤程度的重要指标。
下面将介绍常用的测定植物组织中SOD活性和MDA含量的方法。
一、SOD活性测定方法:1. 混合植物组织提取液:将适量的植物组织(如叶片、根部等)加入冰冻磨碎器中,加入适量的冰冷提取液(Tris-HCl缓冲液,pH 7.8或其他适宜缓冲液),按比例加入少量酒石酸、酚酸、DTT等,然后将混合物离心10分钟。
2.处理提取物:将上述所得的植物组织提取液加入活性溶液,如NBT、PIP等,混匀后放置在37°C水浴中反应一定时间。
3. 停止反应:将反应液加入组织破壁液(甘油、NaCl、Tween-20等混合物),混匀后放置一段时间,离心10-15分钟。
4.测定光密度:取上清液用比色计测定光密度(OD)值,以反映SOD的活性,活性越高,OD值越低。
二、MDA含量测定方法:1.组织提取:将适量的植物组织加入冰冷提取液(如磷酸盐缓冲液,pH7.4),用冷磨具磨碎并移至离心管中,离心5分钟收集上清液。
2.加入TBA液:取上清液与TBA液(三硝基苞球菌素溶液)按比例混合,混匀后在水浴中加热(100°C,10分钟),然后迅速冷却至室温。
3.离心沉淀:将样品离心10分钟,取上清液。
4.测定光密度:分别取上清液测定OD值,OD值越高,MDA含量越高。
三、优化与改进:1.提取液的选择:根据不同植物组织的特点选择合适的提取液,以提高SOD活性和MDA含量的测定效果。
2.比色反应的时间和温度的调整:根据植物组织中SOD活性的变化调整反应时间和温度,以保证测定结果的准确性。
3.重复测量:为了提高实验结果的可靠性,可以重复测量同一样本,并取平均值作为最终结果。
4.与对照的比较:将测定样本与对照组进行比较,以评估SOD活性和MDA含量的变化,进一步分析植物组织的氧化应激程度和损伤程度。
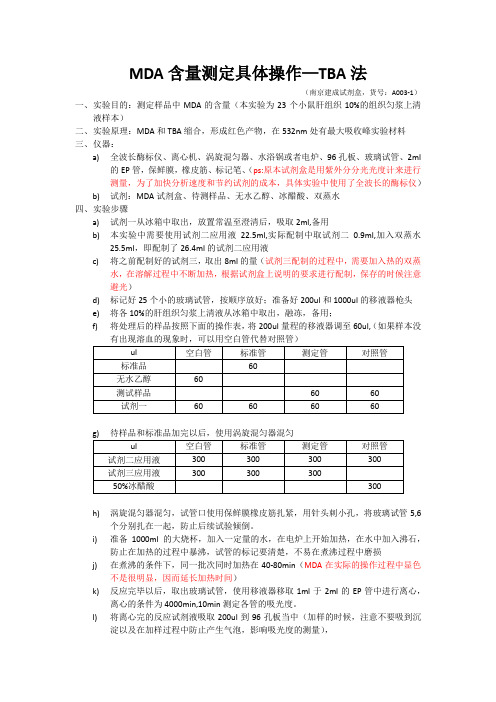
MDA含量测定具体操作—TBA法(南京建成试剂盒,货号:A003-1)一、实验目的:测定样品中MDA的含量(本实验为23个小鼠肝组织10%的组织匀浆上清液样本)二、实验原理:MDA和TBA缩合,形成红色产物,在532nm处有最大吸收峰实验材料三、仪器:a)全波长酶标仪、离心机、涡旋混匀器、水浴锅或者电炉、96孔板、玻璃试管、2ml的EP管,保鲜膜,橡皮筋、标记笔、(ps:原本试剂盒是用紫外分分光光度计来进行测量,为了加快分析速度和节约试剂的成本,具体实验中使用了全波长的酶标仪)b)试剂:MDA试剂盒、待测样品、无水乙醇、冰醋酸、双蒸水四、实验步骤a)试剂一从冰箱中取出,放置常温至澄清后,吸取2ml,备用b)本实验中需要使用试剂二应用液22.5ml,实际配制中取试剂二0.9ml,加入双蒸水25.5ml,即配制了26.4ml的试剂二应用液c)将之前配制好的试剂三,取出8ml的量(试剂三配制的过程中,需要加入热的双蒸水,在溶解过程中不断加热,根据试剂盒上说明的要求进行配制,保存的时候注意避光)d)标记好25个小的玻璃试管,按顺序放好;准备好200ul和1000ul的移液器枪头e)将各10%的肝组织匀浆上清液从冰箱中取出,融冻,备用;f)将处理后的样品按照下面的操作表,将200ul量程的移液器调至60ul,(如果样本没h)涡旋混匀器混匀,试管口使用保鲜膜橡皮筋扎紧,用针头刺小孔,将玻璃试管5,6个分别扎在一起,防止后续试验倾倒。
i)准备1000ml的大烧杯,加入一定量的水,在电炉上开始加热,在水中加入沸石,防止在加热的过程中暴沸,试管的标记要清楚,不易在煮沸过程中磨损j)在煮沸的条件下,同一批次同时加热在40-80min(MDA在实际的操作过程中显色不是很明显,因而延长加热时间)k)反应完毕以后,取出玻璃试管,使用移液器移取1ml于2ml的EP管中进行离心,离心的条件为4000min,10min测定各管的吸光度。

植物组织中丙二醛含量的测定实验报告一、实验目的本实验旨在测定植物组织中丙二醛(MDA)的含量,以评估植物在逆境条件下膜脂过氧化的程度,从而了解植物的抗逆性。
二、实验原理丙二醛(MDA)是膜脂过氧化的最终分解产物之一,其含量可以反映植物细胞膜脂过氧化的程度。
在酸性和高温条件下,MDA 可与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑 2,4-二酮),该物质在 532nm 波长处有最大吸收峰。
由于植物组织中的其他成分在该波长处也有吸收,因此需要同时测定 600nm 波长处的吸光度值进行校正。
三、实验材料与仪器1、实验材料新鲜的植物叶片(如菠菜、水稻等)2、实验试剂(1)05%硫代巴比妥酸(TBA)溶液:称取 05g TBA 溶于 100ml 20%三氯乙酸(TCA)溶液中。
(2)20%三氯乙酸(TCA)溶液3、实验仪器(1)分光光度计(2)离心机(3)恒温水浴锅(4)研钵(5)移液器(6)容量瓶(7)刻度试管四、实验步骤1、提取称取05g 植物叶片,剪碎后放入研钵中,加入5ml 20% TCA 溶液,研磨成匀浆。
将匀浆转移至离心管中,在 4℃下以 10000r/min 离心10min,上清液即为 MDA 提取液。
2、反应吸取 2ml MDA 提取液于刻度试管中,加入 2ml 05% TBA 溶液,混合均匀。
将试管放入沸水浴中加热 15min,然后迅速冷却至室温。
3、测定以 20% TCA 溶液为空白对照,在分光光度计上分别测定 532nm 和600nm 波长处的吸光度值(A532 和 A600)。
五、实验结果计算根据以下公式计算 MDA 含量(μmol/g):MDA 含量= 645×(A532 A600) × V /(W × 1000)其中,645 为 MDA 与 TBA 反应产物在 532nm 处的消光系数;V 为提取液总体积(ml);W 为植物组织鲜重(g)。

丙二醛(MDA)的测定方法一、实验原理植物在逆境下遭受伤害(或衰老)与活性氧积累诱发的膜脂过氧化作用密切相关,膜脂过氧化的产物有丙二醛、二烯轭合物、乙烷等。
其中丙二醛(MDA:Malondialdehyde)是膜脂过氧化最重要的产物之一,因此可以通过检测MDA了解膜脂过氧化程度,以间接测定膜脂受损程度以及植物的抗逆性。
丙二醛在高温条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑2,4-二酮),该物质在532nm处有一吸收高峰,并且在660nm处有较小光吸收。
根据其532nm处的消光值可计算出溶液中丙二醛的含量。
醛、可溶性糖对此反应有干扰,在450nm处有以吸收峰,可用双组分分光光度法加以排除。
二、仪器设备紫外可见分光光度计;离心机;电子天平;研钵;恒温水浴锅;试管;剪刀。
三、主要试剂1、10%三氯乙酸(TCA)2、0.5%硫代巴比妥酸(用10%的三氯乙酸溶解);3、石英砂。
四、实验材料正常生长以及受逆境胁迫的小麦叶片五、实验步骤1. 取小麦不同部位的叶片3~5片,洗净擦干,剪成0.5 cm长的小段,混匀。
2. 称取叶片切断0.3 g,放入冰浴的研钵中,加入2 ml 10%TCA 和少量石英砂,研磨至匀浆,4. 然后在 4℃,12, 000 g 离心 15 min,取上清。
5. 吸取离心的上清液1.5 ml(对照加1.5 ml 10% TCA),加同体积 0.5% TBA溶液,混匀物于沸水浴上反应30 min,迅速冷却后再离心。
6. 取上清液测定532nm、450nm和600nm波长下的消光度。
六、计算含量根据植物组织的重量计算测定样品中MDA的含量:MDA浓度(μmol L-1) = 6.45*(OD535-OD600)-0.56*OD450MDA含量(μmol/g FW)= (MDA浓度(umol/L)*提取液体积(ml)) / 植物组织鲜重(g)七、注意事项1. MDA-TBA显色反应的加热时间,最好控制沸水浴15-30 min之内。

1叶绿素含量测定取样0.2g左右,剪碎,放入黑色胶卷盒中加20ml等量丙酮乙醇混合液(0号调零管:20ml等量丙酮乙醇混合液),48h以后,待材料变白,取上清夜于440、645、663nm处测其OD 值。
计算:叶绿素a含量C=12.7d663-2.69d645叶绿素b含量C=22.9d645-4.68d663叶绿素总含量C=20.2d645+8.02d663类胡罗卜素含量C=4.7d440-0.27(叶绿素a含量+叶绿素b含量)2脯氨酸含量的测定配药:(1)3%磺基水杨酸溶液: 6g----200ml(2)2.5%酸性茚三酮显色液:冰乙酸和6mol/l磷酸经3:2混合,作为溶剂进行配制。
冰乙酸 90ml85%磷酸(15mol/l)24ml用去离子水定溶至60ml茚三酮 3.75g测定:(1)脯氨酸提取:取不同处理的剪碎叶片0.5g,分别置于大试管中,加入5ml 3%磺基水杨酸溶液,管口加盖玻璃球,于沸水浴中浸提10min.(2)取出试管,待冷却至室温后,吸取上清液2ml,加2ml冰乙酸和3ml显色液(0号调零管:2ml 冰乙酸+3ml显色液+2ml去离子水),于沸水浴中加热40min.(3)取出冷却后向各试管加入5ml甲笨充分振荡,以萃取红色物质。
静置,待分层后吸取甲笨层,以0号管为对照在波长520nm下比色。
计算: 从标准曲线中查出测定液中脯氨酸浓度,按下式计算样品中脯氨酸含量。
Y = ( C * V ) / ( A * W )式中:C――提取液中脯氨酸含量(由标准曲线求得),ug;V――提取液总体积,5 mlA――测定时所吸取的体积,2ml;W――样品量,g;Y――脯氨酸含量(干重或鲜重),ug/g.SOD,POD,MDA酶和可溶性蛋白质的配药:3个重复,1SOD1 pH7.8磷酸缓冲液:(a)14.4gNa2HPO4·12H2O溶于400mL水中取366mL;(b)6.24gNaH2PO4·2H2O溶于400mL水中取34mL;两液混成400mL,即为pH7.8磷酸缓冲液。

mda含量测定实验报告MDA 含量测定实验报告一、实验目的丙二醛(MDA)是膜脂过氧化的重要产物之一,其含量的高低可以反映生物体脂质过氧化的程度和细胞损伤的程度。
本实验旨在通过测定样品中的 MDA 含量,了解样品的氧化损伤情况。
二、实验原理MDA 与硫代巴比妥酸(TBA)反应生成红色的产物,该产物在532nm 处有最大吸收峰。
通过测定该产物的吸光度值,可以计算出MDA 的含量。
但样品中的其他物质可能会对测定产生干扰,因此需要通过加样和对照实验来消除干扰。
三、实验材料与仪器1、实验材料新鲜组织样品(如肝脏、心脏等)磷酸缓冲液(PBS)三氯乙酸(TCA)硫代巴比妥酸(TBA)2、实验仪器离心机恒温水浴锅分光光度计移液器容量瓶试管四、实验步骤1、样品制备称取适量的新鲜组织样品,加入预冷的 PBS 缓冲液,在冰浴条件下匀浆。
将匀浆液转移至离心管中,在 4℃下以 10000rpm 离心 10 分钟。
吸取上清液,即为样品提取液。
2、反应体系的制备取两支试管,分别标记为测定管和对照管。
向测定管中加入 2ml 样品提取液和 2ml 06% TBA 溶液。
向对照管中加入 2ml 蒸馏水和 2ml 06% TBA 溶液。
3、反应条件将测定管和对照管放入沸水浴中加热 15 分钟,然后迅速取出并冷却至室温。
4、离心将冷却后的测定管和对照管以 3000rpm 离心 10 分钟,以去除沉淀。
5、吸光度测定以蒸馏水为空白对照,在 532nm 波长处分别测定测定管和对照管的吸光度值,分别记为 A1 和 A2。
五、计算方法MDA 含量(nmol/ml)= 645×(A1 A2) 056×A0其中,A0 为空白对照管的吸光度值。
六、实验结果将测定得到的吸光度值代入上述公式,计算出样品中的MDA 含量。
|样品编号|吸光度值(A1)|吸光度值(A2)| MDA 含量(nmol/ml)||||||| 1 |_____ |_____ |_____ || 2 |_____ |_____ |_____ || 3 |_____ |_____ |_____ |七、结果分析1、比较不同样品之间 MDA 含量的差异,分析可能的原因。