
操作过程
在1000mL带有搅拌的高压釜内加入3,3’-二氯联苯胺盐酸盐32.5g,氯化亚铜1g,铜粉0.3g,七水合硫酸亚铁2g,碳酸铵0.3g,28%的氨水155mL,密闭高压釜,通入氮气置换三次。向釜内通入约22g液氨,升温于200~210℃,控制釜内压力为4~5Mpa(s),搅拌反应18小时,反应结束后,冷至室温,打开高压釜,加入10g九水合硫化钠,密闭高压釜,升温至120℃保温1小时,降至室温,向其中加入约42mL浓盐酸调PH=2,过滤出少量沉淀,滤液减压浓缩至结晶析出,加入100mL浓盐酸,冷冻结晶,过滤,烘干得产品约40g,紫白色的固体,收率:90%
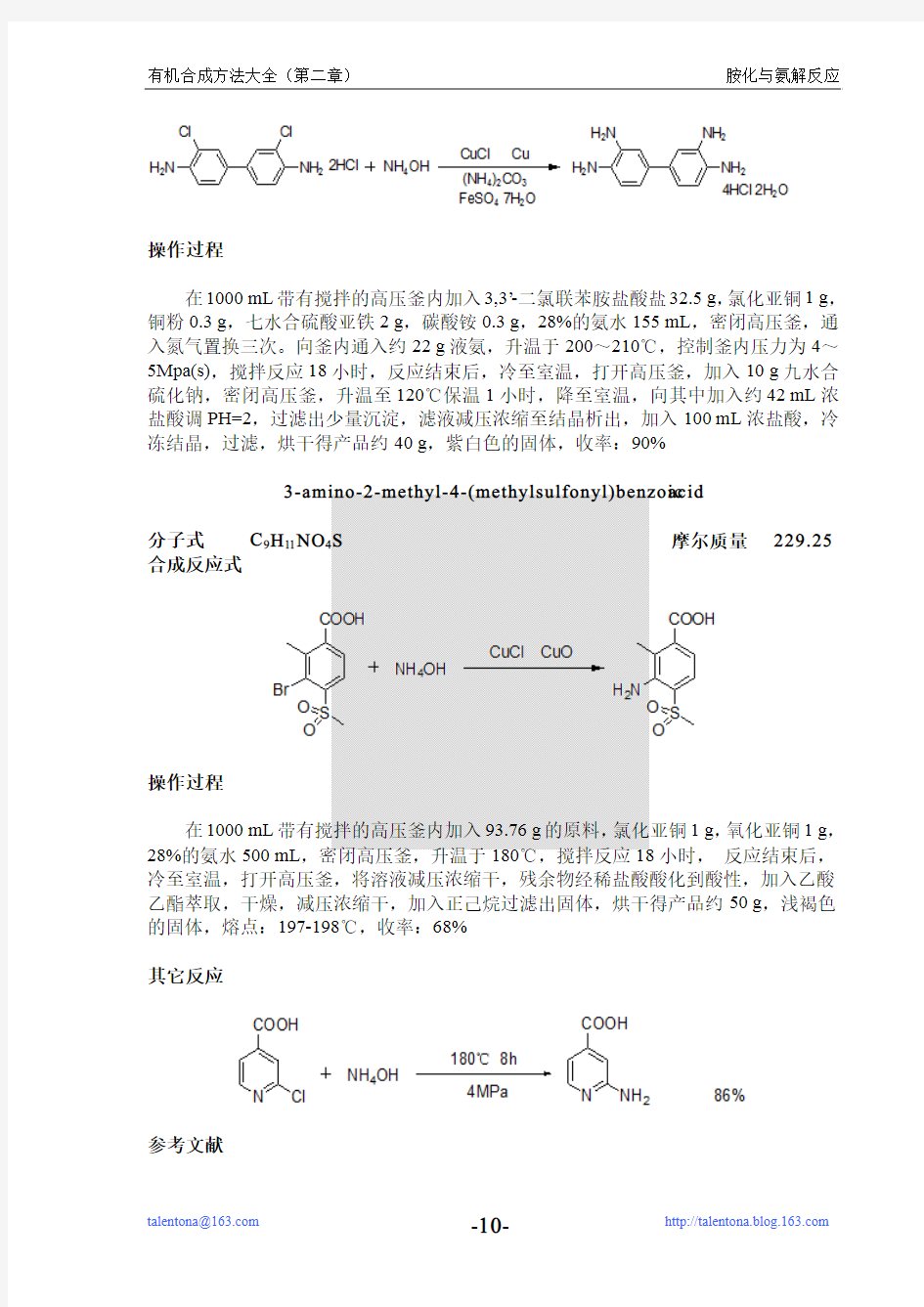
3-amino-2-methyl-4-(methylsulfonyl)benzoic acid
分子式C9H11NO4S摩尔质量229.25合成反应式
操作过程
在1000mL带有搅拌的高压釜内加入93.76g的原料,氯化亚铜1g,氧化亚铜1g,28%的氨水500mL,密闭高压釜,升温于180℃,搅拌反应18小时,反应结束后,冷至室温,打开高压釜,将溶液减压浓缩干,残余物经稀盐酸酸化到酸性,加入乙酸乙酯萃取,干燥,减压浓缩干,加入正己烷过滤出固体,烘干得产品约50g,浅褐色的固体,熔点:197-198℃,收率:68%
其它反应
参考文献
参考文献
[1]Jack(Jianhua)Cao unpublished result
[2]Chand,Pooran;Kotian,Pravin L.;Morris,Philip E.;Bantia,Shanta;Walsh,David A.;
Babu,Yarlagadda S.;Bioorganic&Medicinal chemistry,13(7),2005,2665-2678
2.1.8用六亚甲基四胺(乌络托品)制备
(4-bromophenyl)methanamine
分子式C7H8BrN摩尔质量186.05合成反应式
操作过程
向500mL反应瓶内加入15.4g乌络托品和120mL的氯仿,油浴升温于50℃,开始滴加25g的对溴溴苄,搅拌反应24小时后,反应结束后,冷至室温,过滤,得中间体,将中间体加入250mL反应瓶内,搅拌下加入73mL的浓盐酸,升温回流并蒸出,收集馏出物,向其中加入约50mL的40%氢氧化钠水溶液,分出油层,水层用THF 萃取,合并干燥,减压浓缩干,得产品约15.8g,黄色的油状物,收率:85%
2.1.9二苄基胺为胺化试剂
N,N-dibenzyl-2-chloro-5H-pyrrolo[3,2-d]pyrimidin-4-amine
分子式C20H17ClN4摩尔质量348.83
合成反应式
操作过程
第二章胺化与氨解反应
用氨或伯胺、仲胺与有机物作用生成胺的过程称为氨解胺化反应。氨解有时也称为“胺化”或“氨基化”,但是氨与双键加成生成胺的反应则只能叫氨化不能称为氨解。氨解胺化反应包括:卤基的置换、磺基的置换、羟基的置换、羰基的氢化氨解等。
2.1卤代物的胺化
2.1.1用邻苯二甲基酰亚胺钾盐制备
(4-(isoxazol-5-yl)phenyl)methanamine
分子式C10H10N2O摩尔质量174.20
合成反应式
操作过程
向250mL反应瓶内,投入2.38g原料和20mL的DMF,缓慢升温至80℃,搅拌下分批加入1.85g的邻苯二甲酰亚胺钾盐,在80℃反应2小时,用TLC点板(EA /PE=1:1)跟踪反应终点,降至室温,倾入冰水中,过滤,得中间体3g 将中间体投入100mL反应瓶内,加入60mL的乙醇,再加入1.85g的水合肼(80%),升温回流反应3小时,有大量白色固体析出,降至室温,过滤,滤液减压浓缩干,得产品1.55g,黄色油状物,收率:90%
其它反应
参考文献
[1]Kuramochi Takahiro,Kakefuda Akio,Yamada Hiroyoshi,Tsukamoto Issei,Taguchi
Taku,Sakamoto Shuichi;Bioorganic&Medicinal Chemistry,2005,13(12),
4022-4036
[2]Ambroise Yves,Pillon Florence,Mioskowski Charles,Valleix Alain,Rousseau
Bernard;European https://www.doczj.com/doc/515891375.html,.Chem.,2001,20,3961-3964
2.1.2Hetero Cross-Coupling反应制备
Ethyl5-(3-(benzyloxy)pyrrolidin-1-yl)-1-((2-methoxyethoxy)methyl)-
1H-indazole-3-carboxylate
分子式C25H31N3O5摩尔质量453.53
合成反应式
操作过程
在100mL封管内,投入3.57g的原料和20mL干燥的甲苯,在氮气保护下加入0.022g的醋酸钯及0.05g的R-BINAP,再加入9.7g的无水碳酸铯,密封好封口,油浴控温升温至120℃,保温反应12小时后,降至室温,过滤,滤液减压浓缩干,过硅胶柱分离纯化,得产品4.1g,淡黄色油状物,收率:91%
其它反应
此反应常用溶剂:Toluene,1,4-dioxane,DME,DMF,pyridine,NMP,t-BuOH,THF
此反应常用的碱:t-BuONa,EtONa,NaH,Cs2CO3,CsHCO3,DBU,LiN(TMS)2,DMF,K3PO4此反应常用的催化剂:PdCl2,Pd(OAc)2,Pd2(dba)3,CuI
此反应常用的配体:
1-(pyridin-3-yl)pyrrolidin-5-cyclohexane-2-one
分子式C14H18N2O摩尔质量230
合成反应式
操作过程
在500mL三口反应瓶内,投入15.3g的原料和350mL干燥的甲苯,在氮气保护下加入16g的3-溴吡啶及0.95g的碘化亚铜,再加入65.2g的无水碳酸铯,再加入1 mL的二甲基乙二胺,升温回流反应12小时后,降至室温,过滤,滤液减压浓缩干,过硅胶柱分离纯化,得产品20.5g,淡黄色结晶,收率:90%
其它反应
共60页
此反应常用溶剂:Toluene,1,4-dioxane,DME,DMF,pyridine,NMP,Et3N等
此反应常用的碱:Cs2CO3,K2CO3,KHMDS,NaOtBu,KOtBu,K3PO4,tert-Butyliminotris
(pyrrolidino)phosphorane等
此反应常用的催化剂:Cu,CuI,CuCl,CuSCN,Cu2O,CuCl2,CuSO4.5H2O,CuO,Cu(OAc)2,Cu(acac)2此反应常用的配体:
参考文献
[1]Jiang,Buchwald Metal-catalyzed Cross-Coupling Reactions;2004,2nd Ed,V ol2,Ch13,
699
[2]Hartwig in Handbook of Organopalladium Chemistry for Organic synthesis,Ch III.3.2,
2002
[3]Schlummer,B.Scholz,U.Adv.Synth.Catal.,2004,346,1599-1626
[4]Tanoury,Senanayake,T etr.Lett.,1998,39,6845
[5]Hartwig,J.Am.Chem.Soc.,2001,123,12905
[6]Blackmond,Buchwald,J.Am.Chem.Soc.,2003,125,13978
[7]Shuji Hirano,Yasuhiro Fukudome,Ryoichi Tanaka,Fumie Sato and Hirokazu Urabe,
T etrahedron,2006,62,3896-3916
[8]Artis Klapars,Xiaohua Huang,and Stephen L.Buchwald,J.AM.Chem.Soc.,2002,
124,7421-7428
[9]Ch.Venkat Reddy,Jesudoss V.Kingston,and John G.Verkade,https://www.doczj.com/doc/515891375.html,.Chem.,2007,
XXX,A-P
2.1.4用对甲基苯磺酰胺制备
1-tosyl-2,5-dihydro-1H-pyrrole
分子式C11H13NO2S摩尔质量223.29
合成反应式
操作过程
向250mL反应瓶内,投入12.5g的原料和18.8g的对甲苯磺酰胺,再加入125 mL的DMF,搅拌下分批加入8.36g的NaH(60%,95%),并于室温搅拌反应1小时,用TLC点板跟踪反应终点,反应完后,倾入500mL冰水中,搅拌30分钟,过滤,水洗,正己烷洗,得产品21.2g粗品,在乙酸乙酯-乙醇中重结晶,得产品20g,白色粉状固体,熔点:121-122℃,收率:94%
其它反应
参考文献
[1]Heterocycles,V ol.41,No.7,1995,P1393
[2]WO1998/27090,1998
2.1.5用苄胺制备
1-benzyl-2,5-dihydro-1H-pyrrole
分子式C11H13N摩尔质量159.23
合成反应式
分子式C11H13N摩尔质量159.23合成反应式
操作过程
向250mL反应瓶内,投入12.5g的原料和10.7g的苄胺,再加入125mL的甲苯,升温至92℃搅拌反应18小时,用TLC点板跟踪反应终点,反应完后,倾入500mL 冰水中,搅拌30分钟,分出甲苯相,水相用DCM萃取两次,有机相合并,干燥,减压浓缩干,残余物过硅胶柱分离纯化,得产品13.5g,黄色油状物,收率:85%
其它反应
详见内酯的胺化 2.2.1
参考文献
[1]Lunsford,C.D.,Ward,J.W.,Pallotta,A.J.,Tusing,T.W.,Rose,E.K.,and
Murphy,R.S.,J.Med.Chem.,1959,1,76
[2]Mittermair J.(Badische Anilin&Soda-Fabrik Akt.–Ges.)Ger.946,108,August2,
1956;C.A.,1959,53,62519
[3]Kreher,R.and Pawalczyk,H.,T etrahedron Lett.,1966,2591
2.1.6用氨气+氨水制备
Biphenyl-3,3',4,4'-tetraamine
分子式C12H14N44HCl2H2O摩尔质量432.17
合成反应式
选择题Ⅱ: 151. 下列哪一种化合物不能用以制取醛酮的衍生物? (A) 羟胺盐酸盐 (B) 2,4-二硝基苯 (C) 氨基脲 (D) 苯肼 152. 下列哪个化合物不能起卤仿反应? (A) CH 3CH(OH)CH 2CH 2CH 3 (B) C 6H 5COCH 3 (C) CH 3CH 2CH 2OH (D) CH 3CHO 153. 下列哪个化合物可以起卤仿反应? (A) CH 3CH 2CH 2OH (B) C 6H 5CH 2CH 2OH (C) CH 3COCH 2CH 2COCH 3 (D) HCHO 154. 乙醛和过量甲醛在NaOH 作用下主要生成: 主要产物是: (A) (B) 155. (C) (D) 156. 用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案? (A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO (C) C 6H 5MgBr + CH 3CH 2CHO (D) C 6H 5MgBr + CH 3COCH 3 157. : (A) C 6H 5CH 2OH C 6H 5COOH 652COOCOCH 3 (C) C 6H 5CH =CHCOOCOCH 3 (D) C 6H 5CH =CHCOOH 158. 在稀碱作用下,下列哪组反应不能进行羟醛缩合反应? (A) HCHO + CH 3CHO (B) CH 3CH 2CHO + ArCHO (C) HCHO + (CH 3)3CCHO (D) ArCH 2CHO + (CH 3)3CCHO 159. 三聚氰胺甲醛树脂常用于制造贴面板,合成原料是: (A) 三聚氰胺与甲醛 (B) 三聚异氰酸与甲胺 (C) 尿素与甲醛 (D) 尿素 + 丙二酸酯 160. 有些醛类化合物可被一些弱氧化剂氧化.Fehling 试剂指的是: (A) AgNO 3和NH 3(H 2O)生成的溶液 (B) CuSO 4溶液与NaOH 和酒石酸钾钠生成的溶液 (C) CuSO 4溶液与NaOH 和柠檬酸生成的溶液 (D) CuSO 4与NH 3水的溶液 161. 氢化铝锂和硼氢化钠都是常用的氢化金属络合物,当用它们还原醛或酮时,分子中的四个氢原子都能进行反应,这类反应的特点是: (A) 能产生氢正离子 (B) 能产生氢负离子 (C) 能产生氢自由基 (D) 铝或硼提供电子 162. 下列四个反应,哪一个不能用来制备醛: (A) RMgX + (① HC(OEt)3,② H + /H 2O) (B) RCH 2OH + CrO 3/H 2SO 4 蒸馏 (A) (HOCH 2)3CCHO (B) C(CH 2OH)4 (C) CH 3CH CHCHO (D) CH 3CHCH 2CHO OH O CH 3(C 6H 5)2C CH 3 C C 6H 5O C CH 3C 6H 5OH (CH 3)2C C 6H 5CH 3C C 6H 5(CH 3)2C C(C 6H 5)2 C 6H 5CCH 3 O C 6H 5CHO +(CH 3CO)2O
其他现代有机合成方法技术
7.1.2微波有机合成装置 反应容器一般采用不吸收微波的玻璃或聚四氟乙烯材料 微波干法合成反应技术Villemin 以无机固体为载体的无溶剂有机反应。 将有机反应物浸渍在氧化铝、硅胶、粘土、硅藻土或高岭石等多孔性无机载体上,干燥后置于密封的聚四氟乙烯管进行反应 中,进行反应 反应结束后,产物用适当溶剂萃取后再纯化。 无机固体载体不吸收2450MHz的微波,而吸附在固体介质表面的羟基、水或极性分子则可强烈地吸收微波,从而使这些附着的分子被激活,反应速率大大提高。7.1.3微波技术在有机合成中的应用 微波辐照下的有机反应速率较传统的加热方法快数倍、数十倍甚至上千倍,并且具有操作方便、产率高及产品易纯化等优点 研究过并取得了明显加速效果的有机合成反应有:Diels-Alder反应、酯化反应、重排反应、Knoevenagel反应、Perkin反应、苯偶姻缩合、Reformatsky反应、Deckmann反应、缩醛(酮)反应、Witting反应、羟醛缩合、开环、烷基化、水解、氧化、烯烃加成、消除反应、取代、成环、环反转、酯交换、酰胺化、催化氢化、脱羧、脱保护、聚合、立 微波照射下50min,产率为82%, 传统加热法达到相近产率需480min 2min内产率可达61%~84% Ln = La, Nd, Sm, Dy, Er
7.1.3.2 Diels-Alder 反应 6i 传统加热法则需90min 87% 6 min 常规条件下反应6h 产率仅14% 传统加热法产率较低(<40%) Claisen 重排 传统方法在200℃反应6h ,产率为85% Firies 重排 7.1.3.4烷基化反应 72% 传统条件下反应12h 产率72% TEBA 为三乙基苄基氯化铵 反应速率较传统方法最多提高了80倍 R = COCH 3, SPh, R’ = Bn,苄基,对氯苄基,间甲氧 基苯基,烯丙基,正丁基:PTC 表示相转移催化剂(phase-transfer catalysis)。 7.1.3.5 环反应 产率与传统方法相比没有明显提高,但极大地简化了产品的分离与提纯过程
第四章习题答案 2 命名下列化合物 (1)2,2,6,6-四甲基-3-庚炔;(2) 4-甲基-2-庚烯-5炔;(3) 1-己烯-3,5-二炔; (4) (Z)-5-异丙基-5-壬烯-1-炔;(5)(2E,4Z)-3-叔丁基-2,4-己二烯 3 写出下列化合物的构造式和键线式,并用系统命名法命名。 (1);1-戊烯-4-炔。 (2) ;(E)-3-戊烯-1-炔;(Z;)-3-戊烯-1-炔。 (3) ;2,2,5,5-四甲基-3-己炔。 (4) ;2,5-二甲基-3-庚炔。,4 写出下列化合物的构造式,并用系统命名法命名之。 (1);2-甲基-5-乙基-3-庚炔; (2);(Z)-3,4-二甲基-4-己烯-1-炔; (3);(2E,4E)-2,4-己二烯; (4);2,2,5-三甲基-3-己炔。 5 下列化合物是否存在顺反异构体,如存在则写出其构造式。 (1)存在,; (2)、(3)无顺反异构体; (4)存在,。
8 写出下列反应的产物; (1);(2) ; (3) ; (4);(5); (6);;H2/Lindlar Pd。 (7) 9 用化学方法区别下列化合物。 (1)将三种化合物中加入Br2,不变色的是1-甲基-丁烷;再将剩下的化合物通入银氨溶液,出现白色沉淀的是3-甲基-1-丁炔,无现象的是3-甲基-1-丁烯。(2)将两种化合物通入银氨溶液,出现白色沉淀的是1-戊炔,现象的是2-戊炔。 11 加入银氨溶液得到沉淀,说明为端炔。 12 CH3CH=CHCH=CHCH3 CH3CHBrCHBrCHBrCHBrCH3 13 不饱和度为2,可能为炔烃或二烯烃,加入银氨溶液无沉淀,说明不是端炔, 再根据加1分子氢气所得产物,可推断化合物结构式为 14 从乙炔出发,合成下列化合物。
第二章 脂烃 思考与练习 2-1同系列和同系物有什么不同?丁烷的两种构造异构体是同系物吗? 同系列和同系物含义不同。同系列是指通式相同,结构相似,在组成上相差一个或多个CH 2基团的一系列化合物的总称,同系物则是指同一系列中的具体化合物。如:烷烃是同系列,烷烃中的甲烷和乙烷互称为同系物。丁烷的两种构造异构体不是同系物。 2-2推导烷烃的构造异构体应采用什么方法和步骤?试写出C 6H 14的所有构造异构体。 推导烷烃的构造异构体时,应抓住“碳链异构”这一关键。首先写出符合分子式的最长碳链式,然后依次缩减最长碳链(将此作为主链),将少写的碳原子作为支链依次连在主链碳原子上。如:C 6H 14存在以下5种构造异构体。 2-3脂烃的涵义是什么?它包括哪些烃类?分别写出它们的通式。 脂烃涵盖脂肪烃和脂环烃。 2-4指出下列化合物中哪些是同系物?哪些是同分异构体?哪些是同一化合物? 同系物:⑴和⑻;⑵、⑶和⑸ 同分异构体:⑴和⑷;⑹和⑺ 同一化合物:⑵和⑶ 2-5 写出下列烃或烃基的构造式。 ⑴ (CH 3)3C — ⑵ ⑶ CH 3CH=CH — ⑷ CH 2=CHCH 2— ⑸ ⑹ ⑺ CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 CH 3CH CH 2CH 2CH 3 CH 3 CH 3 CH 2 CH CH 2 CH 33 CH 3 CH CH CH 33CH 3 CH 3C CH CH 3 CH 3 3 (环烯烃、环炔烃、环二烯烃等) (环烷烃) 不饱和脂环烃饱和脂环烃 二烯烃炔烃烯烃 (烷烃)不饱和烃饱和烃 脂环烃 脂肪烃 脂烃 C n H 2n+2C n H 2n C n H 2n-2C n H 2n-2C n H 2n CH 3CHCH 2CH 3CH 3CHCH 2CH 33 CH 3CCH 2CH 3CH 3 3 CH 2CCH 3 3
有机合成的文化的构成与训练 有机合成题,近几年的江苏高考题中,重现率几乎百分之百,从04年的“由丁二烯通过双烯合成,制备甲基环己烷”到05年的“以溴代甲基环己烷为原料合成6-羰基庚酸”,每年的命题方式、形式略有变化:04年重点在推断物质结构,书写结构简式和化学方程式;05年着重在设计合成流程图,具有新意,但难度太大;06年有所改进。 一、要讲技巧,更要讲思想。 ㈠有机合成的重要意义 有机合成是有机化学的核心。学习和研究有机化学的目的,最终是为了合成自然界已存在的和自然界并不存在而人为设计的具有特定结构,因而具有特定性能和用途的有机化合物以造福人类。现在已经发现的三千多万种物质中,绝大部分是科学家合成的有机物。 在1828年武勒开始有机合成直至本世纪60年代之前,人们一直是从原料开始,逐步经过碳链的连接和官能团的安装最后完成的。但由于没有通用的思维规范,其设计过程往往需要相当丰富的理论和实践经验,十分困难。1964年E.J.Corey首创用逆推的方式设计合成路线,由于他独特的操作方式,高度规范合成设计的程序,并使其具备了相对固定的逻辑思维推理模式,因而易学易用,大大推动了这一学科的发展。E.J.Corey也因此获得了1990年诺贝尔化学奖。 人们对有机产品的研究,已经达到一个较高的水准了。如果预测某种结构的有机物具有某项特殊用途,或特殊性质,接下来的问题就是如何寻找合适的原料,采用合理的合成路线,来合成该物质了,所以有机合成具有广阔前景。 ㈡有机合成路线的设计原则 ①原理正确、步骤简单(产率高) ②原料丰富、价格低廉 ③条件合适、操作方便 ④产物纯净、污染物少(易分离) 二、有机合成题的训练方法 首先要掌握“学情”,对症下药,进行针对性的讲解和训练;其次要用经典的例题,特别是近三年的高考题进行典型引导,以建构有机合成的“模型”;再次要充分利用各类有机框图题,进行逆向思维,即以这类题为“素材”,灵活地进行合成路线的训练。 ㈠学生中存在的问题 ①官能团的引入、消除“硬装斧头柄”。究其原因是学生有机基本反应类型掌握不扎实。 ②步骤先后随心所欲。究其原因是没有很好理解有关官能团的相互影响等知识。 ③合成“绕圈子”看不出是为了保护官能团。究其原因是思路狭窄,没有理解条件对反应进行的影响。 ④题给信息不能很好的吸收应用。究其原因是对题给信息解读不够,审题也不严密。当然,也和教师给学生相关的训练太少有关。不妨把经常出现的信息归纳整理给学生。 ㈡有机合成的常见题型 ①给定原料、指定目标分子,设计合成路线,要求书写化学方程式。 例如:以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH),已知两个醛分子在一定条件下可以自身加成。下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。(Ⅲ)是一种3-羟基醛,此醛不稳定,
第二章烃和卤代烃 课标要求 1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构和性质上的差异。 2.了解天然气、石油液化气和汽油的主要成分及应用。 3.了解卤代烃的典型代表物的组成和结构特点以及它们与其他有机物的相互联系。 4.了解加成反应、取代反应和消去反应。 5.举例说明烃类物质在有机合成和有机化工中的重要作用。 要点精讲 一、几类重要烃的代表物比较 1.结构特点 2、化学性质 (1)甲烷 化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。 ①氧化反应 甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。其燃烧热为890kJ/mol,则燃烧的热化学方程式为:CH4(g)+2O2(g)CO2(g)+2H2O(l);△H=-890kJ/mol ②取代反应:有机物物分子里的某些原子或原子团被其他原子或原子团所替代的反应。 甲烷与氯气的取代反应分四步进行:
第一步:CH4+C l2C H3Cl+HCl 第二步:CH 3Cl+ Cl 2CH 2Cl 2+HCl 第三步:CH2Cl 2+ Cl2CH Cl 3+H Cl 第四步:CHCl 3+Cl 2 CCl 4+HCl 甲烷的四种氯代物均难溶于水,常温下,只有CH 3Cl 是气态,其余均为液态,CH Cl 3俗称氯仿,C Cl 4又叫四氯化碳,是重要的有机溶剂,密度比水大。 (2)乙烯 ①与卤素单质X2加成 CH2=CH 2+X2→CH 2X —CH 2X ②与H2加成 CH 2=CH 2+H 2 CH 3—CH 3 ③与卤化氢加成 C H2=C H2+H X→CH 3—CH 2X ④与水加成 C H2=CH 2+H 2O ?? →?催化剂CH 3CH 2OH ⑤氧化反应 ①常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。 ⑥易燃烧 C H2=CH 2+3O2??→ ?点燃 2CO2+2H 2O现象(火焰明亮,伴有黑烟) ⑦加聚反应 二、烷烃、烯烃和炔烃 1.概念及通式 (1)烷烃:分子中碳原子之间以单键结合成链状,碳原子剩余的价键全部跟氢原子结合的饱和烃,其通式为:Cn H2n+2(n ≥l )。 (2)烯烃:分子里含有碳碳双键的不饱和链烃,分子通式为:CnH2n (n ≥2)。 (3)炔烃:分子里含有碳碳三键的一类脂肪烃,分子通式为:CnH2n -2(n ≥2)。 2.物理性质 (1)状态:常温下含有1~4个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。 (2)沸点:①随着碳原子数的增多,沸点逐渐升高。 催化剂 △
第六部分 有机化学设计性实验
6.1设计性实验总体要求 为了巩固学生基本操作技能训练和所学习的各种有关知识,进一步培养面向21世纪的学生所必备的独立地综合运用所学知识和技能进行科学研究的能力我们安排了多个设计实验的内容。这些实验的内容是要求学生运用已学习过的知识,通过查阅文献,借鉴前人的经验教训,设计出常量或半微量或微型实验的方案,在教师认可后并在教师指导下,自己动手合成某些有实用价值的中间体或化合物。也可以结合教师科学研究的需要,合成一些原料或中间体,通过设计实验进一步培养学生的综合能力,培养学生独立进行研究和创新的能力。 学会查阅文献,包括从多媒体计算机的光盘及计算机网络中查阅并利用古今中外的各种书籍、资料及具代表性的期刊、杂志。但是,要注意的是,各种文献中记载的实验步骤和条件往往彼此不同,有些内容出于保密等原因而不详实,这就要求学生能运用已获得的知识和技能独立地进行正确的判断、综合。通过透彻掌握目标分子的合成原理、主副反应、产物(含副产物)的有关性能(如溶解度、熔点、沸点),设计出可行的实验方案(包括合成路线、使用的原料与试剂、仪器的选用、操作条件的控制、主副产物的分离、产品的精制、鉴定等)。 设计方案经教师审定后,学生独立进行实验。实验用量最好半微量或进行微型实验。
实验后除了要交出产品还应写出设计实验报告。设计实验报告应按小论文形式撰写。其格式可参照一般化学、化工杂志的论文,应当包括题目、作者、提要(摘要)、关键词、实验内容、结果讨论、主要参考文献等栏目。要简要地介绍题目的背景、实验的目的意义,要有实验步骤的精确描述(包括原料的配比和用量、工艺流程和实验条件、有关数据和现象等等),要有实验结果的有关数据(包括产物的产量和收率、产品质量的有关物理参数及文献值、图表、波谱及其他有关数据,等等),要有讨论(包括对实验结果的评价、对实验的改进意见、意外情况的分析及自己的心得体会等)。 教师在设计实验实施的过程中要始终起指导作用。对各设计实验必须都心中有数,为学生独立完成实验提供必要的软硬件支持。在审查学生制定的设计方案时,切不可忽略对安全因素的审查,在安全上要做到万无一失。在实验过程中要观察和评价学生的操作技术正确与否,必要时及时予以纠正。要随时准备解答学生实验中出现的各种问题。总之,在充分体现学生的主体作用的同时,要充分发挥教师的主导作用。
第四章:芳烃 学习指导:1.芳烃构造异构和命名; 2. 环上亲电取代反应:取代反应定位规则(两类定位基,电子效应,空间效应,二取代苯的定位规则,定位规则在有机合成上的应用)卤化,硝化,卤化磺化,烷基化和酰基化; 3. 氧化反应(侧链氧化); 4. 萘环上二元取代反应的定位规则; 一、命名 1、写出的名称。 2、写出的系统名称。 3、写出苯乙炔的构造式。 5、写出反-5-甲基-1-苯基-2-庚烯的构造式。 6、写出的系统名称。 二、完成下列各反应式 1、 2、 3、 ( ) 4、
5、 6、 7、 (CH3)2C==CH2 8、 ( ) 三、理化性质比较题 1、比较下列化合物的稳定性大小: (A) C6H5CH2CH2CH==CH2(B) C6H5CH==C(CH3)2 (C) C6H5CH2CH==CHCH3(D) C6H5CH==CHCH==CH2 2、将苄基正离子(A)、对硝基苄基正离子(B)、对甲氧基苄基正离子(C)和对氯苄基正离子 (D)按稳定性大小排列次序。 3、比较下列自由基的稳定性大小: 4、将下列化合物按硝化反应活性大小排列成序: 5、将下列化合物按亲电取代反应活性大小排列成序: 6、下列哪对异构体的稳定性最接近? 7、比较Fe存在下(A)~(D)位置上氯代的反应活性:
8、比较下列碳正离子稳定性的大小: (A) (C6H5)3C+(B) C6H5CH2+(C) CH3+(D) 9、下列化合物中,哪些不能进行Friedel-Crafts反应? 10、预测下列化合物进行亲电取代反应时,第二个取代基进入苯环的位置。 四、用简便的化学方法鉴别下列各组化合物 1、用简便的化学方法鉴别以下化合物: (A) 苯(B) 甲苯(C) 甲基环己烷 2、用简便的化学方法鉴别以下化合物: 五、用化学方法分离或提纯下列各组化合物。 用简便的化学方法除去环己烷中的少量甲苯。 六、有机合成题 1、以甲苯和乙炔为原料(无机试剂任选)合成: 2、完成转化: 3、以甲苯和2-丁醇为原料(无机试剂任选)合成: 七、推导结构题 1、某烃A的分子式为C9H10,强氧化得苯甲酸,臭氧化分解产物有苯乙醛和甲醛。推测A的构造。 2、某芳烃A含九个碳原子,其余为氢原子,相对分子质量为120。A不能使溴的四氯化碳溶液褪色,硝化后只得到两种一元硝基化合物B和C。B和C分别用高锰酸钾氧化后得
吡咯烷类化合物的合成 背景:吡咯烷即四氢吡咯,具有弱碱性,分子式为C4H9N,为无色至黄色液体,有刺鼻气味,避光密封保存,用作医药原料、有机合成、特殊有机溶剂。其取代物具有很广泛的用途,例如l-Boc一3一氰基4-吡咯烷酮是一种药物的中间体,1一正丙基一2一吡咯烷 酮是一种重要的与水互溶的有机溶剂,吡咯烷-2,3,5-三酮是合成稠杂环化合物的重要中间体等。因此研究这类物质的合成方式,提高合成的产率对药物合成很有帮助。 摘要:吡咯烷酮的合成一般都需要依靠氮原子的孤对电子,由于孤对电子的存在,与氮原子连着的氢都比较活泼,容易发生加成反应或取代反应。而环化反应使合成路线中最重要的一步,环化反应的类别多种多样,有通过周环反应环化,也有消去反应。但由于合成路线较长,总体上讲收率都不太高。 本文将以3种吡咯烷类化合物为例讲述吡咯烷类化合物合成的几种思路。 (1)合成N-取代的吡咯烷酮 ①由γ -丁内酯与脂肪烃伯胺在高温、高压条件下,经过一步合成N一取代的吡咯烷酮衍生物是目前工业生产上应用最多、最广泛的合成方法。反应第一阶段是γ -丁内酯与脂肪烃伯胺生成4一羟基一N一烷基丁酰胺;第二阶段是脱水生成N一烷基取代的吡咯烷酮,两阶段反应可在反应器中连续进行,中间体不需要分离。 以N-辛基吡咯烷酮为例,反应历程为两部,首先是胺化开环,胺化开环实际上是伯胺对γ -丁内酯进行的亲核加成反应,形成开环产物的一个过程。γ -丁内酯分子内羰基O原子受氢离子影响带上部分负电荷,加上羰基本身的吸电子效应,使得羰基C原子带上部分正电荷而被活化,碱性较强的伯胺分子以N原子进攻被活化的羰基C原子发生亲核加成反应,生成链状酰胺,完成胺化开环过程,水可作为该开环过程的催化剂。 其次是缩合闭环,缩合闭环是由链状羟基丁酰胺脱水缩合成为五元环的过程。理论上说是由非稳态转变为稳态的过程,应该是一个自发过程,但是本文中缩合闭环要比胺化开环困难得多,这可能是中间体羟基丁酰胺变为相应的吡咯烷酮时需要越过的能垒△E值较大。采用有效的催化剂(合成过程中生成的水)可以降低此活化能,通过降低△E值引发缩合闭环反应,而反应中生成的水也会促进闭环反应。化学式如下页图:
“有机合成路线的设计” 一、借用各类有机物之间的相互转化关系进行有机顺合成线路的设计: 1)从石油(C8H18)出发的顺合成图 2)从天然气(甲烷)出发的顺合成图 3)、从粮食(淀粉)出发的顺合成图 4)、从甲苯出发的顺合成图 5)、(1)一元合成路线:RCH=CH2→一卤代烃→一元醇→一元醛→一元羧酸→酯 (2)二元合成路线:RCH=CH2→二卤代烃→二元醇→二元醛→二元羧酸→酯(链酯、环酯、聚酯) 。 (3) CH3 【归纳】有机顺合成策略:借助各种有机物之间的相互转化关系从原料开始,利用发散性思维顺向而行完成有机顺合成路线的设计;符合绿色环保意识 二、有机逆合成 1、知识准备 (1)、官能团的引入法 ①羟基的引入——从不同反应类型分析; ②卤原子的引入——从加成到取代、从引一个卤原子到引2个卤原子有序分析; ③C=C双键的引入——从消去到加成有序分析; ④羰基的引入——从醇的氧化分析; ⑤羧基的引入——从醛的氧化到酯、肽键的水解; (2)官能团的消除法 ①经从加成反应消除不饱和键 ②经取代、消去、酯化、氧化等反应消去-OH ③经加成或氧化反应消除-CHO ④经水解反应消去酯基。 ⑤经过水解、消去反应消去-X (3)、碳骨架的增减法——引导学生分析下列所给材料,判定在合成信息中比较常见的增减方法:大多通过高温或氧化缩短碳骨架;通过加成增长碳骨架; (1)增长碳链的方法: ①不饱和化合物间的加成、聚合(如乙烯→聚乙烯)、不饱和烃与HCN的加成后水解等。 ②酯化反应(如乙酸与乙醇转化为乙酸乙酯等)。
③有机合成题中碳链的增长,也有可能以信息给出,此类问题中应高度重视反应物与产物中的碳原子数的比较及连接位置关系等。 例1:溴乙烷跟氰化钠反应后再水解可以得到丙酸:CH3CH2Br NaCN CH3CH2CN H2O CH3CH2COOH 例2:已知格氏试剂的合成方法是:(Grignard试剂)。格氏试剂是有机合成中用途很广的一种试剂,可用来合成烷烃、烯烃、醇、醛、酮、羧酸等一系列化合物。如: 例3:醛可以发生分子间的反应,生成羟基醛。如: (2)缩短碳链的方法,其方法主要有:①烃的裂化裂解(石油的裂化、裂解)。②某些烃的氧化(如苯的同系物、烯烃等),例:③羧酸的脱羧反应。④酯的水解反应 例题.写出用和饱和食盐水制乙二酸乙二醋的化学方程式。(利用实验室制甲烷和苯的脱羧反应) 练.1请以乙烯为原料制备草酸二乙酯,设计合成线路。 ?R—R+2NaX 试以苯、2.一卤代烃RX与金属钠作用,可增加碳链制高级烷,反应如下:2RX+2Na?→ 乙炔、Br2、HBr、钠主要原料,制取 (4)官能团的保护法 为防一OH被氧化可先将其酯化 为保护C=C不受氧化可先将其与HBr加成或与水加成 在含有C=C和-CHO的化合物中欲用溴水检验C=C,应先将-CHO用弱氧化剂(银氨溶液、新制Cu(OH)2) 氧化等。 1.如何以丙烯醇(CH2=CH—CH2OH)为原料合成丙烯酸(CH2=CH—COOH)?设计合成线路。 2.怎样以H2O、H218O、空气、乙烯为原料制取CH3C18OOCH2CH3?写出设计合成线路。 3.写出以CH2ClCH2CH2CH2OH为原料制备的各步反应方程式(必要的无机试剂自选)。 2、初步尝试有机逆合成线路的设计方法
第七章醇酚醚 学习指导: 1.醇的构造,异构和命名; 2.饱和一元醇的制法:烯烃水合,卤烷水解,醛、酮、羧酸酯还原和从Grignard试剂制备; 3.饱和一元醇的物理性质:氢键对沸点的影响; 4. 饱和一元醇的化学性质:与金属的反应;卤烃的生成,酸的催化醚作用;与无机酸的反应;脱水反应;氧化与脱氢; 5. 二元醇的性质(高碘酸的氧化,频哪醇重排); 6.酚结构和命名;制法(从异丙苯,芳卤衍生物,芳磺酸制备); 7.化学性质:酚羟基的反应(酸性,成酯,成醚);芳环上的反应(卤化,硝化,磺化);与三氯化铁的显色反应; 8. 取代基对酚的酸性的影响。 9、醚(简单醚)的命名、结构; 10、醚的制法:醇脱水,Williaman合成法; 11、环氧乙烷的性质:与水、醇、氨、Grignard试剂的作用; 12、环醚的开环反应规律;醇、酚与醚等其他有机物在一定条件下相互转化的规律。 习题 一、命名下列各物种或写出结构式。 1、写出4-甲基-2-戊醇的构造式。 2、写出的系统名称并写成Fischer投影式。 3、写出的系统名称。 4、写出的系统名称。 5、写出乙基新戊基醚的构造式。 6、写出3-乙氧基-1-丙醇的构造式。 7、写出的名称。8、写出的系统名称 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、 3、
4、 5、 6、 7、 8、 9、 10、 11、 12、 三、理化性质比较题(根据题目要求解答下列各题)。 1、将下列化合物按与金属钠反应的活性大小排序: (A) CH3OH (B) (CH3)2CHOH (C) (CH3)3COH 2、下列醇与Lucas试剂反应速率最快的是: (A) CH3CH2CH2CH2OH (B) (CH3)3COH (C) (CH3)2CHCH2OH 3、将下列化合物按沸点高低排列成序: (A) CH3CH2CH3(B) CH3Cl (C) CH3CH2OH 4、比较下列醇与HCl反应的活性大小:
智慧树知到《有机合成化学》章节测试答案 第一章 1、有机镁试剂中碳是负电性的,具有强的亲核性。 对 错 答案: 对 2、由于醛反应活性高,一般较难直接制备,因此N,N-二取代甲酰胺与有机镁试剂的反应常用于合成醛。 对 错 答案: 对 3、有机镁试剂与α,β-不饱和醛酮的反应主要生成1,4-加成产物。 对 错 答案: 错 4、有机锂试剂与醛酮反应受空间位阻影响较大。 对 错 答案: 错 5、1 mol羧酸能与2 mol有机锂试剂反应生成酮。 对 错 答案: 对
6、有机锂试剂与烯烃双键发生反应时,只能孤立双键反应而不能与共轭双键反应。 对 错 答案: 错 7、具有顺反异构的烯基卤化物与有机铜试剂发生偶联反应后,双键构型保持不变。 对 错 答案: 对 8、有机锌试剂易燃、易氧化。许多反应中,有机锌试剂都需要现制现用,使用有机锌试剂的反应都需要在惰性气体保护下进行。 对 错 答案: 对 9、α-卤代酸酯可以与镁反应生成格氏试剂,也可以与锌形成有机锌化合物。 对 错 答案: 错 第二章 1、β-酮酸酯的活泼亚甲基的烃化产物有两种水解方式:稀碱溶液中为成酮水解;浓碱溶液中为成酸水解。 对 错 答案: 对
2、只连有一个吸电子基团的亚甲基化合物的酸性一般很弱,要使其完全转变为碳负离子,必须使用很强的碱,反应可以醇作为溶剂。 对 错 答案: 错 3、对于可生成两种碳负离子的酮,在动力学控制条件下,烃化反应主要生成在位阻较小部位烃化的产物。 对 错 答案: 对 4、利用Claisen-Schmidt缩合反应可以合成防日光制品的原料联苯乙烯酮。 对 错 答案: 对 5、Michael加成反应是指亲核的碳负离子与α,β-不饱和化合物在碱性催化剂作用下发生的共轭加成反应。 对 错 答案: 对 6、Perkin反应产物为较大基团处于反位的烯烃。 对 错 答案: 对
第二章脂烃 思考与练习 2-1同系列和同系物有什么不同? 丁烷的两种构造异构体是同系物吗? 同系列和同系物含义不同。同系列是指通式相同,结构相似,在组成上相差一个或多个 CH 2基团的一系列化合物的总称,同系物则是指同一系列中的具体化合物。 女口:烷烃是同系 列, 烷烃中的甲烷和乙烷互称为同系物。丁烷的两种构造异构体不是同系物。 2-2推导烷烃的构造异构体应采用什么方法和步骤?试写出 C 6H 14的所有构造异构体。 推导烷烃的构造异构体时,应抓住“碳链异构”这一关键。首先写出符合分子式的最长碳 链式,然后依次缩减最长碳链(将此作为主链) ,将少写的碳原子作为支链依次连在主链碳原 子上。如: C 6H 14存在以下5种构造异构体。 CH 3- CH 2- CH 2- CH 2- CH 2- CH 3 CH 丁 CH —CH 2一CH 2~ CH 3 CH 3 CH 3- CH 2- CH - CH 2- CH 3 1 CH 3 CH 3- CH -CH -CH 3 I I CH 3 CH 3 CH 3 I CH^^_ CH —CH 3 CH 3 2-3脂烃的涵义是什么?它包括哪些烃类?分别写出它们的通式。 脂烃涵盖脂肪烃和脂环烃。 饱和烃(烷烃) 丿 r 烯烃 不饱和烃 炔烃 二烯烃 饱和脂环烃(环烷烃) 不饱和脂环烃(环烯烃、 2-4指出下列化合物中哪些是同系物?哪些是同分异构体?哪些是同一化合物? 同系物:⑴和⑻;⑵、⑶和⑸ 同分异构体:⑴和⑷;⑹和⑺ 同一化合物:⑵和⑶ 2-5写出下列烃或烃基的构造式。 CH 3CHCH 2CH 3 ⑶ CH 3CH=CH — CH 3 ⑹ CH 3CCH 2CH 3 CH 3 C n H 2n+2 C n H 2n C n H 2 n-2 C n H 2 n-2 C n H 2n ⑴(CH 3)3C —⑵ ⑸ CH 3CHCH 2CH 3 CH 3 ⑷ CH 2=CHCH 2— ⑺ CHy CCH 3 CH 3
第七章 有机合成的设计
7.1 有机合成设计的两种思考方法 7.2 逆向合成分析的常用符号和术语 7.3 切断与合成子 7.4 有机合成设计中的策略 7.5 合成路线的选择 7.6 有机合成设计示例
7.1 有机合成设计的两种思考方法
有机合成的设计两种思考方法 有机合成的设计两种思考方法: 两种思考方法 正向合成设计 其思维程序可概括为:原料→中间产物→产品。 其思维程序可概括为:原料→中间产物→产品。 逆向合成设计 逆向合成设计 其思维程序可概括为:产品→中间产物→ 其思维程序可概括为:产品→中间产物→原料 关键: 碳骨架的变化②官能团的改变。 (关键:①碳骨架的变化②官能团的改变。)
维生素B 维生素 12
H3C CH3 H3C NC
NH
H C H3C 3 CH3 NC (B2O)2O S
N
维生素B 维生素 12前体的合成
H3C CH3 O C6H6, r.t. 72% H
N N
H C H3C 3 CH3 NC
过氧化苯甲酰 氧化
N
S S H 2C
N
H
S CH CH3 CH3
内硫酰胺
二硫化物
环化、开环、脱硫 开环、
R3P, N2, 130 C 84%
NC CH3 H3C H3C H C H3C 3 CH3 NC
N
环酰基烯胺
H3C H2C
N
O
硫醚中间体 硫醚中间体
CH3
t-BuOK, 80 C CH 88% H
H
N
联四环前体
CH
N
O H3C H2 C CH3
NH O
CH3 CH3
脱氢氰酸
O H3C CH3 H3C NC
NH
CH3 CH3 P2S 5 H3C CH3 H3C NC
NH
KCN, KHCO3, H2O 90%
酰基硫代
S
O
82%
环酰基烯胺
胺氰
内硫酰胺
有机合成教学设计 一、教材分析 有机合成是高考难点题型之一,实质是利用有机物的性质,进行必要的官能团反应。要求学生熟练掌握好各类有机物的组成、结构、性质、相互衍生关系以及重要官能团的引入和消去等基础知识。在前三节的学习中,学生掌握了醇、酚、醛、羧酸、酯等含氧衍生物的结构特点、物理性质、化学性质以及用途等方面的知识。学生的逻辑思维能力以及信息迁移能力有了显著提高 , 通过本节课的学习 , 学生将会认识到合成的有机物与人们生活的密切关系 .对学生渗透热爱化学、热爱科学的思想教育;通过有机物逆合成分析法的推理,进-步培养学生逻辑思维能力以及信息的迁移能力。 二、学生分析 1.学生已有知识分析:各类有机物的性质 2.学生思维能力水平分析:要充分运用正向思维和逆向思维方法 , 掌握有机合成的解题方法 , 特别是逆向合成分析法。通过教材例题掌握逆合成分析法的解题思路,并能熟练运用。 三、新课程标准 1、举例说明烃类物质在有机合成和有机化工中的重要作用; 2、认识卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点,知道它们的转化关系 四、教学目标 1.知识与技能目标 能列举碳链增长和引入碳碳双键或三键、卤原子、醇羟基、酚羟基、醛基和羧基的化学反应。并能写出相应的化学方程式。 2.过程与方法目标 了解合成路线设计的一般思路;知道合成关键为构建碳骨架和引入所需官能团。 3.情感态度与价值观目标 认识有机合成对人类生产、生活的重要影响;赞赏有机化学家们为人类社会所做的重要贡献;知道绿色合成思想是选择合成路线的重要原则。 五、教学重点与难点 1.知识与技能上重难点 在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
选择题Ⅱ: 151. 下列哪一种化合物不能用以制取醛酮的衍生物? (A) 羟胺盐酸盐 (B) 2,4-二硝基苯 (C) 氨基脲 (D) 苯肼 152. 下列哪个化合物不能起卤仿反应? (A) CH 3CH(OH)CH 2CH 2CH 3 (B) C 6H 5COCH 3 (C) CH 3CH 2CH 2OH (D) CH 3CHO 153. 下列哪个化合物可以起卤仿反应? (A) CH 3CH 2CH 2OH (B) C 6H 5CH 2CH 2OH (C) CH 3COCH 2CH 2COCH 3 (D) HCHO 154. 乙醛和过量甲醛在NaOH 作用下主要生成: 主要产物是: (A) (B) 155. (C) (D) 156. 用格氏试剂制备1-苯基 -2-丙醇,最好采用哪种方案? (A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO (C) C 6H 5MgBr + CH 3CH 2CHO (D) C 6H 5MgBr + CH 3COCH 3 157. : (A) C 6H 5CH 2OH C 6H 5COOH 652COOCOCH 3 (C) C 6H 5CH =CHCOOCOCH 3 (D) C 6H 5CH =CHCOOH 158. 在稀碱作用下,下列哪组反应不能进行羟醛缩合反应? (A) HCHO + CH 3CHO (B) CH 3CH 2CHO + ArCHO (C) HCHO + (CH 3)3CCHO (D) ArCH 2CHO + (CH 3)3CCHO 159. 三聚氰胺甲醛树脂常用于制造贴面板,合成原料是: (A) 三聚氰胺与甲醛 (B) 三聚异氰酸与甲胺 (C) 尿素与甲醛 (D) 尿素 + 丙二酸酯 160. 有些醛类化合物可被一些弱氧化剂氧化.Fehling 试剂指的是: (A) AgNO 3和NH 3(H 2O)生成的溶液 (B) CuSO 4溶液与NaOH 和酒石酸钾钠生成的溶液 (C) CuSO 4溶液与NaOH 和柠檬酸生成的溶液 (D) CuSO 4与NH 3水的溶液 161. 氢化铝锂和硼氢化钠都是常用的氢化金属络合物,当用它们还原醛或酮时,分子中的四个氢原子都能进 行反应,这类反应的特点是: (A) 能产生氢正离子 (B) 能产生氢负离子 (C) 能产生氢自由基 (D) 铝或硼提供电子 162. 下列四个反应,哪一个不能用来制备醛: (A) (HOCH 2)3CCHO (B) C(CH 2OH)4 (C) CH 3CH CHCHO (D) CH 3CHCH 2CHO OH O CH 3(C 6H 5)2CH 3 C 6H 5O C CH 3C 6H 5OH (CH 3)2C C 6H 5CH 3C C 6H 5(CH 3)2C C(C 6H 5)2C 6H 5CCH 3O C 6H 5CHO +(CH 3CO)2O
选修5有机化学基础第二章测试题 说明:本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分;答题时间40分钟. I卷(共48分) 一、选择题(每小题只有一个正确答案,每小题4分,共48分) 1.下列事实、事件、事故中与甲烷有无关的是() A.天然气的主要成分B.石油经过催化裂化及裂解后的产物 C.“西气东输”中气体D.煤矿中的瓦斯爆炸 2.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是()A.丙烷与氯气在光照的作用下生成氯丙烷的反应 B.乙烯与溴的四氯化溶液生成溴乙烷的反应 C.乙烯与水生成乙醇的反应 D.乙烯自身生成聚乙烯的反应 3.加成反应也是有机化学中的一类重要的反应类型,下列各组物质中不能全部发生加成反应的是() A.乙烷、乙烯B.乙烯、乙炔 C.氯乙烯、溴乙烯D.顺-2-丁烯、反-2-丁烯 4.相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,需要空气量的比较中正确是() A.烷烃最多B.烯烃最多 C.炔烃最多D.三者一样多 5. 关于苯的下列说法中不正确的是() A.组成苯的12个原子在同一平面上 B.苯环中6个碳碳键键长完全相同 C.苯环中碳碳键的键能介于C-C和C=C之间 D.苯只能发生取代反应 6.不能使酸性高锰酸钾溶液褪色的是() A.乙烯B.乙炔C.苯D.甲苯
7.根据下列物质的名称,就能确认是纯净物的是( ) A .溴乙烷 B .二溴乙烷 C .已烯 D .二甲苯 8.下列烃中,苯环上的一氯代物没有同分异构体的是( ) A .甲苯 B .邻二甲苯 C .间二甲苯 D .对二甲苯 9.下列物质中,属于芳香烃且属于苯的同系物的是 ( ) A . B . C . D . 10. 若1 mol 某气态烃CxHy 完全燃烧,需用3 mol O 2,则( ) A .x = 2,y =2 B .x = 2,y =4 C .x = 3,y =6 D .x =3,y =8 11. 能够鉴定氯乙烷中氯元素的存在的操作是 ( ) A .在氯乙烷中直接加入AgNO 3溶液 B .加蒸馏水,充分搅拌后,加入AgNO 3溶液 C .加入NaOH 溶液,加热后加入稀硫酸酸化,然后加入AgNO 3溶液 D .加入NaOH 的乙醇溶液,加热后加入AgNO 3溶液 12. 下列各组混合气体中,比乙烯含碳量高的是( ) A .甲烷和丙烯 B .乙烷和丁烯 C .环丙烷与丙烯 D .丙烯与丙炔 CH=CH 2C 2H 5C CH C CH
《有机合成设计》课程论文 学院:化学工程学院 专业班级:应用化学10-x班 学号:2010302136 学生姓名:xxx 二O一三年六月二十一日
抗抑郁药米氮平及其中间体的合成工艺研究 摘要 米氮平(Mirtazapine)是全球第一个去甲肾上腺素(NA)能和特异性五掘色胺(5-HT)能抗抑郁药(NaSSA),它由荷兰欧加农(Orgaaon)公司研制并于1994年上市,1996年6月通过美国FDA认证,已在70多个国家l临床使用。具有与SSRI 类药物不同的作用机制,其不良反应轻,起效快,是一种安全、有效的新型抗抑郁药。目前,国内报道米氮平的合成工艺主要以l-甲基-3-苯基哌嗪为原料经多步反应制得,该路线表现出许多不足。因此,如何简便合成米氮平具有重要的实际意义。 米氮平是全球抗抑郁药的八大品种之一,商品名为瑞美隆(Remeron),是由荷兰欧加农(Organon)公司开发,并于1994年在荷兰首次上市的全球首个去甲肾上腺素能和特异性五—羟色胺能抑制剂(NaSSA),1996年6月通过美国FDA认证,同年在美国、瑞典、希腊获准上市,2001年进入中国市场。“米氮平”是欧加农公司生产规模最大也是增长最快的产品,己在欧洲、美国、亚洲等70多个国家临床使用。2000年在世界主要市场米氮平销售额为3.822亿美元,2001年比上一年增长了47%,已达5.6l亿美元,由上一年的135位前移到108位,国外许多专家预言到2020年全球抗抑郁药市场将从目前的第4位跃居第2位。 本文主要讨论了米氮平及其中间体2-氨基-3-羟甲基吡啶,N-(2-氯乙基)-N-甲基-α氯-β-苯乙基胺的合成工艺。 一.米氮平的结构及名称 结构式: 米氮平属吡嗪-氮卓类化合物,结构中包括一个吡啶环,一个苯环和一个哌嗪环,它通过一个七元环连接起来,其中14b碳为手性碳原子,具有两个手性对映体。 化学名:1,2,3,4,10,14b-六氢-2-甲基-吡嗪并[2,1-a]吡啶并[2,3-c] [2]苯氮杂卓 分子式:C17H19N3,CA登录号:[61337-67-5],分子量:265.36 二.米氮平合成路线的设计与选择 2.1米氮平结构合成分析 对米氮平(Mirtazapine)结构拆分,其合成分析见下图
高中化学第二章专题讲座(六)卤代烃的生成及在有机合成中的 应用(含解析)新人教版选修5 卤代烃的化学性质比较活泼,能发生许多反应,如取代反应、消去反应等,从而转变成其他类型的化合物。因此,引入卤原子常常是改变分子性能的第一步,卤代烃在有机合成中起着重要的桥梁作用。 1.在烃分子中引入羟基。 例如由苯制苯酚,先用苯与液溴在有铁屑存在的条件下发生取代反应制取溴苯,再用溴苯在氢氧化钠存在的条件下与高温水蒸气发生水解反应便得到苯酚。 又如由乙烯制乙二醇,先用乙烯与氯气发生加成反应制取1,2-二氯乙烷,再用1,2-二氯乙烷和氢氧化钠水溶液发生水解反应制得乙二醇。 2.在特定碳原子上引入卤原子。 例如由1-溴丁烷制取1,2-二溴丁烷,先由1-溴丁烷发生消去反应得到1-丁烯,再由1-丁烯与溴加成得到1,2-二溴丁烷。 3.改变某些官能团的位置。 例如由1-丁烯制取2-丁烯,先由1-丁烯与氯化氢加成得到2-氯丁烷,再由2-氯丁烷发生消去反应得到2-丁烯。 又如由1-溴丙烷制取2-溴丙烷,先由1-溴丙烷通过消去反应制得丙烯,再由丙烯与溴化氢加成得到2-溴丙烷。 再如由1-丙醇制取2-丙醇,先由1-丙醇发生消去反应制丙烯,再由丙烯与氯化氢加成制取2-氯丙烷,最后由2-氯丙烷水解得到2-丙醇。 [练习] 1.有下列合成路线: (1)上述过程中属于加成反应的有_______________(填序号)。 (2)反应②的化学方程式为_____________________________。 (3)反应④为反应,化学方程式为_____________ _____________________________________________________。 解析:环己烯与溴发生加成反应,生成1,2-二溴环己烷;1,2-二溴环己烷在氢氧化钠醇溶液中加热,发生消去反应,生成1,3-环己二烯;1,3-环己二烯再与溴发