鲁科版高中化学课时利用化学反应制备物质教案必修
- 格式:docx
- 大小:11.75 KB
- 文档页数:3

化学反应的利用【教学目标及分解】1.课前预习先学目标①先学课本P47到P49页,重点思考:联想·质疑中的问题,尝试自己查资料解决②回忆有关H2、CO2、NH3的实验室制法,尝试找出制备Cl2的反应原理;③通过小组讨论,尝试完成P48页讨论的第3题2.课中目标①通过展示图片让学生对“利用化学反应造福人类”的认识进一步具体化。
②通过7个交流·研讨帮助学生掌握实验室制备氯气的原理,了解制备装置、净化装置、收集方法及尾气处理方法以及制气装置的气密性检查方法.③通过活动·探究,教师在演示的过程中培养学生的观察能力、实验能力和分析推理能力。
3.课后拓展目标①对某些仪器的用途加以强化②能学以致用,处理一些气体的制备、净化、收集、尾气处理装置。
【教学重、难点】实验室制备氯气的反应原理和干燥纯净的氯气的获取和收集【教学过程】处较易得出结论,尽量让此处学生比较小组讨论:完成2的制方法并演示氯气的制备实【教学反思与改进】1.由于此处能系统介绍气体制备的原理、装置选择(发生、净化、收集、尾气处理),因此本部分内容需要1.5课时才能完成,本节课重点介绍怎样制备干燥纯净的氯气,其它气体及某些特殊装置则放到下个课时再讨论。
2.本节课研讨内容较多,学生会较累。
3.当堂检测第四题涉及到即用即停装置对学生要求较高,可能要放到下节课更理想。
精美句子1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂;幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。



第三节化学反应的利用一、教材分析(一)知识脉络本节教材首先以氯气的实验室制法为例,让学生体会怎样利用化学反应制备新物质的一般思路,并总结曾经学过的常见物质的制备方法。
第二部分承接本章第一节中化学反应中能量释放问题,以“化学能如何转变成电能”为例解释了“为什么说化学反应为人类提供了能源”,并说明了化学在能源开发和利用方面的作用。
作为化学必修模块中元素化合物知识和基本概念、基本理论的最后一节,本节承担着对前面知识的回顾、总结,以及深化和提升学生对化学研究的应用价值的认识的双重任务。
(二)知识框架(三)新教材的主要特点:除了要求学生掌握“氯气的实验室制法”和“原电池的工作原理”等具体的知识点外,致力于培养学生从大视野、高观点、多角度了解化学在人类社会发展中的作用,以及化学研究的前沿。
二.教学目标(一)知识与技能目标1、使学生对“利用化学反应造福人类”认识进一步具体化。
2、引导学生掌握实验室制备氯气的原理和尾气处理方法,了解制备装置及收集方法,以及原电池的工作原理。
3、通过“活动·探究—氯气的制取和原电池的工作原理”,培养学生的观察能力,实验能力和分析推理能力。
4、利用“化学前沿”、“资料在线”等拓展性栏目,为学生提供丰富的材料,开拓他们的视野,使他们从更多角度体会化学科学与人类文明和社会发展的密切关系。
(二)过程与方法目标1、通过“交流·研讨”,提高学生的分析、比较、综合的能力。
2、通过“活动·探究”,培养学生的观察能力和分析解决问题的能力。
(三)情感态度与价值观目标1、通过教材中活动栏目的设计,培养学生的探索精神和实事求是的科学态度。
2、提升学生对化学反应价值的认识,赞赏化学科学对个人生活和社会发展的贡献。
三、教学重点、难点(一)知识上重点、难点如何利用化学反应制造新物质和怎样将化学能转化为电能。
(二)方法上重点、难点探究物质制备的一般思路的形成,能量转化研究的利用。
四、教学准备(一)学生准备1、预习“第三节化学反应的利用“中的“交流·研讨”;2、回顾实验室制取气体时发生装置和收集方法的确定;3、收集身边的废旧电池,思考生活、生产中能量的来源及利用。

第1课时 利用化学反应制备物质[学习目标] 1.掌握实验室制备氯气的原理、净化方法及尾气处理方法。
2.了解常见气体的实验室制备装置及收集方法。
3.了解一些常见物质的制备原理。
一、氯气的制备方法[自主学习]1.氯气的实验室制法 (1)试剂:□01浓盐酸和□02MnO 2。
(2)反应原理化学反应方程式:□03MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
离子反应方程式:□04MnO 2+2Cl -+4H +=====△Mn 2++Cl 2↑+2H 2O 。
①氧化剂是□05MnO 2,还原剂是□06HCl ,氧化剂与还原剂的物质的量之比为□071∶2。
②在MnO 2与浓盐酸反应制取氯气的反应中体现了浓盐酸的□08酸性、□09氧化性。
③若2 mol HCl 参加反应,被氧化的HCl 为□101 mol 。
(3)反应特点固体+液体――→△气体。
(4)实验装置仪器名称:①□11分液漏斗,②□12圆底烧瓶。
2.氯气的工业制法——电解饱和食盐水(1)化学方程式:□132NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑。
氧化剂是□14H 2O ,还原剂是□15NaCl 。
(2)离子方程式:□162Cl -+2H 2O=====通电2OH -+H 2↑+Cl 2↑。
1.在实验室制备的Cl 2中含有哪些杂质?应怎样除去?为防止环境污染,多余的Cl 2一般用什么试剂吸收?提示:HCl 和水蒸气。
分别通入装有饱和食盐水和浓硫酸的洗气瓶。
多余的Cl 2一般用NaOH 溶液吸收,以防污染环境。
2.从氧化还原反应知识的角度分析,工业上和实验室制备Cl 2的反应原理有何异同? 提示:两个反应原理的共同点是把-1价的Cl 氧化成0价的Cl ,不同点是工业上制备Cl 2的氧化剂是H 2O ,还原剂是NaCl ,实验室制备Cl 2的氧化剂是MnO 2,还原剂是HCl 。

鲁科版必修二第二章第3节化学反应的利用的《利用化学反应制备物质》教学设计陕西富平迤山中学王敏一、教学目标(1)知识与技能对“利用化学反应造福人类”的认识进一步的具体化;(2)掌握实验室制备氯气的原理和尾气的处理办法;(3)了解制备装置以及收集方法。
过程与方法通过“活动探究——氯气的制取”,培养学生的观察能力、实验能力和分析推理能力。
情感态度与价值观利用化学前沿等拓展栏目,提供丰富的材料,开阔视野,从多个角度体会化学科学与人类文明和社会发展的密切关系。
二、教学重点和难点重点:如何利用化学反应制造新物质难点:如何利用化学反应制造新物质三、课时安排:一课时四、教学方法:实验自主探究设计为主,演示以及讲授为副。
五、学习方法:学生自主讨论,主动观察,分析讨论,实验探究。
六、教学过程:投影展示Cl2的用途。
通过第一节课的学习同学们已经知道了氯元素在自然界中以化合态存在。
上课所用的氯气是在实验室中制取的。
在实验室里最常见、最经济的含氯化合物是(盐酸)和盐酸盐(如NaCl)。
其中的—1价的Cl转化为Cl2是氧化反应,所以制备Cl2还需使用氧化剂。
下面我们大家就先一起来探究实验室制取氯气的原理。
(课前把学生分成几个学习小组)提供浓盐酸、稀盐酸、NaCl固体、NaCl 溶液、二氧化锰等试剂,让学生自己设计实验方案,确定反应原理。
(二)新课讲授:主要归纳出制取原理、实验装置等内容。
学生几组具有代表性方案通过实验学生得出结论:选择试剂的时候不仅要考虑Cl-的浓度还要考虑H+的浓度。
H+的浓度越大,Cl-的还原性越强,所以实验室制取Cl2采用了浓HCl 和二氧化锰来反应。
为了加快反应,还采用了加热的条件。
1.确定原理:MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O学生练习:指出该反应中的氧化剂、还原剂、氧化产物、还原产物以及盐酸表现的性质并书写其离子方程式。
氧化剂是MnO2,还原剂是浓HCl,氧化产物是Cl2,还原产物是MnCl2,,浓盐酸在这既表现了还原性又表现了酸性。

高一化学学案第三节化学反应地利用第一课时利用化学反应制备新物质一【目标要求】1.了解实验室制备氯气地原理、装置、收集方法和尾气处理方法.2.总结常见气体地制备装置及收集方法二【学习过程】1.氯气地实验室制法<1)反应地原理:_______________________________________注意:稀盐酸与MnO2作用不能制取Cl2.<2)制气类型:_________________________________________<3)发生装置:(仪器名称>_______________________________ <4)收集装置:______________或_________________<5)净化装置:用_______________除去______,再用_____干燥.<6)尾气处理装置:用______________吸收多余地Cl2,防止污染空气.<7)实验装置图:对于这套制取气体地装置,一定要认识各仪器并准确叫出名称,还要明确各装置地作用、原理及注意事项.2.氯气地工业制法工业上利用电解饱和食盐水地方法制氯气.化学方程式:_______________________________________________________3.实验室制备气体综述<1)气体发生装置地类型设计原则:根据__________、____________和____________等因素来选择反应装置.生地水蒸气在管品冷凝后倒流而引下反应、要正确使用分液漏斗<2)净化与干燥装置设计原则:根据净化药品地状态及条件常见气体干燥剂地选择实例:O<3)收集装置设计原则:根据_____________________________<4)尾气处理对于有毒、有害地气体必须用适当地溶液加以吸收<或点燃),使它们变为无毒、无害、无污染地物质.如尾气Cl2、SO2、H2S、Br2<蒸气)等可用___________吸收;尾气CO气体可用___________将它转化为_______气体.HCl、NH3可用____吸收,三【例题及练习】例题1 自主填写课本p48页活动探究三制备物质地反应原理.例题2.下列反应适用于实验室制备氧气地是①高锰酸钾热分解 2KMnO4K2MnO4+MnO2+ O2↑②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑③过氧化氢催化分解 2H2O2 2H2O +O2↑④二氧化氮热分解 2NO2 2NO+ O2↑A.只有① B.①和② C.①和③ D.①③④例题3.二氧化锰与浓盐酸作用制氯气地反应中,作为还原剂地HCl 和参加反应地HCl物质地量之比是 [ ]A.1∶1 B.2∶1C.1∶2 D.任意比例题4、使0.15mo l MnO2与过量地12mol·L-1地浓盐酸反应,使50mL 12mol·L-1地浓盐酸与足量MnO2反应,两者产生地氯气相比<其他条件相同)<).A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较例题5、实验室里用下图所示装置制取纯净地无水CuCl2.试回答下列问题:<1)写出烧瓶中发生反应地化学方程式,并标出电子转移地方向和数目.<2)B处盛有饱和食盐水<或水),其作用是.<3)C处盛放地试剂__________<填名称),其作用是 .<4)E处盛有___________<填名称),发生反应地离子方程式为_________.<5)实验结束时,应先熄灭__________处酒精灯.申明:所有资料为本人收集整理,仅限个人学习使用,勿做商业用途.。



第3节化学反应地利用
利用化学反应制备新物质
【教学目标】
1. 掌握氯气地实验室制法;
2. 了解氯气地工业制法;
3. 会识别常见地化学仪器,选择正确地气体发生装置.
【教学重点、难点】
氯气地实验室制法
【教学方法】
讲授--实验探究
【教学用具】
仪器:铁架台、烧瓶、烧杯、分流漏斗、酒精灯、集气瓶、导管等.
药品:浓盐酸、二氧化锰、氢氧化钠溶液.
【课时分配】 2课时
【教学过程】
备在日常生
氯气地实验室制法
有黄绿色气体
②氯气有毒,看样闻
④写出用氢
1 B
硫酸④石灰水⑤
.②③同地是
【板书设计】
第3节化学反应地利用
一、利用化学反应制备新物质[投影]
1、氯气地实验室制法
申明:
所有资料为本人收集整理,仅限个人学习使用,勿做商业用途.。
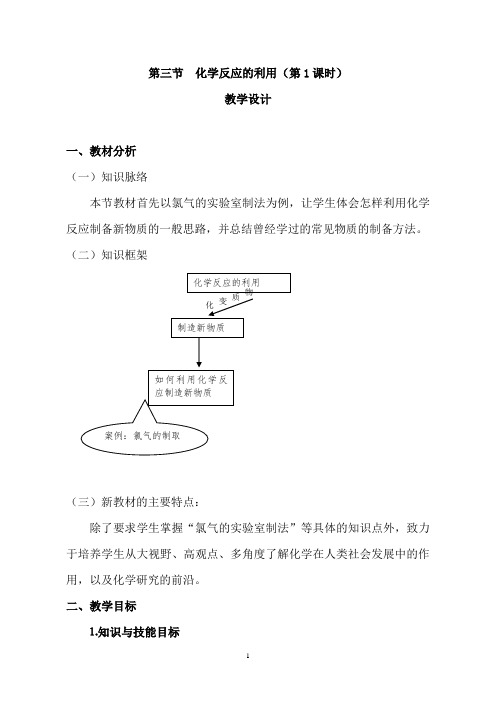
第三节 化学反应的利用(第1课时)教学设计一、教材分析 (一)知识脉络本节教材首先以氯气的实验室制法为例,让学生体会怎样利用化学反应制备新物质的一般思路,并总结曾经学过的常见物质的制备方法。
(二)知识框架(三)新教材的主要特点:除了要求学生掌握“氯气的实验室制法”等具体的知识点外,致力于培养学生从大视野、高观点、多角度了解化学在人类社会发展中的作用,以及化学研究的前沿。
二、教学目标⒈知识与技能目标化学反应的利用如何利用化学反应制造新物质物质变化案例:氯气的制取⑴使学生对“利用化学反应造福人类”认识进一步具体化。
⑵引导学生掌握实验室制备氯气的原理和尾气处理方法,了解制备装置及收集方法。
⑶通过“活动·探究”—氯气的制取,培养学生的观察能力,实验能力和分析推理能力。
⑷利用“化学前沿”和“资料在线”等拓展性栏目,为学生提供丰富的材料,开拓他们的视野,使他们从多个角度体会化学科学与人类文明和社会发展的密切联系⒉过程与方法目标⑴通过“交流·研讨”,提高学生的分析、比较、综合的能力。
⑵通过“活动·探究”,培养学生的观察能力和分析解决问题的能力。
⒊情感态度与价值观目标⑴通过教材中活动栏目的设计,培养学生的探索精神和实事求是的科学态度。
⑵提升学生对化学反应价值的认识,赞赏化学科学对个人生活和社会发展的贡献。
⑶加强学生对环境保护的认识,提高学生的主人公意识三、教学重点、难点(一)知识上重点、难点如何利用化学反应制造新物质(二)方法上重点、难点探究物质制备的一般思路的形成四、教学方法实验探究法,启发、讨论法。
五、教学准备(一)学生准备1、预习书本“第三节化学反应的利用“2、预习《自主学习丛书》第三节化学反应的利用(二)教师准备准备教案,学案六、课时安排1课时七、教学过程【布置作业】课本第48页讨论3。


第1课时 利用化学反应制备物质一、氯气的实验室制法 1.工业制法化学方程式:2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑。
离子方程式:2Cl -+2H 2O=====通电2OH -+H 2↑+Cl 2↑。
反应中氧化剂是H 2O ,还原剂是Cl -。
2.实验室制法 (1)反应原理化学方程式:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
离子方程式:MnO 2+2Cl -+4H +=====△Mn 2++Cl 2↑+2H 2O 。
反应中氧化剂是MnO 2,还原剂是Cl -。
(2)实验装置①制气装置类型:固体+液体――→△气体。
仪器名称:a 分液漏斗。
②气体净化:装置B 的作用是吸收HCl 气体,装置C 中的试剂是浓硫酸,其作用是干燥氯气。
③尾气吸收:装置E 中盛放的试剂是NaOH 溶液,其作用是吸收多余的氯气,防止污染空气,反应的化学方程式是2NaOH +Cl 2===NaCl +NaClO +H 2O 。
(3)实验步骤1.实验室制备氯气反应原理(强氧化剂+浓盐酸)(1)实验室是利用氧化还原反应制备Cl2。
MnO2为氧化剂,HCl部分表现酸性,部分表现还原性,为还原剂。
①随着反应的进行,盐酸浓度逐渐变小,当变为稀盐酸时,反应停止。
②反应中有大量HCl挥发也是造成HCl不能完全参与反应的重要原因。
(2)实验室制备Cl2的其他方法若实验室无MnO2,可以用强氧化剂KMnO4、KClO3、K2Cr2O7代替MnO2制Cl2。
16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O6HCl(浓)+KClO3===KCl+3Cl2↑+3H2O2.氯气净化(先除HCl,后除水蒸气)3.实验室制取氯气注意事项①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,加热温度不宜过高,减少HCl的挥发。


一、氯气的制法
1.实验室制法
(1)反应原理
化学方程式:MnO2+4HCl(浓)eq \o(=====,\s\up10(△),\s\do8())MnCl2+Cl2↑+2H2O。
(2)仪器和试剂
1仪器:圆底烧瓶、分液漏斗、酒精灯、集气瓶、铁架台、石棉网、烧杯。
2试剂:MnO2、浓盐酸、NaOH溶液。
(3)实验装置
(4)实验步骤
eq \x(连)—根据装置图,按从下到上,从左到右顺序连接。
eq \x(检)—eq \a\vs4\al(检查装置气密性。
方法是:关闭分液漏斗活,塞,导管伸入水中,微热烧瓶,若导管口有气,泡冒出,停止加热后导管内上升一段水柱且,保持不动,则说明装置气密性良好。
)
eq \x(装)—eq \a\vs4\al(装药品,先向烧瓶里加固体MnO2,再向,分液漏斗中加浓盐酸。
)eq \x(制)—点燃酒精灯,加热制气体。
eq \x(集)—向上排空气法或排饱和食盐水法收集。
eq \x(验)—eq \b\lc\[\rc\ (\a\vs4\al\co1(\a\vs4\al(1观察集气瓶中气体的颜色,瓶中充满黄绿色气体。
,,2用湿润的淀粉碘化钾试纸放在瓶口,试纸变蓝。
)))
(5)尾气处理
尾气用NaOH溶液吸收,防止污染空气。
反应的离子方程式:2OH—+Cl2===Cl—+ClO—+H2O。
微点拨:实验室制备Cl2时,可用KMnO4或KClO3代替MnO2,利用“固体+液体―→气体(不需要加热)”装置制备:16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O,6HCl(浓)+KClO3===KCl+3Cl2↑+3H2O。
2.工业制法
(1)化学方程式为
2NaCl+2H2Oeq \o(=====,\s\up10(通电),\s\do8())2NaOH+H2↑+Cl2↑。
(2)离子方程式为
2Cl—+2H2Oeq \o(=====,\s\up10(通电),\s\do8())2OH—+H2↑+Cl2↑。
二、利用化学反应制备其他物质
物质实验室制法工业制法氢气Zn+H2SO4===ZnSO4+H2↑C+H2O(g)eq \o (=====,\s\up10(高温),\s\do8())CO+H2
CO+H2O(g)eq \o(=====,\s\up10(高温),\s\do8())CO2+H2二氧
化碳CaCO3+2HCl=== CaCl2+CO2↑+H2OCaCO3eq \o(=====,\s\up10(高温),\s\do8())CaO+CO2↑氧气2H2O2eq \o(=====,\s\up10(MnO2))2H 2O+O2↑分离液态空气硫酸—S+O2eq \o(=====,\s\up10(点燃),\s\do8())SO 2
2SO2+O2eq \o(,\s\up10(V2O5),\s\do8(△))2SO3
SO3+H2O===H2SO4氨气2NH4Cl+Ca(OH)2eq \o(=====,\s\up10(△),\s\do8())CaCl2+2NH3↑+2H2ON2+3H2eq \o(,\s\up10(高温、高压),\s\do8(催化剂))2NH3硝酸NaNO3+H2SO4(浓)eq \o(=====,\s\up10(△),\s\do8())NaHSO4+HNO34NH3+5O2eq \o(=====,\s\up10(高温),\s\do8(催化剂))4NO+6H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
1.判断正误(正确的打“√”,错误的打“×”)
(1)MnO2与浓盐酸反应制Cl2的离子方程式:MnO2+4HCleq \o(=====,\s\up10(△))Mn2++2Cl—+Cl2↑+2H2O。
()
(2)工业上通过电解氯化钠溶液制备金属钠和氯气。
()
(3)生石灰能与水反应,可用来干燥氯气。
()
(4)实验室制取氢气和实验室制取二氧化碳所用的装置相同。
()
[答案] (1)×(2)×(3)×(4)√
2.用向上排空气法收集Cl2和HCl时,可以用来检验瓶中是否已经充满又可区别两气体的是()
A.湿润的KI淀粉试纸
B.湿润的蓝色石蕊试纸
C.蘸有浓氨水的玻璃棒
D.湿润的红色石蕊试纸
B [A项,HCl与KI不反应,不能用于HCl的检验;B项,Cl2使湿润的蓝色石蕊试纸先变红后退色,HCl使其变红;C项,Cl2、HCl与NH3反应现象相同;D项,湿润的红色石蕊试纸不能用于HCl的检验。
]
3.关于实验室制Cl2,下列说法正确的是()
A.可用KMnO4和浓盐酸反应制取
B.用碱石灰干燥Cl2
C.用排水法收集Cl2
D.用饱和石灰水吸收尾气
A [KMnO4、MnO2都是氧化剂,都能与浓盐酸反应制取Cl2,A正确。
Cl2是酸性气体,能溶于水,不能用碱石灰干燥,也不能用排水法收集,B、C错误。
Ca(OH)2微溶于水,饱
和石灰水中溶有的Ca(OH)2太少,吸收尾气不彻底,D错误。
] 氯气的实验室制法实验装置图及各部分解读
1.实验药品:浓盐酸与二氧化锰或浓盐酸与Ø。