半成品检验记录表
- 格式:doc
- 大小:44.50 KB
- 文档页数:1

化妆品半成品及成品检验记录产品名称:唇膏日期:2024年1月1日-2024年1月31日1.外观检验半成品唇膏应具备均匀光滑的外观,无明显颗粒、起皮、挫伤或污渍等缺陷。
2.质地检验-取适量半成品唇膏放置于常温环境下,检测其质地是否保持稳定。
-观察半成品唇膏在施压下的回弹速度,应快速回弹且不产生明显破损或变形。
3.气味检验半成品唇膏应无异味、刺鼻气味或其他异常气味。
4.化学成分检验-检测半成品唇膏中的化学成分是否符合国家相关标准。
-特别关注有害物质(如重金属、致敏物质等)的含量是否超过允许范围。
5.稳定性测试将半成品唇膏置于不同温度和湿度的环境中,进行稳定性测试,验证其在不良环境下的质量保持情况。
1.外包装检验成品唇膏外包装应完整无损,无明显污染、折痕或变形。
2.外观检验成品唇膏应具备均匀光滑的外观,无明显颗粒、起皮、挫伤或污渍等缺陷。
3.质地检验-观察成品唇膏的质地是否与标准样品一致。
-测试其质地在施压下的回弹速度和变形情况,应满足相关标准。
4.气味检验成品唇膏应无异味、刺鼻气味或其他异常气味。
5.化学成分检验-检测成品唇膏中的化学成分是否符合国家相关标准。
-特别关注有害物质(如重金属、致敏物质等)的含量是否超过允许范围。
6.稳定性测试将成品唇膏置于不同温度和湿度的环境中,进行稳定性测试,验证其在不良环境下的质量保持情况。
7.安全性测试通过皮肤刺激试验、眼刺激试验等方法,评估成品唇膏对人体的安全性。
8.抗菌性能测试对成品唇膏进行抗菌性能测试,确认其能否有效抑制或杀灭常见细菌、真菌等微生物。
9.实际使用检验选取一部分成品唇膏进行实际使用测试,以验证其使用体验和效果是否符合预期。
以上记录仅为例示,实际检验记录可根据具体需求和标准进行调整。
检验记录的目的是为了确保半成品和成品的质量符合标准,并保障消费者的健康与安全。
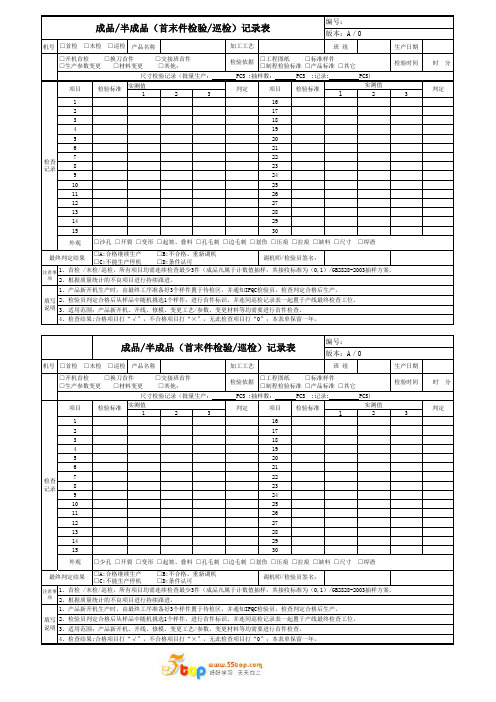
机号产品名称班 组生产日期检验时间 时 分实测值123123116217318419520621722823924102511261227132814291530外观机号产品名称班 组生产日期检验时间 时 分实测值123123116217318419520621722823924102511261227132814291530外观判定加工工艺编号:版本:A/0□开机首检 □换刀首件 □交接班首件□生产参数变更 □材料变更 □其他:□沙孔 □开裂 □变形 □起皱、叠料 □孔毛刺 □边毛刺 □划伤 □压痕 □拉痕 □缺料 □尺寸 □焊渣最终判定结果检验标准实测值2、检验员判定合格后从样品中随机挑选1个样件,进行首件标识。
并连同巡检记录表一起置于产线最终检查工位。
□首检 □末检 □巡检□首检 □末检 □巡检注意事项填写说明检验依据□工程图纸 □标准样件□制程检验标准 □产品标准 □其它检验标准项目项目成品/半成品(首末件检验/巡检)记录表4、检查结果:合格项目打“√”,不合格项目打“×”,无此检查项目打“0”;本表单保留一年。
版本:A/0检查记录□工程图纸 □标准样件□制程检验标准 □产品标准 □其它检验标准实测值尺寸检验记录(批量生产: PCS ;抽样数: PCS ;记录: PCS)判定3、适用范围:产品新开机、开线、修模、变更工艺/参数、变更材料等均需要进行首件检查。
1、首检 /末检/巡检,所有项目均需连续检查最少3件(成品凡属于计数值抽样,其接收标准为(0,1)/GB2828-2003抽样方案。
2、根据质量统计的不良项目进行持续跟进。
1、产品新开机生产时,由最终工序准备好3个样件置于待检区,并通知IPQC检验员,检查判定合格后生产。
检查记录项目判定检验依据加工工艺判定□开机首检 □换刀首件 □交接班首件□生产参数变更 □材料变更 □其他:□A:合格继续生产 □B:不合格、重新调机□C:不能生产停机 □D:条件认可调机师/检验员签名:尺寸检验记录(批量生产: PCS ;抽样数: PCS ;记录: PCS)检验标准项目编号:1、首检 /末检/巡检,所有项目均需连续检查最少3件(成品凡属于计数值抽样,其接收标准为(0,1)/GB2828-2003抽样方案。

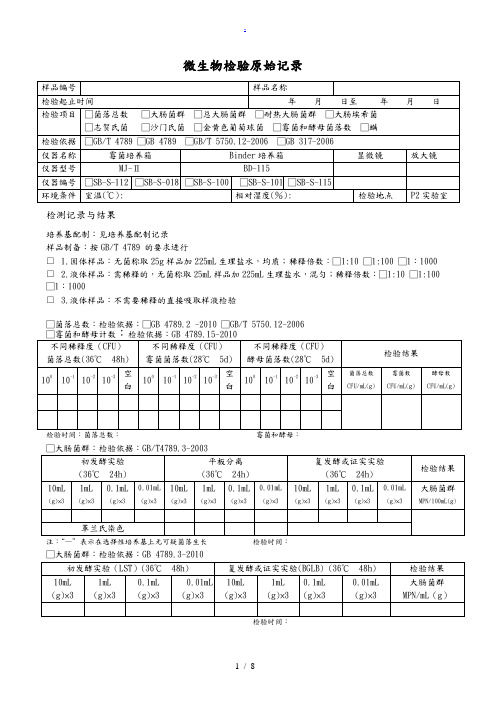
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。

原材、成品、半成品的检查、验收制度范文原材料、成品和半成品的检查验收制度是指对采购的原材料、生产制造的半成品和成品进行检查和验收的规定和程序。
该制度的目的是确保所采购和生产出来的材料和产品符合质量标准和要求,保证产品的质量稳定和安全性。
以下是一般情况下的原材料、成品和半成品的检查验收制度的一些要点:1. 原材料的检查验收制度:- 对于进货的原材料,应该先进行外观检查,确保无明显损坏、变质或异味等问题;- 对原材料进行抽样检测,包括化学成分、物理性能、微生物污染等等,以确保原材料符合规定标准或要求;- 检查原材料的检验报告和证书,确保提供的质量证明文件真实有效;- 严格按照验收标准,判定原材料是否合格。
2. 半成品的检查验收制度:- 对于生产过程中制造的半成品,应该检查其外观、尺寸、物理性能等参数,确认无明显问题;- 进行必要的功能测试和试验,确保半成品的性能符合产品设计要求;- 检查半成品的检验报告和质量记录,确保半成品的每个步骤都符合质量标准;- 验收半成品时,对合格的半成品进行标识和随附必要的文件。
3. 成品的检查验收制度:- 对于生产出来的成品,应该检查其外观、尺寸、功能等参数,确认无明显问题;- 进行相关的性能测试和试验,如强度测试、电气测试、耐久性测试等,以确保成品的性能和功能符合标准和产品要求;- 完善成品的质量文件和记录,包括产品出厂合格证明、产品质量标志等;- 审核相关的质量标准和质量控制文件,并进行验收判定。
需要注意的是,不同行业和不同产品的检查验收制度可能有所不同,需要根据具体情况制定相应的制度和程序,确保质量的可控和可追溯。
原材、成品、半成品的检查、验收制度范文(二)检查、验收制度范本一、引言本检查、验收制度旨在确保原材料、成品和半成品的质量符合公司标准,以保证产品的质量和安全性,提高客户满意度。
本制度适用于所有相关的采购、生产和质检环节。
二、原材料检查、验收制度1.目的确保采购的原材料符合公司的质量要求,防止不良原材料进入生产环节,影响产品质量。


微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进展
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据GB 317.4-.10-2006
检测人:复核人:微生物限度检验记录〔复合膜〕
检验人:复核人:微生物限度检验记录〔辅料〕
检验人:复核人:
微生物限度检验记录〔铝箔、PVC硬片〕
微生物限度检验记录〔半成品、成品〕
微生物限度检验记录〔辅料〕。
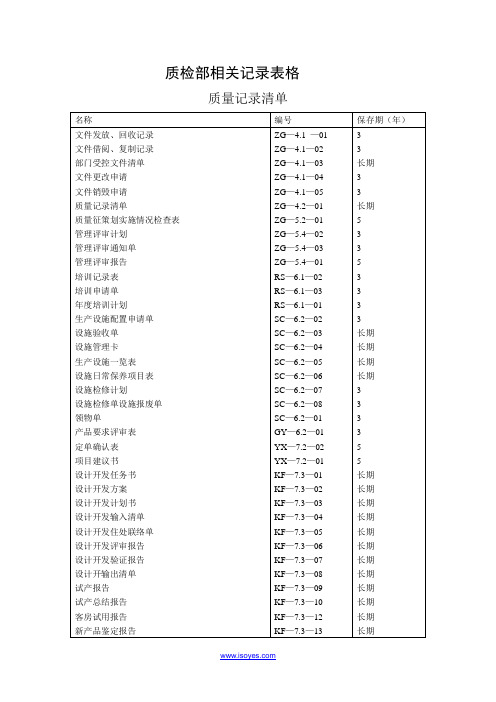
质检部相关记录表格
质量记录清单
文件更改申请
质量策划实施情况检查表
内校记录表
编号:ZG-7.6-04 序号:
编号::ZC-8.1.2-02 序号:
审核组组长:组员年月日第页共页
1审核目的:
2审核依据:GB/T19001-2000idtISO9001:2000
本公司质量手册第一版及质量管理体系其他文件
3审核覆盖产品:
审核时间:年月日至年月日
首次会议时间:月日时分
首次会议时间:月日时分
5现场审核期间请被审核方有关人员参加下列活动:
首、末次会议:最高管理者或其代表及与审核有关的管理要员参加。
审核活动:按审核日程安排,被审核方有关人员在本岗位。
6审核安排:
内审检查表
编号::ZC-8.1.2-03 共页第页
不符项报告
内部质量管理体系审核报告(可另附纸叙述)
进货验证记录表
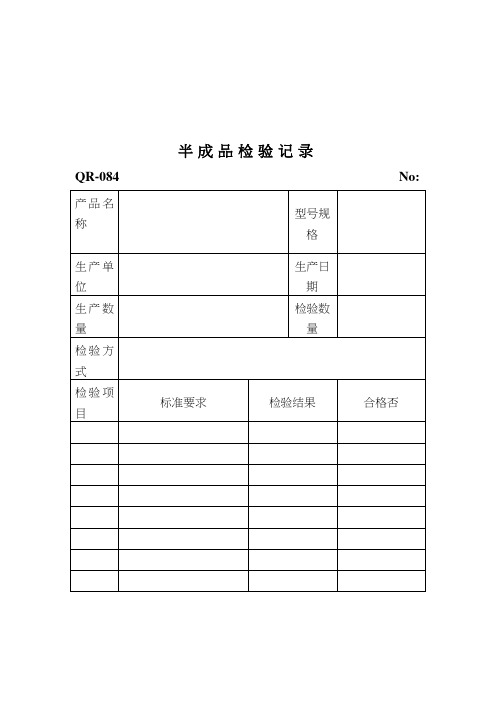
半成品检验记录
成品检验记录
不合格品报告
客户投诉处理单
编号::ZC-8.3-01 序号:
纠正和预防措施处理单
编号::ZC-8.3-02 序号:
改进、纠正和预防措施实施情况一览表
编号::ZC-8.3-03 序号:
信息联络处理单
编号::ZC-8.3-01 序号:
关键控制点监控计划实施状况检查表
编号:SC-6.2-06 执行部门: 序号:
编制: 日期: 批准: 日期:
持续改进计划
合格供方评定表:
供方能力调查表
编号:GY-7.4-0.3 序号:。

IPQC过程检验规范(IATF16949/ISO9001-2015)1.0 目的为了加强生产现场产品品质的管控,有效地控制和降低潜在的品质风险,确保制程中品质处于受控状态。
2.0 范围适用于本公司所有在生产过程中的半成品、成品的检验。
检验依据:产品图纸,作业指导书,控制计划,抽样方案,产品缺陷等级表。
3.0 职责3.1 生产部负责领料确认、工艺检验、自主检验及不合格的处理记录;3.2 品质部负责巡回检验、移转检验及其记录;3.3 新产品的检验由技术部主导,生产部/品管部配合。
4.0 工作程序4.1首件确认是指对生产加工的首件产品或过程发生改变后加工的首件产品进行检验,防止批量性问题的出现,保证生产产品的质量。
4.1.1首件确认时间a. 生产中更换操作者的b. 每个班上班,产品开始加工时c. 生产过程中设备重新调整后d. 产品换型时(产品零件号更换时)e. 工装模具调整后f. 加工工艺参数或材料批次作了更换的4.1.2首件确认的程序a.自检:指由操作者对自己所生产的产品,按照图纸或或作业指导书技术标准进行的检验。
在4.1.1条任何条件下生产的产品必须由员工进行自检,员工自检合格后,带上该产品送IPQC专检。
b.专检:由专职检验员进行的检验。
检验合格后由检验员签名或盖章,该产品可以在该工序上生产。
4.1.3首件确认不合格的处理a.如果首件检验不合格, 则不能生产,必须对设备或工装进行调整, 以使首件符合图纸、作业指导书的要求,然后按首件确认程序送检。
b.操作员工必须确保首件经过了IPQC的检验并合格,如果未经首件确认而擅自进行生产的(不管产品合格与否),将按照公司相关规定对当事人进行处罚。
e.首件检验的合格与否由IPQC确定, IPQC不能确定的, 必须会同领班, 质保部经理, 技术部经理等熟知该产品和工艺的人员共同判定。
4.1.4首件确认的记录a.首先由操作者将首件自检合格的产品,如实将检查结果(如外观、配合、尺寸等)记录在《过程检验记录表》上。

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。


机号产品名称班 组生产日期检验时间 时 分实测值123123116217318419520621722823924102511261227132814291530外观机号产品名称班 组生产日期检验时间 时 分实测值123123116217318419520621722823924102511261227132814291530外观判定加工工艺编号:版本:A/0□开机首检 □换刀首件 □交接班首件□生产参数变更 □材料变更 □其他:□沙孔 □开裂 □变形 □起皱、叠料 □孔毛刺 □边毛刺 □划伤 □压痕 □拉痕 □缺料 □尺寸 □焊渣最终判定结果检验标准实测值2、检验员判定合格后从样品中随机挑选1个样件,进行首件标识。
并连同巡检记录表一起置于产线最终检查工位。
□首检 □末检 □巡检□首检 □末检 □巡检注意事项填写说明检验依据□工程图纸 □标准样件□制程检验标准 □产品标准 □其它检验标准项目项目成品/半成品(首末件检验/巡检)记录表4、检查结果:合格项目打“√”,不合格项目打“×”,无此检查项目打“0”;本表单保留一年。
版本:A/0检查记录□工程图纸 □标准样件□制程检验标准 □产品标准 □其它检验标准实测值尺寸检验记录(批量生产: PCS ;抽样数: PCS ;记录: PCS)判定3、适用范围:产品新开机、开线、修模、变更工艺/参数、变更材料等均需要进行首件检查。
1、首检 /末检/巡检,所有项目均需连续检查最少3件(成品凡属于计数值抽样,其接收标准为(0,1)/GB2828-2003抽样方案。
2、根据质量统计的不良项目进行持续跟进。
1、产品新开机生产时,由最终工序准备好3个样件置于待检区,并通知IPQC检验员,检查判定合格后生产。
检查记录项目判定检验依据加工工艺判定□开机首检 □换刀首件 □交接班首件□生产参数变更 □材料变更 □其他:□A:合格继续生产 □B:不合格、重新调机□C:不能生产停机 □D:条件认可调机师/检验员签名:尺寸检验记录(批量生产: PCS ;抽样数: PCS ;记录: PCS)检验标准项目编号:1、首检 /末检/巡检,所有项目均需连续检查最少3件(成品凡属于计数值抽样,其接收标准为(0,1)/GB2828-2003抽样方案。

一、适用目的:为规范质检员记录填写,统一记录格式,特制定质检员记录填写标准。
二、适用范围:所有质检员三、制度内容:质检过程检验记录表共4种分别为:过程抽检记录表、处罚单、质量问题处理单、成品入库检验报告单(一)配料、灌装间所需记录表为:过程抽检记录表、质量问题处理单、处罚单。
(二)包装间所需记录表为:成品入库检验报告单、处罚单、质量问题处理记录单及辅助记录:过程抽检记录表。
1. 检验记录由质检员在操作时填写在相应要求栏,不得漏项(除备注项外),不允许任意更改,检验员对记录数据及文字描述的真实性负责。
2.所有检验记录不得随意涂改,确有少量数据或文字需要更正时,应将原数据划上一横或错误文字上画两条水平线,再在旁边写上正确的数字,务必保持原数据或文字清晰可辨。
3.填写检验记录一律用蓝色圆珠笔或黑色中性笔填写,字迹清晰工整、色调一致。
需复写时使用蓝色复写纸,字迹要工整,色调一致,各份都要清晰可辨,严禁涂改。
4.过程抽检记录填写标准:(1)半成品过程检验记录填写标准:①记录应按相应栏要求填写完整,各项检验结果都应记录,注明“正常”(√)或“不正常”(×)不正常的并附带有相应的描述且在“处理办法及效果”栏中填写处理办法及跟踪结果。
②检验过程中的各种检验结果及检验中与标准规定有差异的现象要在“备注”栏详细记录。
③过程抽检记录表“备注”栏应填写检验过程中的辅助信息,如:检验过程生产情况、针对单一问题的详细描述等。
④当班生产结束应在过程抽检记录表下方填写当天工作及检验情况的总结,总结要简明扼要、要描述出当天检验时的突出问题及需接班人员注意的问题或当班结束无法完成需要对方完成的工作。
(2)成品过程检验记录填写标准:①在“抽查时间”栏填写抽检产品的品名、规格、产品上的喷码日期(日期要写完整);在“抽检项目、检验结果”栏填写抽检比例(如:4-3-10,4代表此时间段所要抽检产品的总垛数,3代表所要抽检的4垛中具体抽检的垛数,10代表具体抽检的3垛中具体抽检的总件数);在“处理办法及效果、备注”栏填写抽检结果、不合格现象(不合格现象有机器或包装组的要表明)及处理办法;当批次产品检验结束,要在相应抽检记录下方写出当批次抽检的总件数及当批次产品的合格率。
