配位化学
- 格式:doc
- 大小:31.50 KB
- 文档页数:8

配位在化学的名词解释配位是化学领域中一个重要的概念,它在化学反应和材料科学中扮演着关键的角色。
配位化学是指以配位键形式将一个或多个配位子与中心金属原子或离子结合的化学过程。
本文将深入探讨配位化学的概念、配位键的形成与性质、配位化合物的应用以及未来发展方向,以帮助读者更好地理解和应用这一化学原理。
配位化学最早由阿尔弗雷德·韦纳提出,他将化学中的配位理论分为两个部分:“氨合理论”和“阳离子、阴离子配位理论”。
这两个理论成为了后来配位化学的基石。
配位键是一种特殊的化学键,形成于中心金属原子或离子与配位子之间,通过配位键的形成,中心金属原子或离子与配位子之间能够建立稳定的配位化合物。
配位键的形成与性质是配位化学领域中的一个重要研究方向。
配位键的性质直接影响着配位化合物的稳定性和反应性。
配位键的强度取决于中心金属原子或离子的电子亲和力、金属原子或离子和配位子之间的配位键长度、配位子的电子稳定性等因素。
在配位键形成过程中,价电子对的分布起着决定性的作用,电子的共享或转移能够产生更稳定的配位键。
配位化合物在化学反应和材料科学中有着广泛的应用。
一类常见的配位化合物是金属配合物,它们广泛应用于催化剂、荧光探针、医药和生物分析等领域。
金属配合物能够通过配体的选择和调节,实现在催化剂中的高效催化活性、荧光染料中的颜色调节和生物学探针中的特异性识别。
此外,配位化合物还可以应用于材料科学中的电子器件、光电材料和储能材料等领域。
配位化学在未来的发展中有着巨大的潜力。
一方面,配位化学通过结构调控和反应条件的优化,可以进一步提高金属配合物的性能和反应活性,从而实现更高效的应用。
另一方面,研究人员正在不断开发新型的配体和金属配合物,以拓展其在各个领域的应用。
例如,基于可再生能源的配位化学将会成为一个研究重点,通过利用可再生能源驱动水的分解和CO2的还原,制备清洁能源和可回收资源。
总而言之,配位化学是化学领域中一个重要而有趣的研究领域。


化学配位配位化学化学配位,也被称为配位化学,是化学领域中的一个重要分支,涉及到配位化合物的合成、结构解析和反应机理等方面。
配位化学的发展对于理解和应用化学原理有着重要的意义。
本文将探讨化学配位的基本概念、配位化合物的结构和性质以及配位反应的机理等内容。
一、化学配位的基本概念在化学中,配位是指两个或多个化学物质通过共用一对或多对电子而结合在一起形成配位键的过程。
配位化学研究的主要对象是配位化合物,其中配位中心(通常是过渡金属离子)与一个或多个配体(通常是具有孤对电子的分子或离子)形成配位键。
这种配位键的形成使得配位化合物具有独特的结构和性质。
二、配位化合物的结构和性质配位化合物的结构与其性质密切相关。
在配位化合物中,配位中心与配体之间的配位键通常是通过配位基团上的孤对电子与配位中心的空轨道相互作用而形成的。
这种配位键的形成使得配位化合物呈现出各种不同的几何构型,如线性型、平面型、三角型、四角型等。
其中最常见的是八面体和四方形的结构。
配位化合物的性质主要由配位数、配位键的强度以及配体的性质等因素决定。
配位数指的是一个配位中心周围配体的数目。
根据配位中心的电子数和配体的空位数,可以分为单配位、双配位、多配位等不同类型。
配位键的强度取决于配位中心和配体之间的电荷转移情况,一般来说,配位键越强,配位化合物的稳定性越高。
此外,配体的性质也会对配位化合物的性质产生影响,常见的配体包括氨、水、羰基、氯离子等。
三、配位反应的机理配位反应是指在化学反应中,配位中心与配体之间的配位键发生断裂或形成的过程。
根据反应的特点,可以将配位反应分为配位置换反应、配位加成反应和配位消除反应等类型。
配位置换反应是最为常见的一类配位反应,指的是在配位化合物中,一个或多个配体被其他配体取代的过程。
这种反应通常涉及到金属离子与配位基团之间的键的断裂和形成。
配位置换反应的机理可以通过亲核取代机理、酸碱取代机理或配体内取代机理来解释。
配位加成反应是指在配位化合物中,通过配位中心与新的配体之间的配位键形成来实现新配位基团的引入。

配位化学的基本概念与配位化合物的性质配位化学是研究过渡金属离子或中心离子与周围配体(配位体)之间配位键形成、结构及性质的科学。
配位化合物是由一个或多个配体与一个中心离子配位形成的化合物,具有独特的结构和性质。
本文将介绍配位化学的基本概念以及配位化合物的性质。
一、配位化学的基本概念配位化学的基本概念主要围绕着配位键形成、配体和中心离子的性质以及配合物的结构与性质展开。
1. 配位键形成配位键是配体中的一对电子与中心金属离子之间的共用键。
配位键的形成需要配体提供一个或多个孤对电子与中心离子形成配位键。
配位键的形成对配位化合物的性质起着关键作用。
2. 配体的性质配体是指能够提供一个或多个电子对与中心离子形成配位键的分子或离子。
配体的性质主要影响配位键的强弱和配位化合物的稳定性。
常见的配体有氨、水、氯等。
3. 中心离子的性质中心离子是指配位化合物中与配体形成配位键的金属离子或金属原子。
中心离子的性质包括电荷数、价态和配位数等。
中心离子的性质决定了配位化合物的结构和性质。
4. 配位化合物的结构与性质配位化合物的结构与性质主要受到配体种类、中心离子性质以及配位数等因素的影响。
配位化合物可以形成各种不同的结构,如线性、方向、平面、四面体等。
这些结构决定了配位化合物的性质,如颜色、磁性、溶解性等。
二、配位化合物的性质配位化合物具有许多独特的性质,以下将介绍其中的几个重要性质。
1. 颜色许多配位化合物显示出明亮的颜色,如蓝色、红色、黄色等。
这是由于配位键形成后,中心金属离子的d轨道发生分裂,产生能量差,吸收特定波长的光而呈现有色。
2. 磁性配位化合物可以表现出不同的磁性,包括顺磁性和反磁性。
顺磁性是指配位化合物中所含的未成对电子会受到外磁场的吸引,而提高磁性。
反磁性则相反,未成对电子会被排斥。
3. 溶解性配位化合物的溶解性与配体和中心离子的性质密切相关。
一般来说,具有极性配体的配位化合物在极性溶剂中溶解度较高,而中心离子大多数情况下并不直接影响溶解性。

化学反应中的配位化学化学反应中的配位化学是一门研究化学反应中配位物质的反应性质和化学变化的学科。
它在化学领域中具有重要的地位和作用,涉及到化学、物理、材料等多个领域。
本文将从配位化学的基础知识、应用现状和未来展望三个方面来探讨化学反应中的配位化学。
一、配位化学的基础知识1. 配位化学的概念配位化学是指利用有机或配位物与金属离子之间的化学反应,形成络合物(配合物)的一门化学学科。
配合物是指由中心离子(金属离子)和一定数量的配体(有机物或无机物)通过共价键或配位键形成的化合物,具有明确的化学性质和结构特征。
2. 配位化学的基本结构配位化学中离子的配位方式分为三种:线性型、分支型和环状型。
其中,线性型是指配体在金属离子周围形成的一条直线,如[Co(NH3)6]2+;分支型是指配体在金属离子周围形成的一条分支结构,如[Cr(edta)]-;环状型是指配体在金属离子周围形成的一个环结构,如[Mn(H2O)6]2+。
3. 配位化学的反应机制配位化学反应机制主要包括化学键的形成和断裂过程。
在形成化学键的过程中,配体发生了配位键形成的反应,即配体的一个或多个可供给位点上出现一个共价或配位键,形成配合物。
在断裂化学键的过程中,反应产物的配体发生了离去或转移反应,即配合物中的一个或多个配体由于其它反应的作用而离去或被替代。
二、配位化学的应用现状1. 金属配合物在催化反应中的应用金属配合物在催化反应中起到了至关重要的作用。
它可以加速反应速率、提高产率、减少副产物、改善反应条件等多种效果。
如:铂催化剂可以帮助丙烷的氧化反应,使其转化为丙酮。
另外,其他金属如镍、铁、钒、铬等也可以用作催化剂。
2. 金属配合物在材料领域中的应用金属配合物在材料领域中有广泛的应用,可以制备出多种性质优异的材料。
如:可溶于水的金属离子与各种溶液中的有机物反应,可以制备出具有吸附性、交换性和载体性的离子交换树脂。
此外,配位化学也可以用于制备与生物有关的材料,如透明质酸等。

配位化学的配位化合物合成配位化学是化学领域中的一个重要分支,研究的是金属离子与配体形成配位化合物的过程。
配位化合物合成的方法多种多样,可以通过配位反应、溶液反应、固体反应等途径来实现。
本文将介绍配位化学的配位化合物合成方法以及一些典型的实例。
一、配位反应法配位反应法是配位化合物合成的常用方法之一。
在配位反应过程中,金属离子与配体之间会发生配位键的生成或断裂,从而形成新的配位化合物。
常用的配位反应方法包括配体置换反应、配体加合反应和配位缩合反应等。
1. 配体置换反应配体置换反应是指用新的配体取代原有配体的过程。
在这个过程中,原有配体会与金属离子发生键的断裂,然后新的配体与金属离子形成新的配位键。
常见的配体置换反应包括水合作用和配体交换反应等。
例如,将氯化镍和亚硝酸钠反应可以得到亚硝酸镍:NiCl2 + 2 NaNO2 → Ni(NO2)2 + 2 NaCl2. 配体加合反应配体加合反应是指两种或多种配体与金属离子同时发生配位键生成的过程。
在这个过程中,多个配体与金属离子形成配位键,生成多核配位化合物。
常见的配体加合反应有配体加合聚合反应和配体加合还原反应等。
例如,二氯化铜和四氯化碳反应可以得到二氯化四氯化碳铜:CuCl2 + CCl4 → CuCl2(CCl4)3. 配位缩合反应配位缩合反应是指由两个或多个配体与金属离子反应生成一个较大的配位化合物的过程。
在这个过程中,两个或多个配体之间发生缩合,形成一个配位聚合物。
常见的配位缩合反应有缩合聚合反应和配位链反应等。
例如,二乙酸铜和巯基乙醇反应可以得到巯基乙醇合铜(II):Cu(O2CCH3)2 + HSCH2CH2OH → HSCH2CH2OOCCH3 +Cu(OOCCH3)2二、溶液反应法溶液反应法是指在溶液中进行配位化合物合成的方法。
在溶液中,金属离子和配体之间发生反应,形成溶液态的配位化合物。
溶液反应法适用于需要在溶液中合成大量配位化合物或需要对反应进行控制的情况。

配位化学原理
配位化学是无机化学的一个重要分支,主要研究配合物的形成、结构、性质和反应。
配位化学的基本原理包括以下几个方面:
1. 配位键理论:配位化学的核心理论是配位键理论,根据这一理论,配合物是由一个中心金属离子(配位中心)与周围的配体通过配位键结合而形成的。
配位键通常是由金属离子的d轨道与配体的轨道相互重叠形成的。
2. 配位数:配位数是指一个金属离子周围配体的个数,取决于金属离子的电子排布和配体的种类。
金属离子的配位数可以影响配合物的稳定性、化学性质和结构。
3. 配位体的选择:配位体的选择对配合物的性质和稳定性具有重要影响。
配体可以是单原子离子、配位化合物或有机分子,常见的配体包括水、氨、氯化物离子等。
4. 配位化合物的结构:配位化合物的结构通常是由中心金属离子和周围的配体组成的,结构可以是八面体、四面体、六角形等不同形式,取决于金属离子的配位数和配体的种类。
5. 同步化学和反应性:配合物的同步化学性质包括配位键的形成和断裂,金属离子的氧化还原性质等。
配合物可以参与各种反应,如配位置换、还原、氧化等。
总的来说,配位化学原理涉及金属离子与配体之间的相互作用、配合物的结构和性质、配位键的形成和断裂等方面,对于理解和预测配合物的性质和行为具有重要意义。

化学反应的配位化学的计算配位化学是研究配合物形成、反应机理和性质的学科,主要涉及配合物的形成和配位键的形成与破裂等。
在化学反应中,配位化学的计算是非常重要的,可以用来预测反应的可能性、探索机理以及优化实验条件。
本文将介绍几种常见的配位化学计算方法。
一、配位化学的基础概念1. 配位化学基础知识配位化学是指中心金属离子通过配位键与一个或多个配体形成配合物的过程。
在配合物中,中心金属离子和配体之间通过配位键连接。
配位键形成与破裂过程中可以伴随电子转移,导致配合物的性质和结构发生变化。
2. 配位数与配位键数配位数指的是中心金属离子周围配体的个数。
而配位键数则是指配位键的数量。
通过计算配位键数,可以确定配位数,同时也可以判断配体与中心金属离子之间的键的类型(配位键、离子键等)。
二、计算配位化学的方法1. 密度泛函理论(DFT)密度泛函理论是研究材料和分子的基本性质的一种方法。
在配位化学中,可以使用DFT方法计算配体分子和金属离子之间的结合能、键长、结构和电荷分布等。
通过计算可以得出配体的相对稳定性以及得到反应的能垒等信息。
2. 分子力学方法分子力学方法是一种计算化学中常用的近似计算方法,适用于大分子的计算。
在配位化学中,可以使用分子力学方法计算配体和金属离子之间的键长、键能以及配位平面的稳定性等。
分子力学方法计算速度快,但对于反应动力学和电子结构等细节缺乏精确描述。
3. 自洽反应场(SCRF)模型自洽反应场模型考虑了溶剂效应对配位化学的影响。
在计算过程中,可以考虑一个或多个溶剂分子与配体和金属离子的相互作用。
通过自洽反应场模型可以预测在溶液中的反应情况,预测络合物的稳定性等。
三、配位化学计算在实际应用中的例子1. 配位键的强度与稳定性通过配位化学的计算方法,可以预测配位键的强度和稳定性。
例如,可以计算不同配体与相同金属离子结合时的配位键能,并比较它们之间的强度差异。
这些计算结果可以帮助选择更合适的配体,提高配合物的稳定性。


配位化学知识点总结一、配位化学的基本概念配位化学是研究金属离子(或原子)与配体之间形成的配位化合物的结构、性质和反应的化学分支。
首先,我们来了解一下什么是配体。
配体是能够提供孤对电子与中心金属离子(或原子)形成配位键的分子或离子。
常见的配体有水分子、氨分子、氯离子等。
而中心金属离子(或原子)则具有空的价电子轨道,可以接受配体提供的孤对电子。
配位键是一种特殊的共价键,由配体提供孤对电子进入中心金属离子(或原子)的空轨道而形成。
配位化合物则是由中心金属离子(或原子)与配体通过配位键结合形成的具有一定空间结构和化学性质的化合物。
二、配位化合物的组成配位化合物通常由内界和外界两部分组成。
内界是配位化合物的核心部分,由中心金属离子(或原子)与配体紧密结合而成。
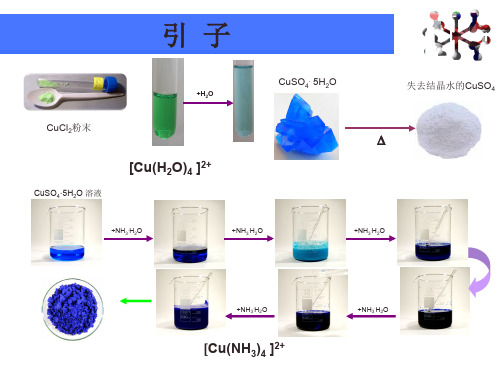
例如,在Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺就是内界。
外界则是与内界通过离子键结合的其他离子。
在上述例子中,SO₄²⁻就是外界。
中心金属离子(或原子)的化合价与配体的化合价之和等于配位化合物的总化合价。
配位数指的是直接与中心金属离子(或原子)结合的配体的数目。
常见的配位数有 2、4、6 等。
三、配位化合物的结构配位化合物具有特定的空间结构。
常见的配位几何构型有直线型、平面三角形、四面体、八面体等。
例如,配位数为 2 时,通常形成直线型结构;配位数为 4 时,可能是平面正方形或四面体结构;配位数为 6 时,多为八面体结构。
这些结构的形成取决于中心金属离子(或原子)的电子构型和配体的大小、形状等因素。
四、配位化合物的命名配位化合物的命名有一套严格的规则。
先命名外界离子,然后是内界。
内界的命名顺序为:配体名称在前,中心金属离子(或原子)名称在后。
配体的命名顺序遵循先无机配体,后有机配体;先阴离子配体,后中性分子配体。
对于同类配体,按配体中原子个数由少到多的顺序命名。
如果配体中含有多种原子,先列出阴离子配体,再列出中性分子配体。

化学配体知识点总结一、配位化学基础知识1. 配位化学的概念配位化学是研究过渡金属和配体之间的相互作用的一门学科。
过渡金属是一种特殊的元素,它们有着特殊的电子结构和反应性。
配体是一种能够与过渡金属形成配位键的分子或离子。
配体可以通过给出一个或多个电子对与过渡金属形成配位键,形成配位化合物。
通过配位化学,我们可以了解过渡金属化合物的结构、性质和反应机理。
2. 配体的种类配体可以分为无机配体和有机配体两类。
常见的无机配体包括水、氨、氰化物、羰基等,而有机配体则包括吡啶、醇、胺、醚等。
无机配体通常是通过原子间的键合来与金属形成配位键,而有机配体则通过配体分子中的功能基团与金属形成配位键。
3. 配位键的形成配位键是配体与过渡金属之间的一种化学键。
过渡金属的d轨道和配体的相应轨道之间存在重叠,从而形成了配位键。
配位键的形成是受到多种因素的影响,包括金属的价态、阳离子的电荷、配体的性质和大小等。
4. 配位数和几何构型通过配位化学,我们可以知道配位化合物中金属离子的配位数和几何构型。
配位数是指一个金属离子与其周围配体形成的配位键的数量。
根据配位键理论,金属离子的配位数可以是4、6、8等。
而几何构型则是指金属离子与配体形成的配位键的空间排列方式,包括正方形平面、正八面体、四面体等多种形式。
二、常见的配体及其性质1. 氨(NH3)氨是一种常见的配体,它可以形成强配位键,并可以与金属离子形成多种配合物。
氨的电负性较低,其空轨道可以与金属的d轨道重叠形成配位键。
氨配体通常是以配位键对的形式与金属形成配合物,因此它对金属离子的配位数和几何构型有重要影响。
2. 水(H2O)水是一种常见的氧化亲合力强的配体,它可以与过渡金属形成稳定的配位键,形成水合离子。
水合离子在水溶液中具有重要的生物和化学活性,对于生物体内的金属离子的稳定性和反应活性有着重要的影响。
3. 氰化物(CN-)氰化物是一种双电子配体,它在配位化学中有着重要的地位。

化学中的配位化学化学中的配位化学是现代化学的重要分支之一,它研究的是含有配体的化合物的性质和反应机理。
在配位化学中,分子中的中心原子和其周围的配体之间形成了一种特殊的结构——配合物。
这些配合物具有独特的物理化学性质,如催化反应、生物酶的活性、光学活性等等。
本文将简要介绍配位化学的相关概念和应用。
配体和配位键配体是指在配合物中与中心原子形成配位键的化学物质。
配体可以是单个原子或者是一个复杂的分子。
常见的配体包括水、氨、卤素、羰基、氮气和磷酸基等等。
在配合物中,配体以配位键的形式与中心原子结合,形成一个有机功能团体。
配合物中的配位键是一种新的化学键,它由配位原子和中心原子之间的电子共享所形成。
配合物的构成和稳定性一个配合物通常是由一个中心原子和若干个配体组成的化合物。
在配合物中,配体通过形成配位键与中心原子结合,在配位键的形成中充当了一个具有强吸电子特性的末端原子。
一个配合物中通常会存在多个配位键,这样就构成了一个三维的配位空间。
由于分子中的配体和中心原子之间的相互作用,配合物具有较高的稳定性和较低的反应活性。
配合物的结构与电子排布在配合物中,中心原子和配体之间形成的配位键具有不同的构型和电子排布。
大多数情况下,配合物的排布是球形对称的。
但是也存在一些不规则的配合物,如四面体和八面体配合物等等。
配位键的形成导致了分子中的原子的电子状态的改变,大部分配合物具有复杂的电子排布。
特别地,在一些过渡金属化合物中,d 轨道的电子也参与到配位键的形成中,这样就会产生一些更加复杂的配位键结构。
配合物的性质和应用配合物具有广泛的应用价值,在医药、催化剂、材料科学、化学分析等领域有着重要的应用。
其中,医药领域中的金属配合物被广泛用于肿瘤治疗、抗病毒治疗等。
催化剂领域中的过渡金属配合物可以通过空间位阻和电子效应的调节来提高催化剂的催化效率和选择性。
材料科学领域中的金属配合物可以被用于纳米材料的制备、电子材料的研究等。
化学分析领域中的金属配合物也被广泛用于水污染、重金属检测等方面。

配位化学知识点总结配位化学是化学的一个重要分支,它探讨的是化学中的配位作用,即两个或多个分子相互作用形成复合物。
在高分子材料、医药、冶金、土木工程和环境科学等领域应用广泛。
配位化学的基础知识和技能是化学专业学生和研究人员必备的求生技能之一。
本文将介绍配位化学的基本概念、重要原则以及主要应用。
一、配位化学的基本概念1. 配位体在化学中,配位体是指通过给体原子与金属中心之间的化学键与金属形成配合物的分子或离子。
著名的例子有氨、水、五硝基吡啶、乙二胺等。
2. 配位作用配位作用是指配位体的给体原子利用孤对电子与金属中心形成协同共振化学键的过程。
配位能力取决于给体原子的化学性质。
一般来说,仅具有孤对电子的原子或离子能够作为配位体。
在配位作用中,给体原子发生了电子的向金属中心的迁移,原子中的孤对电子与金属中心的未配对电子形成共价键。
3. 配位数配位数是一个复合物中与离子或分子互相作用的中心原子数量。
通常,金属离子具有高配位数,而范德瓦尔斯复合物和氢键配合物具有较低的配位数。
二、配位化学的重要原则1. 八面体配位八面体配位是指配合物中金属中心周围八个空间位置上配位体的均匀分布,也是最常见的配位几何形态之一。
一些典型的八面体配位化合物包括六氟合铁酸钾和硫脲铜硫脲。
2. 方阵配位方阵配位是一种由四个配位体组成的四面体形态的配位体,常见的方阵配位化合物包括四氟合镍和四氯合钴。
3. 配体场理论配体场理论是解释元素化学、配位化学和配位化合物性质的一种理论。
该理论通过将配位体组合成简单的场点,进而表征复合物的化学键结构和物理性质。
三、配位化学的主要应用1. 工业催化工业化学中的催化剂往往是由配位化合物构成,钯的催化反应、铂的催化脱氢和钨的催化氧化反应都是利用了配位体的协同作用完成的。
例如,五氯甲基钌配合物和卟啉钴配合物在氧气氧化和n 桥苯甲基乙烯二醇转移反应中均被用作催化剂。
2. 生物学知识生物配合物(例如血红蛋白和维生素B12)中的重要化学反应是由于配位体与活性中心原子之间的化学反应所形成的。

配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。

配位化学教案配位化学是现代化学领域的一个重要分支,它研究物质中金属离子与其它化合物或分子之间形成的配合物结构及性质。
配位化学在生物学、医学、材料科学等领域都有着广泛的应用。
本教案将介绍配位化学的基本概念、原理和相关实验方法,帮助学生深入了解这一领域的知识。
一、配位化学基本概念1.1 配位物的定义配位物是指由中心金属离子和配体分子通过配位键结合而成的化合物。
中心金属离子通常是过渡金属元素,而配体则是能够提供一个或多个孤对电子给中心金属离子形成配位键的分子或离子。
1.2 配位键的形成配位键是通过中心金属离子与配体之间的电子对共价或者协同共价键形成的。
配位键的形成可分为硬配位和软配位两种类型,硬配位以强极性金属离子和小的、硬的配体为主,软配位则以较软的金属离子和大的、软的配体为主。
1.3 配位数和配位几何配位数是指配位物中中心金属离子与配体形成的配位键的个数,而配位几何则是指这些配位键在空间中的排布方式。
常见的配位数包括2、4、6等,配位几何则有线性、四方形平面、八面体等形式。
二、配位化学实验方法2.1 合成配位化合物合成配位化合物是配位化学研究的重要实验方法之一。
通过控制金属离子与配体的摩尔比例及反应条件,可以合成出不同种类的配位化合物。
实验中需要注意反应条件的控制以及产物的纯度检测。
2.2 表征配位化合物表征配位化合物是验证合成产物结构及性质的关键步骤。
常用的表征方法包括元素分析、红外光谱、核磁共振等。
通过表征可以确定配位物的组成、配位键结构以及稳定性等信息。
2.3 测定配位物的性质测定配位物的性质是研究配位化学的重要手段。
包括测定配位化合物的磁性、光谱性质、配位键键长等。
这些性质的测定可以进一步揭示配位物的结构和反应机理。
三、配位化学在生物和医学中的应用3.1 金属配合物药物金属配合物药物是一类利用金属离子与配体形成的稳定配合物来治疗疾病的药物。
例如,铂类抗肿瘤药物顺铂、卡铂等就是金属配合物药物的代表。

配位化学分类配位化学是无机化学的一个重要分支,研究的是金属离子或中心原子与周围配体之间的相互作用和配位化合物的性质。
根据配位物中配体的种类和数量,配位化学可以分为多种类型。
一、单一配体配位化合物单一配体配位化合物是指配位物中只含有一种配体的化合物。
根据配体的性质,可以将单一配体配位化合物分为阴离子配位化合物、中性配位化合物和阳离子配位化合物。
1. 阴离子配位化合物阴离子配位化合物是指配位物中的配体为阴离子的化合物。
常见的阴离子配体有氰离子(CN-)、氨基(NH2-)、氯离子(Cl-)等。
阴离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
2. 中性配位化合物中性配位化合物是指配位物中的配体为中性分子的化合物。
常见的中性配体有水(H2O)、一氧化碳(CO)、氨(NH3)等。
中性配体可以通过与金属离子之间的协同作用来形成配位键。
3. 阳离子配位化合物阳离子配位化合物是指配位物中的金属离子为阳离子的化合物。
常见的阳离子配体有氯离子(Cl-)、溴离子(Br-)、碘离子(I-)等。
阳离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
二、多配体配位化合物多配体配位化合物是指配位物中含有多种配体的化合物。
根据配体的数量和结构,多配体配位化合物可以进一步分为双核配位化合物、多核配位化合物和大环配位化合物。
1. 双核配位化合物双核配位化合物是指配位物中含有两个金属离子的化合物。
双核配位化合物可以通过两个金属离子之间的配位键连接起来,形成一个稳定的配位体系。
2. 多核配位化合物多核配位化合物是指配位物中含有多个金属离子的化合物。
多核配位化合物可以通过多个金属离子之间的配位键连接起来,形成一个复杂的配位体系。
3. 大环配位化合物大环配位化合物是指配位物中含有大环结构的化合物。
大环配位化合物可以通过大环结构中的配体与金属离子之间的配位键形成。
三、配位聚合物配位聚合物是指配位物中含有多个相同或不同金属离子的化合物。

配位化学课件配位化学课件配位化学是化学中一门重要的学科,它研究的是金属离子与配体之间的相互作用和配位化合物的性质。
在化学课程中,配位化学是一个重要的分支,它不仅涉及到理论知识的学习,还需要进行实验操作和数据处理。
为了更好地教授配位化学知识,许多教师和学者制作了配位化学课件,以帮助学生更好地理解和掌握这门学科。
一、配位化学的基本概念和原理配位化学的基本概念是指金属离子与配体之间的相互作用。
在配位化学中,金属离子通常是正离子,而配体则是带有配位基团的分子或离子。
当金属离子与配体结合形成配位化合物时,它们之间会形成配位键,配位键的形成会导致配位化合物的性质发生变化。
配位化学的原理主要包括配位键的形成和配位化合物的性质。
配位键的形成是指金属离子和配体之间的电子转移过程,通常涉及到配体中的孤对电子和金属离子中的空轨道。
配位化合物的性质则取决于金属离子的性质、配体的性质以及配位键的强度和类型。
二、配位化学课件的设计和使用为了更好地教授配位化学知识,许多教师和学者制作了配位化学课件。
这些课件通常包括理论知识的介绍、实验操作的演示和数据处理的方法。
通过使用配位化学课件,学生可以更直观地了解配位化学的基本概念和原理,提高学习效果。
在配位化学课件的设计中,需要注意以下几个方面。
首先,课件的内容要简洁明了,重点突出,避免冗长和复杂的叙述。
其次,课件的布局要清晰,包括标题、目录、正文和总结等部分,方便学生阅读和理解。
另外,课件中可以加入一些配位化合物的结构示意图和实验操作的演示动画,以增加学生的兴趣和参与度。
配位化学课件的使用可以通过教师讲解和学生自学相结合的方式进行。
教师可以根据课件的内容进行讲解和解答学生的问题,同时可以通过实验操作的演示和数据处理的方法进行实践教学。
学生可以通过阅读课件、观看演示和进行实验操作,加深对配位化学知识的理解和掌握。
三、配位化学课件的优缺点配位化学课件的使用有许多优点。
首先,配位化学课件可以提供直观的图像和动画,帮助学生更好地理解和掌握配位化学的概念和原理。

配位聚合物在光电磁材料中的应用摘要:配位聚合物由于其特殊的结构及其在光电磁等方面优异的性能引起了科学家的广泛关注。
本文综述了金属有机化合物在光电磁材料中的应用,并对新型多功能材料在设计、合成与应用方面的广阔前景作了展望。
关键词:配位聚合物;多功能材料;非线性光学;材料化学引言:配位聚合物(coordination polymers)或金属-有机框架(metal-organic frameworks,简称 MOFs)是指利用金属离子与有机桥联配体通过配位键合作用而形成的一类具有一维,二维或三维无限网络结构的配位化合物[1]。
近年来,配位聚合物作为一种新型的功能化分子材料以其良好的结构可裁性和易功能化的特性引起了研究者浓厚的兴趣。
配合物有无机的金属离子和有机配体,因此它兼有无机和有机化合物的特性,而且还有可能出现无机化合物和有机化合物均没有的新性质。
配位聚合物分子材料的设计合成、结构及性能研究是近年来十分活跃的研究领域之一,它跨越了无机化学、配位化学、有机化学、物理化学、超分子化学、材料化学、生物化学、晶体工程学和拓扑学等多个学科领域,它的研究对于发展合成化学、结构化学和材料化学的基本概念及基础理论具有重要的学术意义,同时对开发新型高性能的功能分子材料具有重要的应用价值[2-7]。
并对分子器件和分子机器的发展起着至关重要的作用。
配位聚合物在新的分子材料中将发挥重要的作用。
配位化学理论在材料的分子设计中也将起着重要的指导作用。
材料按其性能特征和用途大致可划分为结构材料和功能材料两大类。
功能材料种类繁多,功能各异,其共同的特点和发展趋势是:(1) 性能优异;(2) 分子化;(3) 巨大的应用前景。
金属有机光电磁材料综合了这几方面特点,将发展成为新一代材料,其结构和性能决定了它的应用越来越广泛。
以下是金属有机化合物分别在光电磁材料中的应用。
1配位聚合物在光学材料中的应用配位聚合物的光学性质研究主要集中在光致发光、电致发光以及非线性光学等方面[8]。
1.1光致发光和电致发光材料当外界光照射到某些物质的时候,这些物质会发射出各种波长和不同强度的可见光,而当外界光停止照射时,这种发射光也随之消失,我们称这种发光现象叫光致发光( PL);当物质在一定的电场下,被相应的电能所激发也能产生发光现象,我们称之为电致发光(EL)。
发光的原因是由于分子吸收了某一特定波长的光而达到激发态,激发态是不稳定的中间态,当它通过辐射跃迁回到基态时,能量以分子荧光或磷光的形式释放,这时分子就表现出发光的性质。
发光材料是有机电致发光器件中的核心部分,现代合成技术的发展已经使染料的发光范围可以通过分子的剪裁精细调节。
经过 20多年的深入研究,已经设计合成出系列的红色(R)、绿色(G)和蓝色(B)发光材料,一些性能优良的材料已经用于制备单色发光器件如八羟基喹啉铝 (Alq3) 等。
某些有机化合物本身就有发光性质,但有些没有,通过与金属离子配位以后,有些原来不发光的有机化合物转变为能发光的配合物;有些原来发光很弱的有机化合物变成了强发光的金属有机配合物。
这说明了金属离子通过了某种方式提高了有机配体的发光效率。
这类有机化合物绝大多数是芳香族化合物,金属离子多为非过渡金属离子,如 8 -羟基喹啉可以与许多二价、三价、四价金属离子生成配合物,羟基蒽酮染料和偶氮染料与Al3+、Be2+、Ga3+、Sc3+、In3+、Th4+、Zr4+和Zn2+等离子都能形成发光配合物。
锌的有机配合物是有机薄膜电致发光(有机EL)器件中的重要材料,如 Zn-甲亚胺配合物都具有较高的熔点,因而有助于 EL器件的耐热性和提高器件的稳定性[9]。
它的其它配合物如 Zn(BTZ)2 (图1) 显示了很强的荧光,并且可通过真空蒸镀形成非常好的无结晶薄膜,亮度很高,接近为白色发光。
这是一种新型的RGB(Red-Green-Blue)发光材料[10]。
对于有机EL器件应用于全色显示和背照明是极其有意义的,还有锌的羟基黄酮类配合物,它们也可以用作电致发光材料[11]。
红色发光金属配合物中,主要有稀土铕配合物、金属卟啉配合物和金属钌配合物等。
最早报道用于有机电致发光器件的稀土铕配合物是三价铕离子与三氟乙酰噻吩丙酮( TTA) (结构见图2)的二元配合物Eu(TTA)3。
Kido等将Eu配合物作为客体发光材料掺杂到主体材料中,形成主客体结构[12]。
在最佳条件下得到器件的起亮电压为6 V,最大亮度达到 460 cd·m-2(16V)。
这是目前 Eu配合物 EL材料中发光亮度最高的器件。
1.2非线性光学材料当光和物质相互作用时,会产生吸收、反射、散射和发光等和光的强度发生变化的效应其入射的频率(或能量)则没有变化。
而在激光这类高强度的电磁场和物质相互作用时会产生非经典光学的频率、相位、偏振和其它传输性质变化的新电磁场。
能够起这种作用的物质我们称之为非线性光学材料。
如二阶非线性光学材料,是指它能和入射的基频为ω的光波相互作用后产生频率为2ω的倍频光波. 随着科学高速发展而进入信息技术时代,非线性光学材料研究在现代激光技术、光学通讯、光子计算和动态成像等高新技术中都有广泛应用。
第一篇报道金属有机化合物的非线性光学(NLO)性质的文章发表于1986年[13],从那以后,金属有机非线性光学材料的研究逐步展开,不断深入。
总的发展过程是:由随机测试发展到有意识地进行分子设计;由测试粉末倍频效应发展到测试(或计算)分子二阶非线性系数β;由二阶非线性光学效应扩展到三阶效应;由借用有机非线性光学材料的分子设计理论逐步发展到总结金属有机化合物自身的结构与性能的关系。
近年来,Marder等合成了一系列带二茂铁基团的吡啶季铵盐(如图3),其中当 X-为碘阴离子时,化合物的粉末倍频效应为尿素的220倍[8],这是迄今为止金属有机化合物中粉末倍频效应最强的化合物。
通过改变过渡金属的氧化状态(d电子数目)、几何构型及它们的顺磁反磁性可以改进这类化合物的非线性光学特性。
目前已经对一系列有机金属分子的 NLO系数和不同金属离子、配体成键方式和共轭性间的关系进行了研究。
其中金属羰基化合物如:Cr (η6-C6H5X)(CO)3 (X = H,OMe,NH2,COOMe) ,其中芳基作为给体通过d-π*反馈键而作为基态受体[14];金属茂烯类:一系列铁和钌的二茂铁作为给体,以共轭键联结不同受体的配合物呈现很高的β值[15];它们在UV和可见光区具有两个强吸收带。
由EHMO计算表明能量最低的跃迁是 MLCT带。
而最高的能量的跃迁是具有一定金属成分的配体的π→π*跃迁。
秦金贵等合成了多种高价钛、锆的多茂金属有机化合物,发现该类配合物具有较浅的颜色,在可见区基本透明,并能较容易结晶为非心空间群,具有潜在的应用价值。
他们还合成了一类线型有机汞化合物,研究表明该类化合物具有较大β值和较宽的透过波段[16] 金属有机配位化合物的NLO材料近年来有了很大的进展:如 Thompson的水杨醛腙类的一维链状配合物、Sakaguchi等的联吡啶钌衍生物以及一些钼和钨的亚硝基配合物等。
具有代表性的是平面型金属配合物反式 [M(L)2X (σ- C6H5A)][17]其中M = Ni,Pd和 Pt作为桥,联结 X = I,Br,Cl等电子给体和 Ph-A (A = CHO,NO2 )等电子受体,L = P (Et)3等。
后来也对一系列过渡金属配合物的二阶NLO进行过研究[18],特别是对混合价配合物 [(NH3)5Ru-N≡C-Ru (CN)5]的研究[19],它具有目前最大的二阶NLO系数。
2配位聚合物在导电材料中的应用近年来,由线性碳桥桥联的过渡金属有机化合物(又称金属有机“分子导线”)以其在一维分子导体、液晶材料和非线性光学材料方面的潜在应用价值引起学术界和产业界的关注。
一维无限链状多烯的离域体系可用作具有导电性和非线性光学性能的金属有机低聚物和聚合物的前体,也可用于合成新的多不饱和有机化合物。
可通过分子设计与合成将含有机配体的过渡金属 LnM引入共轭桥的两端或嵌入到碳链中间。
金属有机片断的引入可增加不饱和碳链的稳定性,其可极化、电子受授等性质和MLCT(金属-配体电荷转移)作用或非中心对称性则会增强这类棒状π离域体系分子的液晶性质、非线性光学性质和一维导电性[20]。
用于导电材料的金属有机化合物主要有两类:(1)低维配位聚合物,如基于大环平面如酞菁、卟啉等堆砌成柱的导电材料。
(2)电荷转移复合盐,其中包括富勒烯(Fullerene)金属盐。
酞菁(Pc)是一种 18π电子体系的大环共扼平面配体。
对于PcCu I、PcNiI、PcH2 I 酞菁配合物,其室温电导率可达 500~2000 S·cm-1 [21] 电导呈现出明显的各向异性。
Joyner和Kenny首先报道了以氧为桥联配体的一维酞菁聚合物[PcMO ]∞ (M = Si,Ge,Sn)。
从[PcGaF ]n的晶体结构数据可知其面间距为3187 Å,大于分子间π -π相互作用的距离(314 Å)[22]而在这些聚合物中掺杂碘时,其电导率可增加高达109数量级。
粉末X 射线研究表明,分子链中酞菁环的面间距越近,π轨道的重叠越大,其电导率越高。
国内中科院钱人元和王佛松等在聚吡咯、聚苯胺等导电高分子材料方面也开展了大量工作.具有导电性能的分子金属电荷转移盐可分为三大类:即DA、DX和CA型,其中C为阳离子,X为阴离子,导电主要来源于D和A组分。
随着第一个有机金属导体TTF-TCNQ的出现,许多导体、超导材料也相继问世,如电化学结晶合成的DA型导体α-( EDT-TTF) [Ni(dmit)2](TTF) [Ni(dmit)2]2,α和α′-(TTF) [Pd(dmit)2 ]2等甚至显示超导性质,DX型分子导体k-(ET)2Cu[N(CN)2]Br和k-(ET)2Cu [N(CN)2] Cl等等。
3配位聚合物在磁性材料中的应用由于当代高技术发展的需要,铁磁体作为信息记录、存储材料越来越重要,而金属有机材料质轻、易加工,很多方面迫切需要以有机铁磁材料代替无机铁磁材料。
十几年来,科学家们试图设计、合成出稳定性好、磁含量高、铁磁转变温度高和具有较高矫顽力的金属有机铁磁体,取得了一些可喜的成果。
20世纪 80年代中期,意大利化学家Gatteschi首先把具有成桥能力的有机自由基NITR(2- R-4,4,5,5-四甲基-3-氧化-咪唑啉-1-氧基自由基,R为脂肪基团或芳香取代基团)作为自旋载体引入分子铁磁体的合成,制备了许多一维链金属-自由基化合物 M(hfac)2-NITR(hfac为六氟乙酰丙酮),极大地丰富了低维磁体系的研究内容。