化学平衡常数 专题
- 格式:doc
- 大小:697.00 KB
- 文档页数:4

2024届全国高考(新高考)化学复习历年真题好题专项(化学平衡常数及转化率计算)练习1.[2022ꞏ广东卷]恒容密闭容器中,BaSO 4(s )+4H 2(g )⇌BaS (s )+4H 2O (g )在不同温度下达平衡时,各组分的物质的量(n )如图所示。
下列说法正确的是( )A.该反应的ΔH <0B.a 为n (H 2O )随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO 4,H 2的平衡转化率增大2.[2022ꞏ海南卷]某温度下,反应CH 2===CH 2(g )+H 2O (g )⇌CH 3CH 2OH (g )在密闭容器中达到平衡。
下列说法正确的是( )A.增大压强,v 正>v 逆,平衡常数增大B.加入催化剂,平衡时CH 3CH 2OH (g )的浓度增大C.恒容下,充入一定量的H 2O (g ),平衡向正反应方向移动 D.恒容下,充入一定量的CH 2===CH 2(g ), CH 2===CH 2(g )的平衡转化率增大3.[2023ꞏ专题模块测试]K 、K a 、K w 分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )A.在500 ℃、20 MPa 条件下,在5 L 密闭容器中进行合成氨的反应,使用催化剂后K 增大B.室温下K (HCN )<K (CH 3COOH ),说明CH 3COOH 的电离程度一定比HCN 的大 C.25 ℃时,pH 均为4的盐酸和NH 4I 溶液中K w 不相等D.2SO 2+O 2 催化剂△2SO 3达平衡后,改变某一条件时K 不变,SO 2的转化率可能增大、减小或不变4.[2023ꞏ湖南师大附中高三月考]N 2O 5是一种新型硝化剂,一定温度下发生反应2N 2O 5(g )⇌4NO 2(g )+O 2(g ) ΔH >0,T 1温度下的部分实验数据如下表所示。
t /s 0 500 1 000 1 500c (N 2O 5)/(molꞏL -1) 5.00 3.52 2.50 2.50下列说法正确的是( )A .该反应在任何温度下均能自发进行B .T 1温度下的平衡常数为K 1=125,1 000 s 时N 2O 5(g )转化率为50%C .其他条件不变时,T 2温度下反应到1 000 s 时测得N 2O 5(g )浓度为2.98 molꞏL -1,则T 1<T 2D .T 1温度下的平衡常数为K 1,T 2温度下的平衡常数为K 2,若T 1>T 2,则K 1<K 25.[2023ꞏ福建福州质检]在1 L 的密闭容器中充入2 mol N 2和7 mol H 2,发生反应N 2+3H 2⇌2NH 3,保持其他条件不变,相同时间内测得NH 3的浓度与温度的关系如图所示。
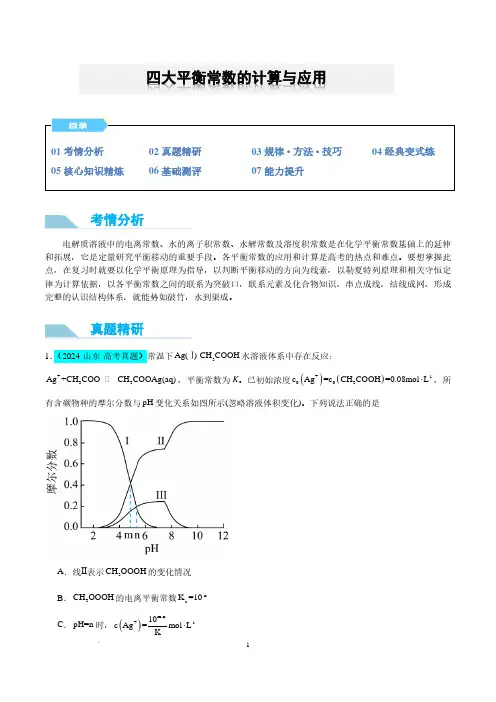
四大平衡常数的计算与应用考情分析真题精研D .pH=10时,()()+-13c Ag+c CH COOAg =0.08mol L⋅2.(2024·安徽·高考真题)环境保护工程师研究利用2Na S 、FeS 和2H S 处理水样中的2+Cd 。
已知25℃时,2H S 饱和溶液浓度约为-10.1mol L ⋅,()-6.97a12K H S =10,()-12.90a22K H S =10,-17.20sp K (FeS)=10,-26.10sp K (CdS)=10。
下列说法错误的是A .2Na S 溶液中:()()()()()+--2-c H+c Na =c OH +c HS +2c S +B .-120.01mol L Na S ⋅溶液中:()()()()+2---c Na >c S >c OH >c HSC .向()2+-1c Cd=0.01mol L⋅的溶液中加入FeS ,可使()2+-8-1c Cd <10mol L ⋅D .向()2+-1c Cd=0.01mol L⋅的溶液中通入2H S 气体至饱和,所得溶液中:()()+2+c H >c Cd注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp 可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a (或K b )、K h 均变大。
规律·方法·技巧A .pH=6.5时,溶液中()()2-2+3c CO <c PbB .()()2+3δPb=δPbCO 时,()2+c Pb <1.010×()-1M lg c /mol L ⋅(M 代表+Ag 、-Cl 或2-4CrO )随加入NaCl 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列叙述正确的是经典变式练核心知识精炼(1)A、C、B三点均为中性增大(2)D点为酸性溶液,E点为碱性溶液(1)a、c点在曲线上,a→c Na2SO4固体,但K sp不变基础测评1.(2024·陕西商洛·模拟预测)室温下,用-10.1mol L ⋅的二甲胺()32CH NH 溶液(二甲胺在水中的电离与一水合氨相似)滴定-110.00mL0.1mol L ⋅盐酸溶液。

专题复习十化学平衡常数班级:___________________姓名:_____________________学号:_________________1、化学平衡常数的表达式2、如何理解化学平衡常数K的意义?K值大小与可逆反应进行程度有怎样的关系?3、化学平衡常数的特点是什么?在使用平衡常数时,为什么一定要指明反应温度?4、转化率的计算式是什么?平衡常数与反应物的平衡转化率都能表示反应进行的程度,它们之间有什么不同?哪一个更能反映出反应的本质?5、平衡常数的书写①W(s)+I2(g)WI2 (g)②常温下,HAc溶液电离平衡常数③CO32-(aq)+H2O HCO3-(aq)+OH-(aq)④AgCl(s) Ag+(aq)+Cl-(aq)⑤C(s)+ H2O(g)CO(g)+ H2(g)⑥C H3COOH(l)+ CH3OH(l) CH3COOCH3(l)+ H2O(l)归纳:说明书写化学平衡常数表达式的若干注意事项。
同一可逆反应的K正与K逆间存在怎样的关系?练习一:在常温下,下列反应的平衡常数的数值如下,请填写下列空白:2NO(g)2(g)+O 2(g) K 1=1×1030 2H 2(g)+O 2(g) 2O(g) K 2=2×1081 2CO 2(g) 2CO(g)+O 2(g) K 3=4×10-92(1)常温下,NO 分解产生O 2的反应的平衡常数表达式为 ;(2)常温下,NO 、H 2O 、CO 2三种化合物分解放出O 2的倾向由大到小的顺序为 ;练习二:下列反应在210℃达到平衡: ①PCl 5(气)PCl 3(气)+Cl 2(气)(正反应吸热)K 1=1 ②CO(气)+Cl 2(气)COCl 2(气)(正反应放热) K 2=5×104 ③COCl 2(气)CO(气)+ Cl 2(气) (正反应吸热)K 3(1)根据反应①的平衡常数K 1表达式,下列等式一定成立的是a.[PCl 5]=[PCl 3]=[Cl 2]=1b. [PCl 5]=[PCl 3][Cl 2]=1c. [PCl 5]=[PCl 3][Cl 2] 反应②和反应③的K 3 和K 2值的关系为(2)降低Cl 2浓度,反应③的K 2值 (填“增大”、“减少”或“不变”)(3)要使反应①和反应②的K 值相等,应采取的措施是讨论:教材P 55有关大气固氮和工业固氮的平衡常数K 值分别如下表一和表二。

(也叫(也叫 )值越大,表示反应进行得 ,反应物转化率,反应物转化率 ;值越小,表示反应进行得 ,反应物转化率,反应物转化率 。
mA(g)+ nB(g)pC(g)+ qD(g),反应向,反应向进行进行 ,反应向,反应向进行进行 若升高温度,K值增大,则正反应为若升高温度,K值增大,则正反应为 反应1、化学平衡常数只与1、化学平衡常数只与 (g)(g)NH 1/2N 的关系式:的关系式: 。
的关系式:的关系式:。
的关系式:的关系式:O(g)CO )平衡常数的大小反映了化学反应进行的 反应若升高温度,K值减小,则正反应为若升高温度,K值减小,则正反应为 有关,与反应物或生成物的浓度无关。
有关,与反应物或生成物的浓度无关。
Fe(s)+CO 。
t ℃ 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 D 、c(CO) = c(CO 2) E、化学平衡常数K 不变不变F 、单位时间内生成CO 的分子数与生成H 2O 的分子数相等的分子数相等 ⑷某温度下,各物质的平衡浓度符合下式:c(CO 2)×)×c(H c(H 2)=c(CO)×)=c(CO)×c(H c(H 2O),试判此时的温度为 。
试推导在下列浓度下反应进行的方向试推导在下列浓度下反应进行的方向 序号 CO(mol/L ) H 2O (mol/L )CO 2 (mol/L )H 2 (mol/L )Q C 与K 关系及反应进行方向 1 0.3 0.5 0.4 0.4 2 1.0 0.3 0.5 0.6 3 0.8 1.6 0.7 1.7 7对于反应2SO 2(g)+ O 2(g) == 2SO 3(g) ,若在一定温度下,若在一定温度下,将0.1mol 的SO 2(g)和0.06mol O 2(g)注入一体积为2L 的密闭容器中,当达到平衡状态时,测得容器中有0.088mol 的SO 3(g) 试求在该温度下试求在该温度下(1)此反应的平衡常数。


专题41化学平衡常数及计算1.【2022年辽宁卷】某温度下,在1L 恒容密闭容器中2.0mol X 发生反应2X(s)Y(g)+2Z(g) ,有关数据如下:时间段/min 产物Z 的平均生成速率/-1-1mol L min⋅⋅0~20.200~40.150~60.10下列说法错误的是A .1min 时,Z 的浓度大于-10.20mol L ⋅B .2min 时,加入0.20mol Z ,此时正逆v (Z)<v (Z)C .3min 时,Y 的体积分数约为33.3%D .5min 时,X 的物质的量为1.4mol2.【2022年江苏卷】用尿素水解生成的3NH 催化还原NO ,是柴油机车辆尾气净化的主要方法。
反应为32224NH (g)+O (g)+4NO(g)4N (g)+6H O(g) ,下列说法正确的是A .上述反应ΔS<0B .上述反应平衡常数()()()()46224432c N c H O K=c NH c O c (NO)⋅⋅⋅C .上述反应中消耗31mol NH ,转移电子的数目为232 6.0210⨯⨯D .实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小3.(2021·湖南真题)已知:()()()A g 2B g 3C g + 0H ∆<,向一恒温恒容的密闭容器中充入1molA 和3molB 发生反应,1t 时达到平衡状态I ,在2t 时改变某一条件,3t 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
下列说法正确的是A .容器内压强不变,表明反应达到平衡B .2t 时改变的条件:向容器中加入C C .平衡时A 的体积分数ϕ:(II)(I)ϕϕ>D .平衡常数K :(II)(I)<K K 4.(2020·浙江高考真题)5 mL 0.1mol ⋅L −1KI 溶液与1 mL 0.1mol ⋅L −1FeCl 3溶液发生反应:2Fe 3+(aq )+2I −(aq )⇌2Fe 2+(aq )+I 2(aq ),达到平衡。

化学平衡常数————————————————————————————————作者: ————————————————————————————————日期:ﻩ(十一)化学平衡常数专题1.某温度时,N2+3H22NH3的平衡常数K=a,则此温度下,NH332H2+错误!N2的平衡常数为( )A.错误!B.错误!C.错误!aD.错误!2.某恒定温度下,在一个2 L的密闭容器中充入A气体、B气体,测得其浓度为2 mol·L-1和1mol·L-1;且发生如下反应:3A(g)+2B(g)⇌4C(?)+2D(?)已知“?”代表C、D 状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5∶4,则下列说法中正确的是()①该反应的化学平衡表达式:K=错误!②此时B的转化率为35%③增大该体系压强,平衡向右移动,但化学平衡常数不变④增加C的量,A、B转化率不变A.①② B.②③ C.①④D.③④3.[双选]氮元素的+4价氧化物有两种,它们之间发生反应:2NO2⇌N2O4ΔH<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
下列说法正确的是()A.b点的操作是压缩注射器B.c点与a点相比,c(NO2)增大,c(N2O4)减小C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数K b>KcD.d点:v(正)>v(逆)4.[双选]利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)⇌5CO2(g)+I2(s)ΔH。
不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。
下列说法正确的是()A.T1<T2,ΔH>0B.T1温度下,该反应的平衡常数为1024C.T2温度下,0~0.5 min内,CO的平均反应速率为0.3mol·L-1·min-1D.T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.85.已知某化学反应的平衡常数表达式为K=\f(c(CO2)·c(H2),c(CO)·c(H2O)),在不同的温度下该反应的平衡常数如表所示:t/℃700800 830 1 000 1 200K 1.671.11 1.00 0.600.38下列有关叙述不正确的是( )A.该反应的化学方程式是CO(g)+H2O(g)⇌CO2(g)+H2(g)B.上述反应的正反应是放热反应C.若在1L的密闭容器中通入CO2和H2各1 mol,5min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态D.若平衡浓度符合下列关系式:错误!=错误!,则此时的温度为1 000℃6.在某一体积可变的恒温密闭容器中发生如下反应:X(g)+Y(g)⇌2Z(g) ΔH<0。

五大平衡常数 专题平衡常数影响因素:所有平衡常数K 、K a 、K b 、K w 、K h 、K sp ,都只与温度和本身性 一、化学平衡常数可逆反应达到平衡后的体系中,m A(g)+n B(g)⇌p C(g)+q D(g) 表达式 K =)B ()A ()D ()C (n m q p c c c c ⋅⋅①T 升高,K 增大,则正反应吸热;T 升高,K 减小,正反应放热。
②Q c K ,反应向正方向进行;Q c =K ,反应刚好达到平衡; Q cK,反应向逆方向进行。
③同一个反应,正逆平衡常数乘积为1, K (正)·K (逆)=1 ④化学计量数均扩大n 倍或缩小为,则K '=K n或K '= ⑤几个不同的可逆反应,Ⅲ式=Ⅰ式+Ⅱ式,则K Ⅲ=K Ⅰ·K Ⅱ。
或Ⅲ式=Ⅰ式-Ⅱ式,则K Ⅲ=常考点:(1)化学平衡常数表达式; (2)化学平衡常数的计算;(3)由化学平衡常数计算初始浓度或平衡浓度; (4)计算反应物的平衡转化率或生成物的产率;(5)用化学平衡常数K 判断平衡移动的方向、反应的热效应等。
二、电离平衡常数弱酸的电离平衡中,HA ⇌H ++A -表达式 K a =)HA ()A ()H (c c c —⋅+弱碱的电离平衡中,BOH ⇌B ++OH -表达式 K b =)BOH ()OH ()B (c c c —⋅+①T 升高,K 增大;电离是吸热的;②K 越大,酸的酸性或碱的碱性相对越强;反之,K 越小,酸的酸性或碱的碱性相对越弱。
③多元酸的K a1>>K a2>>K a3。
主要考查点:(1)直接计算电离平衡常数、水解平衡常数;(2)由电离平衡常数、水解平衡常数推断弱酸、弱碱的相对强弱或浓 度;(3)由K a 、K b 或K h 计算pH;(4)K a 、K b 、K h 、K W 之间的定量关系。
三、水的离子积常数(1)纯水以及电解质水溶液中;H 2O ⇌H ++OH —或H 2O+H 2O ⇌H 3O ++OH —表达式K W =c (OH -)·c (H +) (2)拓展应用在液氨、H 2O 2、乙醇等的自偶电离平衡中。

专题7 化学平衡常数及反应自发性【知识预习】 一、化学平衡常数1.概念:在一定温度下,一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数比值,用符号K 表示。
2.表达式:对于一般的可逆反应:m A (g )+n B (g )p C (g )+q D (g ),在一定温度下达到平衡时:K =()()()()p q m n c C c D c A c B 。
3.注意事项:(1)表达式中各物质的浓度是平衡时的浓度,不是起始浓度也不是物质的量。
(2)对于一个具体的可逆反应,平衡常数K 只与温度(T )有关,与反应物或生成物的浓度无关。
(3)正逆反应的化学平衡常数不一样,互为倒数关系。
(4)反应物或生成物中有固体或纯液体存在时,由于其浓度看视为常数,是固定不变的,不能代入平衡常数表达式中。
(5)化学平衡常数是指某一具体反应的平衡常数。
若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
(6)稀溶液中进行的反应,如有水参加,水的浓度不必写在平衡常数表达式中。
4.化学平衡常数K 的应用(1)化学平衡常数值的大小是可逆反应进行程度的标志。
K 值越大,说明平衡时生成物的浓度越大,反应物的浓度越小,它的正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越高。
反之,则相反。
一般地,K >105时,该反应就进行得基本完全了。
可以说,化学平衡常数是在一定温度下一个反应本身固有的内在性质的定量体现。
(2)可以利用K 值做标准,判断正在进行的可逆反应是否平衡及不平衡时向何方进行建立平衡。
(Q :浓度积)对于可逆反应a A(g)+b B(g)c C(g)+d D(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:()()()()p q m n c C c D c A c B =Q c,Q c ⎩⎪⎨⎪⎧<K 反应向正反应方向进行,v 正>v 逆=K 反应处于化学平衡状态,v 正=v 逆>K 反应向逆反应方向进行,v 正<v 逆。

平衡常数和平衡转化率计算专题一、已知初始浓度和平衡浓度求平衡常数和平衡转化率1.化学反应2SO 2(g )+O 2(g )2SO 3(g )是硫酸制造工业的基本反应。
将0.050mol 的SO 2(g )和0.030mol 的O 2(g )注入体积为1.0L 的密闭反应器,并置于某较高温度下的恒温环境中,达到化学平衡后,测的反应器中有0.044 mol SO 3(g ),求该温度下反应的平衡常数及SO 2和O 2平衡转化率。
2、在某温度下,将H 2(g)和I 2(g)各0.1mol 混合物充入10L 的密闭容器中,充分反应达到平衡时,测得[H 2]=0.0080mol/L ,求:(1)反应的平衡常数及H 2和I 2的平衡转化率(2)其它条件不变,充入的H 2(g)和I 2(g)各0.2mol,求达平衡时各物质的平衡浓度、及H 2和I 2的平衡转化率 。
二、已知平衡转化率和初始浓度求平衡常数1.反应SO 2(g)+ NO 2(g) SO 3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L 的SO 2(g)和NO 2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO 2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数及NO 2的转化率。
(2)若NO 2(g)的初始浓度增不变,SO 2(g)的初始浓度增大到3mol/L,则它们的转化率变为多少?三、已知平衡常数和初始浓度求平衡浓度及转化率。
1.温度为1200℃时测的反应CO 2(g )+H 2(g ) CO (g )+H 2O (g )的平衡常数K 为1。
若反应从CO 2(g )和H 2(g )开始,且CO 2(g )和H 2(g )的初始浓度均为0.0100 mol/L 时,计算各物质的平衡浓度及CO 2和H 2的平衡转化率。
【小结】化学平衡常数与转化率的区别和联系由化学平衡常数K 可以推断反应进行的 ,K 越大,说明反应进行的越 ,反应物的转化率也越 ,但K 只与 有关;转化率也可以表示某一可逆反应进行的 ,α越大,反应进行的越 ,但是α与反应物的起始浓度等因素有关,转化率变化,K 变化。
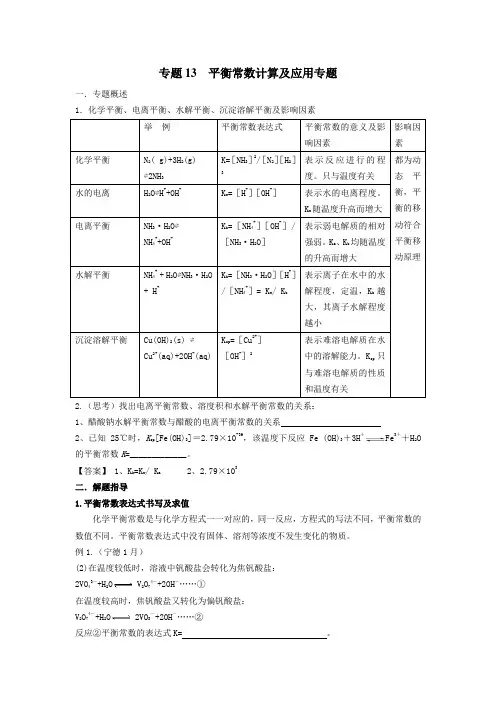
专题13 平衡常数计算及应用专题一.专题概述1.化学平衡、电离平衡、水解平衡、沉淀溶解平衡及影响因素2.(思考)找出电离平衡常数、溶度积和水解平衡常数的关系:1、醋酸钠水解平衡常数与醋酸的电离平衡常数的关系2、已知25℃时,K sp [Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+Fe 3++H 2O 的平衡常数K =_____________。
【答案】 1、K h =K w / K a 2、2.79×103二.解题指导1.平衡常数表达式书写及求值化学平衡常数是与化学方程式一一对应的,同一反应,方程式的写法不同,平衡常数的数值不同。
平衡常数表达式中没有固体、溶剂等浓度不发生变化的物质。
例1.(宁德1月)(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:2VO 43-+H 2O V 2O 74-+2OH -……① 在温度较高时,焦钒酸盐又转化为偏钒酸盐:V 2O 74-+H 2O 2VO 3-+2OH -……② 反应②平衡常数的表达式K= 。
【答案】 K=[OH-]2[VO3-]2/[V2O74-]例2.【2014年山东高考】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO 2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl 2(g)2ClNO(g) K2∆H < 0 (II)(1)4NO 2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
【答案】K12/K22.判断反应进行的程度对于同类型的反应,K的表达式相同时,K值越大,表示反应进行的程度越大;K值越小,表示反应进行的程度越小。
常用于电离、水解、沉淀溶解平衡。
例3.(2012年厦门市考前模拟)根据右表提供的数据,下列判断正确的是A. 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3B. 结合H+ 的能力:ClO->CO32->F-C. 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32- + 2HF = 2F- + H2O + CO2↑D. 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO- + CO2 + H2O = HCO3- + HClO【答案】 D3.判断反应进行的方向或平衡移动方向任意状态下的生成物与反应物的浓度幂之积的比值为Qc,则 Qc=K,反应处于平衡状态Qc>K,反应向逆反应方向进行 Qc<K,反应向正反应方向进行例4. 【2014年江苏高考】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)下列说法正确的是A.该反应的正方应为放热反应B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小C.容器I中反应达到平衡所需时间比容器Ⅲ中的长D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行【答案】A、D例5.(2013福师大附中5月)(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:2NH4+(aq) + Mg(OH)2(s) Mg2+(aq) +2NH3·H2O(aq)写出上述反应的平衡常数表达式某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验请分析实验①、②产生不同现象的原因:。
选择题:下列哪个因素不会影响化学平衡常数的大小?A. 温度B. 压力C. 反应物和生成物的浓度D. 反应的本质(正确答案)对于一个给定的化学反应,当其达到平衡时,平衡常数K的值表示什么?A. 反应物的初始浓度B. 生成物的最终浓度C. 反应物和生成物在平衡时的浓度幂之积的比值(正确答案)D. 反应速率和生成速率的比值如果一个反应的平衡常数K很大,这意味着什么?A. 反应很难进行B. 反应在正向进行时会达到很高的浓度C. 反应在平衡时,生成物的浓度远高于反应物(正确答案)D. 反应速率很慢当温度改变时,化学平衡常数K的值会如何变化?A. 总是增加B. 总是减少C. 可能增加也可能减少,取决于反应的热效应(正确答案)D. 保持不变对于一个放热反应,当温度升高时,其平衡常数K的值会如何变化?A. 增加B. 减少(正确答案)C. 保持不变D. 无法确定下列哪个表达式正确地表示了反应A + B ⇌ C + D的平衡常数K?A. K = [A][B]/[C][D]B. K = [C][D]/[A][B](正确答案)C. K = [A] + [B]/[C] + [D]D. K = [C] - [D]/[A] - [B]在一个密闭容器中,反应2SO₂+ O₂⇌2SO₃达到平衡。
如果此时增加SO₂的浓度,平衡常数K的值会如何变化?A. 增加B. 减少C. 保持不变(正确答案)D. 无法确定对于一个给定的化学反应,其平衡常数K的值与反应的什么性质有关?A. 反应速率B. 反应的热效应C. 反应物和生成物的种类及反应的温度(正确答案)D. 反应物的初始浓度在一个可逆反应中,如果平衡常数K的值很小,这意味着什么?A. 反应在平衡时,反应物的浓度远高于生成物(正确答案)B. 反应在平衡时,生成物的浓度远高于反应物C. 反应很容易进行D. 反应速率很快。
2021年高考化学复习化学平衡及平衡常数专题练习(含答案)根据勒夏特列原理,如一个已达平衡的系统被改变,该系统会随之改变来抗衡该改变,以下是2021年高考化学复习化学平衡及平衡常数专题练习,请考生练习。
2.可逆反应2SO2(g)+O2(g) ??2SO3(g)达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K 为平衡常数,Qc为浓度商)()A.Qc不变,K变大,O2转化率增大B.Qc不变,K变大,SO2转化率减小C.Qc变小,K不变,O2转化率减小D.Qc增大,K不变,SO2转化率增大【答案】C【解析】当可逆反应2SO2+O2??2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,浓度商Qc变小,平衡向右移动,SO2的转化率增大,但O2的转化率降低,温度不变,K值不变。
3.(2021天水质检)工业上常用可逆反应2SO2(g)+O2(g)??2SO3(g) 0制备硫酸,下列对该反应的说法正确的是 ()A.增大压强,平衡向逆反应方向移动B.升高温度,平衡向正反应方向移动C.当v(SO2)∶v(O2)∶v(SO3)=2∶1∶2时,反应达到平衡状态D.当单位时间内生成2 mol SO2的同时生成2 mol SO3,说明该反应达到平衡状态【答案】D4.(2021合肥一模)已知:A(g)+2B(g)??2C(g) H=-Q kJ/mol (Q0),在恒容的密闭容器中充入1 mol A和2 mol B,在一定条件下反应。
下列有关说法正确的是()A.平衡前,随着反应的进行,容器内气体密度逐渐减小B.平衡时,该反应放出的热量为Q kJC.平衡后,再向容器中通入1 mol 氦气,A的转化率增大D.平衡后,缩小容器体积,A的浓度增大【答案】D5.(2021四川卷)在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应 X(g)+Y(g)??2Z(g) 0,一段时间后达到平衡,反应过程中测定的数据如下表:t/min 2 4 7 9 n(Y)/mol 0.12 0.11 0.10 0.10 下列说法正确的是()A.反应前2 min的平均速率v(Z)=2.010-3molL-1min-1B.其他条件不变,降低温度,反应达到新平衡前 v(逆)v(正)C.该温度下此反应的平衡常数K=1.44D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大【答案】C【解析】由表中数据可求得前2 min内生成Z为0.08 mol,故v(Z)==410-3molL-1min-1,故A错误;该反应的正反应是放热反应,降低温度平衡正向移动,反应达到新平衡前v(逆) 6.(2021重庆卷)在恒容密闭容器中通入X并发生反应:2X(g)??Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是()A.该反应进行到M点放出的热量大于进行到W点放出的热量B.T2下,在0~t1时间内,v(Y)= molL-1min-1C.M点的正反应速率大于N点的逆反应速率D.M点时再加入一定量X,平衡后X的转化率减小【答案】C【解析】根据图象可知,T1T2,0,因此该反应是放热反应,故c(X)变化越大,放出热量越多,故M点放出的热量小于W 点放出的热量,A项错误;T2温度下,在0~t1时间内,v(Y)=v(X)=molL-1min-1,B项错误;因T1T2,vM正=vM逆vW 逆,又因vN逆【答案】C【解析】根据各物质的化学反应速率之比等于化学计量数之比,v(N)=v(M)==1.010-3molL-1min-1,A项错误;实验②中X(g)+ Y(g)??M(g)+ N(g)c起始(molL-1)0.010.040 0c转化(molL-1) 0.008 0.008 0.008 0.008c平衡(molL-1) 0.002 0.032 0.008 0.008求得:K===1.0,B项错误;根据温度相同,则K相等,X(g)+ Y(g)?? M(g)+N(g)c起始(molL-1)0.020.03 0 0c转化(molL-1) a a a ac平衡(molL-1) 0.02-a 0.03-a a aK===1.0,求得a=0.012molL-1,则X的转化率=100%=60%,C 项正确;根据上述三段式求得,在700 ℃时,K2.6,则温度升高,K减小,该反应为放热反应,若④的温度为800 ℃,此时与③为等效平衡,b=0.060,但④的温度为900 ℃,则平衡逆向移动,b0.060,则D项错误。
化学平衡常数题组1、N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:A.T1温度下,500 s时O2的浓度为0.74 mol·L-1B.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol·L-1 C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2D.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为0.52、在一定温度下,固定体积为 2 L的密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0,n(SO2)随时间的变化如下表:A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态B.用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大3、已知反应:2D+E3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是( )A.pH=6.8时,D的浓度(mg/L)一定最大B.调节pH到8.8,可使该反应正、逆反应速率都为0C.在pH相同的条件下,增大压强,D的浓度(mg/L)增大D.温度相同时,不同pH条件下,该反应的平衡常数相同4、用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是()52424(g) 2NO2(g),c(N2O4)随时间的变化如表所示。
回答下列问题:(1)在0~40s时段,化学反应速率v(NO2)为__________ mol·L-1·s-1;此温度下的化学平衡常数K为__________。
(2)下列能说明该反应达到平衡状态的是________。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变C.混合气体的密度不再改变 D.混合气体的压强不再改变(3)该反应达到平衡后,降温至50 ℃,c(N2O4)变为0.080 mol·L-1,混合气体的颜色变__________(填“深”或“浅”),该反应的正反应为__________反应(填“吸热”或“放热”),判断的理由是__________________________________。
(4)该反应达到平衡后,若只改变一个条件,达到新平衡时,能使NO2的体积分数增大的是。
A.充入一定量的NO2 B.增大容器的容积C.分离出一定量的NO2 D.充入一定量的N2(5)100 ℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)__________v逆(N2O4)(填“>”“=”或“<”)。
6、氢能是最重要的新能源。
储氢作为氢能利用的关键技术,是当前关注的热点之一。
储氢可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
+3H 2(g)在某温度下,向恒容容器中加入环己烷,其起始浓度为amol ·L -1,平衡时苯的浓度为bmol ·L -1,该反应的平衡常数K = 7、 铁及其化合物与生产、生活关系密切。
已知t℃时,反应FeO(s)+CO(g)Fe(s)+CO 2(g)的平衡常数K =0.25。
①t℃时,反应达到平衡时n (CO):n (CO 2)= 。
②若在1 L 密闭容器中加入0.02 mol FeO(s),并通入xmolCO ,t℃时反应达到平衡。
此时FeO(s)转化率为50%,则x = 。
8、NH 3经一系列反应可以得到HNO 3,2NO (g )+O 22NO 2(g)。
在其他条件相同时,分别测得NO 的平衡转化率在不同压强(P 1、P 2)下温度变化的曲线(如图)。
1、比较P 1、P 2的大小关系:________________。
2、随温度升高,该反应平衡常数变化的趋势是________________。
9、 在容积为100L 的容器中,通入一定量的N 2O 4,发生反应N 2O 4g) 2NO 2 (g),随温度升高,混合气体的颜色变深。
回答下列问题:(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。
在0~60s 时段,反应速率v 24(N O )为 mol·L 1-·s1-;反应的平衡常数1K 为 。
(2)100℃时达平衡后,改变反应温度为T ,以24(N O )c 以0.0020 mol·L 1-·s1-的平均速率降低,经10s 又达到平衡。
①T 100℃(填“大于”或“小于”),判断理由是 。
②列式计算温度T 时反应的平衡常数2K = 。
10、物质(t -BuNO)2在正庚烷溶剂中发生如下反应:(t -BuNO)22(t -BuNO) 。
(1)当(t -BuNO)2的起始浓度(c 0)为0.50 mol·L -1时,实验测得20℃时的平衡转化率(α)是65 %。
列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t -BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl 4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl 4,并保持(t -BuNO)2起始浓度相同,则它在CCl 4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
11、有一反应:CO(g) + H 2O(g)CO 2(g) + H 2(g);△H <0,在850℃时K =1。
(1)若温度升高到950℃,达到平衡时K_____1(填写“>”“<”或“=”)。
(2)在850℃时,固定容积的密闭容器中,放入混合物,起始浓度c(CO)=0.01mol/L , c[H 2O(g)]=0.03mol/L ,c(CO 2)=0.02mol/L ,c(H 2)=0.05mol/L ,则反应开始时,H 2O(g)的消耗速率比生成速率_____(填写“大”“小”或“不能确定”)。
(3)保持温度、容器的体积不变,若往容器中存入适量的H 2,则重新达到平衡,CO 的反应 速率比充H 2之前_____(填写“大”“小”或“不能确定”),理由是________。
12、利用催化氧化反应将SO 2转化为SO 3是工业上生产硫酸的关键步骤。
已知:SO 2(g ) +1/2O 2(g )SO 3(g ) △H =-98 kJ ·mol -1。
(1)某温度下该反应的平衡常数K =10/3,若在此温度下,向100 L 的恒容密闭容器中,充入3.0 mol SO 2(g)、16.0 mol O 2(g)和3.0 mol SO 3(g),则反应开始时v (正) v (逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L 的密闭容器中充入2.0 mol SO 2和1.0 mol O 2,达到平衡后体积变为1.6 L ,则SO 2的平衡转化率为 。
高温FeSO 4/Al 2O 3(3)在(2)中的反应达到平衡后,改变下列条件,能使SO 2(g)平衡浓度比原来减小的是A .保持温度和容器体积不变,充入1.0 mol O 2B .保持温度和容器内压强不变,充入1.0 mol SO 3C .降低温度D .移动活塞压缩气体(4)若以右图所示装置,用电化学原理生产硫酸,写 出通入O 2电极的电极反应式为 。
(4)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:CO(g)+1/2O 2(g)CO 2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。
请填写表中的空格。
②相同温度下,某汽车尾气中CO 、CO 2的浓度分别为1.0×10-5mol ·L -1和1.0×10-4mol ·L -1。
若在汽车的排气管上增加一个补燃器,不断补充O 2并使其浓度保持为1.0×10-4mol ·L -1,则最终尾气中CO 的浓度为_________mol ·L -1。
13、已知:I 2能与I -反应成I 3-,并在溶液中建立如下平衡:I 2 +I -I 3-。
通过测平衡体系中c(I 2)、c(I -)和c(I 3-),就可求得该反应的平衡常数。
I 、某同学为测定上述平衡体系中c(I 2),采用如下方法:取V 1 mL 平衡混合溶液,用c mol·L -1的Na 2S 2O 3溶液进行滴定(反应为I 2+2Na 2S 2O 3=2NaI +Na 2S 4O 6),消耗V 2 mL 的Na 2S 2O 3溶液。
根据V 1、V 2和c 可求得c(I 2)。
(1)上述滴定时,可采用___________做指示剂,滴定终点的现象是____ ____。
(2)下列对该同学设计方案的分析,正确的是____________(填字母)。
A .方案可行。
能准确测定溶液中的c(I 2)B .不可行。
因为I -能与Na 2S 2O 3发生反应 C .不可行。
只能测得溶液中c(I 2)与c(I 3-)之和Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件已知:①I -和I 3-不溶于CCl 4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即)]([)]([2242O H I c CCl I c 是一个常数(用K d 表示,称为分配系数),且室温条件下K d =85。
回答下列问题:(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是____ ___ _(填名称)。
试指出该操作中应注意的事项为 。
(任写一条)(4)下层液体中碘单质的物质的量浓度是________________。
(5)实验测得上层溶液中c(I 3-)=0.049 mol·L -1,结合上述有关数据,计算室温条件下反应 I 2+I-I 3-的平衡常数K =____________________(用具体数据列出计算式即可)。
)14、在1.0 L 密闭容器中放入0.10 mol A(g),在一定温度进行如下反应: A(g)B(g)+C(g) △H =+85.1kJ · mol -1反应时间(t)与容器内气体总压强(p)的数据见下表: 回答下列问题:(3)①由总压强p 和起始压强p 0表示反应体系的总物质的量n 总和反应物A 的物质的量n (A ), 一定条件下用0.1mol/LNa 2S 2O 3溶液滴定,终点时消耗Na 2S 2O 3溶液17.0mL 气体隔膜(仅不允许气体通过)化学平衡常数 题组答案1、C2、D3、D4、C5、(1)0.002 5 0.36 (2)BD (3)浅 吸热 降低温度平衡向放热反应方向移动,降低温度c (N 2O 4)浓度增大,平衡逆向移动(或从NO 2浓度变化角度解释也可) (4)BD (5)<6、解析:利用三段式解题+3H 2(g)起始(mol/L ) a 0 0 转化(mol/L ) b b 3b 平衡(mol/L ) a-b b 3b化学平衡常数K= =mol 3/L 3;7、解析:根据反应FeO(s)+CO(g)Fe(s)+CO 2(g),平衡常数K 为0.25,因为固体的浓度为1,则k=c(CO 2)/c(CO)=0.25,体积相同,所以反应达到平衡时n (CO):n (CO 2)=4:1,若在1 L 密闭容器中加入0.02 mol FeO(s),并通入xmolCO ,t℃时反应达到平衡。