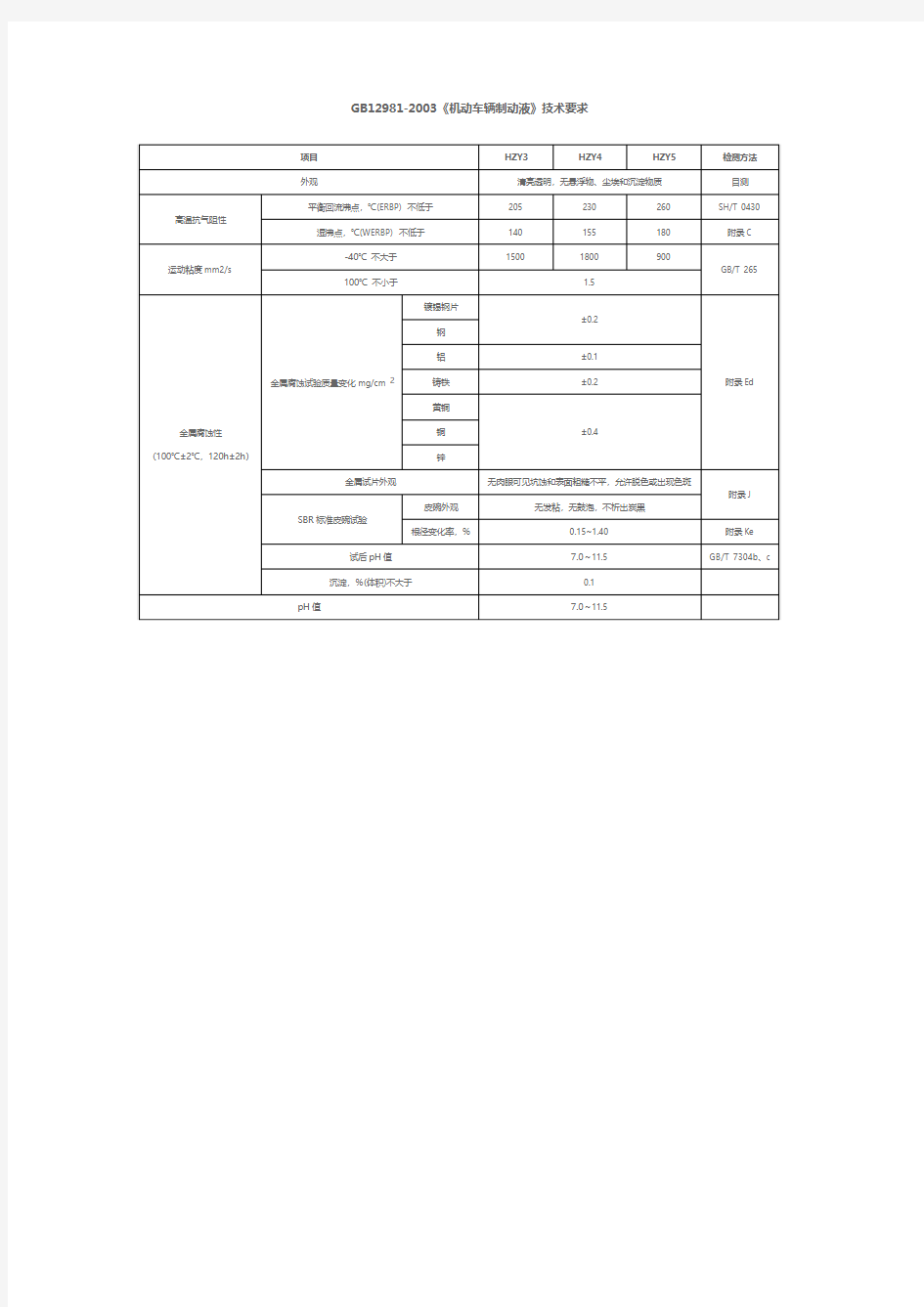
GB12981-2003《机动车辆制动液》技术要求
龙泉换流站控制系统与直流保护介绍 一、高压直流输电系统的基本介绍 1、高压直流输电工程的组成部分:交流开关场、换流变、换流阀、直流开关场及直流输电 线路。 2、特点 适合大功率、远距离输电;输电线路相对于交流输电线路要经济的多;为全国大范围联网提供了便利的条件;填补了我国直流输电技术的空白。直流设备对环境的要求较高;我国在直流输电方面起步较晚,主要依靠国外技术支持,因此现阶段直流输电设备较昂贵。 3、前景 随着我国充分利用丰富的水利资源,大力发展水电建设,直流输电将发挥其重大的经济及社会效益。 二、控制与保护系统设备介绍(按位置及控制区域) 1、盘柜介绍: PCP pole control and protection BCP bipole control and protection ACP ac control and protection AFP ac filter control and protection DFT dc field termination BFT bipole field termination AFT ac field termination ASI Auxiliary system interface TFT Transformer Field Termination ATI auto transformer interface CP control pulse CRC cyclic redundancy check DCOCT dc optical current transducer DPM digital signal processor GWS gate workstation OWS operator workstation EWS ENGINERRING WORKSTA TION ERCS electronic reactive control system FP fire pulse I/O input/output LAN local area network CAN Control Area Network TDM Time Division Multiplex LFL line fault recorder MACH2 Modular Advanced Control HVDC(High V oltage Direct Current) and SVC(Static Reactive Power Compensation) 2nd edition DOCT digital optical current transducer OIB optical interface board
人用药品注册技术要求国际协调会 ICH三方协调指导原则 药物或生物技术产品开发相关的生物标记物: 验证申请的背景资料、结构和格式 E16 现行第四阶段版本 2010年8月20日 该指导原则由相应的ICH专家小组制定,按照ICH进程,已递交管理部门讨论。在ICH 进程第四阶段,最终草案被推荐给欧盟、日本和美国的管理机构采纳。
药物或生物技术产品开发相关的生物标记物:验证申请的背景资料、结构和格式 E16 文件历史 现行第四阶段版本
药物或生物技术产品开发相关的生物标记物: 验证申请的背景资料、结构和格式 ICH三方协调指导原则 2010年8月20日进入ICH进程第四阶段, 本指导原则已被推荐给ICH三方的管理当局采纳。 目录 1.简介 (1) 1.1背景 (1) 1.2 目的 (1) 1.3 范围 (1) 1.4 一般原则 (2) 2. 生物标记物验证申请的结构 (3) 2.1第一部分:区域行政信息 (4) 2.2第二部分:摘要 (4) 2.2.1生物标记物验证的概述 (4) 2.2.2. 数据摘要(分析、非临床、临床;如适用) (8) 2.3第三部分:质量 (8) 2.4第四部分(非临床)与第五部分(临床) (9) 3.缩写 (10)
药物或生物技术产品开发相关的生物标记物: 验证申请的背景资料、结构和格式 1.简介 1.1背景 使用生物标记物可能有助于获得更为安全和有效的药物或生物技术产品,指导剂量选择和提高风险获益比。本指导原则是基于各个地区先前提交的含有生物标记物数据的申请经验而制定的。此类申请包括独立的生物标记物验证申请或者药品相关管理程序中上市申请的一部分(NDA/BLA/MAA)。对生物标记物数据的申请制定统一的格式将会使得跨区域之间的审评和评估交流更为简化和方便。 1.2 目的 本指南提出了关于基因组生物标记物(见ICH E151中的定义)验证申请的背景资料、结构和格式方面的建议。验证是指得出结论确认:在陈述的使用范围内,可依据生物标记物的评估结果来充分反映生物过程、反应或事件,并支持生物标记物在药物或生物技术产品的研发过程中的使用(包括从发现到批准后阶段)。如果生物标记物能直接或间接地帮助管理决策,可以向管理机构提交该生物标记物的验证申请。本指导原则的目的是为生物标记物验证申请制定一个一致推荐的结构,从而可以使不同区域的申请达到统一,并促进申请者与监管机构以及监管机构之间的讨论。在整个ICH监管区域内推荐使用一致的格式,还有助于降低申办者的负担。同时预期,本指南推荐的文件格式会促进生物标记物数据与特定产品的相关申请整合。在药物或生物技术产品开发过程中的任何时候均可进行生物标记物验证,包括从发现到批准后阶段。在适当情况下,本文件提供了一般指导原则,用于将生物标记物验证数据整合至人药注册上市许可申请的通用技术文件(CTD)格式中。这种整合的CTD格式同样适用于生物标记物数据作为提交的NDA、BLA、MAA、其他批准后监管程序的一部分,或者是回应监管机构要求的情况。 1.3 范围 本指导原则的范围是关于药物或生物技术产品开发相关(包括转化医学方法药代动力学、药效学、有效性和安全性等方面)的临床和非临床基因组生物标记物的验证申请的背景资料、结构和格式。验证申请中可以包括用作分类标记的单个基因组生物标记物或多个基因组生物标 1ICH E15中将基因组生物标记物定义为“一种可衡量的DNA和/或RNA特征,可作为一项指标指示正常生物过程、致病过程和/或对治疗方法或其他干预措施的反应”。
关于化学药品注册分类及申报资料要求部分问题答疑 1.国外上市,国内未上市药品,改变其剂型,增加适应症按几类新药申报? 答:按照化学药品注册分类3申报,经批准后再按照补充申请增加适应症。 2.水针、粉针和静滴剂型转换按新药报批,还是按补充申请报批?是否需临床研究?是否要新药证书? 答:未上市销售的品种按照新药申请,批准后发给新药证书。已有同品种上市销售的按照已有国家标准的药品申请,批准后不发给新药证书。水针、粉针和静滴剂型之间相互转换的申请,如果给药途径、方法、剂量等一至,一般不需进行临床研究,但是申请人必须是具备相应生产条件的药品生产企业。 3.普通片改为缓释、控释剂,其药量不变时,可否免做动物药代动力学,只进行临床药代? 答:在《办法》附件二中第四项申报资料项目及说明的第20条中规定,速释、缓释、控释制剂应当同时提供与普通制剂比较的单次或者多次给药的动物药代动力学研究资料。因此,动物药代动力学不能免做。 4.已按化学药品受理,但尚未批准临床研究的动物组织提取物是否要退回,按生物制品的要求申报? 答:不需要退回。申请的药品属于化学药品的,我司将按照《办法》附件二的要求进行审批;申请的药品属于生物制品的,我司将按照《办法》附件三的要求进行审批。 5.基因工程激素和酶制剂按生物制品申报,还是按化学药品申报? 答:基因工程激素按照生物制品管理;单一成份的酶制剂按照化学药品管理,多组份的酶制剂按照生物制品管理。 6.已上市药品可否同时申报改变剂型、给药途径、适应症等?该种情况如何填写新药类别? 答:可以。已在国内上市的药品,改变剂型的同时改变给药途径,该剂型未在国外上市的,属注册分类2;已上市的,属注册分类3。增加适应症属于补充申请,只有在原注册申请被批准后才能提出。 7.国内外资企业可否购买国外母公司已批准上市但尚未在我国注册的喷雾剂的喷雾器具和药粉在国内组装、申报新药?如进口注册进口器具和药粉组成喷雾剂,如何申报?报生产,还是进口分装?批准后有无生产期限? 答:喷雾器具按照医疗器械管理,应当按照我局对医疗器械的要求准备申报资料;药粉属药
《直流输电原理》题库 一、填空题 1.直流输电工程的系统可分为两端(或端对端)直流输电系统和多端直流输电系统两大类。 2.两端直流输电系统的构成主要有整流站、逆变站和直流输电线路三部分。 3.两端直流输电系统可分为单极系统、双极系统和背靠背直流输电系统三种类型。 4.单极系统的接线方式有单极大地回线方式和单极金属回线方式两种。 5.双极系统的接线方式可分为双极两端中性点接地接线方式、双极一端中性点接地接线方 式和双极金属中线接线方式三种类型。 6.背靠背直流系统是输电线路长度为零的两端直流输电系统。 7.直流输电不存在交流输电的稳定性问题,有利于远距离大容量送电。 8.目前工程上所采用的基本换流单元有6脉动换流单元和12脉动换流单元两种。 9.12脉动换流器由两个交流侧电压相位差30°的6脉动换流器所组成。 10.6脉动换流器在交流侧和直流侧分别产生6K±1次和6K次特征谐波。12脉动换流器在 交流侧和直流侧分别产生12K±1次和12K次特征谐波。 11.为了得到换流变压器阀侧绕组的电压相位差30°,其阀侧绕组的接线方式必须一个为 星形接线,另一个为三角形接线。 12.中国第一项直流输电工程是舟山直流输电工程。 13.整流器α角可能的工作范围是0<α<90°,α角的最小值为5°。 14.α<90°时,直流输出电压为正值,换流器工作在整流工况; α=90°时, 直流输出电为 零,称为零功率工况; α>90°时,直流输出电压为负值,换流器则工作在逆变工况。15.直流输电控制系统的六个等级是:换流阀控制级、单独控制级、换流器控制级、极控制 级、双极控制级和系统控制级。 16.换流器触发相位控制有等触发角控制和等相位间隔控制两种控制方式。 17.直流输电的换流器是采用一个或多个三相桥式换流电路(也称6脉动换流器)串联构 成。其中,6脉动换流器的直流电压,在一个工频周期内有6段正弦波电压,每段60°。
透明质酸有什么美容作用 透明质酸另一名称为玻尿酸,玻尿酸为错误译名,但是女性们说的玻尿酸就是它,那么透明质酸有什么美容作用呢。 1.消除脸颊部皱纹 为消除脸颊部的皱纹,传统上采取脸部提升的方法,也就是我们通常所说的“拉皮术”。这种手术是从太阳穴附近的发际线切开皮肤,并沿耳部向耳垂和耳后部切开,然后切除多余的皮肤,将脸部皮肤拉紧,从而达到消除脸颊部皱纹的目的。但是在实际生活中,由于对手术刀的恐惧,大部分参与者并不愿意作这种手术。另外,年龄段在30~40岁左右的参与者大部分也不愿意做这种整个脸部的拉皮术,因为她们大多只希望作局部的皱纹消除。HA疗法避免了使用令人恐惧的手术刀,仅仅采用注射针,消除了参与者的恐惧感。因此,采用局部注入HA凝胶的方法可以方便的满足这些爱美人士快捷、安全、奇效的需求。 2.消除眼周皱纹 眼部的皮肤是人体中最薄的皮肤,因此也是最容易出现下垂,褶皱的地方。传统上的眼睑整容术经常会造成使眼部看起来劳累,无精神。现在,我们可以采用局部注入HA凝胶的方法满足这些人的需求。这种方法有许多优点,除了可以起到填充皱纹的效果外,由于只有针眼大的伤口,它不会损伤周围皮肤,而且HA特有的润滑、保湿作用
可以有效补充眼部水分,使双目神采奕奕。 3.消除粉刺疤痕 传统上消除粉刺疤痕的方法有很多。例如以含有合适营养成份的面霜促进疤痕处胶原的再生,以减少疤痕。此方法作用效果较慢,而且由于人的个体差异使之对营养成分吸收能力不同,疗效相差很大。另外也可以使用化学剥离剂,例如AHA剥离剂去掉死皮,促进新皮的再生。现在有了另一种方法即使用合适的皮肤填充剂,将其注射于疤痕处,抬升周围的皮肤,使疤痕消失。国际上已开始使用利用HA 制成的凝胶作为填充剂,例如美国的Restylane,使用效果良好。 透明质酸钠在医学美容方面的应用现在,有了一种新的医学美容方法,能够消除“鸡皮”,还您光滑如织的皮肤。这就是透明质酸(HA)植入疗法。人们在科学实践中发现,人体的皮肤中存在一种叫HA的物质,它和人们熟知的胶原蛋白一起对皮肤起着支撑、保水的作用,失去她,皮肤就会变得干燥,失去弹性,出现皱纹。HA植入疗法作为消除皱纹的医学美容术最先在美国兴起,目前在欧洲、日本已经流行。这种疗法由于其良好的疗效和几乎没有副作用,正成为女士们的新宠。 HA植入疗法的疗效:HA植入疗法不属于传统的外科手术,简单操作即可完成。它可以方便地软化皮肤线条、淡化皱纹,每次仅需20分钟,却可以达到九个月以上的疗效。HA疗法并不是一劳永逸的,由于HA也是人体本身的固有物质,注射于皮肤中后会逐渐被人体分解和吸收,其分解吸收的速度有个体差异。一般其效果可持续9~12
ICH 人用药品注册的国际技术要求 ICH三方协调指导原则 人用药品注册常规技术文件 第四部分:质量-M4Q 模块2:质量概述 模块3:质量 本指南于2000年9月,在ICH指导委员会上进入第4阶段,推荐被ICH践约三方采用。(编号方式和节标题已经被统一校订,在2002年9月11-12日华盛顿DC的会议上同意采用e-CTD。) 本指南由ICH专家工作组改进完善后,由常务方依照ICH的程序进行磋商。在程序的第4阶段,最终文件被推荐由ICH的三个践约方欧盟,日本和美国采用。
目录表 模块2 : 常规技术文件概要 (5) 2.3:整体质量概述 (QOS) .................................... 错误!未定义书签。介绍................................................... 错误!未定义书签。2. 3.S 原料药 (名称,生产商) ................................ 错误!未定义书签。 2.3.S.1一般信息(名称,生产商) ............................. 错误!未定义书签。 2.3.S.2产品(名称,生产商) ................................. 错误!未定义书签。 2.3.S.3特性 (名称,生产商) ................................ 错误!未定义书签。 2.3.S.4原料药的控制 (名称,生产商) ........................ 错误!未定义书签。 2.3.S.5参考标准或原料 (名称, 生产商) ..................... 错误!未定义书签。 2.3.S.6容器密闭系统(名称,生产商) ........................ 错误!未定义书签。 2.3.S.7稳定性 (名称,生产商) .............................. 错误!未定义书签。2.3.P 药品 (名称,剂型) .................................... 错误!未定义书签。 2.3.P.1药品的描述和成分 (名称, 剂型) ..................... 错误!未定义书签。 2.3.P.2药物发展 (名称, 剂型) .............................. 错误!未定义书签。 2.3.P.3产品 (名称,剂型) .................................. 错误!未定义书签。 2.3.P.4赋形剂控制 (名称,剂型) ............................ 错误!未定义书签。 2.3.P.5药品的控制(名称,剂型) ............................. 错误!未定义书签。 2.3.P.6参考标准或原料(名称,剂型) ........................ 错误!未定义书签。 2.3.P.7容器密闭系统 (名称,剂型) .......................... 错误!未定义书签。 2.3.P.8稳定性 (名称,剂型) ................................ 错误!未定义书签。2.3.A 附件................................... 错误!未定义书签。 2.3.A.1设备和装置 (名称,生产商) .......................... 错误!未定义书签。 2.3.A.2外来因素安全性评价 (名称,剂型,生产商) ................................ 错误!未定义书签。 2.3.A.3赋形剂............................................. 错误!未定义书签。2.3.R 地区信息....................................... 错误!未定义书签。
附录3 电子控制系统技术要求 第1节 一般规定 1.1 一般要求 1.1.1 本附录中电子控制系统系指气体燃料发动机的电控系统以及气体燃料控制系统。 1.1.2 本附录中电子控制系统的设备和装置的设计和制造,应向本社申请检验。 1.1.3 本附录中涉及的电控系统的供电应符合本规范第9章第3节的相关要求。 第2节 气体燃料发动机电控系统技术要求 2.1 一般要求 2.1.1 电控系统电子设备的设计、制造、检验,包括软件设计,应满足本社《钢质海船入级规范》第7篇或《钢质内河船舶建造规范》第4篇,以及《电气电子设备型式认可试验指南》的有关规定。 2.2 功能要求 2.2.1 气体燃料发动机电控系统系指电子控制的燃气和燃油(如有时)系统。它控制喷气量、空燃比、点火时刻、喷油量(如有时)等参数,能柔性调节气体燃料发动机各系统参数,对外进行数据交换。气体燃料发动机电控系统由传感器、电子控制器(ECU)、执行机构、机旁控制器以及对外接口组成。 2.2.2 电控系统对气体燃料发动机的监测功能及控制功能设计,应满足本规范第10章和第11章的相关要求。 2.2.3 电控系统主电源失效时,应能在机旁控制和遥控控制地点均进行声光报警。 2.2.4 电控系统应具有故障自诊断和安全保护功能,当出现故障时,系统应立即进行故障诊断,启动相应的安全保护功能,以维持气体燃料发动机工作。 2.2.5 应具备机旁控制功能,以及供集控室或驾驶室的远程控制系统使用的对外接口。 2.2.6 电控系统的监测功能,应能对系统的传感器、电子控制器(ECU)及执行机构的主要功能故障进行报警。机旁控制和遥控控制地点均应设有声光报警。 2.2.7 电控系统应能监视气体燃料发动机工作情况,自动调整气体燃料发动机各系统参数,并对系统及部件故障进行检测和报警。 2.2.8 电控系统应设有检查端口,使监测和维修方便。 2.2.9 电控系统应具有数据记录功能,应能自动记录气体燃料发动机一定数量的最新运行数据,对运行过程中的报警及故障等异常状态进行存储,异常状态的存储记录只能被手动清除。 2.2.10 电控系统应能够将发动机状态及报警通过对外接口输出给船舶的监控系统。这些状态及报警应包含但不限于本附录表2.2.10所列项目。
附件2: 化学药品注册分类及申报资料要求 一、注册分类 1.未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2.改变给药途径且尚未在国内外上市销售的制剂。 3.已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6.已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1.药品名称。 2.证明性文件。 3.立题目的与依据。 4.对主要研究结果的总结及评价。 5.药品说明书、起草说明及相关参考文献。 6.包装、标签设计样稿。 (二)药学研究资料 7.药学研究资料综述。 8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9.确证化学结构或者组份的试验资料及文献资料。 10.质量研究工作的试验资料及文献资料。 11.药品标准及起草说明,并提供标准品或者对照品。
浅析直流输电控制保护系统 摘要:直流输电是电力系统近年来迅速发展的一项新技术,直流输电克服了电 感损耗,只有导线电阻损耗,主要应用于远距离大容量输电、电力系统联网、远 距离海底电缆、大城市地下电缆送电、配电网络轻型直流输电等方面。直流输电 与交流输电相互配合,构成现代电力传输系统。随着电力系统技术经济需求的不 断增长和提高,直流输电受到广泛的注意并得到不断的发展。 关键词:电力系统;直流输出;保护层面;控制保护 一、直流输电概况 (一)直流输电系统概念 直流输电系统由直流线路、逆变站、整流站、交流侧电力滤波器、直流侧电 力滤波器、换流变压器、无功补偿装置、直流电抗器以及保护、控制装置等构成,通常是两端直流输电系统,其中整流站和逆变站属于换流站,通过整流站和逆变 站能够实现交流电力和直流电力的转换,换流站是直流输电系统比较重要的组成 部分。首先由交流系统的送电端将交流功率通过换流变压器送到整流器,完成交 流功率到直流功率的转化,然后将直流功率通过线路传输到逆变器,逆变器又会 将直流功率转化为交流功率,最终传输到交流电力系统的受电端。 (二)换流站的换流技术 整流站和逆变站都属于换流站,他们的核心元件都是换流器,通常由一个或 者是多个基本换流单元组成的,多采取串联模式,其中电路一般应用三相换流桥,较为常用的材料为可控硅阀,即常说的晶闸阀。当换流器进行工作的时候,控制 桥阀能够触发控制调节装置,改变了触发相位,从而达到直流输送功率、流经电 阻的直流电流、直流电压的瞬时值等的调整。与此同时,同样的触发脉冲能够控 制所有桥阀的每一个可控硅元件,在三相电源的波为对称正弦波的时候,线电压 从负到正,经过零点时脉冲会触发桥阀,使得阀两端的电压均变为正电压,完成 阀开通的动作。六个脉冲发生器能够各自独立的完成对位于单桥换流器中六个桥 阀的触发,使得交流正弦波刚好能够经过第一个周期,在线电压行进到下一个零 点的时候,交流弦电源开始触发第二个周期,但是在工程上所应用的多为十二脉 的双桥换流器,因为十二脉双桥换流器能够产生更小脉波的直流输电电压。 二、直流输电控制保护层 直流输电系统的控制根据层级的不同可以分为三个层面,即现场控制层、过 程控制层、运行人员控制层。 (一)现场控制层 现场控制层使得交直流主设备能够在就地进行控制,通过硬线将交直流主设 备与较近距离的设备接口进行连接,通过现场总线将交直流主设备与较远距离的 设备接口进行连接。通过分布式的I/O控制单元实现现场控制,包括高压装置的 联锁、输出控制命令、控制命令的监控、SER事件的产生、自诊断、二进制模拟 量的预处理等功能。通过现场控制层面能够实现控制系统的分层式、分布式,来 自调度中心的控制命令经由高速LAN和现场总线进行传达,监控系统的实时数据 在逐层反馈,保证主系统、从系统的循环数据传输过程。 (二)过程控制层 过程控制层包括交流/直流站控制系统和极控系统,是直流输电控制系统的核 心组成。交流/直流站控制系统的任务是顺序控制交流场和换流站直流系统,为了
透明质酸钠(要特别介绍) 透明质酸钠为第四代仿生化妆品添加剂。于1934年被KARL MEYER从牛眼玻璃体中发现,它是从牛眼玻璃体中提取的一种大分子多糖。具有抗衰老和保鲜包装和采用生物技术三大特点。透明质酸钠本身是人体皮肤的构成之一,是人体内分布最广的一种酸性黏糖,存在于结缔组织的基质中,具有强效的保湿作用。天然存在于角膜内皮中,可吸收其本身重量1000倍水分,是目前最好的保湿剂之一。 透明质酸(又称玻尿酸、透明质酸钠)是国内外新兴的高级生物制品,分子量为几万至几百万,其水溶液具有极高的保湿性、粘弹性和润滑性,可广泛用于化妆品、医药、美容保健食品等行业中。 商品透明质酸一般为其钠盐,即透明质酸钠(Sodium Hyaluronate),但习惯上仍称为透明质酸。 透明质酸具有特殊的保水作用,是目前发现的自然界中保湿性最好的物质,被称为理想的天然保湿因子(Natural moisturizing factor,NMF,例如:2%的纯透明质酸水溶液能牢固地保持98%水分)。 人类皮肤成熟和老化过程也随着透明质酸的含量和新陈代谢而变化,它可以改善皮肤营养代谢,使皮肤柔嫩、光滑、去皱、增加弹性、防止衰老,又称为抗衰老因子。 在保湿的同时又是良好的透皮吸收促进剂。与其他营养成分配合使用,可以起到促进营养吸收的更理想效果使用含有透明质酸HA的保养品,可以改善干燥和已出现皱纹的肌肤,使其恢复光滑和弹性,因此,透明质酸是改善干燥及老化肌肤的最理想产品。本品是广泛存在于动物和人体的生理活性物质,在人皮肤、关节滑膜液、脐带、房水及眼玻璃体中均有分布。分子量为500000~730000道尔顿,其溶液具有高黏弹性及仿形性,为眼科手术的辅助剂,药液注入前房后维持一定的眼前房深度,便于手术操作,并有保护角膜内皮细胞及眼内组织,减少手术并发症,促进伤口愈合的作用。
安全防范系统雷电浪涌防护技术要求 GA/T 670-2006 中华人民共和国公安部2006-12-14发布2007-06-01实施 前言 本标准的附录A、附录B为资料性附录。 本标准由全国安全防范报警系统标准化技术委员会(SAC/TC 100)提出并归口。 本标准起草单位:广西地凯科技有限公司、全国安全防范报警系统标准化技术委员会(SAC/TC100)秘书处、广西壮族自治区公安厅技防办。 本标准主要起草人:王东生、刘希清、张凡夫、施巨岭、张跃、马宁。 1 范围 本标准规定了安全防范系统雷电防护的基本要求,着重规定了安全防范系统雷电浪涌防护的具体要求。 本标准适用于安全防范系统雷电防护的设计、实施和检验等。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本,凡是不注日期的引用文件,其最新版本适用于本标准。 GB 18802.1—2002 低压配电系统的电涌保护器(SPD) 第1部分:性能要求和试验方法(IEC 61643-1:1998,IDT) GB 50057-1994(2000年版) 建筑物防雷设计规范 GB 50343-2004 建筑物电子信息系统防雷技术规范 GB 50348-2004 安全防范工程技术规范 3 术语和定义 下列术语和定义适用于本标准。 3.1 安全防范系统security and protection system:SPS 以维护社会公共安全为目的,运用安全防范产品和其他相关产品,所构成的入侵报警系统、视频安防监控系统、出入口控制系统、防爆安全检查系统等;或由这些系统作为子系统组合或集成的电子系统或网络。 [GB 50348-2004,2.0.2] 3.2 直击雷direct lightning flash 闪击直接击在建筑物、其他物体、大地或防雷装置上,产生电效应、热效应和机械力者。 [GB 50057-1994(2000年版)附录8] 3.3 雷电感应lightning induction 闪电放电时,在附近导体上产生的静电感应和电磁感应,它可能使金属部件之间产生火花。 [GB 50057-1994(2000年版)附录8] 3.4 雷电浪涌lightning surge 与雷电放电相联系的电磁辐射,所产生的电场和磁场能够耦合到电气(电子)系统中而产生破坏性的冲击电流或电压。 3.5 雷电活动区分类classification of thunder and lightning active zone
附件4: 药品补充申请注册事项及申报资料要求 一、注册事项 (一)国家食品药品监督管理局审批的补充申请事项: 1.持有新药证书的药品生产企业申请该药品的批准文号。 2.使用药品商品名称。 3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。 4.变更用法用量或者变更适用人群范围但不改变给药途径。 5.变更药品规格。 6.变更药品处方中已有药用要求的辅料。 7.改变影响药品质量的生产工艺。 8.修改药品注册标准。 9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 11.申请药品组合包装。 12.新药的技术转让。 13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。 15.改变进口药品的产地。 16.改变进口药品的国外包装厂。 17.进口药品在中国国内分包装。 18.其他。 (二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项: 19.改变国内药品生产企业名称。 20.国内药品生产企业内部改变药品生产场地。 21.变更直接接触药品的包装材料或者容器(除上述第10 事项外)。 22.改变国内生产药品的有效期。 23.改变进口药品制剂所用原料药的产地。 24.变更进口药品外观,但不改变药品标准的。 25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 26.补充完善进口药品说明书安全性内容。 27.按规定变更进口药品包装标签。 28.改变进口药品注册代理机构。 29.其他。 (三)省级食品药品监督管理部门备案的补充申请事项: 30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。 31.补充完善国内生产药品说明书安全性内容。 32.按规定变更国内生产药品包装标签。
直流输电工程控制系统与阀控接口分析及优化措施研究 摘要换流阀与控制保护设备接口技术的应用,使得不同技术路线的控制保护技术与不同技术路线的换流阀之间实现了连接。本文首先对目前直流输电工程中应用的不同技术路线阀控接口进行了全面比较分析,总结出存在的差异,并根据实际运维经验指出存在的问题和隐患,提出了针对性改进意见,为设备功能完善和优化设备选型奠定了良好的基础。 关键词控制保护设备;阀控;接口 前言 高压直流系统传输容量的快速增长使得换流阀技术和控制保护技术得到了飞速的改进和提高,而换流阀与控制保护接口技术的应用,使得不同技术路线控制保护技术与不同技术路线的换流阀之间实现了连接,并在特高压直流输电工程中得到了应用。控制保护系统与阀控之间的接口,主要用于接收控制保护系统下发的控制命令,产生点火脉冲触发换流阀以及监视换流阀中晶闸管的状态信息。控制保护系统与阀控系统之间信号的有效、可靠传递是直流工程高效稳定的保证,因此,有必要对直流控制保护系统与阀控接口进行研究,优化二次回路设计,使直流控制保护系统的性能得到最有效的发挥,为技术方案的制定与设备选型提供技术支持。 1 阀控系统运行状况分析 目前直流输电控制系统一般分为5个层级,从高层次至低层次等级分别为:系统控制级、双极控制级、极控制级、换流器控制级和换流阀控制级。从目前在运的直流系统来看,一般将前4个层级置于直流控制保护系统(以下简称“极控”)中,其可靠运行对提高整个直流输电系统的可用率具有重要作用。而换流阀控制级设有单独的阀控系统(以下简称“阀控”),主要包括阀基电子设备、门级单元以及阀冷却泄露监视器等,负责将极控发出的控制脉冲通过光纤发送至晶闸管,同时负责接收来自晶闸管的监控信号,将其代表的晶闸管状态传递给极控,监视换流阀运行。换流站正常运行时,换流阀每一次触发均需要极控与阀基电子设备之间配合正确,才能保证系统正常工作,否则必然导致阀报警或跳闸,从而导致阀组停运乃至直流闭锁,对系统造成巨大的冲击,威胁到整个电力系统的稳定。 由于各阀和控保厂家采用不同技术路线,使得各厂家阀控与极控间的接口信号不尽相同。目前国内的主流直流控制保护系统有2种技术路线:第一种基于ABB技术路线,主要厂家有ABB和南瑞继保;第二种基于Siemens技术路线,主要厂家有西门子和许继。而换流阀技术路线多达4种,阀控与极控的接口更是多种多样,均已应用于特高压直流输电工程。极控与阀控之间接口的好坏,直接决定了直流输电系统运行的稳定性。因此针对目前形势各样的接口设计,有必要进行分析比较[1]。
透明质酸钠凝胶 透明质酸钠也叫玻璃酸钠。1934年,Meyer等自牛眼玻璃体(hyaloid body)分离出一种含糖醛酸(uronic acid)和氨基己糖的高分子多糖,命名为“hyaluronic acid”。该词由“hyaloid”(透明的、玻璃状的)和“uronic acid”组合而成,《生物化学名词》译为“透明质酸”,《中国药典药》和国家药品标准称为“玻璃酸”。在生理中性环境中,hyaluronic acid是一个聚阴离子。1985年,Balazs等建议“hyaluronan”一词作为此种多糖的总称,不管其处于何种程度的解离度。“hyaluronan”已广泛应用,涵盖了任何状态的透明质酸及其盐(hyaluronate),通常将其译为“透明质酸”,缩写为HA。在目前, 凝胶。 主要成分: 本品主要成份为透明质酸钠,辅料含氯化钠,磷酸氢二钠,磷酸二氢钾。 化学名称: (1-4)-O-β-D葡萄糖醛酸-(1-3)-2-乙酰氨基-2-脱氧-β-D葡萄糖。 分子式: (C14H20NO11Na)n
不同工艺生产的透明质酸的分子量也各不相同,天然性状的透明质酸钠的分子量一般在80万~250万之间,通常认为透明质酸钠的分子量越高则粘弹性越好,疗效也就越好。 微生物发酵法制取: 用Streptococcus zooepidemics(兽疫链球菌)的突变体(mutant)发酵制取。此突变体无溶血活性,产透明质酸钠量大,产品分子量可达250万。 从动物组织提取: 用蛋白酶去除蛋白质,以十六烷基氯化吡啶单离HA,以足量氯仿进一步去除蛋白质。纯品中氨基酸含量仅为0.35%,分子量最高可达120万。 眼科手术: 眼科手术辅助用医疗器械,用于白内障摘除术和人工晶体手术等。 骨科手术: 骨科手术,主要用于预防肌腱粘连,缝合术后于暴露肌腱吻合处、腱周、腱间均匀涂抹本品,也可于损伤修复部鞘内或局部注射,或二者并行,视情况而定。 关节腔内注射: 常用于治疗骨关节炎及类风湿性关节炎等。
人用药品注册技术要求国际协调会定期安全性更新报告的基本原则及其对我国的启示 任经天杨乐郭晓昕杜晓曦*(国家食品药品监督管理总局药品评价中心,北京100045) 中图分类号:R951文献标识码:A文章编号:1672-8629(2013)07-0400-05 基金项目:“十二五”重大新药创制专项课题“大品种药物IV期临床试验及新药临床试验审评研究技术平台”(2011ZX09304-08) 作者简介:任经天,男,副研究员,药品不良反应监测与评价。 * 通讯作者:杜晓曦,女,主任药师,药品不良反应监测与评价。 E-mail:duxiaoxi@cdr.gov.cn 摘要: 通过介绍人用药品注册技术要求国际协调会定期安全性更新报告的基本原则,建议我国要稳步推进定期安全性更新报告相关工作,对于在我国的数据锁定点与国际诞生日不一致的,应根据不同情况提交汇总桥接报告、补充报告以及补充病例列表和汇总表。药品生产企业通过定期安全性更新报告,重在发现药品安全风险,为深入开展研究并控制风险提供线索。 关键词: 人用药品注册技术要求国际协调会;定期安全性更新报告;启示TheBasicPrinciplesofICHPSURandItsImplicationsforChina REN Jing-tian Yang Le Guo Xiao-xin DU Xiao-xi *(Center for Drug Reevaluation,CFDA,Beijing 100045,China)Abstract:The article introduced the basic principles of ICH Periodic Safety Update Reports (PSUR).The article suggested that PSUR should be promoted step by step.When the data lock point in China couldn't be synchronized with the IBD,Line-listings and Summary Tabulations,Summary Bridging Reports and Addendum Reports should be adopted depending on the circumstances.The Marketing Authorization Holder(MAH)should put emphasis on finding safety risks through PSUR,and provide clues for further investigation and risk management.Keywords:ICH;PSUR;implication 2011年7月,《药品不良反应报告与监测管理办法》(卫生部部长令第81号)开始实施,办法要求药品生产企业(含境外制药厂商)提交定期安全性更新报告(以下简称 “PSUR”)。2012年9月,国家食品药品监督管理局在参考人用药品注册技术要求国际协调会(ICH)E2C(R1)的基础上,印发了《药品定期安全性更新报告撰写 规范》 (国食药监安[2012]264号)[1] 。由于撰写规范重点规定了PSUR的撰写内容与要求,本文通过介绍ICHPSUR的基本原则[2],以期更好地帮助药品生产企业理解并撰写上市药品的PSUR。 1背景 ICH在国际医学科学组织委员会(CIOMS)PSUR(1992年)的基础上,于1996年11月发布了《临床安全性数据管理:上市药品定期安全性更新报告》(E2C),建议欧盟、美国和日本的药品监管当局采纳。为了更好地理解并执行PSUR,ICH于2003年2月发布了《附录》,对E2C相关条款进行进一步的说明、指导,并增加了对PSUR理解上 的灵活性;《附录》需要与E2C联合使用。2005年11月,ICH将E2C与 《附录》合并形成E2C(R1)。PSUR要求药品生产企业对报告期内的安全性数据进行全面的评价,具有可行性和可实现性。ICH通过引入国际诞生日(InternationalBirthDate,IBD)概念、统一PSUR格式和内容,协调在ICH成员国提交PSUR的要求,提高了工作效率,对保护公众健康的所有部门都有重要意义。 2ICHPSUR基本原则 2.1一个活性物质一份报告 ICH建议一份PSUR应当包括一个活性物质的所有剂型、适应证和给药方案。这样最大的优点是可以对安全性数据进行有基础的连续分析。在一份PSUR中,应当单独提交同一活性物质不同剂型、适应证和给药方案的安全性数据,并进行分层分析;这样,不必单独准备PSUR就能够提出不同剂型、适应证、给药方案和用药人群(如老人或者儿童)的安全性问题。 在某些情况下,也可以接受一个活性物质提交多个PSUR,其前提是药品生产企业应当报告药品监管部门、 并在药品获得上市许可时得到监管部门的同意。比如:①对于复方制剂,可以按照复方制剂提交PSUR,互相参考复方制剂的PSUR和单一活性物质的PSUR;也可以在单一活性物质的PSUR中包括这部分复方制剂的数 400
附件4:药品补充申请注册事项及申报资料要求一、注册事项 (一)国家食品药品监督管理局审批的补充申请事项: 1、持有新药证书的药品生产企业申请该药品的批准文号。 2、使用药品商品名称。 3、增加中药的功能主治或者化学药品、生物制品国内已有批准的适应症。 4、变更用法用量或者变更适用人群范围但不改变给药途径。 5、变更药品规格。 6、变更药品处方中已有药用要求的辅料。 7、改变影响药品质量的生产工艺。 8、修改药品注册标准。 9、替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 10、进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 11、申请药品组合包装。 12、新药的技术转让。 13、修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 14、改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。 15、改变进口药品的产地。 16、改变进口药品的国外包装厂。 17、进口药品在中国国内分包装。 18、其它 (二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项: 19、改变国内药品生产企业名称。 20、国内药品生产企业内部改变药品生产场地。 21、变更直接接触药品的包装材料或者容器(除上述第10事项外)。 22、改变国内生产药品的有效期。 23、改变进口药品制剂所用原料药的产地。 24、变更进口药品外观,但不改变药品标准的。 25、根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 26、补充完善进口药品说明书安全性内容。 27、按规定变更进口药品包装标签。
河北唐山德龙 3MW余热发电项目总承包工程主控室设备技术规范书 天津海天方圆节能技术有限公司 二○一六年三月
一、总则 1 本规范书适用于本期工程的电气系统微机保护及监控、常规控制设备。它提出了设备及其系统的功能设计、结构、性能、安装和试验等方面的技术要求。 2 本规范书提出的是最低限度的技术要求,并未对一切技术细节作出明确规定,卖方应提供符合本规范书和行业制造标准的优质产品。 3如果卖方没有以书面形式对本规范书的条文提出异议,则意味着卖方提供的设备及其系统完全符合本规范书的要求。如有异议,不管是多么微小,都应在投标书的“差异表”中说明,并在投标书的有关章节中加以详细描述。 4 本规范书所使用的标准如与卖方所执行的标准发生矛盾时,按较高标准执行。合同执行过程中,若国家标准更新,应按最新标准执行。 5卖方保证买方购买的和使用的合同产品不会引起第三方的侵权之诉,卖方必须弥补买方由此发生的任何费用及赔偿引起的损失。 6 本规范书经买卖双方确认后作为订货合同的技术附件,与合同正文具有同等效力。 二、工程概况 1 工程规模 本期工程设计规模为1×3MW汽轮发电机组。 2电气系统概况 本期新上一台3MW汽轮发电机组,机端电压10.5kV。单设发电机出口母线,发电机发出的电经并网联络线与厂内原有的10KV系统并网。本期新上一台低压厂用变压器,厂变高压侧断路器柜、并网联络柜均接自发电机10KV母线,业主提供一路低压380V电源作为备用电源。主接线结构请详见“电气主接线图”。
三、设备设计、制造、验收所用的标准 1 DL/T5136-2001火力发电厂、变电所二次接线设计技术规程 2 GB/T15145 微机线路装置通用技术条件 3 DL478-92 静态继电器保护及安全自动装置通用技术条件 4 GB7261 继电器及继电保护装置基本实验方法 5 GB6162-85 静态继电保护及保护装置的电器抗干扰实验 6 GB14285-93 电力系统继电保护及安全自动装置技术规程 7高频干扰技术措施及高频干扰实验标准应符合DL478的规定 8辐射电磁场干扰试验应符合GB/T14598.9-1995(IEC255-22-3-1989)III 9 GB4858电器继电器的绝缘试验 10 GB50062-92电力装置继电保护及自动化装置设计规程 11 DL/T5153-2002 火力发电厂厂用电设计技术规定 12 电测量及电能计量装置设计技术规程 四、当地气象条件 项目地乐亭县属暖温带滨海半湿润大陆性季风气候类型区,冬季长达170天,夏季为72天,春季66天,秋季51天。境内季节气温,基平吻全于平均气温,10℃-22℃为春季和秋季,22℃以上为夏季,10℃以下为冬季标准。年平均气温在10℃左右。 乐亭县多年年平均降水量为613.2毫米,年降水总量7.94亿立方米。境内大气降水有3个特点: (1)大气降水年内分配极不均匀,表现在冬春干旱少雨,夏秋雨水集中。从多年年平均值来看,6-9月份(汛期)降雨量为495.7毫米,占全年的80.8%,其余各月降水量为117.5毫米,仅占全年的19.2%。 (2)大气降水在年际分配上变率大。据乐亭气象站(局)30年