离子的检测与鉴定
- 格式:doc
- 大小:33.50 KB
- 文档页数:3

Zn离子的检测方法随着工业和生活用水中污染物的增加,水体中重金属离子的检测显得尤为重要。
Zn离子作为一种重要的金属离子,在环境监测、水质安全和生物医学领域具有广泛的应用。
因此,研究和发展准确、灵敏的Zn离子检测方法具有重要的科学和实用价值。
本文将介绍几种常见的Zn离子检测方法。
一、原子吸收光谱法原子吸收光谱法是一种常见的分析技术,适用于测定各种金属离子。
在Zn离子的测定中,可以利用原子吸收光谱仪来测定Zn离子溶液的吸光度。
首先,将待测溶液与一定浓度的Zn标准溶液进行比色,记录吸光度。
然后,根据标准曲线确定待测溶液中Zn离子的浓度。
二、电化学法电化学法是利用电化学方法测定溶液中的物质浓度的一种分析技术。
常见的电化学方法包括电位滴定法、电解析法和电位分析法等。
在Zn离子的检测中,可以使用电化学技术来测定Zn离子溶液中的电位变化。
通过电位变化的测定,可以间接确定溶液中Zn离子的浓度。
三、荧光分析法荧光分析法是利用物质在受激发后发出的荧光性质来测定其浓度的一种分析方法。
在Zn离子的检测中,可以使用荧光染料或荧光探针来测定Zn离子的浓度。
这些荧光染料或荧光探针可以与Zn离子形成配合物,形成具有特定荧光信号的复合物,通过测定荧光信号的强度或寿命来确定Zn离子的浓度。
四、分子印迹技术分子印迹技术是一种将目标分子嵌入合成聚合物中,生成具有目标分子选择性识别能力的材料的方法。
在Zn离子的检测中,可以使用分子印迹技术合成具有特异性对Zn离子选择性吸附和识别的分子印迹聚合物。
通过将待测溶液与分子印迹聚合物接触,Zn离子能够被聚合物选择性地吸附,从而实现Zn离子的测定。
综上所述,Zn离子的检测可以通过原子吸收光谱法、电化学法、荧光分析法和分子印迹技术等多种方法来实现。
这些方法各自具有不同的优缺点,适用于不同领域和场景的Zn离子检测。
未来的研究应该继续改进和发展这些方法,提高其准确性、灵敏度和实用性,以满足不断增长的环境监测和生物医学需求。

锌离子的鉴定方法锌是一种重要的金属元素,广泛应用于冶金、化工、电子、建筑等领域。
在环境监测和工业生产中,对锌离子的准确鉴定具有重要意义。
本文将介绍几种常见的锌离子鉴定方法,帮助读者更好地了解和掌握锌离子的检测技术。
一、离子色谱法。
离子色谱法是一种常用的离子分析技术,适用于锌离子的快速准确检测。
该方法利用离子交换树脂对溶液中的锌离子进行分离和检测,具有分析速度快、灵敏度高的特点。
离子色谱法不仅适用于水样、土壤样品中锌离子的检测,还可以应用于工业废水和废气的监测。
二、原子吸收光谱法。
原子吸收光谱法是一种常用的金属元素分析技术,对于锌离子的检测具有较高的准确性和灵敏度。
该方法通过锌离子对特定波长的光吸收进行定量分析,能够精确测定样品中的锌含量。
原子吸收光谱法不仅适用于水样、土壤样品中锌离子的分析,还可以用于金属合金、化工产品中锌含量的测定。
三、电化学方法。
电化学方法包括极谱法、电位滴定法等,是一种常用的锌离子分析技术。
这些方法通过测定电极在锌离子存在下的电位变化或电流响应,来实现锌离子的定量分析。
电化学方法具有分析速度快、操作简便的特点,适用于各种类型样品中锌离子的检测。
四、荧光法。
荧光法是一种灵敏度较高的分析方法,对于锌离子的检测具有较好的应用前景。
该方法利用荧光物质与锌离子形成络合物后产生荧光信号,通过测定荧光强度来确定样品中锌离子的含量。
荧光法不仅适用于水样、生物样品中锌离子的检测,还可以用于食品、药品中锌含量的分析。
综上所述,锌离子的鉴定方法多种多样,每种方法都具有其独特的优势和适用范围。
在实际应用中,可以根据样品的特点和分析要求选择合适的方法进行锌离子的检测。
希望本文所介绍的内容能够对读者有所帮助,为锌离子分析提供参考和指导。

镍离子的鉴定一、引言镍是一种重要的金属元素,广泛应用于不同领域,如电池、合金、催化剂等。
然而,过量的镍离子会对环境和健康产生负面影响。
准确鉴定镍离子的存在是至关重要的。
本文将介绍镍离子鉴定方法。
二、理论基础镍在水中通常以Ni2+离子形式存在,它具有典型的d8电子构型。
在分析中使用了一些典型的配体来鉴定Ni2+离子,如硫代草酸盐(EDTA)、苯并三唑(BTA)和二甲基甲酰胺(DMF)等。
三、实验步骤1. 硫代草酸盐法步骤:①取一定量的试样溶液,并加入适量的EDTA试剂。
②调节pH值至10左右。
③加入指示剂(如印度靛蓝),直到颜色变为红色或紫色。
结果解释:如果出现上述颜色,则表明存在Ni2+离子。
2. 苯并三唑法步骤:①取一定量的试样溶液,并加入适量的BTA试剂。
②调节pH值至5-9之间。
③加入指示剂(如酚酞),直到颜色变为橙色或红色。
结果解释:如果出现上述颜色,则表明存在Ni2+离子。
3. 二甲基甲酰胺法步骤:①取一定量的试样溶液,并加入适量的DMF试剂。
②调节pH值至7-9之间。
③加入指示剂(如二氯苯胺),直到颜色变为蓝紫色或深紫色。
结果解释:如果出现上述颜色,则表明存在Ni2+离子。
四、注意事项1. 实验操作要规范,避免误差的产生。
2. 指示剂的选择和使用要准确,以保证实验结果的准确性。
3. 实验中应注意安全,避免有害物质对人体和环境造成危害。
五、结论通过上述三种方法中任意一种方法对样品进行检测,都能够准确地鉴定镍离子的存在。
在实际应用中,可以根据具体情况选择合适的方法进行分析。

铜离子的鉴定
1、铜离子的鉴定
检测铜离子的方法有多种,其中最常用的是化学分析。
化学分析:
氨基酸溶液-铜离子会发生配位反应,形成特定的配合物,从而导致氨基酸溶液的比色发生变化,使用紫外可见光谱法,可以检测铜离子的浓度。
X射线衍射法-按照晶体结构,把铜离子溶液滴在胶片上,然后以X射线衍射法分析晶体各微米元素的构成,从而确定晶体中是否存在铜离子。
比色分析-根据铜离子与某些有机染料的反应可以制备出前面提到的配位配合物,从而减轻染料的色品,使得染料比色发生变化,可以作为铜离子的检测方法。
原子吸收法-原子吸收法也是检测铜离子的常用方法,通过底物自由基的原子吸收光谱测量,可以得到溶液中铜离子的浓度。
电感耦合等离子体质谱法-电感耦合等离子体质谱法是一种用于测量有机物质组成元素和其他物质的常用方法,可以测量铜离子的含量,这是一种比较精确的方法。
除了以上常用的检测方法外,还可以使用其他特殊的微量元素分析仪器,如原子吸收分光光度计(AAS)、原子荧光光谱(AES)、X 射线光谱仪(XRF)等,也可以用于检测铜离子的浓度。
- 1 -。

实验常见阳离子的分离与鉴定-V1实验常见阳离子的分离与鉴定阳离子是指带正电荷的离子,常见的有盐酸中的K+、Na+、Mg2+、Ca2+等。
在实验室中对这些阳离子的分离和鉴定是一项比较常见的实验操作,下面将对此进行重新整理。
一、分离NH4+和Fe3+实验操作步骤:1.将NH4+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,并加入HCl,沉淀消失;3.将所得溶液加入HgCl2,出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的氨盐等。
二、分离Ba2+和Fe3+实验操作步骤:1.将Ba2+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,得到沉淀和过滤液;3.将所得沉淀加入Na2CO3,在锅炉中加热,轻轻搅拌,直到溶解;4.将溶液冷却,加入硫酸钠,出现白色沉淀。
实验操作目的:该实验可用于检测水中钙、铁的含量。
三、分离Mg2+和Fe2+实验操作步骤:1.将Mg2+和Fe2+混合,加入氨水,pH值达到9.5~10.2;2.将所得溶液加入EDTA,出现蓝色沉淀。
实验操作目的:该实验可用于检测水或者土壤中的镁和铁的含量。
四、分离Ca2+和Ba2+实验操作步骤:1.将Ca2+和Ba2+混合,加入Na2SO4;2.出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的钙盐。
五、分离Na+和K+实验操作步骤:1.将Na+和K+混合,并加入Na2CO3;2.加热,溶解后冷却,加入二甲基黄。
3.观察产生的沉淀,小型重沉。
实验操作目的:该实验可用于检测水中钠、钾的含量。

分离与鉴定常见非金属阴离子的实验报告实验目的:通过实验分离和鉴定常见的非金属阴离子,并研究它们在不同试剂下的化学反应特性。
实验原理:阴离子是电荷为负的离子,而非金属阴离子是在化合物中没有金属阳离子的阴离子。
常见的非金属阴离子包括:氯离子(Cl-)、溴离子(Br-)、碘离子(I-)、硝酸根离子(NO3-)、硫酸根离子(SO42-)、碳酸根离子(CO32-)、氢碳酸根离子(HCO3-)和硫代硫酸根离子(S2O32-)等。
在实验中,我们将使用一些常见的化学试剂来鉴定这些非金属阴离子的存在。
实验步骤:1. 溴苯试剂鉴定溴离子:- 取少量待鉴定溴离子的溶液,加入溴苯试剂。
- 若反应产生橙红色的沉淀,则表明溴离子存在。
2. 银镜反应鉴定碘离子:- 取少量待鉴定碘离子的溶液,加入碘化钾试剂。
- 加入稀硝酸,再滴加少量银氨溶液。
- 若出现镜面反应(镜面变黑),则表明碘离子存在。
3. 巴特利特试剂鉴定硝酸根离子:- 取少量待鉴定硝酸根离子的溶液,加入巴特利特试剂。
- 若反应产生红色的沉淀,则表明硝酸根离子存在。
4. 钡盐鉴定硫酸根离子:- 取少量待鉴定硫酸根离子的溶液,加入硝酸钡试剂。
- 若反应产生白色的沉淀,则表明硫酸根离子存在。
5. 盐酸鉴定碳酸根离子:- 取少量待鉴定碳酸根离子的溶液,加入盐酸。
- 若反应产生气泡,并放置数分钟后仍有气泡释放,则表明碳酸根离子存在。
6. 碳酸氢钠鉴定氢碳酸根离子:- 取少量待鉴定氢碳酸根离子的溶液,加入碳酸氢钠试剂。
- 若反应产生气泡,并用湿润的红色石蕊试纸测试,变蓝色或紫色,则表明氢碳酸根离子存在。
7. 亚铁离子鉴定硫代硫酸根离子:- 取少量待鉴定硫代硫酸根离子的溶液,加入氨水和一滴亚铁离子溶液。
- 若反应产生深红色或棕褐色的沉淀,则表明硫代硫酸根离子存在。
实验结果与讨论:根据实验步骤所描述的反应过程,我们可以鉴定出待测溶液中是否存在特定的非金属阴离子。
通过溴苯试剂鉴定,若反应产生橙红色沉淀,我们可以确认溴离子的存在。

离子鉴定实验报告离子鉴定实验报告引言:离子鉴定实验是化学实验中的一项重要内容,通过对溶液中离子的检测和鉴定,可以帮助我们了解物质的性质和组成。
本次实验旨在通过一系列实验步骤和反应,准确鉴定出溶液中存在的离子类型。
实验目的:通过离子鉴定实验,准确鉴定出溶液中存在的离子类型,并了解不同离子的特性和反应规律。
实验原理:离子鉴定实验主要基于离子间的化学反应和特性。
不同离子在特定条件下会发生特定的反应,通过观察反应现象和产物的性质,可以推断出溶液中存在的离子类型。
实验步骤:1. 鉴定阳离子a. 取一小部分溶液,加入氯化铵试剂。
若产生白色沉淀,则可能存在银离子。
b. 取一小部分溶液,加入氯化钡试剂。
若产生白色沉淀,则可能存在钡离子。
c. 取一小部分溶液,加入氯化铜试剂。
若产生蓝色沉淀,则可能存在铜离子。
2. 鉴定阴离子a. 取一小部分溶液,加入硝酸银试剂。
若产生白色沉淀,则可能存在氯离子。
b. 取一小部分溶液,加入硝酸铅试剂。
若产生黄色沉淀,则可能存在碘离子。
c. 取一小部分溶液,加入硝酸铝试剂。
若产生白色沉淀,则可能存在磷酸根离子。
实验结果与讨论:根据实验步骤中观察到的反应现象和产物性质,可以得出以下结论:1. 溶液中存在银离子,通过与氯离子反应生成白色沉淀的反应可以推断出。
2. 溶液中存在钡离子,通过与硫酸钡反应生成白色沉淀的反应可以推断出。
3. 溶液中存在铜离子,通过与氢氧化钠反应生成蓝色沉淀的反应可以推断出。
4. 溶液中存在氯离子,通过与硝酸银反应生成白色沉淀的反应可以推断出。
5. 溶液中存在碘离子,通过与硝酸铅反应生成黄色沉淀的反应可以推断出。
6. 溶液中存在磷酸根离子,通过与硝酸铝反应生成白色沉淀的反应可以推断出。
结论:通过离子鉴定实验,我们成功地鉴定出了溶液中存在的离子类型。
这项实验不仅帮助我们理解了离子的特性和反应规律,也为进一步研究和应用提供了基础。
离子鉴定实验在化学领域具有广泛的应用价值,可以用于分析和检测不同样品中的离子成分,为实际问题的解决提供科学依据。

阴阳离子的鉴定
阴离子和阳离子是化学中离子的两种基本类型。
阴离子带有负电荷,而阳离子带有正电荷。
在化学分析中,可以通过不同的实验方法来鉴定阴离子和阳离子。
阳离子的鉴定方法:
1.火焰试验:将待鉴定物质放入火焰中,观察火焰的颜色。
不同的阳离子会产生不同颜色的火焰。
例如,钠离子会产生黄色火焰,钾离子会产生紫色火焰。
2.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,钡离子通常通过加入硫酸钡溶液来鉴定,生成白色沉淀(硫酸钡)。
阴离子的鉴定方法:
1.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,氯离子可以通过加入银离子(硝酸银溶液)来鉴定,生成白色沉淀(氯化银)。
2.气体的鉴定:一些气体可以用来鉴定特定的阴离子。
例如,二氧化硫气体可以用于检测硫离子。
3.酸碱中性化反应:使用适当的酸或碱与待鉴定物质反应,观察是否发生中性化反应。
例如,用氢氧化钠溶液可以鉴定酸性溶液中的氢离子。
在实验室中,这些方法通常结合使用,以确保对离子的准确鉴定。
通过观察沉淀、颜色变化和气体产生等现象,可以得出关于阳离子和阴离子的信息。

钠离子的检验方法
1. 火焰法检验:向待检物质中加入肉眼可见的氯化钡,若生成白色沉淀,加热至红热,则沉淀变成黄色,表示钠离子存在。
2. 火山法检验:将待测物质加入硝酸银溶液中,若生成白色沉淀,则加热或置于紫外线照射下,若沉淀呈黑色,则钠离子存在。
3. 氯化钴试剂检验:加入氯化钴试剂,若溶液呈红色,则表示存在钠离子。
4. 电感耦合等离子体原子发射光谱法:利用该方法可以对钠离子进行准确测量和分析。
5. 离子选择性电极法:使用钠离子选择性电极,可以通过电位差变化来检验钠离子的存在。
6. 离子交换色谱法:通过离子交换柱分离并检测钠离子,适用于水样中钠离子的检测。
总之,根据实验需要和条件的不同,可以选择不同的方法进行钠离子的检验。

Zn离子的检测方法1. Zn离子的分离:加入氨-氯化铵(1:1)调节pH至8~9,加入10滴TAA加热8~10分钟,搅拌。
过滤沉淀,向沉淀中加入浓硝酸,待溶解后加入尿素和甘氨酸,加热,趁热过滤沉淀,弃去沉淀。
向母液加入甘氨酸,调pH为6,加入5滴TAA加热。
过滤保留沉淀,加入双氧水和稀醋酸,加热,是沉淀完全溶解。
Zn离子的定性检出:向上述溶液中滴加(NH4)2Hg(SCN)4和CuSO4溶液,若加入戊醇在有机相中有紫色沉淀聚集,即Zn2Hg(SCN)4·Cu2Hg(SCN)4混晶。
则可鉴定含有锌离子。
Zn离子的定量测定:调节pH为弱酸性,EDTA滴定,指示剂用百里酚蓝,终点颜色变为紫色或蓝色?(不可确定)。
2.蛋氨酸螯合锌是由蛋氨酸与硫酸锌经过合成反应形成的蛋氨酸锌螯合物.它的螯合率决定了该物质的生物利用率,影响着动物体的消化和吸收.螯合率的测定在衡量产品质量,改进生产工艺,研究微量元素的作用机理等均有积极意义,但是,目前螯合率的测定均比较复杂,(如:离子交换树脂法,凝胶过滤色谱法,电极法等),这些方法,一般的实验室难以检测,为此,本文针对螯合物产品重点研究出了一套简便,易行的检测方法,经过多次比对结果令人满意.1,实验材料无水甲醇,双硫腙氯仿溶液(5ug/mL),EDTA标准滴定溶液(0.05mol/L),抗坏血酸,硫脲溶液:50g/L,氟化铵溶液:200g/L,盐酸溶液:1+4,乙酸—乙酸钠缓冲溶液,二甲酚橙指示液:2g/L. 2,实验原理氨基酸微量元素螯合物几乎不溶于甲醇等有机溶剂中,而游离金属离子均能溶解于甲醇等有机溶剂中,利用这一特性,我们用无水甲醇来分离提纯氨基酸微量元素螯合物.3,螯合物的鉴别纯的氨基酸微量元素螯合物在有机溶剂中应没有游离的金属离子存在.另外,因为双硫腙易与Cu,Zn,Fe离子形成红色络合物,所以我们用双硫腙试剂来鉴别游离金属离子,只要出现红色,证明螯合物中有游离金属离子存在,因此我们就判定此产品为不合格产品.称取蛋氨酸螯合锌试样1g,用25mL无水甲醇提取,过滤,取滤液0.1mL加入3mL双硫腙氯仿溶液,试样应呈蓝绿色(双硫腙颜色),不得出现红色现象.为了验证此方法的可行性,我们用蛋氨酸与无机金属锌按照蛋氨酸螯合锌的配比,混合成蛋氨酸锌混合物,然后同样用此方法与蛋氨酸螯合锌做比较.检验结果如下表:表1双硫腙试剂检验蛋氨酸螯合锌及蛋酸混合锌样品的甲醇溶液的实验结果样品溶液鉴别现象检验结果空白蓝绿色没有游离锌存在蛋氨酸螯合锌蓝绿色没有游离锌存在蛋氨酸混合锌红色有大量游离锌存在蛋氨酸混合锌样品的甲醇溶液在加入双硫腙试剂后,呈红色,蛋氨酸螯合锌样品的甲醇溶液在加入双硫腙试剂后呈蓝绿色(双硫腙颜色),所以双硫腙确实能与游离的金属离子形成红色络合物,从两者甲醇溶液的颜色变化可知样品是否完全螯合.(百分百螯合)此鉴别方法有效的检测了产品的螯合情况,在鉴别合格的前提下就可以直接测定金属离子的含量.4,锌含量的测定4.1 原理将试样用盐酸溶解,加适量的水,加入氟化铵,硫脲,抗坏血酸作为掩蔽剂,以乙酸—乙酸钠溶液调节PH值为5-6,以二甲酚橙为指示剂,用乙二胺四乙酸二钠标准滴定溶液滴定,至溶液由紫红色为亮黄色即为终点.4.2 分析步骤称取蛋氨酸锌式样0.5~1.0g(准确至0.0002g)置于250mL锥形瓶中,加少量水润湿.加5mL盐酸溶液(1+4)使式样溶解,加50mL水,10mL氟化铵溶液,10mL硫脲溶液,0.2g抗坏血酸,摇匀溶解后加入15mL乙酸—乙酸钠缓冲溶液和3滴二甲酚橙指示液,用乙二胺四乙酸二钠标准滴定溶液由紫红色变为亮黄色即为终点.同时做空白实验.4.3 结果计算式样中锌含量X以质量百分数(%)表示,按下式计算:X=(V1-V0)C×0.06539×100m式中:V1——滴定试样溶液所消耗乙二胺四乙酸二钠标准滴定溶液的体积,mL;V0——滴定空白溶液所消耗乙二胺四乙酸二钠标准滴定溶液的体积,mL;C——乙二胺四乙酸二钠标准滴定溶液的实际浓度,mol/L;0.06539——与 1.00mL乙二胺四乙酸二钠标准滴定溶液C(EDTA=1.000mol/L)相当的以克表示的锌的质量; m——试样的质量.5,测定螯合率5.1 原理由于氨基酸微量元素螯合物在甲醇等有机溶剂中的溶解度极小,而游离金属离子均能溶解于甲醇等有机溶剂中,利用二者在甲醇中溶解度的差异,我们用无水甲醇来分离提纯氨基酸螯合物,然后用EDTA配位滴定法滴定游离态中的锌离子,计算出螯合率.5.2测定方法称取0.5~1.0g蛋氨酸螯合锌样品,然后按4.2中的分析步骤进行,计算出锌离子的含量(为总含量).另称相同量的蛋氨酸锌螯合物样品,加50ml无水甲醇,充分搅拌,过滤,沉淀用甲醇反复洗涤3次,按4.2的分析方法测定滤液(游离态)中锌离子的含量.6,讨论6.1 由于蛋氨酸螯合锌微溶于水,为了避免甲醇中含有少量的水分会将锌离子游离出来,所以所用的甲醇必须经过蒸馏除水后方可用来提纯蛋氨酸螯合锌.6.2 双硫腙试剂与锌离子的络合反应非常灵敏,只要有痕量的锌离子存在,就会与双硫腙生成红色络合物,并且颜色会随着锌离子的增多而加深,因此我们可以从颜色的深浅来判断游离锌的多少,双硫腙氯仿溶液极易挥发,故应现用现配. 6.3方法的适用性测定多个产品,并用同配比的无机盐产品做对比,考察方法的适用性(表3,表4).表3 蛋氨酸锌螯合物与蛋氨酸锌混合物的鉴别比较试样名称试样编号鉴别现象检验结果空白蓝绿色无锌离子存在蛋氨酸螯合锌1#蓝绿色无锌离子存在蛋氨酸螯合锌2#蓝绿色无锌离子存在蛋氨酸螯合锌3#蓝绿色无锌离子存在蛋氨酸螯合锌4#蓝绿色无锌离子存在蛋氨酸螯合锌5#蓝绿色无锌离子存在蛋氨酸螯合锌6#蓝绿色无锌离子存在蛋氨酸混合锌红色大量锌离子存在7,结论本次实验重复性好,鉴别方法反应灵敏,操作简便,能够快速而有效的对氨基酸微量元素螯合物是否完全螯合进行定性鉴定.螯合率检测方法简单易行,以上数据均有利说明了此方法的准确性和再现性.3.食品中锌的测定--二硫腙比色法1 主题内容与适用范围本标准规定了食品中锌的测定方法。
铅离子的鉴定介绍铅离子是一种常见的有毒金属离子,它广泛存在于环境中,包括土壤、水体、空气等。
铅离子对人体健康有严重威胁,可能导致神经系统、肾脏、血液系统等多种疾病。
因此,对铅离子进行及时准确的鉴定非常重要,以便采取相应的措施进行治理和防护。
鉴定方法1. 原子吸收光谱法原子吸收光谱法是目前应用较广泛的铅离子鉴定方法之一。
该方法通过测量样品中吸收光的强度来分析铅的含量。
具体步骤如下:1.收集样品,并将其溶解在适当的溶剂中;2.根据样品的性质选择合适的基体和化学预处理方法;3.使用原子吸收光谱仪测量样品吸收光的强度;4.通过与标准品进行比较,确定样品中铅离子的含量。
2. 电化学法电化学法是一种常用的铅离子鉴定方法,主要利用电化学技术来检测铅离子的存在。
常用的电化学方法包括电位滴定法、阳极溶出伏安法和恒电位溶出伏安法等。
具体步骤如下:1.准备电化学工作电极,并进行表面处理;2.将样品与适当的电解质结合,制备电化学工作溶液;3.使用电化学仪器进行实验,如电位滴定仪、伏安计等;4.通过分析电位-电流曲线或滴定曲线,确定铅离子的浓度。
3. 分子光谱法分子光谱法是通过分析铅离子与某些有机分子的光谱特性来鉴定铅离子的方法。
常用的分子光谱法包括荧光光谱法、紫外-可见光谱法等。
具体步骤如下:1.准备适当的试剂和样品溶液;2.使用分子光谱仪器(如荧光光谱仪、紫外-可见分光光度计)测量样品的光谱参数;3.通过比较样品光谱与标准物质光谱的差异,确定铅离子的存在。
鉴定结果的解释根据各种鉴定方法得到的结果,我们可以判断样品中是否存在铅离子,并确定其浓度。
在实际应用中,通常会参考相应的标准,如环境标准、食品安全标准等,来评估铅离子的含量是否超出安全限值。
结论铅离子的鉴定是保护人体健康和环境的关键步骤之一。
采用合适的鉴定方法,可以准确地检测铅离子的存在,并根据鉴定结果采取相应的控制措施,以减少对人体和环境的危害。
参考文献1.王某某,张某某. 铅离子环境检测技术及应用进展[J]. 中国环境监测,2020(03):128-131.2.李某某,刘某某. 电化学法在铅离子检测中的应用[J]. 分析测试学报,2021(01):89-94.3.张某某,陈某某. 分子光谱法在铅离子鉴定中的应用进展[J]. 光谱学与光谱分析, 2019(04):1051-1057.。
几种离子的鉴别方法离子的鉴别方法是化学分析中常用的重要手段之一,可以根据其特定的物理化学性质进行判断和鉴别。
以下介绍几种常见的离子鉴别方法:一、常用的离子鉴别方法之一是溶液的反应性质。
1.阴阳离子的反应鉴别:阴离子通过与阳离子的反应形成沉淀或溶解现象来区分。
例如,将待鉴定离子添加到已知阳离子的溶液中,观察是否出现沉淀现象,通过沉淀的形成、颜色、形态等特征来判断鉴定离子的种类。
2.气体的反应鉴别:一些离子在接触特定的试剂时,会产生气体。
例如,CO3^2-与酸反应产生CO2气体,通过检测气体的产生来鉴别CO3^2-离子。
3.氧化还原反应鉴别:一些离子在氧化还原反应中具有特殊的性质。
例如,Fe3+在还原条件下可以被还原为Fe2+,通过观察颜色的变化来鉴别Fe3+离子。
二、离子鉴别的另一种方法是通过离子的酸碱性质进行鉴定。
1.酸碱反应鉴别:根据酸碱滴定的原理,向待鉴定离子溶液中逐滴加入已知浓度的酸或碱,通过观察溶液的酸碱指示剂的颜色变化,确定待鉴定离子的酸碱性质。
2.氢氧化物的沉淀鉴别:一些阳离子与氢氧化物反应时会生成沉淀。
例如,溴化铵试剂可以与Ba2+、Pb2+形成沉淀,通过沉淀的特征来鉴别阳离子的种类。
三、光谱分析是离子鉴别的又一重要方法。
1.紫外可见光谱:一些离子在紫外可见光谱中具有特定的吸收和发射特征,通过检测溶液在紫外可见光谱下的吸收曲线或发射光谱特征来鉴定离子。
2.火焰光谱:通过加热一些元素或化合物的溶液,利用其产生的特定颜色的火焰光谱线来鉴别元素或离子的种类。
3.原子吸收光谱:通过测量溶液中特定离子在特定波长处光的吸收程度,从而确定溶液中对应离子的浓度或存在状态。
以上是几种常见的离子鉴别方法,通过这些方法,在化学分析实验中可以根据不同离子的特性进行鉴定和分析。
离子的检测与鉴定
阳离子:
一、铵根离子:
取少量样品溶于水,加入氢氧化钠后加热,有刺激性气味气体生成,或用湿润的红色石蕊试纸检测该气体,试纸变蓝,或用蘸有浓盐酸(浓硝酸)的玻璃棒检测,有白烟产生。
二、镁离子:
取少量样品溶于水,加入过量氢氧化钠溶液后,有白色沉淀。
3、铝离子:
取少量样品溶于水,逐滴加入氢氧化钠溶液至过量,先显现白色沉淀,后来溶解消失。
4、铜离子:
取少量样品溶于水(蓝色),逐滴加入氢氧化钠溶液至过量,显现蓝色沉淀。
五、铁离子:
(1)取少量样品溶于水(黄色),逐滴加入氢氧化钠溶液到过量,显现红褐色沉淀。
(2)取少量样品溶于水(黄色),逐滴加入硫氰化钾溶液,显现血红色物质。
六、亚铁离子:
(1)取少量样品溶于水(绿色),逐滴加入氢氧化钠溶液,先显现白色沉淀,迅速变成灰绿色,又变成红褐色。
(2)取少量样品溶于水(绿色),先加入硫氰化钾溶液,无任何现象,再加入氧化剂,显现血红色物质。
(3)取少量样品溶于水(绿色),加入铁氰化钾溶液,显现蓝色沉淀。
常见阴离子的分离与鉴定实验报告常见阴离子的分离与鉴定实验报告引言:阴离子是化学中一类带负电荷的离子,它们在化学反应中起着重要的作用。
为了研究和鉴定常见的阴离子,我们进行了一系列的实验。
本实验报告将详细介绍实验的目的、原理、实验步骤和结果,并对实验结果进行分析和讨论。
实验目的:1. 掌握常见阴离子的分离与鉴定方法;2. 熟悉常见阴离子的化学性质;3. 提高实验操作技能。
实验原理:常见阴离子的分离与鉴定主要依靠化学反应的特性。
在本实验中,我们主要使用了沉淀反应、酸碱中和反应和气体演化反应等方法。
实验步骤:1. 分离:将待测样品溶解于适量的水中,并通过适当的处理方法,如加热、稀释等,使得样品中的阴离子充分溶解。
2. 分组:根据阴离子的不同特性,将样品分为不同的组别,以便进行后续的实验操作。
3. 沉淀反应:将每个组别的样品分别与不同的沉淀试剂反应,观察是否生成沉淀物。
根据沉淀物的颜色、形状和溶解性等特征,可以初步判断阴离子的存在情况。
4. 酸碱中和反应:将每个组别的样品分别与酸碱试剂反应,观察是否产生酸碱中和反应。
根据反应产生的气体、颜色变化和pH值的变化等特征,可以进一步确定阴离子的种类。
5. 气体演化反应:将每个组别的样品分别与适当的试剂反应,观察是否产生气体。
根据气体的性质和产生气体的反应类型,可以进一步鉴定阴离子的种类。
实验结果与分析:根据实验步骤进行实验后,我们观察到了不同的反应现象,并得到了如下的实验结果:1. 沉淀反应:在样品A中加入氯化银试剂后,观察到了白色沉淀物的生成,表明样品A中存在氯离子。
2. 酸碱中和反应:在样品B中加入盐酸试剂后,观察到了气泡的产生,并且溶液的pH值下降,表明样品B中存在碳酸根离子。
3. 气体演化反应:在样品C中加入硫酸铜试剂后,观察到了蓝色气体的产生,表明样品C中存在硫化物离子。
根据实验结果,我们可以初步确定样品A中存在氯离子、样品B中存在碳酸根离子、样品C中存在硫化物离子。
化学实验中的常见离子反应与观察方法在化学实验中,离子反应是非常常见的实验现象。
离子是带电的原子或分子,它们在反应中参与化学变化,产生新的物质。
本文将介绍一些常见的离子反应与观察方法。
一、氯离子的反应与观察方法氯离子在实验中的常见反应包括:1. 氯离子与银离子的反应:Ag+ + Cl- → AgCl当氯离子(Cl-)与银离子(Ag+)反应时,会形成白色的氯化银沉淀(AgCl),该反应可以用来检测氯离子的存在。
2. 氯离子与硝酸银的反应:Cl- + AgNO3 → AgCl↓ + NO3-氯离子与硝酸银反应时,会产生白色的氯化银沉淀(AgCl)和硝酸根离子(NO3-)。
此反应也是检测氯离子的重要方法。
二、硫酸根离子的反应与观察方法硫酸根离子在实验中的常见反应包括:1. 硫酸根离子与钡离子的反应:Ba2+ + SO42- → BaSO4↓当硫酸根离子(SO42-)与钡离子(Ba2+)反应时,会生成白色的硫酸钡沉淀(BaSO4),通过观察沉淀的形成可以检测硫酸根离子的存在。
2. 硫酸根离子与银离子的反应:Ag+ + SO42- → Ag2SO4↓硫酸根离子(SO42-)与银离子(Ag+)反应会产生黄色的硫酸银沉淀(Ag2SO4),利用这个反应可以检测硫酸根离子的存在。
三、碳酸根离子的反应与观察方法碳酸根离子在实验中的常见反应包括:1. 碳酸根离子与盐酸的反应:H+ + CO32- → CO2↑ + H2O当碳酸根离子(CO32-)与盐酸(HCl)反应时,会产生气体二氧化碳(CO2)的释放,可以通过这个观察到碳酸根离子的存在。
2. 碳酸根离子与钙离子的反应:Ca2+ + CO32- → CaCO3↓碳酸根离子(CO32-)与钙离子(Ca2+)反应会生成白色的碳酸钙沉淀(CaCO3),通过观察沉淀的形成可以检测碳酸根离子的存在。
四、硫离子的反应与观察方法硫离子在实验中的常见反应包括:1. 硫离子与铁离子的反应:Fe2+ + H2S → FeS↓ + 2H+硫离子(S2-)与铁离子(Fe2+)反应会生成黑色的硫化铁沉淀(FeS),通过观察沉淀的形成可以检测硫离子的存在。
检验铜离子的方法以检验铜离子的方法为标题,下面将介绍几种常用的方法。
一、火焰试验法火焰试验法是一种简单且常用的检验铜离子的方法。
将待检样品溶解在适当的溶剂中,然后将溶液滴入火焰中,观察火焰颜色的变化。
铜离子在火焰中会发出独特的蓝绿色光芒,因此如果观察到蓝绿色火焰,即可判定样品中含有铜离子。
二、络合滴定法络合滴定法是一种精确测定铜离子浓度的方法。
该方法需要使用特定的络合剂,如EDTA(乙二胺四乙酸)作为滴定剂。
首先将待检样品中的铜离子与络合剂形成络合物,然后使用标准溶液滴定至颜色变化终点,从滴定过程中消耗的标准溶液的体积可以计算出铜离子的浓度。
三、比色法比色法是一种常用的半定量检验铜离子的方法。
根据铜离子与某些试剂反应产生的颜色深浅来判断铜离子的存在与否。
例如,将待检样品与苯酚溶液反应,生成深蓝色络合物,通过比较溶液的颜色深浅可以大致判断铜离子的含量。
四、电化学法电化学法是一种准确测定铜离子浓度的方法。
常用的电化学方法有电位滴定法和电感耦合等离子体质谱法。
这些方法利用电极与样品溶液之间的电化学反应来测定铜离子的浓度,具有高精确度和准确性。
五、光谱法光谱法是一种常用的分析方法,可以用来检验铜离子的存在。
常用的光谱法有紫外可见吸收光谱法和原子吸收光谱法。
紫外可见吸收光谱法可以通过测量铜离子在紫外可见光区域的吸收情况来判断铜离子的存在。
原子吸收光谱法则利用铜原子对特定波长的光的吸收来测定铜离子的浓度。
检验铜离子的方法有火焰试验法、络合滴定法、比色法、电化学法和光谱法等。
根据需要选择合适的方法,可以快速、准确地检验铜离子的存在与浓度。
离子的检测与鉴定:
阳离子:
1、铵根离子:取少量样品溶于水,加入氢氧化钠后加热,有刺激性气味气体生成,或用湿
润的红色石蕊试纸检测该气体,试纸变蓝,或用蘸有浓盐酸(浓硝酸)的玻璃
棒检测,有白烟产生。
涉及的离子方程式、化学方程式:
2、镁离子:取少量样品溶于水,加入过量氢氧化钠溶液后,有白色沉淀。
涉及的离子方程式:
3、铝离子:取少量样品溶于水,逐滴加入氢氧化钠溶液至过量,先出现白色沉淀,后来溶
解消失。
涉及的离子方程式、化学方程式:
4、铜离子:取少量样品溶于水(蓝色),逐滴加入氢氧化钠溶液至过量,出现蓝色沉淀。
涉及的离子方程式:
5、铁离子:(1)取少量样品溶于水(黄色),逐滴加入氢氧化钠溶液到过量,出现红褐色沉淀。
涉及的离子方程式:
(2)取少量样品溶于水(黄色),逐滴加入硫氰化钾溶液,出现血红色物质。
涉及的离子方程式:
取少量样品溶于水(黄色),逐滴加入苯酚溶液,出现紫色物质。
6、亚铁离子:(1)取少量样品溶于水(绿色),逐滴加入氢氧化钠溶液,先出现白色沉淀,迅
速变成灰绿色,又变成红褐色。
涉及的离子方程式、化学方程式:
(2)取少量样品溶于水(绿色),先加入硫氰化钾溶液,无任何现象,再加入氧
化剂,出现血红色物质。
涉及的离子方程式、化学方程式:
(3)取少量样品溶于水(绿色),加入铁氰化钾溶液,出现蓝色沉淀。
7、银离子:(1)取少量样品溶于水,逐滴加入氨水至过量,先出现白色沉淀,后溶解消失。
涉及的离子方程式、化学方程式:
(2)取少量样品溶于水,加入含氯离子(或溴离子、碘离子)的溶液,产生不溶
于硝酸的白(淡黄、深黄)色沉淀。
涉及的离子方程式、化学方程式:
8、钡离子:取少量样品溶于水,加入含硫酸根离子的溶液,出现白色不溶于酸的沉淀。
涉及的离子方程式:
9、钙离子:取少量样品溶于水,加入含碳酸根离子的溶液,出现白色溶于酸的沉淀。
涉及的离子方程式:
10、氢离子:(1)指示剂——紫色石蕊变红,红色(加过碱)酚酞褪成无色。
(2)pH小于7。
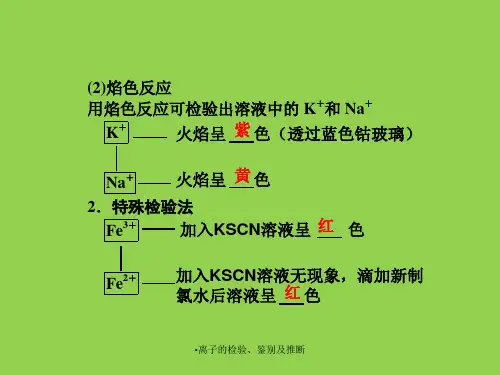
(3)与金属生成气体。
(4)溶解多种难溶于水的碱和盐。
11、钠、钾离子:钠离子焰色反应为黄色,钾离子焰色反应为紫色(透过蓝色钴玻璃)。
阴离子:
1、碳酸根离子:(1)取少量样品溶于水,逐滴加稀盐酸至过量,先不出无色无味气体,后出
无色无味气体,该气体能使澄清石灰水变浑浊。
涉及的离子方程式、化学方程式:
(2)取少量样品溶于水,加入含钙离子、钡离子的盐溶液,出现白色溶于酸
的沉淀。
涉及的离子方程式、化学方程式:
2、碳酸氢根离子:取少量样品溶于水,逐滴加稀盐酸,立即出现无色无味气体,该气体使
澄清石灰水变浑浊。
涉及的离子方程式、化学方程式:
3、亚硫酸根离子:(1)取少量样品溶于水,逐滴加稀盐酸至过量,先不出无色有刺激性气味
气体,后出无色有刺激性气味气体,该气体能使澄清石灰水变浑浊,
该气体也能使红色品红溶液褪色,加热后品红又恢复成红色,该气体
也能使紫红色酸性高锰酸钾溶液褪色。
涉及的离子方程式、化学方程式:
(2)取少量样品溶于水,加入含钙离子、钡离子的盐溶液,出现白色溶于
酸的沉淀。
涉及的离子方程式、化学方程式:
4、亚硫酸氢根离子:取少量样品溶于水,逐滴加稀盐酸至过量,先不出无色有刺激性气味
气体,后出无色有刺激性气味气体,该气体能使澄清石灰水变浑浊,
该气体也能使红色品红溶液褪色,加热后品红又恢复成红色,该气体
也能使紫红色酸性高锰酸钾溶液褪色。
涉及的离子方程式、化学方程式:
5、硫离子:取少量样品溶于水,逐滴加入稀盐酸,先不出气体,后出现无色有臭鸡蛋气味
的气体,该气体可使硫酸铜溶液生成黑色沉淀。
涉及的离子方程式、化学方程式:
6、硫氢根离子:取少量样品溶于水,逐滴加入稀盐酸,立即出现无色有臭鸡蛋气味的气体,
该气体可使硫酸铜溶液生成黑色沉淀。
涉及的离子方程式、化学方程式:
7、硅酸根离子:取少量样品溶于水,逐滴加入稀盐酸至过量,出现白色不溶于酸的沉淀。
涉及的离子方程式:
8、偏铝酸根离子:取少量样品溶于水,逐滴加入稀盐酸至过量,先出现白色沉淀,后又消
失。
涉及的离子方程式、化学方程式:
9、硝酸根离子:取少量样品溶于水,加入浓硫酸后再加入铜粉,有气体生成,进入空气后
变成红棕色。
涉及的离子方程式、化学方程式:
10、硫酸根离子:取少量样品溶于水,先加盐酸酸化无任何现象(排除银离子、碳酸根离子、
硅酸根离子、亚硫酸根离子的干扰),再加氯化钡出现白色沉淀。
涉及的离子方程式:
11、氯离子:取少量样品溶于水,加入硝酸银溶液,生成不溶于硝酸的白色沉淀。
涉及的离子方程式:
12、溴离子:(1)取少量样品溶于水,加入硝酸银溶液,生成不溶于硝酸的淡黄色沉淀。
涉及的离子方程式:
(2)取少量样品溶于水,加入强氧化剂,再加四氯化碳,下层四氯化碳显橙红(黄)
色。
涉及的离子方程式:
13、碘离子:(1)取少量样品溶于水,加入硝酸银溶液,生成不溶于硝酸的深黄色沉淀。
涉及的离子方程式:
(2)取少量样品溶于水,加入四氯化碳,再加氧化剂,振荡静置后下层四氯化
碳显紫红色。
涉及的离子方程式、化学方程式:
(3)取少量样品溶于水,加入淀粉,再加氧化剂,溶液显蓝色。
涉及的离子方程式、化学方程式:
14、氢氧根离子:(1)指示剂——紫色石蕊变蓝,无色酚酞变红。
(2)pH大于7。
(3)前面用氢氧化钠溶液检验的阳离子。