烷烃 人教版
- 格式:doc
- 大小:272.50 KB
- 文档页数:20








烷烃一.学习目的和要求:1.掌握烷烃的同系列、同分异构和构造异构。
2.掌握烷烃的命名法、常见基团的名称。
3.掌握烷烃的结构,包括碳正四面体的概念、sp3杂化和σ键。
4.掌握烷烃的构象及构象的表示方法。
5.掌握烷烃的物理性质。
6.掌握烷烃的化学性质(稳定性、裂解、氧化及取代反应、各种氢的相对活泼性)。
7.掌握烷烃光卤代反应历程。
8.掌握甲烷氯代反应过程中的能量变化,包括过渡态理论、反应热、活化能。
9.掌握一般烷烃的卤代反应历程。
10.了解烷烃的来源。
二.本章节重点、难点烷烃的同系列、同分异构和构造异构、烷烃的命名法、烷烃的结构、烷烃的构象及构象的表示方法、烷烃的物理性质、烷烃的化学性质、烃光卤代反应历程、甲浣氯代反应过程中的能量变化。
三.教学内容分子中只有C、H两种元素的有机化合物叫做烃,烃可以分为以下几类:烷烃开链烃(脂肪烃) 烯烃、二烯烃烃 炔烃环状烃(脂环烃) 脂环烃芳香烃烷烃是分之中的碳除以碳碳单键相连外,碳的其他价键都为氢原子所饱和的烃叫做烷烃,也叫做饱和烃。
2.1 烷烃的同系列及同分异构现象2.1.1 烷烃的同系列最简单的烷烃是甲烷,依次为乙烷、丙烷 、丁烷、戊烷等,它们的分子式、构造式分别为:分子式 构造式 构造简式甲烷 CH 4 CH 4 乙烷 C 2H 6 CH 3CH 3丙烷 C 3H 8 CH 3CH 2CH 3丁烷 C 4H 10 CH 3CH 2CH 2CH 3从上述结构式可以看出,链状烷烃的组成都是相差一个或几个CH 2(亚甲基)而连成碳链,碳链的两端各连一个氢原子。
所以烷烃的通式为CnH2n+2 。
这种结构和化学性质相似,组成上相差一个或多个CH 2的一系H C HHH列化合物称为同系列。
同系列中的化合物互称为同系物。
由于同系列中同系物的结构和性质相似,其物理性质也随着分之中碳原子数目的增加而呈规律性变化,所以掌握了同系列中几个典型的有代表性的成员的化学性质,就可推知同系列中其他成员的一般化学性质。

第一节 烷 烃[核心素养发展目标] 1.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
2.认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。
3.了解烷烃的命名规则,会对烷烃进行命名。
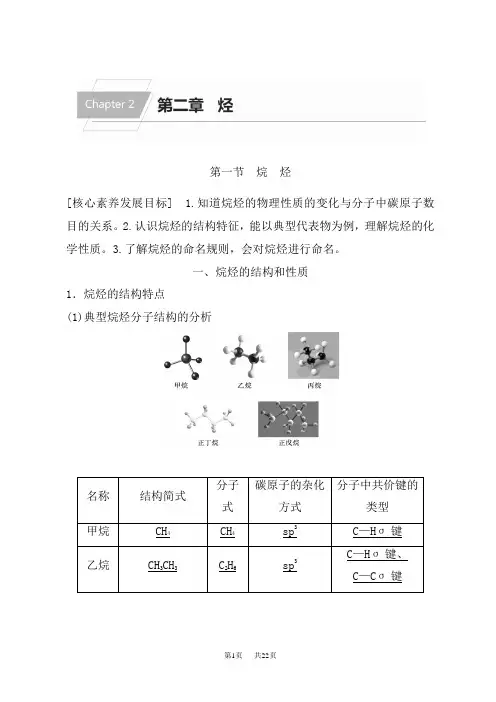
一、烷烃的结构和性质1.烷烃的结构特点 (1)典型烷烃分子结构的分析(2)烷烃的结构特点①烷烃的结构与甲烷相似,分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
分子中的共价键全部是单键。
②它们在分子组成上的主要差别是相差一个或若干个CH2原子团。
像这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物称为同系物。
同系物可用通式表示。
③链状烷烃的通式:C n H2n+2(n≥1)。
2.烷烃的性质(1)物理性质阅读教材表2-1并结合你已学知识内容,填写下表:(2)化学性质①稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂、溴的四氯化碳溶液等都不发生反应。
烷烃之所以很稳定,是因为烷烃分子中化学键全是σ键,不易断裂。
②特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
之所以可以发生取代反应,是因为C —H 有极性,可断裂,CH 3CH 2Cl 会继续和Cl 2发生取代反应,生成更多的有机物。
③氧化反应——可燃性烷烃燃烧的通式为C n H 2n +2+3n +12O 2――→点燃nCO 2+(n +1)H 2O 。
如辛烷的燃烧方程式为2C 8H 18+25O 2――→点燃16CO 2+18H 2O 。
(1)在烷烃分子中,所有的化学键都是碳碳单键( )(2)烷烃中除甲烷外,很多都能使酸性KMnO 4溶液的紫色褪去( ) (3)分子通式为C n H 2n +2的烃不一定是烷烃( )(4)所有的烷烃在光照条件下都能与氯气发生取代反应( ) (5)丙烷分子中所有碳原子在一条直线上( )(6)光照条件下,1molCl 2与2molCH 4充分反应后可得到1molCH 3Cl( )(7)标况下,11.2L己烷所含共价键的数目为9.5N A( )答案(1)×(2)×(3)×(4)√(5)×(6)×(7)×1.有4种碳骨架如下的烃,下列说法正确的是( )①a和d是同分异构体②b和c是同系物③a和b都能发生加成反应④只有b和c能发生取代反应A.①②B.①④C.②③D.②④答案 A解析a为,d为,a和d分子式相同但结构不同,互为同分异构体,①正确;b为,c为,b和c都是烷烃,互为同系物,②正确;a可以发生加成反应,b不可以发生加成反应,③不正确;a中—CH3上的H原子可以发生取代反应,烷烃和环烷烃都能发生取代反应,④不正确。

烷烃的知识点总结人教版一、烷烃的物理性质:1. 烷烃是无色、无味、无臭的气体、液体或固体,在常温下是无害的。
它们是不易溶解的非极性分子,因此在水中几乎不溶解,但可以溶解在非极性溶剂中,如石油醚、石油醇等。
2. 烷烃的密度小,比空气轻,在空气中能上升,容易燃烧。
3. 烷烃的沸点随着分子量的增大而增高,直链烷烃的沸点一般要比支链烷烃高,因为分子量相同的情况下,支链烷烃的分子间作用力较小。
4. 烷烃是热不足的燃料,在有氧气状况下燃烧会放出大量的热能,生成水和二氧化碳。
二、烷烃的化学性质:1. 烷烃是不活泼的分子,不易被氧化、还原、置换等。
但在高温或有催化剂的条件下也会参与一些化学反应,如烷烃的裂解反应,即在高温下或有催化剂的情况下,烷烃分子会裂解成小碳烷(烯)和氢气。
2. 烷烃可以和卤素(如氯气、溴水)反应,生成相应的卤代烷,也可以和氯化氢发生反应生成醇。
3. 烷烃也可以和臭氧发生反应,生成相应的醛、酮等。
4. 由于烷烃是非极性分子,因此很难和水发生反应,但可以和氨气发生反应生成氮化合物。
5. 烷烃在高温和有氧气的条件下可以燃烧,生成二氧化碳和水。
三、烷烃的系统命名法:1. 烷烃的系统命名法是根据碳原子数来进行的,直链烷烃的命名以“烷”为结尾,支链烷烃的命名以“烷”为结尾,支链的位置和种类用“-yl”来表示。
2. 直链烷烃的命名遵循一定的规则,先确定主链的长度,然后确定主链的前缀,根据主链上的支链的位置和种类来确定支链的名称和位置。
3. 支链烷烃的命名要按照主链和支链的长度进行组合,使用连字符“-”隔开,以表示不同分子之间的连接。
4. 烷烃的结构式需要根据命名法来进行绘制,通过分析结构式可以了解烷烃分子中碳原子的排列方式。
四、烷烃的应用:1. 烷烃作为燃料广泛应用于航空、汽车、火箭等交通工具中,也用于生产锅炉、家用燃气等领域。
由于烷烃的燃烧产生的污染物较少,因此在环保方面有一定的优势。
2. 烷烃是石油和天然气的主要成分之一,也是化工、医药等行业的原料,用于生产塑料、合成橡胶、合成纤维、合成肥料等。
烷烃【课前复习】温故——会做了,学习新课才有保障1.通常状况下,甲烷_____________(填“很稳定”或“很活泼”),跟酸、碱及常用氧化剂都______________(填“不发生反应”或“易发生反应”);在点燃条件下,甲烷能在空气里___________或___________,在___________条件下,甲烷能与Cl2发生取代反应,在高温条件下(隔绝空气),甲烷发生___________(填“分解反应”或“取代反应”)。
2.结构和组成相似的物质,化学性质相似,沸点与式量有关。
He、Ne、Ar、Kr、Xe式量逐渐增大,沸点依次___________(填“升高”或“降低”下同);F2、Cl2、Br2、I2式量逐渐增大,沸点依次___________。
3.由___________互称为同素异形体。
___________互称为同位素。
知新——先看书,再来做一做4.烷烃的概念是什么?掌握烷烃的概念应注意哪些问题?烷烃的通式是什么?5.烷烃物理性质有何递变规律?常温常压下,哪些烷烃是气体,哪些烷烃是液体,哪些烷烃是固体?6.烷烃的化学性质与甲烷的化学性质有何关系?烷烃的特征反应是什么?烷烃能使溴水和酸性KMnO4(aq)溶液褪色吗?7.同系物的概念是什么?掌握同系物的概念应理解哪些问题?如何理解有机物的结构相似?符合烷烃通式C n H2n+2的有机物,结构一定相似吗?8.什么是同分异构现象?什么样的物质互称为同分异构体?同素异形体、同位素、同系物、同分异构体的区别与联系分别是什么?【学习目标】1.了解烷烃的概念、结构特点和通式。
烷烃与饱和链烃的关系是认识烷烃的重要基础,烷烃的结构特点是学习本节的一个难点,烷烃的通式是后面学习其他烃的通式的基础。
2.了解烷烃的化学性质和烷烃物理性质的递变规律,这是本节内容的一个重点。
3.掌握烃基、同系物、同分异构现象和同分异构体的概念;能判断两种或多种物质是不是同系物,是不是同分异构体;能写出C5以内的烷烃分子的所有同分异构体。
同位素和同分异构体是本节重点,同分异构体也是本章难点和高考热点。
记住丙基、丁基和戊基的种数,它们是高考中经常出现的内容。
4.掌握烷烃的两种命名方法:习惯命名法和系统命名法。
其中烷烃系统命名法是本节的重点,还是本节的难点、本章的难点,也是高考的常考内容,是掌握其他烃的命名的基础。
【基础知识精讲】一、烷烃烃分子里,碳原子之间都以碳碳单键结合成链状,碳原子的其余价键全部跟氢原子结合,这样的烃叫做饱和烃,又叫烷烃。
(1)烷烃首先是烃,分子中只含C、H两种原子。
(2)烷烃分子中只有两种键,碳碳单键(这是烷烃的重要结构特点)和碳氢键。
(3)烷烃是饱和烃。
C原子数一定的烷烃分子中,H原子数已达到最多,其他同碳数的烃分子中的H原子数都不会比烷烃多。
烷烃的分子式可用通式C n H2n+2(n∈N)表示,具有这一通式的物质一定是烷烃。
(4)烷烃分子成链状,可以是所谓的“直链”,如:也可以含有支链,如:但结合为环状的不是烷烃,如:它们属于环烷烃,通式为C n H2n,化学性质与烷烃相似。
碳原子间结合成链状是烷烃的另一个重要结构特点。
所有烷烃分子都具有相似的结构特点:链状和碳碳单键。
(5)下列烷烃是同一种物质前3种分别是结构简式,难以反映立体形象。
其实每2个—CH3都在以某个C原子为中心的四面体顶点上如图5-10所示,第4种是前3种的一种简写。
图5-10二、烷烃物理性质的递变规律烷烃的物理性质随着分子是C原子数的递增,呈现如下变化规律:(1)沸点逐渐升高。
因为结构和组成相似的物质,分子越大,分子间作用力越大,故沸点越高。
符合此变化规律的常见物质组是:常温下,随烷烃分子中C原子数的递增,它们的状态由气态变到液态又变到固态;C1~C4的烷烃是气体,C5~C16的烷烃是液体,C17以上的烷烃是固体。
(2)相对密度(或密度)逐渐增大。
三、烷烃的化学性质烷烃的化学性质以甲烷为代表,特征反应是取代反应。
(1)燃烧生成CO2和H2O(2)光照条件下,与卤素单质的气体(如Cl2)发生取代反应。
(3)高温下,发生分解反应。
(4)不能使溴水和酸性高锰酸钾溶液褪色,与强酸、强碱也不反应。
四、同系物结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
把握其概念应注意以下几点:(1)结构相似:结构相似是不同物质间互称同系物的根本原因,在概念中起决定作用。
所谓“结构相似”其实质是:化学键类型相同、官能团相同,如烷烃同系物的结构特点是:链状结构(可以是“直链”,也可以带支链),碳碳原子间以C—C单键连接。
(2)相差一定数目的CH2原子团:这是同系物分子间的一种组成差别,是结构相似的一种表现形式,由此可以推出,互称同系物的物质应该具有相同的通式,如烷烃同系物的通式是:C n H 2n +2(n ∈N ),但具有相同通式或者说相差一定数目CH 2原子团的物质不一定互称为同系物;但符合通式C n H 2n +2且分子内C 原子数不同的有机物一定是烷烃同系物。
五、同分异构(1)同分异构现象:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象。
(2)同分异构体:概念1:分子式相同,结构式不同的化合物互称为同分异构体。
概念2:具有同分异构现象的化合物互称为同分异构体。
(3)同系物、同分异构体、同位素和同素异形体的比较(4)戊烷的同分异构体 ①C 5H 12有3种同分异构体:②3种同分异构体的沸点,按正、异、新戊烷顺序而递减。
因为同分异构体所带支链越多,分子结构越趋于球形,分子间接触面越小,分子间作用力就越小,故其沸点越低。
如图5-11,表示了3个戊烷同分异构体分子间的结合:图5-11键线式中,键的端点和拐点处有1个C 原子,C 原子的其他键用H 补足,从左向右显然是结合力越来越小,其沸点越来越低。
注意,新戊烷在常温下已是气体。
(5)己烷的同分异构体有5种六、烃基烃失去1个原子后所剩余的原子团叫做烃基。
(1)烃基通常用—R表示,其中短线表示1个电子。
(2)烃基是电中性的,因为烃失去的是H原子,即失去的这个H原子是单电子。
如甲基是甲烷分子失去1个氢原子的产物:—CH3粒子内所含电子数为:2+7=9。
(3)烷烃失去1个H原子后剩余的原子团叫做烷基。
(5)烃基不是单独存在的,而是存在于有机物分子之中,如:七、丙基、丁基和戊基(1)丙基有2种(丙烷只1种)(2)丁基有4种(丁烷只2种)先写出丁烷的同分异构体:正丁烷和异丁烷,然后用不同数字标注不等效H原子(也可同时用相同数字标注等效H原子)从①~④位上分别去掉1个H原子,可得4种不同的丁基:(3)戊基有8种(戊烷只3种)可依据写丁基的方法写出8种戊基来。
八、习惯命名法(1)根据分子里所含碳原子的数目来命名,碳原子数在十以下的,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸来表示;碳原子数在十以上的,就用数字来表示。
例如C5H12叫戊烷,C17H36叫十七烷。
(2)同分异构体,用“正”“异”“新”等来区别。
如戊烷的3种同分异构体,分别叫做正戊烷、异戊烷和新戊烷。
(3)习惯命名法有很大的局限性,同分异构体越多,命名越困难。
九、系统命名法(1)选主链,定某烷。
①主链应是最长的C链,即是含C原子数目最多的C链,不一定是“最直”的C链。
如下列有机物主链的两种选择,前者是错误的,后者是正确的。
②选择主链,要注意“支链”上C原子数目的隐蔽性。
如下列有机物主链的两种选择,前者是错误的,后者是正确的。
因为乙基上含有2个C原子,将—C2H5展开,其写法为—CH2—CH3。
③当主链上C原子数相同时,主链的选择,还要满足支链尽量多的原则。
如下列有机物主链的两种选择,前者是错误的,后者是正确的,尽管它们的主链上都是有8个C原子。
因为前一种选法,只有3个支链,而后一种选法,则有4个支链。
④选择了主链,就可根据主链上的C原子数目,称该烷烃为“某烷”。
(2)编号,确定支链位置①编号,是指给主链上的C原子编号,以确定支链的位置。
②离支链最近的一端为起点,依次向主链的另一端编号。
如下列两种编号,前者正确,后者错误。
③当距离主链两端等距离的C原子上具有不同的支链时,遵循简单在前,复杂在后的原则。
如下列两种编号,前者正确,后者错误。
因为甲基比乙基简单,编号时应优先考虑。
④当距离主链两端等距离的C原子上具有相同的支链,且C链上还有其他支链时,以离其他支链近的一端为编号起点,依此类推,此即最低系列原则。
如下列两种编号,前者正确,后者错误。
前者支链序号之和为:2+3+3+6+7+7+8+9=45,后者支链序号之和为:2+3+4+4+5+8+8+9=43,43<45,后者遵循了曾经应用的“序号之和最小原则”,现在“序号之和最小原则”已被摒弃,代之以最低系列原则;观察即可命名,省去了计算的繁琐。
(3)写名称①支链作为取代基,写在烷烃名称的前面。
②支链的位置用阿拉伯数字注明,阿拉伯数字写在取代基名称前面。
③合并相同的取代基,用汉数字(如二、三等)标注其个数,写在取代基名称前面,阿拉伯数字后面。
④阿拉伯数字间用“,”隔开,注意不要用“、”。
⑤汉字和阿拉伯数字间用短线隔开。
⑥不同的取代基,命名时遵循简单在前,复杂在后的原则,即先写甲基,后写乙基,依次类推。
如下列有机物的名称,前者正确,后者错误。
名称1:4,4—二甲基—3,3—二乙基庚烷(√)名称2:3—二乙基—4,4—二甲基庚烷(×)即将乙基写在甲基的前面是错误的。
⑦较复杂取代基的名称要写准确。
如下列有机物的命名,前两者正确,后者错误。
名称1:4—异丙基辛烷(√)名称2:4—2—丙基辛烷(√)名称3:4—丙基辛烷(×)有时,阿拉伯数字间也画短横线——当取代基的名称中有阿拉伯数字时。
【学习方法指导】[例1]下列有机物的命名正确的是()命名为:2,3—二甲基—4—异丙基—己烷A.①②B.③⑥C.④⑤D.全部解析:本题有以下两种解法:方法1(常规解法):逐项分析。
①错。
按系统命名法,应在阿拉伯数字和汉字之间加短横杠“—”。
②错。
编号和书写取代基都应遵循“简单在前,复杂在后”的原则。
正确命名为:3—甲基—3—乙基戊烷。
故③正确。
④错。
选主链应遵循支链尽量多的原则,且汉字之间不应加短横杠相隔;正确命名为:2,3,5—三甲基—4—乙基己烷。
由此可知⑥正确。
⑤错。
编号应遵循最低系列原则,摒弃序号之和最小原则。
正确命名为:2,3,6,6,8—五甲基壬烷。
方法2(排除法):①错则排除A、D选项。
B、C选项中皆不含②,故可不对②进行分析。
由③正确,可知答案。
答案:B[例2]下列有机物的一元取代物的同分异构体有三种的是()①CH3CH2CH2CH2CH3②(CH3)3CCH2CH3③CH(CH2CH3)3④(CH3)2C(CH2CH3)2⑤(CH3)2CH—C(CH3)3⑥(CH3)3C—C(CH3)3A.①②③④⑤B.②⑥C.①②⑥D.④⑤⑥解析:本题也有两种解法,位置判定法(由于同一C原子上的H原子是等效的,所以又叫等效氢判定法)和排除法。