细菌内毒素检查法
- 格式:doc
- 大小:33.00 KB
- 文档页数:8

细菌内毒素检查法细菌内毒素检查法(2005年一部)附录ⅩⅢD细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
内毒素的量用内毒素单位(EU)表示。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成。
用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于试验中鲎试剂灵敏度复核、干扰试验及各种阳性对照。
凝胶法细菌内毒素检查用水系指内毒素含量小于0.015EU/ml的灭菌注射用水。
光度测定法用的细菌内毒素检查用水,其内毒素的含量应小于0.005EU/ml。
试验所用器皿需经处理,以去除可能存在的外源性内毒素,常用的方法是250℃干烤至少60分钟,也可采用其他确证不干扰细菌内毒素的适宜方法。
若使用塑料器械,如微孔板和微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器械。
试验操作过程应防止微生物的污染。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
一般要求供试品溶液的PH值在6.0~8.0的范围内。
对于过酸、过碱或本身有缓冲能力的供试品,需调节被测溶液(或其稀释液)的PH值,可使用酸、碱溶液或鲎试剂生产厂家推荐的适宜的缓冲液调节PH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公式确定:L=K/M式中 L为供试品的细菌内毒素限值,以EU/ml、EU/mg 或EU/U(活性单位)表示;K为人每公斤体重每小时最大可接受的内毒素剂量,以EU/(kg.h)表示,注射剂K=5EU/(kg.h),放射性药品注射剂K=2.5EU/(kg.h),鞘内用注射剂K=0.2EU/(kg.h);M为人用每公斤体重每小时的最大供试品剂量,以ml/(kg.h)、mg/(kg.h)或U/(kg.h)表示,人均体重按60kg计算,注射时间若不足1小时,按1小时计算。

药典三部版通则细菌内毒素检查法标准化工作室编码[XX968T-XX89628-XJ668-XT689N]1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
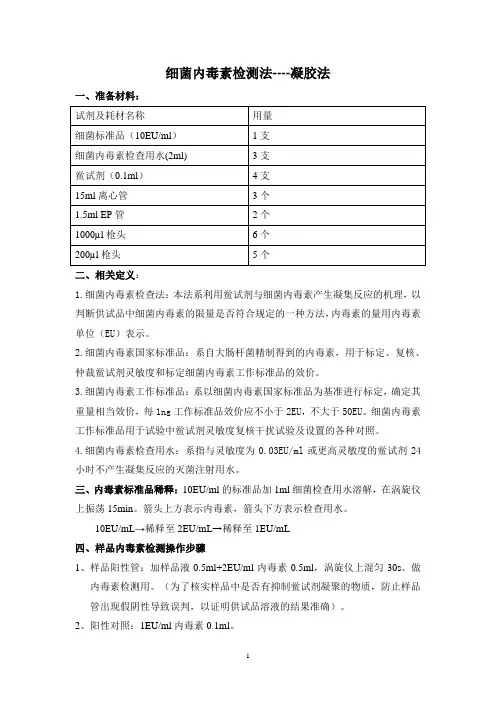
细菌内毒素检测法----凝胶法一、准备材料:试剂及耗材名称用量细菌标准品(10EU/ml)1支细菌内毒素检查用水(2ml) 3支鲎试剂(0.1ml)4支15ml离心管3个1.5ml EP管2个1000µl枪头6个200µl枪头5个二、相关定义:1.细菌内毒素检查法:本法系利用鲎试剂与细菌内毒素产生凝集反应的机理,以判断供试品中细菌内毒素的限量是否符合规定的一种方法,内毒素的量用内毒素单位(EU)表示。
2.细菌内毒素国家标准品:系自大肠杆菌精制得到的内毒素,用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。
3.细菌内毒素工作标准品:系以细菌内毒素国家标准品为基准进行标定,确定其重量相当效价,每1ng工作标准品效价应不小于2EU,不大于50EU。
细菌内毒素工作标准品用于试验中鲎试剂灵敏度复核干扰试验及设置的各种对照。
4.细菌内毒素检查用水:系指与灵敏度为0.03EU/ml或更高灵敏度的鲎试剂24小时不产生凝集反应的灭菌注射用水。
三、内毒素标准品稀释:10EU/ml的标准品加1ml细菌检查用水溶解,在涡旋仪上振荡15min。
箭头上方表示内毒素,箭头下方表示检查用水。
10EU/mL→稀释至2EU/mL→稀释至1EU/mL四、样品内毒素检测操作步骤1、样品阳性管:加样品液0.5ml+2EU/ml内毒素0.5ml,涡旋仪上混匀30s。
做内毒素检测用。
(为了核实样品中是否有抑制鲎试剂凝聚的物质,防止样品管出现假阴性导致误判,以证明供试品溶液的结果准确)。
2、阳性对照:1EU/ml内毒素0.1ml。
3、阴性对照:细菌内毒素检查用水0.1ml。
4、样品管:样品液0.5ml+细菌内毒素检查用水0.5ml,涡旋仪上混匀30s,做内毒素检测用。
5、鲎试剂的准备:每支鲎试剂用0.1ml检查用水溶解。
6、以上准备完成后,从1、2、3、4管中分别取0.1ml加到溶解好的鲎试剂中,封口膜封口,37度孵育1h。

细菌内毒素检查法1 简述1.1 本规范适用于细菌内毒素检查法——凝胶法和光度测定法。
后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行实验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
1.2 供试品细菌内毒素限值的确定1.2.1 药典中有规定的,按供试品各论中规定限值;1.2.2 尚无标准规定的,按以下公式确定供试品内毒素限值:L=K/M式中L为供试品的细菌内毒素限值,以EU/ml、EU/mg、EU/U表示。
K为按规定的给药途径,人用每公斤体重每小时最大可接受的内毒素剂量,以EU/(k g•h)表示。
其中注射剂,K=5EU/(k g•h);放射性药品注射剂,K=2.5EU /(k g•h);鞘内用注射剂,K=0.2EU/(k g•h)。
M为人用每公斤体重每小时的最大供试品剂量,以m1/(k g•h)、mg/(k g•h)、U/(k g•h)表示。
药品人用最大剂量可参阅国家批准的药品说明书和《临床用药须知》等权威著作,中国人均体重按60kg计算,注射时间小于l小时的按l小时计。
若供试品按体表面积给药,供试品每平方米体表面积计量乘以0.027即可转换为每千克体重计量[即M=(最大给药剂量/(m2·h)×1.62m2)/60kg]。
1.3 供试品最大有效稀释倍数的确定供试品的最大有效稀释倍数(MVD)按下式计算:MVD=CL/λL为供试品的细菌内毒素限值;C为供试品溶液的浓度。
当L以EU/ml表示时,C等于1.0ml/m1;当L的单位以EU/mg或EU/U表示时,C为供试品制备成溶液后的浓度,单位为mg/m1或U/m1。
作业指导书指导书编号TYFDC-SOP-FF-073细菌内毒素检查法第2页共18页第二版批准李忠华初审吴雅凝起草吴雅凝λ在凝胶法中为鲎试剂的标示灵敏度,在光度测定法中为所使用的标准曲线中的最低内毒素浓度。
如供试品为注射用无菌粉末或原料药,则MVD取1,可计算供试品的最小有效稀释浓度C:λ/L。

1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公式确定:L=K/M式中 L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U (活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h),放射性药品注射剂K=2.5 EU/(kg·h),鞘内用注射剂K=0.2 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(k g·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62㎡计算。

1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公L=K/M式中L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h),放射性药品注射剂K=2.5 EU/(kg·h),鞘内用注射剂K=0.2 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62㎡计算。

JP本法利用鲎试剂(从鲎——Limuluspolyhemus 或 Tachypleus tridentatus——血细胞提取物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量。
该检查包括两种方法:一为凝胶法,系利用鲎试剂与内毒素产生凝集反应的原理;另一种为光度测定法,该法利用鲎试剂与内毒素反应过程中的光学变化来实现内毒素的测定,这种方法又可分为浊度法(基于形成凝胶的过程中,溶菌液的浊度变化)和显色法(得到的肽-呈色基团复合物断裂后,检测反应混合物的色度)。
检测时,可用其中任一种方法进行试验。
当测定结果可疑或有争议时,除非另有规定,以凝胶法测定结果为准。
试验操作过程应防止内毒素的污染。
仪器所有的玻璃器皿及由其他耐热材料制成的器皿需用已验证的工艺在热烘箱内进行去热原处理。
去热原时,常用的最小时间和温度设置分别为30分钟和250℃。
若使用塑料器械,如微孔板和微量进样器配套的吸头等,它们必须标明无内毒素并确对试验无干扰。
内毒素储备标准溶液的制备以BET检查用水溶解内毒素10000对照标准品或内毒素100对照标准品,制取细菌内毒素试验(BET)的内毒素储备标准溶液。
内毒素的量用内毒素单位(EU)表示。
1EU相当于1个内毒素国际单位(1U)。
内毒素标准溶液的制备充分混合内毒素储备标准溶液后,用水稀释,即得BET检查用内毒素标准溶液。
得到的稀释液应尽快使用,以免因吸附而导致活性损失。
供试品溶液的制备除非另有说明,以BET检查用水溶解或稀释药品来制备供试品溶液。
药用容器内盛放的供试品溶液的制备方法见其他具体规程。
如有必要,调节待测溶液的pH值,使鲎试剂和供试品溶液的混合物的pH值在所选鲎试剂的使用pH范围内。
一般要求供试品溶液的pH值范围为6.0——8.0。
试液或调节pH值用溶液应用BET检查用水配制,在去除内毒素的容器中贮存。
确定最大有效稀释倍数最大有效稀释倍数(MVD)指可检测出内毒素限值的供试品溶液的最大稀释倍数。

内毒素检测标准及方法
内毒素检测的标准及方法主要包括以下几个方面:
检测标准:
1.细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显
色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
2.细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)
相当。
检测方法:
内毒素检测主要使用鲎试验法,这是国际上至今为止检测内毒素最好的方法,具有简单、快速、灵敏、准确的特点,被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采用。
鲎试剂按实验方法可分为凝胶法、动态浊度法、终点浊度法、动态显色法、终点显色法。
其中凝胶法操作简单、经济,不需要专用测定设备,可以进行定性或半定量测定。
请注意,进行内毒素检测时应严格遵守相关标准和操作规范,确保结果的准确性和可靠性。

1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公L=K/M式中L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h),放射性药品注射剂K=2.5 EU/(kg·h),鞘内用注射剂K=0.2 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62㎡计算。

光度法细菌内毒素检查实验方法
光度法细菌内毒素检查实验方法主要包括以下步骤:
1.准备试剂和样品:准备所需的宣试剂、内毒素标准品、样品等。
2.加样:按照实验要求,将室试剂、内毒索标准品和样品加入反应管中。
3.孵育:将反应管放入恒温箱中,在适宜的温度下进行孵育。
4.检测:在孵育结束后,使用光度计检测反应管中的吸光度或透光率。
5.结果分析:根据检测结果,计算样品中的内毒素含量,并与标准品进行比较,判断样品是否合格。
需要注意的是。
光度法细菌内毒索检查实验方法的具体操作步骤可能因不同的实验条件和仪器而有所差异。
因此,在进行实验前,应仔细阅读实验说明书,了解实验原理和操作步骤,并严格按照实验要求进行操作。
同时,为了保证实验结果的准确性和可靠性,还应进行必要的实验质星控制和验证。
细菌内毒素检查法应用指导原则细菌内毒素检查法是一种常用的检测细菌内毒素含量的方法,以下是其应用指导原则:1. 临床应用:细菌内毒素检查法主要用于临床诊断中,可以辅助判断细菌感染的程度和危险程度,对临床治疗方案的选择和预后评估具有重要意义。
2. 检测细菌内毒素:细菌内毒素检查法可以检测细菌体内产生的内毒素,包括脂多糖、肽、毒菌素等,可以提供关于感染病原体的重要信息。
3. 适用菌种:该检查法主要适用于产生内毒素的细菌,如大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌等。
不同菌种产生的内毒素种类和水平可能有所不同,需要根据具体情况选择合适的检测方法。
4. 适用样本:内毒素检查法适用于各种临床样本,如血液、尿液、体液等。
不同样本中的内毒素含量可能有差异,需要根据具体情况选择合适的样本。
5. 检测方法选择:目前常用的细菌内毒素检测方法包括酶联免疫吸附试验(ELISA)、质谱法(Mass Spectrometry)和生物活性检测法等,选择合适的检测方法需要考虑其敏感性、特异性、操作简便性和成本等方面的因素。
6. 结果解读:细菌内毒素检查结果应综合临床表现和其他检查结果进行解读,单一的内毒素检测结果并不能确定感染的严重程度和预后情况。
在临床应用中,需要综合患者的临床症状、实验室检查和影像学等多方面信息进行综合评估。
7. 质量控制:在使用细菌内毒素检查法时,需要进行质量控制,确保检测结果的准确性和可靠性。
这包括实验室操作规范、标准品的选择和存储、仪器的检验和维护等方面。
总之,细菌内毒素检查法在临床应用中有着重要的意义,可以提供有关感染病原体的重要信息,但需要根据临床情况综合判断和解读结果。
质量控制也是使用该检查法时需要注意的重要方面。
2020年的药典中有多种方法可用于检测细菌内毒素,以下是其中一些常见的方法:
杂交酶联免疫吸附试验(ELISA):ELISA是一种常用的定性和定量检测方法,可以用于测定细菌内毒素的存在和浓度。
该方法利用特异性抗体与目标内毒素结合,并通过酶标记来检测反应的产物。
液相色谱-质谱联用(LC-MS):LC-MS是一种高灵敏度和高选择性的分析技术,可用于细菌内毒素的检测和鉴定。
该方法将样品通过液相色谱分离,然后与质谱仪相连,通过质谱仪的检测来确定内毒素的存在和浓度。
生物学方法:一些生物学方法也可用于检测细菌内毒素,如小鼠致死试验和细胞毒性试验。
小鼠致死试验通过注射待测样品到小鼠体内,观察小鼠的生存情况来判断内毒素的存在。
细胞毒性试验则使用细胞培养体外模型,通过观察细胞的存活情况来评估内毒素的毒性。
凝胶凝集试验:凝胶凝集试验是一种常用的定性检测方法,通过将内毒素与抗体反应,在凝胶中观察反应的凝胶凝集情况来判断内毒素的存在与否。
细菌内毒素检查法1 简述1.1 本规范适用于细菌内毒素检查法——凝胶法和光度测定法。
后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行实验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
1.2 供试品细菌内毒素限值的确定1.2.1 药典中有规定的,按供试品各论中规定限值;1.2.2 尚无标准规定的,按以下公式确定供试品内毒素限值:L=K/M式中L为供试品的细菌内毒素限值,以EU/ml、EU/mg、EU/U表示。
K为按规定的给药途径,人用每公斤体重每小时最大可接受的内毒素剂量,以EU/(kg?h)表示。
其中注射剂,K=5EU/(kg?h);放射性药品注射剂,K=2.5EU /(kg?h);鞘内用注射剂,K=0.2EU/(kg?h)。
M为人用每公斤体重每小时的最大供试品剂量,以m1/(kg?h)、mg/(kg?h)、U/(kg?h)表示。
药品人用最大剂量可参阅国家批准的药品说明书和《临床用药须知》等权威著作,中国人均体重按60kg计算,注射时间小于l小时的按l小时计。
若供试品按体表面积给药,供试品每平方米体表面积计量乘以0.027即可转换为每千克体重计量[即M=(最大给药剂量/(m2·h)×1.62m2)/60kg]。
1.3 供试品最大有效稀释倍数的确定供试品的最大有效稀释倍数(MVD)按下式计算:MVD=CL/λL为供试品的细菌内毒素限值;C为供试品溶液的浓度。
当L以EU/ml表示时,C等于1.0ml/m1;当L的单位以EU/mg或EU/U表示时,C为供试品制备成溶液后的浓度,单位为mg/m1或U/m1。
λ在凝胶法中为鲎试剂的标示灵敏度,在光度测定法中为所使用的标准曲线中的最低内毒素浓度。
如供试品为注射用无菌粉末或原料药,则MVD取1,可计算供试品的最小有效稀释浓度C:λ/L。
1.4 在使用新一批号的鲎试剂前,必须进行鲎试剂灵敏度复核实验。
1.5 药典中已有规定的品种或有其他内毒素检验标准的品种,可直接进行内毒素检查,如在检验中出现干扰的情况需再进行干扰实验的验证;其他未建立内毒素检查的品种需先进行干扰实验,确定不干扰浓度后再进行内毒素检查。
1.6 细菌内毒素检查过程中的阴性对照、阳性对照和供试品阳性对照必须同时进行,否则实验结果无效。
2 实验材料及用具2.1 天平供试品称量用,精度为0.1mg以下。
2.2 电热干燥箱除外源性内毒素用,温度应能达到250℃。
2.3 恒温水浴箱或适宜的恒温器(37℃±1℃)。
2.4 水银温度计或酒精温度计,精度在l℃以下。
2.5 旋涡混合器。
2.6 鲎试剂,应具有国家主管部门的批准文号。
2.7 细菌内毒素国家标准品或细菌内毒素工作标准品,除另有规定外,应使用由中国药品生物制品检定所统一发放的标准品。
2.8 凝胶法细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)0.005EU/ml(用于光度测定法)且对内毒素试验无干扰作用。
2.9 实验用具移液管(或刻度吸管、微量加样器及无热原吸头)、凝集管(10mm×75mm)、三角瓶、试管、试管架、洗耳球、时钟、75%酒精棉、剪刀、砂轮。
所用玻璃器皿须经250℃干烤至少30min。
若使用塑料器械,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对实验无干扰的器械。
2.10 细菌内毒素光度测定仪器。
3 实验准备3.1 玻璃器皿的洗涤将玻璃器皿放入铬酸洗液或其他热原灭活剂或清洗液中充分浸泡,然后取出将洗液空干,用自来水将残留洗液彻底洗净,再用蒸馏水反复冲洗三遍以上,空干后放入适宜的密闭金属容器中或用锡箔纸包好后再放入金属容器内,放置入电热干燥箱。
3.2 除去玻璃器皿表面可能存在的外源性内毒素玻璃器皿置烤箱后,将烤箱调至250℃,待烤箱温度升至设定的温度后开始计时,干烤至少30min。
达到规定时间后,关断电源,待烤箱温度自然降至室温。
在不打开金属容器的情况下,可在两天内使用;如果玻璃器皿用锡箔纸包装,在不打开包装的情况下可在两周内使用,否则须再次干烤除去可能存在的外源性内毒素。
3.3 供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在己去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
4 凝胶法操作方法4.1 鲎试剂灵敏度复核鲎试剂灵敏度复核的目的不仅是考察鲎试剂的灵敏度是否准确,也是考察检验人员操作方法是否正确及实验条件是否符合规定。
因此要求每个实验室在使用一批新的鲎试剂或试验条件发生了任何可能影响检验结果的改变时,应进行鲎试剂灵敏度复核实验。
4.1.1 实验操作4.1.1.1 细菌内毒素标准溶液的制备取细菌内毒素国家标准品或工作标准品一支,轻弹瓶壁,使粉末落入瓶底,然后用砂轮在瓶颈上部轻轻划痕,75%酒精棉球擦拭后启开,启开过程中应防止玻璃屑落入瓶内。
按照标准品说明书,加入规定量的细菌内毒素检查用水溶解其内容物,用封口膜将瓶口封严,置旋涡混合器上混合15min。
然后进行稀释,制备成4个浓度的细菌内毒素标准溶液,即2λ、λ、0.5λ、0.25λ(λ为所复核的鲎试剂的标示灵敏度),每稀释一步均应在旋涡混合器上混合30s(详细过程参见标准品使用说明书)。
若使用的为细菌内毒素国家标准品,可按其使用说明书中的方法将其稀释至规定浓度后分装、保存。
若为细菌内毒素工作品,为一次性使用。
4.1.1.2 待复核鲎试剂的准备取规格为0.1ml/支的鲎试剂18支,轻弹瓶壁,使粉末落入瓶底,用砂轮在瓶颈轻轻划痕,75%酒精棉球擦拭后启开备用,防止玻璃屑落入瓶内。
每支加入0.1ml检查用水溶解,轻轻转动瓶壁,使内容物充分溶解,避免产生气泡。
若待复核鲎试剂的规格不是0.1ml/支时,取若干支按其标示量加入检查用水复溶,充分溶解后将鲎试剂溶液混和在一起,然后每o.1m1分装到10mm×75mm凝集管中,要求至少分装18管备用。
4.1.1.3 加样将已充分溶解的待复核鲎试剂18支(管)放在试管架上,排成5列,其中4列4支(管),1列2支(管)。
4支(管)4列每列每支分别加入0.1ml的2λ、λ、0.5λ和0.25λ的内毒素标准溶液;另2支(管)加入0.1ml检查用水。
4.1.1.4 加样结束后,将鲎试剂用封口膜封口,轻轻振动混匀,避免产生气泡,连同试管架放人37℃±1℃水浴或适宜恒温器中,试管架保持水平状态,保温60±2min。
4.1.1.5 观察并记录结果。
将试管架从水浴中轻轻取出,避免振动,将每管拿出缓缓倒转180°观察,管内形成凝胶,并且凝胶不变形,不从管壁滑脱者为阳性,记录为(+);未形成凝胶或凝胶不能保持完整并从管壁滑脱者为阴性,记录为(-)。
4.1.2 实验结果计算如最大浓度2λ 4管均为阳性,最低浓度0.25λ 4管均为阴性,阴性对照为阴性时实验为有效,按下式计算反应终点浓度的几何平均值即为鲎试剂灵敏度的复核结果(λc)。
λc=lg-1(∑X/n)式中X为反应终点浓度的对数值(lg)。
反应终点浓度是系列递减的内毒素标准溶液中最后一个呈阳性结果的浓度。
n为每个浓度的平行管数。
4.1.3 结果判断当λc在0.5λ~2λ(包括0.5λ和2λ)时判定该批鲎试剂灵敏度复核合格,可用于干扰实验和供试品细菌内毒素检查,并以λ(标示灵敏度)为该批鲎试剂的灵敏度。
4.1.4 举例设待复核鲎试剂的灵敏度为0.125EU/m1。
实验结果如下:λc= lg-1(∑X/4)= lg-1[(lg0.125+lg0.25+lg0.0625+lg0.0625)/4]= 0.105(EU/m1)λc在0.5λ~2λ范围内,符合规定。
并且使用该批鲎试剂时,其灵敏度为标示灵敏度0.125EU/ml。
4.2 干扰实验4.2.1 操作方法干扰实验的目的是确定供试品在多大的稀释倍数或浓度下对内毒素和鲎试剂的反应不存在干扰作用,为能否使用细菌内毒素检查法提供依据。
并且验证当供试品的配方和工艺有变化,鲎试剂来源改变或供试品阳性对照结果呈阴性时供试品是否存在干扰作用。
由于干扰实验检验的是在供试品存在的情况下内毒素与鲎试剂的反应是否正常,与所使用鲎试剂的灵敏度无关,因此在干扰实验预实验中原则上可使用任一灵敏度的鲎试剂。
但建议使用较低灵敏度(如0.5或0.25EU/m1)的鲎试剂,可尽量避免供试品所含的内毒素对干扰实验造成的阳性影响。
4.2.1.1 干扰实验预实验预实验的目的是初步确定供试品的最大不干扰浓度(当限值以EU/mg或EU/U活性单位表示)或最小不干扰稀释倍数(当限值以EU/m1表示),为正式干扰实验提供依据。
4.2.1.1.1 将无可检测到内毒素的供试品进行一系列倍数的稀释,但最大的稀释倍数不得超过MVD=CL/λ0.03(0.03EU/ml为现今我国市售鲎试剂的最高灵敏度)。
4.2.1.1.2 使用鲎试剂对每一稀释倍数进行检验。
每一稀释倍数下做2支供试品管和2支供试品阳性对照(即用该浓度的供试品稀释液将内毒素标准品制成2λ浓度)。
另取2支加入细菌内毒素检查用水作为阴性对照,2支加入2λ浓度的内毒素标准溶液作为阳性对照。