化学原理[4]化学键与分子结构4
- 格式:ppt
- 大小:3.01 MB
- 文档页数:70

作业:P71:2,3,4,5,6;P83:2;3;P81:9; 更正:P71: 3. 给出电子在l = 4的5g 轨道的所有可能的量子数。
说明为什么不存在3f 轨道或4g 轨道。
为什么说只有原子序数从122 (121)开始的元素,5g 轨道才被电子所占有。
五、 多电子原子的核外电子排布i) 处理多电子原子的结构,必须采用近似方法 中心场近似只考察其中一个电子的运动,而把原子核对它的库仑吸引以及其他N -1个电子对它的库仑排斥笼统地看成是一个处在原子中心的正电荷Z* 对它的库仑吸引:V = -*2Z e 4r πε通过这个势函数,多电子原子就可以简单地当作单电子原子来处理。
这样,上一节处理单电子原子的全部结果,只要略作修正,都适用于多电子原子。
在多电子原子中,电子的运动状态也是由n , l , m l 和m s 四个量子数决定的,电子在由这四个量子数所决定的各运动状态上的空间分布特征完全和在单电子原子中一样。
在电荷为Z*的中心场作用下运动的电子的能量为:E = -Z m e h e *2422028n ε=-Z Eh *222nZ*称为作用在电子上的有效核电荷:Z* = Z -σσ称为屏蔽常数,其意义是:一个核电荷为Z (>1) 的多电子原子,作用在电子上的电荷不再是核电荷Z,而是扣除了其它电子的屏蔽作用以后的有效核电荷Z*。
要了解多电子原子的电子结构,关键在于确定其它电子对被考察的电子的屏蔽常数。
电子的“屏蔽作用”是广义的,它包括了内层电子的真实的屏蔽作用,也包括了同层电子及外层电子的排斥作用。
这是氢原子的1s, 2s, 3s轨道的边界图,每个球包含约90%的电子密度。
简单地讲,轨道尺寸正比于n2。
内层电子对外层电子的屏蔽效应大,外层电子对内层电子的屏蔽效应小。
ii) 斯莱特规则在量子力学中,这个屏蔽作用是通过光谱实验数据得到的。
1930年,美国的斯莱特(J. C. Slater) 提出了一套估算屏蔽常数的半经验规则,按量子数n和l的递增,把多电子原子的原子轨道按如下的顺序分组:(1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (4f) (5s, 5p)……可以按下面的简单规则估算一个电子对另一个电子的屏蔽系数:1. 处在右面的各轨道组内的电子对左面轨道组内的电子没有屏蔽作用,屏蔽系数为0;2. 在同一轨道组内的电子,除(1s)组的二个电子间的屏蔽系数为0.30外,其它各轨道组内电子间的屏蔽系数都是0.35;3. 主量子数为n-1的各轨道组内的电子对(ns, np)组各电子的屏蔽系数为0.85;4. 主量子数等于和小于n-2的各轨道组内的电子对(ns, np)组各电子的屏蔽系数均为1.00;5. 处在(nd)或(nf)组左面的各轨道组内的电子对(nd)或(nf)组内电子的屏蔽系数均为1.00。

![化学原理[4]化学键与分子结构-2](https://uimg.taocdn.com/2b692b22c77da26924c5b049.webp)


第四章化学键与分子结构补充习题【选择题】1.下列卤化物中,离子键成分大小顺序正确的是()。
A.CsF>RbCl>KBr>NaI B.CsF>RbBr>KCl>NaFC.RbBr>CsI>NaF>KCl D.KCl>NaF>CsI>RbBr2.下列物质中沸点高低顺序正确的是()。
A.H2Te>H2Se>H2S>H2O B.H2Se>H2S>H2O>H2Te;C.H2O>H2S>H2Se>H2Te D.H2O>H2Te>H2Se>H2S3.既能衡量元素金属性强弱,又能衡量其非金属性强弱的物理量是()。
A.电负性B.电离能C.电子亲和能D.偶极矩4.Pb2+、Bi3+离子均属何种电子构型()。
A.18 B.18 + 2 C.8 D.9~175.下列离子型化合物熔点最低的是()。
A.NaF B.BaO C.SrO D.MgO6.下列各化学键中极性最大的是()。
A.B-Cl B.Ba-Cl C.Be-Cl D.Br-Cl7.下列分子中属于非极性分子的是()。
A.CHCl 3B.PCI 3C.CO2D.HCl8.下列分子中,空间构型不是直线的是()。
A.CO B.H 2O C.CO2D.HgCI 29.下列说法中错误的是()。
A.杂化轨道有利于形成σ键B.杂化轨道均参加成键C.采取杂化轨道成键,更能满足轨道最大重迭原理D.采取杂化轨道成键,能提高原子成键能力10.BF4-离子中,B原子采用的杂化轨道是()。
A.sp B.sp2C.sp 3D.不等性sp3 11.下列分子中,构型是平面三角形的分子是()。
A.CO2B.PCl3C.BCl3D.NH312.下列分子中键角最大的是()。
A.PCl3B.NH3C.SiCl4D.CO213.下列关于杂化轨道理论的说法中正确的是()。
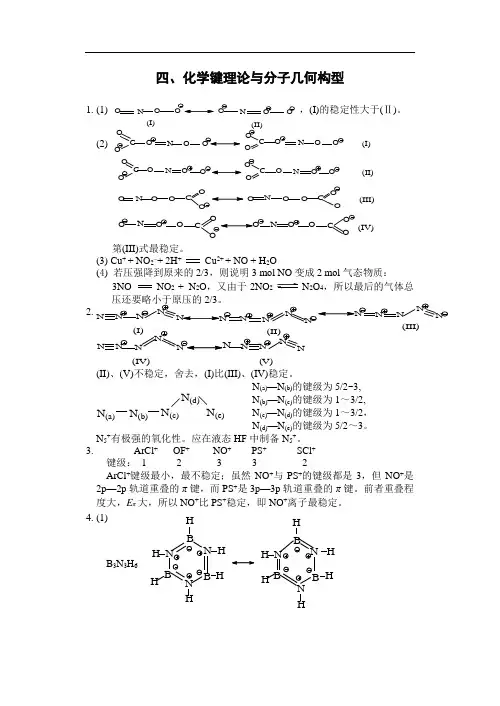
四、化学键理论与分子几何构型1. (1),(I)的稳定性大于(Ⅱ)。
(2)C OOO N O C OO O N O O (I)O C OO N OOCOO ONOO(II)O N O O CO OO NOOC O O (III)ONOOC ON OOCO O(IV)第(III)式最稳定。
(3) Cu + + NO 2–+ 2H + Cu 2+ + NO + H 2O(4) 若压强降到原来的2/3,则说明3 mol NO 变成2 mol 气态物质:3NO NO 2 + N 2O ,又由于2NO 2N 2O 4,所以最后的气体总压还要略小于原压的2/3。
2. N NN N NNNN N(IV)(V)(II)、(V)不稳定,舍去,(I)比(III)、(IV)稳定。
N (a)N (b)N (c)N (d)N (e) N (a)—N (b)的键级为5/2~3,N (b)—N (c)的键级为1~3/2,N (c)—N (d)的键级为1~3/2,N (d)—N (e)的键级为5/2~3。
N 5+有极强的氧化性。
应在液态HF 中制备N 5+。
3. ArCl + OF + NO + PS + SCl + 键级: 1 2 3 3 2ArCl +键级最小,最不稳定;虽然NO +与PS +的键级都是3,但NO +是2p —2p 轨道重叠的π键,而PS +是3p —3p 轨道重叠的π键。
前者重叠程度大,E π大,所以NO +比PS +稳定,即NO +离子最稳定。
4. (1)B 3N 3H 6N H H H H H N B N B B H H H H H H NB B H N BNO N O O O N O O (I)(II)N N N N N N N N N N (I)(II)N N N N N(III)(2) HH HH H H Cl HH H ClClB 3N 3H 6 3HCl N N N B BB(3) 无机苯的三甲基取代物有:B N B N B N HHHCH 3H 3CCH 3B NB N B N CH 3CH 3H 3CH HHB B N B N CH 3HHHCH 3CH 3(I)(Ⅱ)(III)B N B N B N CH 3HCH 3HCH 3H B N B N B N CH 3H H CH 3HH 3CB NB N B N CH 3H 3CH 3HH(IV) (V) (Ⅵ)实际上只有四种类型,因为II 、IV ;IV 、VI 属于同类型中的几何异构体。





第六章化学键和分子结构第一节离子键一、什么是化学键人们已经发现和合成了上千万种物质。
为什么仅仅一百零几种元素的原子能够形成这么多种形形色色的物质呢?原子是怎样互相结合的?为什么两个氢原子能自动结合成氢分子,而两个氦原子不能结合在一起?为什么原子间按一定数目比互相结合?原子结合成分子后,性质为什么与原来的差别很大?为了弄清以上的许多问题,首先,就要在原子结构知识基础上,进一步研究原子在形成分子时的相互作用。
原子既然可以结合成分子,原子之间必然存在着相互作用,这种相互作用不仅存在于直接相邻的原子之间,而且也存在于分子内的非直接相邻的原子之间。
前一种相互作用比较强烈,是使原子相互作用而联结成分子的主要因素,破坏它要消耗比较大的能量。
这种相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
化学键的主要类型有离子键、共价键、金属键等,在这一章里,我们先学习离子键和共价键。
二、离子键我们已经知道,金属钠跟氯气能发生反应,生成氯化钠:2Na+Cl2=2NaCl因为钠原子的电离能很小,容易失去电子,而氯原子很容易结合电子。
当钠跟氯气起反应时,钠原子的3s电子转移到氯原子的3p轨道上:钠原子失去1个3s电子,形成类似氖原子的稳定电子层结构,带上一个单位正电荷,成为钠离子(Na+);氯原子得到1个电子,形成类似氩原子的稳定电子层结构,带上一个单位负由荷,成为氯离子(Cl-)。
钠离子和氯离子之间除了有静电相互吸引作用外,还有电子与电子、原子核与原子核之间的相互排斥作用。
当两种离子接近到某一定距离时,吸引和排斥作用达到了平衡,于是阴、阳离子之间就形成了稳定的化学键。
在化学反应中,一般是原子的最外层电子发生变化,为了简便起见,我们可以在元素符号周围用小黑点(或×)来表示原子的最外层电子。
这种式子叫做电子式。
例如·也可以用电子式来表示分子(或离子)的生成。
例如,氯化钠的生成可以用电子式表示如下:象氯化钠那样,阴、阳离子间通过静电作用所形成的化学键叫做离子键。