
第1课时物质的量摩尔质量
[学习目标定位] 1.知道物质的量、摩尔质量的单位及含义。2.理解物质的量的基准——阿伏加德罗常数的含义。3.能进行物质的质量、微粒数目与物质的量之间的换算。
一物质的量及其单位——摩尔
1.国际单位制(SI)中的七个基本单位
物理量长度质量时间电流热力学温度物质的量发光强度
单位名称
米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩(mol) 坎(cd)
及符号
物质的量是表示含有一定数目粒子集合体的物理量,用符号
一个整体概念,为专用名词,不可任意加减字,既不是物质的质量,也不是物质的数量。
3.物质的量的单位——摩尔
1.下列说法不正确的是()
A.物质的量可以理解为物质的数量
B.物质的量是国际单位制中七个基本物理量之一
C.摩尔是物质的量的单位
D.物质的量描述对象是分子、原子等微观粒子
答案 A
二阿伏加德罗常数、摩尔质量
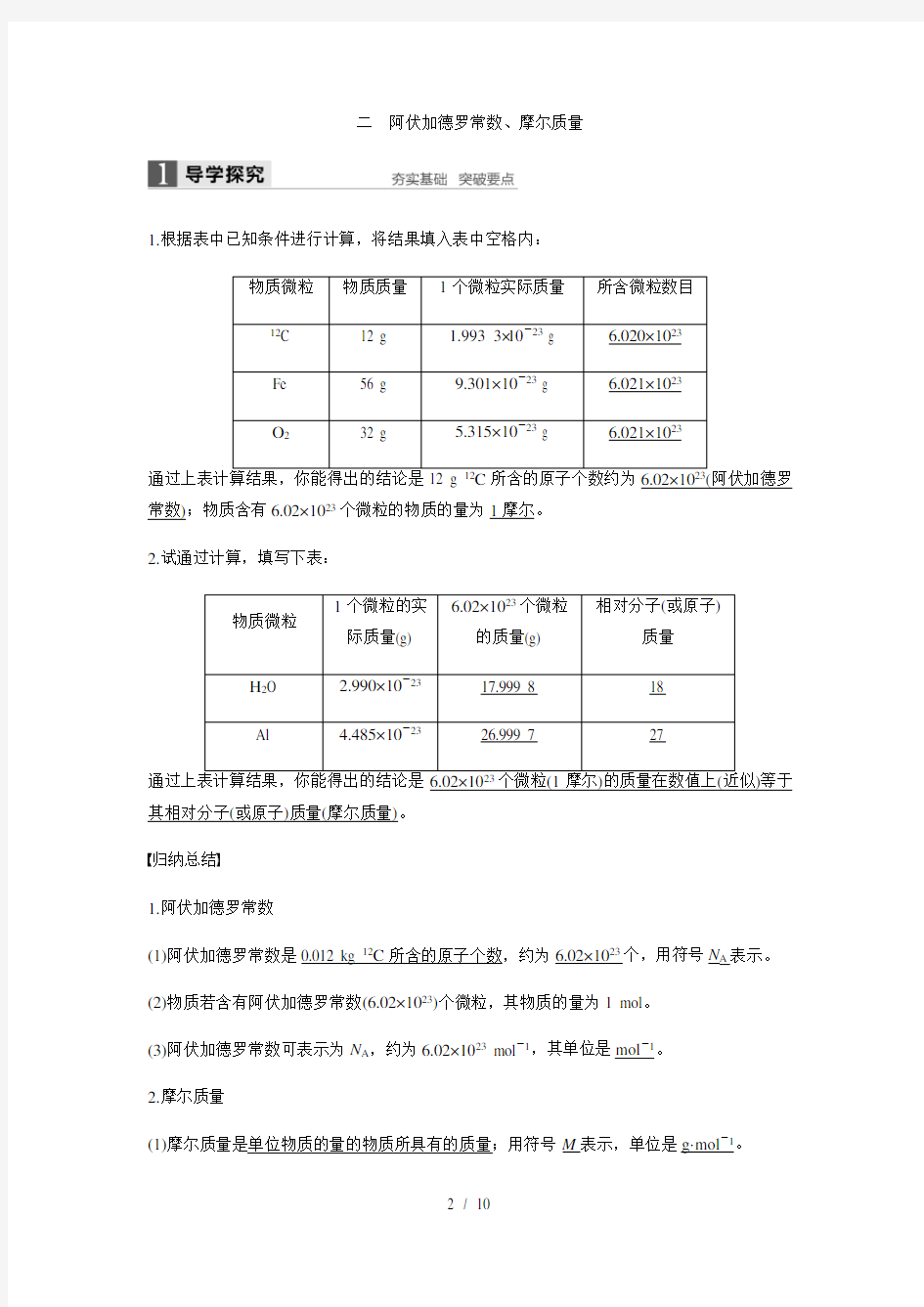
1.根据表中已知条件进行计算,将结果填入表中空格内:
物质微粒物质质量1个微粒实际质量所含微粒数目
12C 12 g 1.993 3×10-23 g 6.020×1023
Fe 56 g 9.301×10-23 g 6.021×1023
O232 g 5.315×10-23 g 6.021×1023
所含的原子个数约为6.02×10(阿伏加德罗常数);物质含有6.02×1023个微粒的物质的量为1摩尔。
2.试通过计算,填写下表:
物质微粒1个微粒的实
际质量(g)
6.02×1023个微粒
的质量(g)
相对分子(或原子)
质量
H2O 2.990×10-2317.999 8 18
Al 4.485×10-2326.999 7 27
通过上表计算结果,你能得出的结论是6.02×10个微粒(1摩尔)的质量在数值上(近似)等于其相对分子(或原子)质量(摩尔质量)。
归纳总结
1.阿伏加德罗常数
(1)阿伏加德罗常数是0.012 kg 12C所含的原子个数,约为6.02×1023个,用符号N A表示。
(2)物质若含有阿伏加德罗常数(6.02×1023)个微粒,其物质的量为1 mol。
(3)阿伏加德罗常数可表示为N A,约为6.02×1023 mol-1,其单位是mol-1。
2.摩尔质量
(1)摩尔质量是单位物质的量的物质所具有的质量;用符号M表示,单位是g·mol-1。
(2)上表中1 mol各物质的质量各不相同,但在数值上分别(近似)等于该物质的相对原子质量或相对分子质量。
2.下列有关物质的量和摩尔质量的叙述,正确的是()
A.水的摩尔质量是18 g
B.0.012 kg 12C中约含有6.02×1023个碳原子
C.1 mol水中约含有6.02×1023个氢原子
D.1 mol任何物质都含有6.02×1023个分子
答案 B
解析摩尔质量的单位是g·mol-1,A错误;碳是由原子构成的,根据规定,0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,近似为6.02×1023 mol-1,B正确;在1 mol水中约含有2×6.02×1023个氢原子,错误;构成物质的基本粒子有分子、原子和离子等,并非任何物质都是由分子构成的,D错误。
易错警示在运用物理量的过程中,务必要正确注明单位。看清粒子的种类是解题的关键。
3.下列说法正确的是()
A.1 mol H+的质量是1 g
B.H2的摩尔质量是2 g
C.1 mol O2的质量是32 g·mol-1
D.1 mol Na+的质量是11 g
答案 A
解析 1 mol H+的质量是1 mol×1 g·mol-1=1 g,A正确;H2的摩尔质量是2 g·mol-1,B不正确;1 mol O2的质量是1 mol×32 g·mol-1=32 g,C不正确;1 mol Na+的质量是1 mol×23 g·mol-1=23 g,D不正确。
理解感悟(1)质量的单位是g,摩尔质量的单位是g·mol-1,相对分子质量的单位是1,进
行概念辨析时要注意这点。摩尔质量在数值上等于它们的相对分子质量或相对原子质量。(2)对具体的物质,其摩尔质量是确定的,不随物质的量的多少而变化,也不随物质的聚集状态的变化而变化。
三 关于物质的量的简单计算
1.3.01×1022个O 2的物质的量是0.05 mol ;2 mol H 2O 所含的分子个数是1.204×1024个,所含氢原子的物质的量是4 mol 。
2.硫酸的摩尔质量是98 g·mol -
1,24.5 g 硫酸的物质的量是0.25 mol ,氧原子的物质的量是1 mol 。
3.氢氧化钠的摩尔质量是40 g·mol
-1,1.5 mol 氢氧化钠的质量是60 g 。
4.已知26.5 g 某化合物的物质的量为0.25 mol ,则该化合物的摩尔质量是106 g·mol -
1,相对分子质量是106。 归纳总结 1.基本关系式
(1)n =N
N A (n 表示物质的量,N 表示粒子数)。
关系式中N A 的单位是mol -
1。
(2)M =m
n
(M 为摩尔质量,m 为物质的质量)。
在M 、n 和m 中,已知任意两项求第三项;若M 的单位是g·mol -1
时,则m 的单位是g 。
2.恒等关系式
由基本关系式n =N N A 和n =m M 可得恒等关系式:N N A =m
M 。在 N 、N A 、m 、M 中,已知任意三
项可求第四项。一般情况下,N A 、M 是已知的,则N 与m 可互求。
4.N A 代表阿伏加德罗常数,下列说法中正确的是( )
A.2.3 g钠由原子变成离子时,失去的电子数为0.2N A
B.0.2N A个硫酸分子与19.6 g磷酸含有相同的氧原子数
C.28 g氮气所含的原子数为N A
D.N A个氧分子与N A个氢分子的质量比为8∶1
答案 B
解析A中Na+为+1价,2.3 g钠为0.1 mol钠原子,失去的电子数为0.1N A,故A错误;B 中19.6 g磷酸即为0.2N A个磷酸分子(19.6 g÷98 g·mol-1=0.2 mol),等物质的量的硫酸(H2SO4)与磷酸(H3PO4)含有相同的氧原子数,故B正确;C中28 g氮气(N2)即为1 mol氮分子(28 g÷28 g·mol-1=1 mol),所以应含2N A个氮原子,故C错误;D中N A个氧分子质量为32 g,N A 个氢分子质量为2 g,则其质量比为16∶1,故D错误。
理解感悟本题体现的是以物质的量为中心的计算、N A与物质的量的关系并由此延伸到微粒个数、物质的质量,应熟练掌握它们的换算关系。在分析判断时还要注意弄清用N A所表示的粒子的种类和所给物质的关系。
5.在14.2 g Na2SO4中:
(1)含有的Na+的数目是;
(2)含有的SO2-4的质量是;
(3)含氧原子的物质的量是。
答案(1)1.204×1023(2)9.6 g(3)0.4 mol
解析由化学式Na2SO4可得如下关系式:
Na2SO4~2Na+~SO2-4~4O
方法一n(Na2SO4)=
14.2 g
142 g·mol-1
=0.1 mol
所以有:
(1)n(Na+)=2n(Na2SO4)=0.2 mol,
N(Na+)=0.2 mol×6.02×1023 mol-1=1.204×1023;
(2)n(SO2-4)=n(Na2SO4)=0.1 mol,
m(SO2-4)=0.1 mol×96 g·mol-1=9.6 g;
(3)n(O)=4n(Na2SO4)=0.4 mol。
方法二在关系式中,系数比等于粒子个数比,若都扩大6.02×1023倍,则化学计量数比就等于物质的量比:
Na2SO4~2Na+~SO2-4~4O
1 mol
2 mol 1 mol 4 mol
而在一个关系式中,等量的某一物质,可用不同的单位来表示。如2 mol Na+,可用质量2×23 g来表示,也可用离子个数2×6.02×1023来表示。在计算时,为方便计算,通常是化学计量数反映的量与该物质(已知量或待求量)的题给单位相同。如:本题中已知量Na2SO4是14.2 g,那么化学计量数反映的1 mol的Na2SO4就用“142 g”来计算;(1)中求Na+的个数,化学计量数反映的2 mol Na+就用“2×6.02×1023”来计算;以此类推,有如下计算式:
Na2SO4~2Na+~SO2-4~4O
14.2 g 142 g=
N Na+
2×6.02×1023=
m SO2-4
96 g=
n O
4 mol
解得:N(Na+)=1.204×1023
m(SO2-4)=9.6 g
n(O)=0.4 mol。
理解感悟针对不同粒子之间的量(如质量、物质的量、粒子个数)的换算,先用常规方法,再用关系式法计算,通过比较找出较好的方法。一题多解,不仅可熟练知识,掌握解题技巧,还可提高思维能力和解决问题的能力。
通过摩尔质量、阿伏加德罗常数就可以顺利知道一定质量的物质中含有的微粒个数,物质的量起着桥梁的作用。
质量m÷摩尔质量
摩尔质量×n×阿伏加德罗常数
阿伏加德罗常数÷
微粒数目N
1.下列说法中正确的是()
A.摩尔是用来描述微观粒子的物理量
B.0.5 mol H2O中含有的原子数目为1.5N A
C.64 g氧相当于2 mol氧
D.1 mol任何物质都含有6.02×1023个原子
答案 B
解析摩尔是物质的量的单位,而不是物理量,A不正确;0.5 mol H2O中含有1 mol H原子和0.5 mol O原子共1.5 mol原子,即1.5N A,B正确;2 mol氧未指明微粒种类,C不正确;1 mol任何物质不一定含有6.02×1023个原子,如1 mol O2,D不正确。
2.下列说法正确的是()
A.1 mol氯含有6.02×1023个微粒
B.阿伏加德罗常数的数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量
D.H2O的摩尔质量是18 g
答案 B
解析使用摩尔时没有指明微粒的名称,或为1 mol Cl2约含6.02×1023个Cl2分子,或为1 mol Cl约含6.02×1023个Cl原子,A错误;不要把摩尔质量与相对原子质量混同,应为钠的摩尔质量以g·mol-1为单位时在数值上等于它的相对原子质量,C错误;摩尔质量的单位为g·mol -1,H2O的摩尔质量是18 g·mol-1,D错误。
3.下列说法不正确的是()
A.硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个N2和6.02×1023个O2的质量比等于7∶8
C.3.2 g O2所含的原子数目约为0.2×6.02×1023
D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g
答案 D
解析H2SO4的摩尔质量为98 g·mol-1,6.02×1023个H3PO4分子的质量为98 g,二者数值相等,A正确;6.02×1023个N2和6.02×1023个O2的质量比为二者的相对分子质量之比,即28∶32
=7∶8,B正确;3.2 g O2物质的量为3.2 g
32 g·mol-1
=0.1 mol,含氧原子数约为0.1×2×6.02×1023,C正确;0.5×6.02×1023个CO2物质的量为0.5 mol,质量为0.5 mol×44 g·mol-1=22 g,D不正确。
4.2015年10月,科学家屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下列关于双氢青蒿素的说法正确的是()
A.N A个双氢青蒿素的质量为284 g·mol-1
B.均为N A的C、H、O三种原子的质量比6∶1∶8
C.14.2 g双氢青蒿素中含有的原子总数为2.2N A
D.含有N A个碳原子的双氢青蒿素的物质的量为1 mol
答案 C
解析质量的单位是g,不是g·mol-1,A错误;当摩尔质量的单位是g·mol-1时,均为N A 个C、H、O三种原子的物质的量为1 mol,分别乘以各自的摩尔质量12 g·mol-1、1 g·mol-1、16 g·mol-1,得到质量比12∶1∶16,B错误;14.2 g双氢青蒿素的物质的量是14.2 g÷284 g·mol-1=0.05 mol,由于在一个分子中含有的原子个数是44个,所以0.05 mol双氢青蒿素中含有的原子的总数为2.2N A,C正确;一个双氢青蒿素的分子中含有15个碳,含有N A个碳原子的双氢青蒿素的物质的量为1 mol÷15≈0.067 mol,D错误。
5.(1)请填写下表:
(2)O 2和O 3等质量的O 2和O 3所含分子数之比为 ,原子个数比为 。 (3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH 3的相对分子质量为17,则NH 3的摩尔质量为 。
②N A 为阿伏加德罗常数,已知a g 某气体中含分子数为b ,则该气体的摩尔质量为 。 ③已知一个铁原子的质量为b g ,则铁的摩尔质量为 。
④1.28 g 某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。 答案 (1)
(2)3∶2 (3)①17 g·mol -1 ②aN A b g·mol -1
③bN A g·mol -
1 ④64 g·mol -
1 解析 (1)M (SO 2)=64 g·mol -
1, M (SO 2-
4)=96 g·
mol -
1, 2 mol SO 2的质量为2 mol×64 g·mol -
1=128 g ,
2 mol SO 2的分子数目为2 mol×6.02×102
3 mol -
1=1.204×1024, 6.02×1022个
SO 2-
4的物质的量为
6.02×1022
6.02×1023 mol -1
=0.1 mol ,
0.1 mol SO 2-
4的质量为0.1 mol×
96 g·mol -
1=9.6 g 。
(2)n (O 2)∶n (O 3)=m 32∶m 48=3∶2,则分子数之比为3∶2;N 1(O)∶N 2(O)=(m 32×2)∶(m 48
×3)=1∶1。
(3)依据摩尔质量的定义式:M =m
n ,结合物质的量(n )与N A 的关系即可列出相关表达式,不
要忘记单位。