(完整版)高二化学认识同周期元素性质的递变规律
- 格式:docx
- 大小:12.31 KB
- 文档页数:5





同主族同周期元素性质递变规律探究同主族同周期元素性质递变规律是指在元素周期表中,同一主族(即同一列)和同一周期(即同一横行)的元素,在一定程度上存在着性质的递变规律。
这种递变规律是由于元素的原子结构和电子排布的变化所引起的,以下将对同主族同周期元素性质递变规律进行探究。
1.同主族元素性质递变规律:同一主族的元素具有相似的外层电子配置,因此它们的化学性质有很多共同点。
主要有以下几个规律:(1)原子半径递增规律:同一主族元素的原子半径随着周期数的增加而逐渐增大。
这是因为随着周期数的增加,核电荷数也逐渐增加,而外层电子又在同一能级上,因此电子屏蔽效应增大,使得电子云更加扩散,导致原子半径增大。
(2)电离能递减规律:同一主族元素的第一电离能随着周期数的增加而逐渐降低。
这是由于随着周期数的增加,电子屏蔽效应增强,外层电子离核距离增加,对核的吸引力减弱,因而电子更容易被移去。
(3)电负性递增规律:同一主族元素的电负性随着周期数的增加而逐渐增加。
原子的电负性是指原子吸引价电子的能力,而原子的吸引力与原子半径和核电荷数有关。
同一主族元素的核电荷数逐渐增加,而半径逐渐变大,使得同一主族元素的电负性增加。
2.同周期元素性质递变规律:同一周期的元素具有相似的内层电子配置,因此它们的化学性质也有很多共同点。
主要有以下几个规律:(1)原子半径递减规律:同一周期元素的原子半径随着主量子数(或周期数)的增加而逐渐减小。
这是由于周期数的增加,进一层的电子壳不断增加,而内层电子壳并没有明显增加,因此电子云边界更加靠近核,使得原子半径减小。
(2)电离能递增规律:同一周期元素的第一电离能随着主量子数(或周期数)的增加而逐渐增大。
这是由于主量子数的增加,原子中的价电子离核距离增加,外层电子屏蔽效应增强,导致原子对电子的吸引力增大,因而电子更不容易被移去。
(3)电负性递减规律:同一周期元素的电负性随着主量子数(或周期数)的增加而逐渐减小。

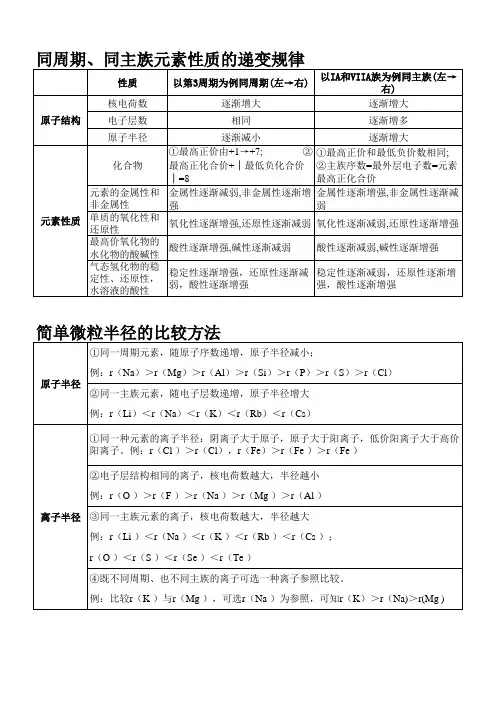
同周期元素性质的递变规律:同一周期元素(稀有气体元素除外)的原子,从左往右,最外层电子数逐渐增加,原子半径逐渐减小,元素的原子失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强第3周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Na > Mg > Al氧化性:Na+< Mg2+< Al3+(相反)与水或酸反应置换出氢的难易程度:Na > Mg > Al易难剧烈不剧烈最高价氧化物对应的水化物的碱性NaOH > Mg(OH)2> Al(OH)3元素原子得电子能力(元素的非金属性)Si < P < S < Cl还原性:P3->S2->Cl-(Si4-不存在) (相反)元素单质的氧化性Si < P < S < Cl2单质与氢气化合的难易程度Si < P < S < Cl2难易气态氢化物的稳定性SiH4< PH3< H2S < HCl最高价氧化物对应的水化物的酸性H4SiO4(或H2SiO3) < H3PO4< H2SO4< HClO4第2周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Li > Be氧化性:Li+< Be2+(相反)与水或酸反应置换出氢的难易程度:Li > Be易较难剧烈较不剧烈最高价氧化物对应的水化物的碱性LiOH > Be(OH)2元素原子得电子能力(元素的非金属性)C < N < O < F还原性:N3->O2->F-(C4-不存在) (相反)元素单质的氧化性C < N2< O2< F2单质与氢气化合的难易程度C < N2< O2< F2难易气态氢化物的稳定性CH4< NH3< H2O < HF最高价氧化物对应的水化物的酸性H2CO3< HNO3同主族元素性质的递变规律:同主族元素从上到下,电子层数依次增多,原子半径逐渐增大,元素的原子失电子能力逐渐增强,得电子能力逐渐减弱即元素的金属性逐渐增强,非金属性逐渐减弱ⅦA族ⅠA族(除氢H外,即碱金属元素)。




高二化学必修元素周期律知识点梳理化学对我们认识和利用物质具有重要的作用。
小编准备了高二化学必修元素周期律知识点,具体请看以下内容。
1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。
2.同周期元素性质递变规律第三周期元素11Na12Mg13Al14Si15P16S17Cl18Ar(1)电子排布电子层数相同,最外层电子数依次增加(2)原子半径原子半径依次减小(3)主要化合价+2+3+4-4+5-3+6-2+7-1(4)金属性、非金属性金属性减弱,非金属性增加(5)单质与水或酸置换难易冷水剧烈热水与酸快与酸反应慢(6)氢化物的化学式SiH4H2SHCl(7)与H2化合的难易由难到易(8)氢化物的稳定性稳定性增强(9)最高价氧化物的化学式Na2OMgOAl2O3SiO2P2O5SO3Cl2O7最高价氧化物对应水化物(10)化学式NaOHMg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4(11)酸碱性强碱中强碱两性氢氧化物弱酸中强酸强酸很强的酸(12)变化规律碱性减弱,酸性增强?第ⅠA族碱金属元素:Li Na K Rb Cs Fr(Fr是金属性最强的元素,位于周期表左下方)第ⅦA族卤族元素:F Cl Br I At(F是非金属性最强的元素,位于周期表右上方)判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。
同周期比较:金属性:Na>Mg>Al与酸或水反应:从易→难碱性:NaOH>Mg(OH)2>Al(OH)3?非金属性:Si<P<S<Cl单质与氢气反应:从难→易氢化物稳定性:SiH4<PH3<H2S<HCl酸性(含氧酸):H2SiO3<H3PO4<H2SO4<HClO4??同主族比较:金属性:Li<Na<K<Rb<Cs(碱金属元素)与酸或水反应:从难→易碱性:LiOH<NaOH<KOH<RbOH<CsOH非金属性:F>Cl>Br>I(卤族元素)单质与氢气反应:从易→难氢化物稳定:HF>HCl>HBr>HI金属性:Li<Na<K<Rb<Cs还原性(失电子能力):Li<Na<K<Rb<Cs氧化性(得电子能力):Li+>Na+>K+>Rb+>Cs+非金属性:F>Cl>Br>I氧化性:F2>Cl2>Br2>I2还原性:F-<Cl-<Br-<I-酸性(无氧酸):HF<HCl<HBr<HI?比较粒子(包括原子、离子)半径的方法:(1)先比较电子层数,电子层数多的半径大。
第三节元素周期表的应用认识同周期元素性质的递变规律第 1 课时【教学目标】1.以第3 周期元素为例,使学生掌握同周期元素性质递变规律,并能用原子结构理论初步加以解释;2.通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力;【教学重点】同周期元素性质递变规律【教学难点】同周期元素性质递变规律【教学方法】1.通过“活动·探究”,学会运用具体事物来研究抽象概念的思想方法;2.通过“阅读探究”、“交流·研讨”、“观察思考”等活动,培养学生获取并整合信息的能力;【教师具备】1.实验器材药品Na、Mg、Al 及MgCl2、AlCl3溶液NaOH 溶液2.多媒体课件【教学过程】【转折】我们通过设计实验方案、实施实验方案验证了我们对Na、Mg、Al 失电子能力的推测,那么,Si、P、S、Cl 的得电子能力是否如我们所预测的一样依次增强?【投影】方法导引【讲解】分析方法导引内容。
阅读方法导引的内容,获得判断非金属元素得电子能力强弱的判断依据。
培养学生由材料获得知识的能力。
使学生充分理解理论指导的内容,能在归纳整理阅读材料时有一个准确的把握。
【阅读】教材P21 页“阅读探究”【概括】请完成表格【投影】表格【板书】硅、磷、硫、氯四种非金属元素原子得电子能力逐渐增强。
【小结】这节课,大家通过自行设计实验方案,实施实验方案,探索出Na、Mg、Al 失电子能力的强弱;通过阅读探究的方式得出Si、P、S、Cl 得电子能力的强弱。
【投影】完成填空学生代表回答学生集体回答培养学生自学能力以及获取并整合信息的能力。
巩固本节所学内容。
10 分钟【课堂练习】【课堂练习】答案:1. 判断下列说法是否正确:1、错(1) C、N、O、F 原子半径依次增大2、对(2)PH3、H2S、HCl 稳定性依次增强(3)HClO 比H2SO4酸性强。
(4)甲、乙两种非金属元素与金属钠反应时,甲得电子的数目3、错4、错多,所以甲活泼。
《同周期、同主族元素性质的递变》讲义在化学的世界里,元素的性质变化有着一定的规律,其中同周期和同主族元素性质的递变是非常重要的内容。
理解这些规律,对于我们深入研究化学、预测化学反应、掌握物质的性质等都具有极其重要的意义。
一、同周期元素性质的递变元素周期表中,同一周期的元素从左到右,原子序数依次增大,电子层数相同,核电荷数逐渐增多,原子半径逐渐减小。
1、核电荷数和电子层数在同周期中,随着原子序数的增加,核电荷数逐渐增大,而电子层数保持不变。
这意味着原子核对外层电子的吸引力逐渐增强。
2、原子半径由于核电荷数的增加,对电子的吸引作用增强,使得原子半径逐渐减小。
例如,在第三周期中,钠(Na)的原子半径大于镁(Mg),镁的原子半径又大于铝(Al)。
3、化合价同周期元素的化合价从左到右呈现出从+1 价逐渐升高到+7 价(氟、氧一般没有正价),然后再降低的趋势。
从左到右,金属性逐渐减弱,非金属性逐渐增强。
例如,钠是典型的金属元素,化学性质活泼,容易失去电子;而氯是典型的非金属元素,容易得到电子。
5、单质的还原性和氧化性金属单质的还原性逐渐减弱,非金属单质的氧化性逐渐增强。
例如,钠单质的还原性强于镁单质,氯气的氧化性强于硫单质。
6、最高价氧化物对应水化物的酸碱性碱性逐渐减弱,酸性逐渐增强。
以第三周期为例,氢氧化钠(NaOH)是强碱,氢氧化镁Mg(OH)₂是中强碱,氢氧化铝Al(OH)₃是两性氢氧化物,硅酸(H₂SiO₃)是弱酸,磷酸(H₃PO₄)是中强酸,硫酸(H₂SO₄)是强酸,高氯酸(HClO₄)是最强的无机酸。
二、同主族元素性质的递变同主族元素,从上到下,电子层数逐渐增多,原子半径逐渐增大,核电荷数也在增加,但对最外层电子的吸引力逐渐减弱。
1、原子半径和电子层数电子层数增多是导致原子半径增大的主要原因。
例如,碱金属元素中,锂(Li)的原子半径小于钠(Na),钠小于钾(K)。
2、化合价主族元素的最高正化合价等于主族序数(氧、氟除外)。
第三节元素周期表的应用
认识同周期元素性质的递变规律
第1课时
【教学目标】
1.以第3周期元素为例,使学生掌握同周期元素性质递变规律,并能用原子结构理论初步加以解释;
2.通过实验探究”、观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力;
【教学重点】
同周期元素性质递变规律
【教学难点】
同周期元素性质递变规律
【教学方法】
1.通过活动探究”,学会运用具体事物来研究抽象概念的思想方法;
2.通过阅读探究”、交流研讨”、观察思考”等活动,培养学生获取并整合信息的能力;
【教师具备】
1.实验器材药品Na、Mg、Al及MgCl2、AICI 3溶液NaOH溶液
2.多媒体课件。