微粒构成物质 认识化学元素
- 格式:ppt
- 大小:589.00 KB
- 文档页数:20

物质的微粒和化学符号物质是组成宇宙万物的基本构成单位。
无论是我们身边的物质,还是遥远的星系中的物质,都由微粒组成。
微粒是不可再分的最小粒子,它们以不同的方式组合形成各种物质。
化学符号则是用来表示不同元素的标记,它们是我们理解和研究物质的重要工具。
微粒的符号微粒通常用不同的符号来表示。
最基本的微粒有原子、分子和离子。
•原子是物质的基本微观单位。
它由质子、中子和电子组成。
原子的符号通常使用该元素的化学符号来表示,例如氧的原子用符号 O 表示。
•分子是由两个或更多原子通过化学键结合形成的。
分子的符号通常用化学式来表示,如水分子的符号是H₂O。
•离子是带正电荷或负电荷的原子或分子。
正离子称为阳离子,负离子称为阴离子。
离子的符号通常用带电荷的原子符号来表示,例如氯离子用Cl⁻ 表示,钠离子用Na⁺ 表示。
除了原子、分子和离子,还有其他的微粒形式,如电子、中子和质子等。
它们是组成原子的基本粒子,但它们本身并不组成稳定的物质。
化学符号化学符号是化学元素的简化标记。
化学元素是指具有特定原子数和原子核的不可分解物质种类。
每个化学元素都有一个唯一的化学符号,由一个或两个字母组成。
例如,氧元素的化学符号是 O,碳元素的化学符号是 C,氢元素的化学符号是H。
化学符号的第一个字母通常是元素名称的大写字母,第二个字母(如果有)通常是小写字母。
当化学符号的第一个字母是大写字母时,它信息量更大,代表相对较常见或有特定性质的元素。
化学符号广泛应用于化学方程式、周期表和化学命名等。
它们使得科学家和化学工作者能够准确地表示和交流有关元素和化学反应的信息。
总结微粒是物质的基本构成单位,包括原子、分子和离子等。
它们以不同的方式组合形成各种物质。
化学符号是用来表示不同元素的标记,它们是我们理解和研究物质的重要工具。
每个化学元素都有一个唯一的化学符号,由一个或两个字母组成。
化学符号被广泛应用于化学方程式、周期表和化学命名等领域,以便准确地表示和交流有关元素和化学反应的信息。

专题05 构成物质的微粒一、新课标的要求:1.认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
2.能用微粒的观点解释某些常见的现象。
3.知道原子是由原子核和核外电子构成的。
4.知道原子可以结合成分子、同一元素的原子和离子可以互相转化,初步认识核外电子在化学反应中的作用。
二、考情分析:1、考查情况:化学是在分子、原子的基础上研究物质的组成、结构、性质及其变化规律的一门基础的自然学科。
从此可以看出构成物质的微粒在化学学科中的重要地位。
构成物质的微粒是各地中考必考的一个知识点,也是中考化学的热点内容。
2、考查形式:纵观近几年的各地中考试题,不难发现该知识点考查形式有:物质的微粒性、微粒基本性质、原子的构成、三种微粒的联系与区别等。
从题型上来说,可主要有选择和填空题。
从题目形式上说,有识记形、理解形、判断正误形和推断推理形。
3、命题方向:该考点的命题方向主要是通过创设相关问题情景或图表信息等,既可以考查学生对相关知识点的理解和掌握情况;还可以去考查学生分析、解答相关的实际问题的能力等。
4、试题难度:由于该知识点涉及微观知识,比较抽象且琐碎,是学生在理解上有一定难度的知识,使得分的难度增加。
试题难度一般为中等或难等的题目。
☆知识梳理☆一、:构成物质的微粒构成物质的基本微粒有三种:分子、原子和离子。
1、由原子构成的物质有:2、由分子构成的物质有:3、由离子构成的物质:注意:1、上述规律对初中的大多数物质起作用。
2、混合物的构成微粒要按其中所含物质的成分来分析。
二、微粒的基本性质:构成物质的微粒有以下性质:1、微粒很小(质量小、体积小)2、微粒时刻不停地做规则运动(运动速率与温度成正比)3、微粒间有间隔(间隔与温度成正比,与压强成反比)4、同种微粒,化学性质相同注意:1、微粒时刻不停地做规则运动,温度高时运动速率快;温度低时运动速率慢,但不是不运动。
此观点可解释扩散现象。
2、微粒间的间隔与温度成正比,温度高时微粒间的间隔变大,温度低时微粒间的间隔变小。
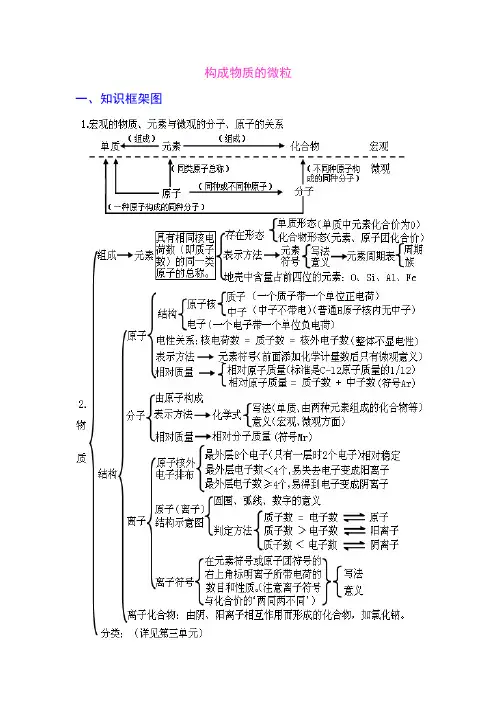
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。




教学设计一、【课题】人教版五·四学制八年级化学第三单元课题2 原子的结构第2课时原子核外电子的排布二、【课标要求】㈠物质构成的奥秘:微粒构成物质,认识化学元素。
从宏观到微观、从定性到定量,体现了化学学科发展的趋势。
对物质组成的微观研究和定量研究使化学摆脱了经验形态,逐步形成科学的理论。
本主题将帮助学生用微粒的观念去学习化学,通过观察、想像、类比、模型化等方式使学生初步理解化学现象的本质;从五彩缤纷的宏观世界步入充满神奇色彩的微观世界,激发中学生学习化学的兴趣;利用有关原子结构的科学史实,使学生了解科学家严谨求实的科学态度;通过对问题的探究和实践活动,提高学生的想像能力、创新能力,帮助学生初步认识辩证唯物主义的一些观点。
三、【教材分析】本课时内容是人教版五·四学制八年级化学第三单元《物质构成的奥秘》课题2 《原子的结构》第2课时《原子核外电子的排布》。
本单元在初中化学课程中占有重要的基础地位。
通过建立微粒观来解释宏观物质世界,是化学学科的特点;本单元这些基本概念是学习元素化合物、化学实验和化学基本计算等其它板块的重要工具。
学生在本单元前几节课已经认识了分子、原子等微观粒子运动的一些特点,对分子、原子以及原子的构成也有了初步了解,在本节课中再从原子构成入手来进一步认识原子核外电子排布的部分简单规律。
通过本课题的学习,可以为学生从化学角度认识物质及其变化的实质打下基础,为高中化学中学习原子核外电子的排布规律打下良好的基础。
四、【学情分析】学生在前面两个单元学到的微观知识有限,本单元前几节课学生从生活中常见的现象入手,对分子、原子的存在及特点有了一定的认识,通过了解科学家发现原子内部结构的史实对原子内部结构有了一定的想象和认识,但本课题内容比较抽象,所以在教学中要通过各种活动来激发学生的学习兴趣,同时帮助学生在头脑中建立原子结构模型,这也是教学中的难点。
五、【教学目标】1.通过自主学习和观看视频,知道原子核外电子是分层排布的。


第三讲:微粒与元素主讲人:赖诗港知识导航:一、粒子模型物理变化过程中,分子本身没有发生改变,只是分子之间的间隔在变化。
分子和原子的区别是在化学反应中能否进行再分,化学变化的实质是分子分裂成原子,原子重新组合成新物质的分子,所以原子是化学反应中最小的粒子。
由分子构成的物质,分子是保持其化学性质的最小粒子。
二、原子结构1.原子内部结构模型的建立是一个不断完善、不断修正的过程:①道尔顿原子模型(1803年)——实心球模型。
②原子模型(1904年)——西瓜模型(或枣糕模型)。
③原子模型(1911年)——行星绕太阳模型(或核式结构模型)。
④玻尔原子模型(1913年)——模型。
(或轨道模型)⑤电子云模型(1927年—1935年)——电子云模型。
2.物质构成:1-20号原子结构示意图3、离子的形成阳离子(原子失去电子而形成的,带正电) 阴离子(原子得到电子而形成的,带负电)物质的微观构成:物质是由分子、原子或离子构成。
物质的宏观组成:物质是由元素组成的。
同位素原子:质子数相同而中子数不同的原子互为同位素原子。
同种元素组成的不同种单质,互称为同素异形体。
例如金刚石和石墨是同素异形体,红磷和白磷也是同素异形体。
6、元素及元素周期律决定元素种类的粒子是核电荷数(即质子数)。
(1)元素符号:国际上统一用拉丁文的第一个大写字母来表示元素,当元素的第一个字母相同时,可再写上该元素名称的第二个字母(小写)以示区别。
常见的元素符号:离子① 金属元素:钾 、钙 、钠 、镁 、铝 、锌 、铁_ 、锡 、铅 、铜 、汞 、银 、铂 、金(钡 、锰 、锂 、铍 )。
② 非金属元素:碳 、硅 、硫 、磷 、氢 、氧 、氮 、氟 、氯 、溴 、碘 。
③ 稀有气体:氦 、氖 、氩 。
(2)元素符号的含义:既有宏观的含义,又有微观的意义。
① 表示__ ;② 表示__ 。
(3)元素、原子、离子、分子的涵义及相互关系:阳离子 原子 阴离子金属单质:Mg 等(4)元素周期表是按 从小到大有序排列起来的,它的每一周期从左到右按 元素→ 元素→ 元素顺序排列,每一族元素具有相似的_ ___,每一周期中 相同。

构成物质的微粒知识点一、化学变化中的最小微粒原子 1.原子的构成原子一般是由质子、中子和电子构成,有的原子不一定有中子(H 原子),质子数也不一定等于中子数。
原子的种类由核电荷数(质子数)决定。
2.在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3.定义式:Ar精确应用:相对原子质量之比=原子实际质量之比,相对原子质量大的,实际质量就大 计算应用:即相对原子质量≈质子数+中子数注意:相对原子质量不是原子质量,是一个比值,单位为1,可以用来比较几种原子的实际质量大小4.原子是化学变化中的最小微粒,化学变化中原子种类和数目不发生改变二、原子核外电子排布与离子1.电子排布——分层排布:第一层不超过2个,其他层不超过8个(对前20号元素而言)。
2.原子结构示意图:(1)含义:(以镁原子结构示意图为例) (2)原子的最外层电子数与元素的分类、化学性质的关系 元素的分类最外层电子数 得失电子趋势 化学性质 稀有气体元素8个(氦为2个) 相对稳定,不易得失电子 稳定 金属元素一般少于4个 易失去最外层电子 不稳定 非金属元素 一般多于4个 易得到电子 不稳定元素的化学性质决定于原子的最外层电子数。
原子(不带电) 原子核(带正电)核外电子(每个电子带一个单位负电荷) 质子(带一个单位正电荷) 中子(不带电)体积很小,质量占原子质量绝大多数121(kg)(kg)⨯=标准碳原子的质量一个原子的实际质量相对原子质量原子最外层电子数为8(氦为2)的结构称为稳定结构。
(3)原子、阳离子、阴离子的判断:原子:质子数=核外电子数阴离子:质子数<核外电子数,带负电荷阳离子:质子数>核外电子数,带正电荷(4)原子与对应离子的异同不变:质子数、中子数、核电荷数、相对原子质量改变:最外层电子数、电子总数、微粒电性(从不带电到带电)、化学性质可能改变:电子层数(阴离子不变,阳离子变少)(5)原子和离子的稳定性对于稀有气体原子,原子更稳定对于其他原子,最外层达到8电子的离子更稳定三、保持物质化学性质的微粒(分子)化学反应的本质是原有的分子破裂,原子重新结合成新的分子,因此化学变化中分子的种类必然改变,分子的数目可能不变(取决于具体的反应)。

构成物质的微粒有哪些
构成物质的微粒包括原子、分子和离子。
这些微粒是物质的基本组成单位,根据物质的性质和化学结构的不同,它们可以以不同的方式组合和排列。
1. 原子:原子是构成物质的最基本的微粒,是化学元素的基本单位。
每种元素都由一种特定类型的原子组成,其化学性质由其原子的结构和排列决定。
2. 分子:分子是由两个或更多个原子以共价键相连形成的结构单元。
分子可以是同一种元素的原子组成的,也可以是不同元素的原子组成的化合物。
例如,氧气分子(O2)由两个氧原子以共价键连接形成。
3. 离子:离子是由失去或获得一个或多个电子而带有电荷的原子或分子。
正离子是失去了一个或多个电子的,带有正电荷;负离子是获得了一个或多个电子的,带有负电荷。
离子通过离子键相互吸引形成化合物,如氯化钠(NaCl)中的钠离子和氯离子。
这些微粒以不同的方式组合和排列形成各种不同类型的物质,如元素、化合物和混合物。
对于理解物质的性质和行为,以及化学反应的机理和速率等方面都至关重要。
1/ 1。
物质构成的奥秘单元整体教学设计本单元的内容属于《新课程标准》中的“物质构成的奥秘”部分,包括微粒构成物质和认识化学元素两个方面。
通过实验比较空气和离子等,学生能够认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
同时,学生也能用微粒的观点解释某些常见的现象,例如浓氨水和浓盐酸接近时的“空中生烟”。
此外,学生还能初步认识核外电子在化学反应中的作用,了解元素周期表、原子序数、周期和族的概念,掌握常见元素的名称和符号,知道元素的简单分类。
本单元教材是“双基”的重要组成部分,通过了解物质的微观结构,能够理解物质的多样性和统一性,理解物质变化的客观性和复杂性,形成化学的基本观念,发展学生探究物质及其变化的兴趣。
初中化学基础知识和基本技能是构成学生科学素养的基本要素,是为学生的终生研究和将来适应现代社会生活打好基础所必需的。
本单元教材对于学生十分重要,它既是今后研究的理论基础,又是必不可少的工具。
本单元的目标聚焦在知识与技能方面,包括认识物质的微粒性,了解原子、分子、离子等微粒的构成,初步认识原子的内部结构、核外电子排布、离子的形成,知道原子是由原子核和核外电子构成的,了解元素周期表、原子序数、周期和族的概念,掌握常见元素的名称和符号,知道元素的简单分类。
通过本单元的研究,学生能够形成“化学变化过程中元素不变”的观念,为今后的化学研究打下基础。
利用相对原子质量和相对分子质量进行简单计算,可以理解商品标签上标示物质成分和含量的信息。
通过查阅资料,学生可以获取相关信息,并用文字、图表和化学语言表述。
同时,运用比较、分类、归纳、概括等方法对信息进行加工。
在小组活动中,学生可以培养主动与他人交流和讨论的能力,以清晰表达自己的观点。
这有助于形成良好的研究惯和方法。
通过研究本单元,学生可以建立科学的物质观,深入理解“世界是物质的”和“物质是变化的”这些辩证唯物主义观点。
同时,学生可以领悟自然界基本组成的简单性,并形成化学变化过程中元素不变的观念。
2.3 构成物质的微粒(II)——原子和离子一、教学内容:1、知道原子、离子也是构成物质的一种微粒,了解原子的结构。
2、理解相对原子质量的概念,会查相对原子质量。
3、初步学习通过“模型”来认识物质结构。
4、建立物质是无限可分的观点。
二、重点、难点:知道原子、原子的结构,理解相对原子质量是重点。
原子结构的空间想象,相对原子质量的理解是难点。
三、教学程序(一)分子很小,分子又是由什么构成的呢?分子还能不能分割呢?分子还可以分成更小的微粒—原子! 【探究实验】加热氧化汞氧化汞的分解现象:管壁上有银白色物质生成,在试管口试验的带火星的木条复燃原理:氧化汞−−→−加热汞 + 氧气 HgO Hg O 2结论:在化学变化中,氧化汞分子本身发生了变化,分解成汞原子和氧原子,而汞原子和氧原子不能再分,它们只是重新组合。
(二)原子也是构成物质的一种微粒1、原子也是构成物质的一种微粒金属、稀有气体(氦气He 等)、金刚石、硅等是由原子构成的 2、原子的质量—相对原子质量原子的质量很小,使用很不方便,如氢原子:×2710-kg氧原子:kg 2610657.2-⨯ 相对原子质量=一个碳原子实际质量一个原子的实际质量⨯)12/1(用以上方法,代入具体数据,就可算出各种原子的相对原子质量,如:H 的相对原子质量=110993.1)12/1(10674.12627=⨯⨯⨯--kg kg(近似值)O 的相对原子质量=kgkg262610993.1)121(10657.2--⨯⨯⨯=16其它常见元素的相对原子质量的计算结果见课本P89表中(近似值) 注意:相对原子质量 = 质子数 + 中子数 3、原子的构成⎪⎩⎪⎨⎧⎩⎨⎧负电荷每个电子带一个单位的电子核外电子不显电性中子正电荷每个质子带一个单位的质子原子核原子:::4、原子内部的特点原子的核内质子数=核外电子数=核电荷数=原子序数5、原子结构示意图(三)离子是构成物质的又一种微粒离子的形成:化学变化中,中性的原子得到或失去电子成为带电荷的微粒,这种微粒就是离子。
科学 成就学生 卓越未来第十讲 构成物质的微粒及元素【知识提纲】(一)微粒构成物质及微粒微观构成1、你还能记得原子、离子、元素、单质、化合物、核电荷数等这些概念吗?2根据表中信息完成其余空格 中填写上述四个概念,并在“→”上表示它们间的相互关系。
4、原子、离子结构及元素性质与原子结构的关系科学成就学生卓越未来照规律在图中补上所缺的结构图,你所画的是 ___(原子或离子)结构示意图;这两种结构区分的方法是________________________________________________________(二)物质的简单分类分析右图:(1)请你根据自己的理解填写相应的空位,并选择其一对其结构或组成继续划分...............。
(2)请写出由离子..直接构成的物质和生活中常见混合物...的实例各一个。
、。
【典型例题】1.根据物质相对分子质量和所含元素的化合价有规律排列的一组分子式:CH4,X,H2O,HF。
其中X应选择()A、HClB、H2S C、PH3D、NH32.某物质的分子式为Hn RO2n-1,它的相对分子质量是m ,则R元素的相对原子质量是A、m-3n-1B、m-3n+1C、m-33n-16D、m-33n+163.某氧化物的分子式为RxOy,它的相对分子质量是M,则R元素的相对原子质量是A、(M-16x)/yB、(M-16y)/xC、M-16yD、M+16y4.在19世纪,化学家对氧化锆的化学式有争议。
经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233,若氧化物中锆的化合价与氯化物中锆的化合价相同,试判断氧化锆的化学式为()A、ZrO2 B、Zr2O C、Zr2O3D、ZrO6.某元素R的化合价是奇数(不变价),其氯化物的相对分子质量是m,其氧化物的相对分子质量是n,则R的化合价是()A、2(m-n)/55B、2(n-m)/55C、(2m-n)/55D、(2n-m)/557.金属R的氧化物的相对分子质量是X,其氯化物的相对分子质量是Y,则此金属的化合价是()A、(2X-Y)/55B、(2Y-X)/55C、2(Y-X)/55D、(X+Y)/558、经测定某个原子中共有25个粒子,其中有9个粒子不显电性,则它的相对原子质量......_____。