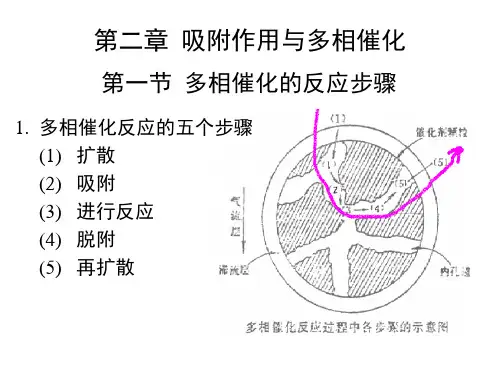
表面吸附与多相催化
- 格式:ppt
- 大小:3.31 MB
- 文档页数:44


多相催化反应机理
多相催化反应是指在反应中存在两个或更多的相,如气体与固体的催化反应、液体与固体的催化反应等。
其机理可以分为以下几个步骤:
1. 吸附:反应物进入固体催化剂表面,通过吸附与催化剂发生物理或化学吸附作用。
这一步通常是决定整个反应速率的关键步骤,在反应过程中会产生吸附物。
2. 表面反应:吸附物上的反应物与其他吸附物相互作用,发生化学反应。
这一步骤通常是反应物转化为产物的关键步骤,其速率取决于吸附物的浓度和反应物之间的相互作用强度。
3. 解吸:反应物与产物从催化剂表面解吸,离开催化剂,进入反应体系中。
解吸过程可能是可逆的,有时会回到吸附阶段。
以上是一个基本的多相催化反应机理,在实际的多相催化反应中,还可能存在其他的步骤或中间体。
催化剂的种类和特性以及反应条件(如温度、压力、溶剂等)也会对反应机理产生影响。




物理吸附与化学吸附在催化中的应用摘要:吸附过程与催化作用在国民经济和环境保护方面具有重要意义。
他们是化学工业,石油炼制以及国民经济其他领域最活跃的研究课题之一。
这两个领域涉及到的都是表面现象,使用的都是多孔固体。
吸附是催化反应得以发展的最关键步骤之一,通过它揭示催化本质和研究催化性质越来越受到人们的重视,因此许多在线原位动态测量技术得以快速发展。
关键词:物理化学吸附表征测定孔结构气体探针1. 吸附现象吸附:当流体与多孔固体接触时, 流体中某一组分或多个组分在固体表面处产生积蓄, 此现象称为吸附。
吸附也指物质(主要是固体物质)表面吸住周围介质(液体或气体)中的分子或离子现象[1,2]。
实际上,人们很早就发现并利用了吸附现象,如生活中用木炭脱湿和除臭等。
随着新型吸附剂的开发及吸附分离工艺条件等方面的研究,吸附分离过程显示出节能、产品纯度高、可除去痕量物质、操作温度低等突出特点,使这一过程在化工、医药、食品、轻工、环保等行业得到了广泛的应用,例如:(1)气体或液体的脱水及深度干燥,如将乙烯气体中的水分脱到痕量,再聚合。
(2)气体或溶液的脱臭、脱色及溶剂蒸气的回收,如在喷漆工业中,常有大量的有机溶剂逸出,采用活性炭处理排放的气体,既减少环境的污染,又可回收有价值的溶剂。
(3)气体中痕量物质的吸附分离,如纯氮、纯氧的制取。
(4)分离某些精馏难以分离的物系,如烷烃、烯烃、芳香烃馏分的分离。
(5)废气和废水的处理,如从高炉废气中回收一氧化碳和二氧化碳,从炼厂废水中脱除酚等有害物质。
1.1吸附吸附属于一种传质过程,物质内部的分子和周围分子有互相吸引的引力,但物质表面的分子,其中相对物质外部的作用力没有充分发挥,所以液体或固体物质的表面可以吸附其他的液体或气体,尤其是表面面积很大的情况下,这种吸附力能产生很大的作用,所以工业上经常利用大面积的物质进行吸附,如活性炭、水膜等。
当液体或气体混合物与吸附剂长时间充分接触后,系统达到平衡,吸附质的平衡吸附量(单位质量吸附剂在达到吸附平衡时所吸附的吸附质量),首先取决于吸附剂的化学组成和物理结构,同时与系统的温度和压力以及该组分和其他组分的浓度或分压有关。



第2章催化剂的表面吸附和孔内扩散内容提示流固(气-固,液-固,气-液-固)多相催化反应包括反应物分子的孔内扩散,表面吸附,产物分子的脱附和孔内扩散步骤,因而多相催化反应的机理与吸附和扩散机理是不可分割的。
本章主要介绍催化剂的表面吸附作用,表面积,孔结构和孔内扩散。
2.1催化剂的物理吸附与化学吸附吸附现象:当气体与固体表面接触时,固体表面上气体的浓度高于气相主体浓度的现象称为吸附现象。
吸附过程:固体表面上气体浓度随时间增加而增大的过程,称为吸附过程。
反之气体浓度随时间增加而减小的过程,称为脱附过程。
吸附平衡:当吸附过程进行的速率和脱附过程进行的速率相等时,固体表面上气体浓度不随时间而改变,这个状态称为吸附平衡。
等温吸附:在恒定温度下进行的吸附过程称为等温吸附。
等压吸附:在恒定压力下进行的吸附过程称为等压吸附。
吸附剂与吸附质:吸附气体的固体物质称为吸附剂,被吸附的气体称为吸附质。
吸附态:吸附质在表面吸附后的状态称为吸附态。
(吸附态不稳定且与游离态不同)吸附中心:吸附通常发生在吸附剂表面的局部位置这样的位置称为吸附中心。
2.1.1物理吸附与化学吸附及其比较物理吸附是靠分子间作用力,即范德华力实现的。
由于这种作用力比较弱,对分子结构影响不大,可把物理吸附看成凝聚现象。
化学吸附时,气固分子相互作用,改变了吸附分子的键和状态,吸附中心与吸附质之间发生了电子的重新调整和再分配。
化学吸附力属于化学键力。
由于该作用力强,对吸附分子的结构有较大影响,可把化学吸附看成化学反应。
化学吸附一般包含着实质的电子共享和电子转移。
而不是简单的微扰或弱极化作用。
物理吸附和化学吸附的特性比较2.1.2 吸附位能曲线吸附位能曲线表示吸附质分子所具有的位能与其距吸附表面距离之间的关系。
下图描述了氢在镍表面上吸附时的三种状态。
氢分子在镍表面上吸附的位能曲线及表面吸附示意图从右图C曲线可见,当H2分子离表面很远时,即在>0.5nm处,H2分子解离为H 原子需要一定能量DHH (即氢的离解434kj.mol)H原子接近表面时,由于化学键的形成而使位能降低。
多相催化多相催化反应是气态或液态反应物与固态催化剂在两相界面上进行的催化反应。
其历程至少包括反应物在催化剂表面上的化学吸附,吸附中间物的转化(表面反应)和产物脱附三个连续步骤。
阐明一个多相催化反应的历程,需揭示有关催化剂的活性部位和表面吸附中间物的结构和性质;吸附与催化反应的关系(如吸附分子之间反应或吸附分子与气相分子反应);催化剂表面活性部位如何在催化循环中获得再生以使催化反应能连续进行等。
一般是通过多相催化反应的动力学与催化剂的物理化学分析以获得对其历程的了解和应用,下面就让我来阐述具体的影响过程。
吸附质分子与固体表面原子(或分子)发生电子的转移、交换或共有,形成吸附化学键的吸附。
由于固体表面存在不均匀力场,表面上的原子往往还有剩余的成键能力,当气体分子碰撞到固体表面上时便与表面原子间发生电子的交换、转移或共有,形成吸附化学键的吸附作用。
化学吸附的主要特点是:仅发生单分子层吸附;吸附热与化学反应热相当;有选择性;大多为不可逆吸附;吸附层能在较高温度下保持稳定等。
化学吸附又可分为需要活化能的活化吸附和不需活化能的非活化吸附,前者吸附速度较慢,后者则较快。
化学吸附是多相催化反应的重要步骤。
研究化学吸附对了解多相催化反应机理,实现催化反应工业化有重要意义。
吸附特点与物理吸附相比,化学吸附主要有以下特点:①吸附所涉及的力与化学键力相当,比范德华力强得多。
②吸附热近似等于反应热。
③吸附是单分子层的。
因此可用朗缪尔等温式描述,有时也可用弗罗因德利希公式描述。
捷姆金吸附等温式只适用于化学吸附:V/Vm=1/a·㏑CoP。
式中V是平衡压力为p 时的吸附体积;Vm是单层饱和吸附体积;a和c0是常数。
④有选择性。
⑤对温度和压力具有不可逆性。
另外,化学吸附还常常需要活化能。
确定一种吸附是否是化学吸附,主要根据吸附热和不可逆性。
吸附机理可分3种情况:①气体分子失去电子成为正离子,固体得到电子,结果是正离子被吸附在带负电的固体表面上。