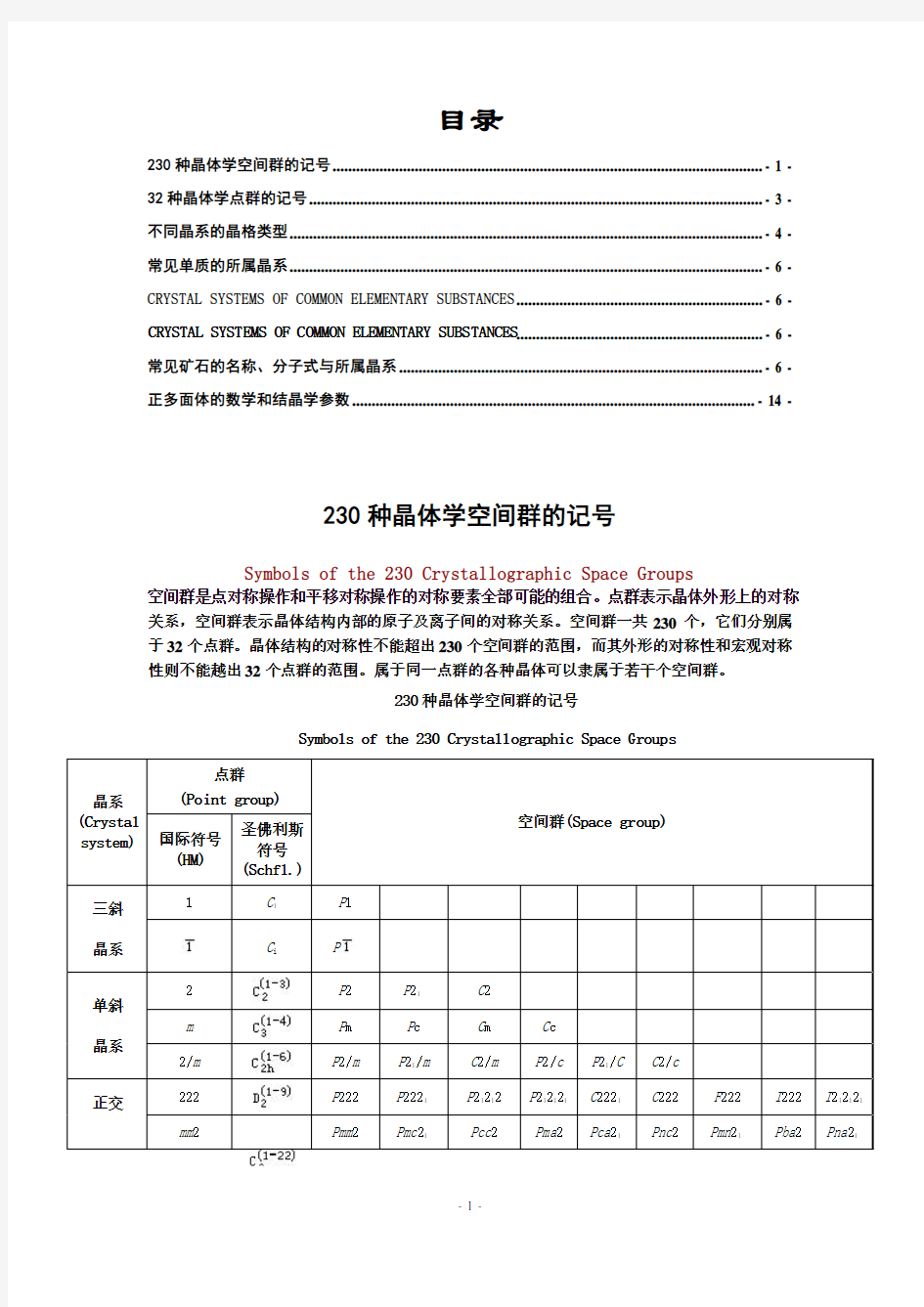
目录
230种晶体学空间群的记号..............................................................................................................- 1 - 32种晶体学点群的记号....................................................................................................................- 3 - 不同晶系的晶格类型.........................................................................................................................- 4 - 常见单质的所属晶系.........................................................................................................................- 6 - CRYSTAL SYSTEMS OF COMMON ELEMENTARY SUBSTANCES ...............................................................- 6 - CRYSTAL SYSTEMS OF COMMON ELEMENTARY SUBSTANCES ...............................................................- 6 - 常见矿石的名称、分子式与所属晶系.............................................................................................- 6 - 正多面体的数学和结晶学参数.......................................................................................................- 14 -
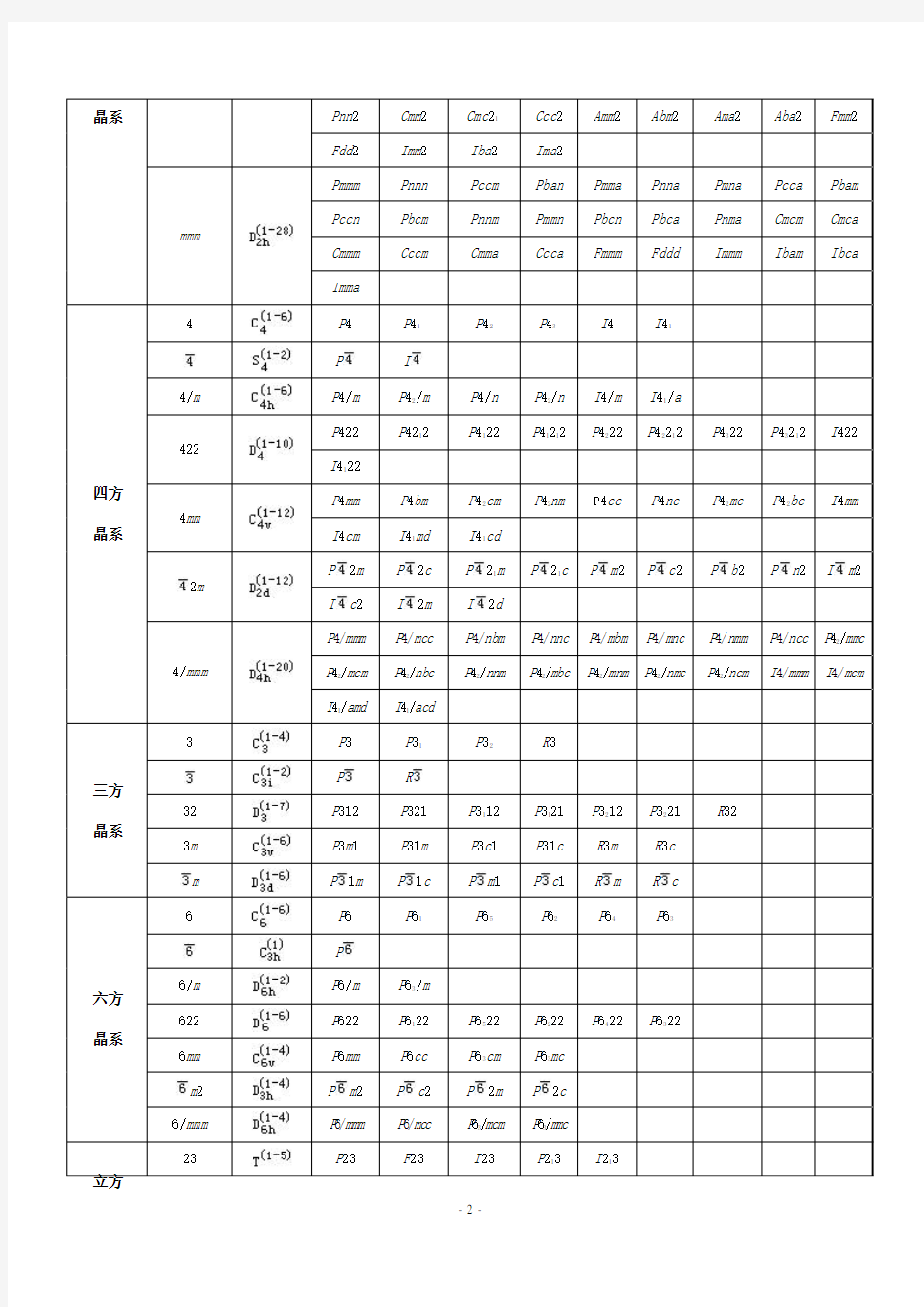
230种晶体学空间群的记号
Symbols of the 230 Crystallographic Space Groups
空间群是点对称操作和平移对称操作的对称要素全部可能的组合。点群表示晶体外形上的对称关系,空间群表示晶体结构内部的原子及离子间的对称关系。空间群一共230个,它们分别属于32个点群。晶体结构的对称性不能超出230个空间群的范围,而其外形的对称性和宏观对称性则不能越出32个点群的范围。属于同一点群的各种晶体可以隶属于若干个空间群。
230种晶体学空间群的记号
Symbols of the 230 Crystallographic Space Groups
点群
(Point group) 晶系
(Crystal system) 国际符号(HM)
圣佛利斯符号
(Schfl.) 空间群(Space group)
1
C 1 P 1 三斜 晶系
C i
P
2
P 2 P 21 C 2
m
P m P c C m C c
单斜 晶系 2/m P 2/m P 21/m C 2/m P 2/c P 21/C C 2/c
222
P 222 P 2221 P 21212 P 212121 C 2221 C 222 F 222 I 222 I 212121 正交
mm 2
Pmm 2
Pmc 21
Pcc 2
Pma 2
Pca 21
Pnc 2
Pmn 21
Pba 2
Pna 21
Pnn2 Cmm2 Cmc21 Ccc2 Amm2 Abm2 Ama2 Aba2 Fmm2
Fdd2 Imm2 Iba2 Ima2
Pmmm Pnnn Pccm Pban Pmma Pnna Pmna Pcca Pbam
Pccn Pbcm Pnnm Pmmn Pbcn Pbca Pnma Cmcm Cmca
Cmmm Cccm Cmma Ccca Fmmm Fddd Immm Ibam Ibca 晶系
mmm
Imma
4 P4 P41 P42P43 I4 I41
P I
4/m P4/m P42/m P4/n P42/n I4/m I41/a
P422 P4212 P4122 P41212 P4222 P42212 P4322 P43212 I422 422
I4122
P4mm P4bm P42cm P42nm P4cc P4nc P42mc P42bc I4mm 4mm
I4cm I41md I41cd
P2m P2c P21m P21c P m2 P c2 P b2 P n2 I m2 2m
I c2 I2m I2d
P4/mmm P4/mcc P4/nbm P4/nnc P4/mbm P4/mnc P4/nmm P4/ncc P42/mmc
P42/mcm P42/nbc P42/nnm P42/mbc P42/mnm P42/nmc P42/ncm I4/mmm I4/mcm 四方
晶系
4/mmm
I41/amd I41/acd
3 P3 P31P32R3
P R
32 P312 P321 P3112 P3121 P3212 P3221 R32
3m P3m1 P31m P3c1 P31c R3m R3c
三方
晶系
m P1m P1c P m1 P c1 R m R c
6 P6 P61P65P62P64P63
P
6/m P6/m P63/m
622 P622 P6122 P6522 P6222 P6422 P6322
6mm P6mm P6cc P63cm P63mc
m2P m2 P c2 P2m P2c
六方
晶系
6/mmm P6/mmm P6/mcc P63/mcm P63/mmc
立方
23 P23 F23 I23 P213 I213
m
Pm 3 Pn 3 Fm 3 Fd 3 Im 3 Pa 3 Ia 3
432 P 432 P 4232 F 432 F 4132 I 432 P 4332 P 4132 I 4132
3m
P 3m F 3m I 3m P 3n F 3c I 3d
Pm m Pn n
Pm n
Pn m
Fm m
Fm c Fd m Fd c
Im m
m m
Ia d
32种晶体学点群的记号
Symbols of the 32 Crystallographic Point Groups
点群不存在平移操作,所有的对称要素都集中在一个共同的点上。对称要素包括旋转、反映、反伸(对称中心)与旋转反伸。有这4个对称要素组合出32个点群。
下表中“轴向对称要素的方向和数目”的圆括号内数据代表该对称要素的数目。
32种晶体学点群的记号
Symbols of the 32 Crystallographic Point Groups
点群(Point group)
序号
(No.)
晶系
(Crystal system) 国际符号
(HM)
圣佛利斯符号(Schfl.)
轴向对称要素的方向和数目(Orientation and number of axial symmetry factor)
劳埃群(Laue group)
1
C 1 1 三斜晶系
C i
2
C 2 m C 3 2
单斜晶系
2/m C 2h 2/m
222
D 2 mm 2 D 2v 3 正交晶系 mmm
D 2h mmm
c a [110]
4
C 4 4
S 4 4/m C 4h
4/m
422 D 4 4 2(2) 2(2) 4 四方晶系 4mm
C 4v
4
m (2) m (2)
4/mmm
2m D2d 2(2) m(2)
4/mmm D4h
c a
3 C3 3
C3i
32 D3 3 2(2)
3m C3v 3 m(3)
5 三方晶系
m D3d
m
c a [210]
6 C6 6
C3h
6/m C6h
6/m
622 D6 6 2(3) 2(3)
6mm C6v 6 m(3) m(3)
m2D3h m(3) 2(3)
6 六方晶系
6/mmm D6h
6/mmm
c [111] [110]
23 T 2(3) 3(4)
m T h (4)
m
432 O 4(3) 3(4) 2(6)
3m T d 3(3) 3(4) m(6)
7 立方晶系
m m O h (4)
m m
不同晶系的晶格类型
Lattice Types of Different Crystal Systems
不同晶系的晶格类型
Lattice Types of Different Crystal Systems 三斜
简单立方体心立方面心立方 三斜晶系 立方晶系
简单单斜 底心单斜 简单四方体心四方 单斜晶系 四方晶系
简单正交底心正交交体正交面心正交
正交晶系
六方
三方六方晶系 三方晶系
常见单质的所属晶系
Crystal Systems of Common Elementary Substances
常见单质的所属晶系
Crystal Systems of Common Elementary Substances
单质名称(Name of elementary substance)
元素符号
(Symbol of
element)
晶系
(Crystal
system)
单质名称
(Name of
elementary
substance)
元素符号
(Symbol of
element)
晶系
(Crystal
system)
银 Ag 立方 铂 Pt 立方 砷 As 三方 正交硫 S 正交 金 Au 立方 单斜硫 S 单斜 铋 Bi 三方 三方硫 S 三方 金刚石 C 立方 锑 Sb 三方 石墨 C 六方 硒 Se 六方 铜 Cu 立方 硅 Si 立方 α-铁 Fe 立方 β-锡(白) Sn 四方 镍 Ni 立方 碲 Te 六方 铅 Pb 立方 锌 Zn 六方
常见矿石的名称、分子式与所属晶系
Names, Molecular Formulas and Crystal Systems of Common Ores
常见矿石的名称、分子式与所属晶系
Names, Molecular Formulas and Crystal Systems of Common Ores
名称(Name) 分子式
晶系
(Crystal
名称(Name) 分子式
晶系
(Crystal
(Molecular formula) system) (Molecular formula) system) 硫砷银矿 AgAsS3三方 橙红石 HgO 正交 碲金银矿 Ag3AuTe2立方 辰砂 HgS 六方 溴银盐 AgBr 立方 黑辰砂 HgS 立方 氯银盐 AgCl 立方 硒汞矿 HgTe 立方 辉铜银矿 Ag1.55Cu0.45S-Ⅲ 四方 碲汞矿 HgTe 立方 硫铜银矿 Ag0.93Cu1.07S-Ⅲ 正交 白云石 KAl2[AlSi3O10](OH)2单斜 硒铜银矿 AgCuSe 正交 锂云母 K2Al3Li2[AlSi7O22](OH)4单斜 硫铁银矿 AgFe2S3正交 明矾石 KAl3(SO4)2(OH)6三方 黄碘银矿 AgI 立方 天然钾霞石 KAlSiO4六方 碘银矿 AgI 六方 白榴石 KAlSi2O6四方 辉银矿 Ag2S-Ⅱ 立方 高白榴石 KAlSi2O6立方 深红硫锑银矿 AgSbS3三方 铁白榴石 KAlSi2O6四方 高硒银矿 Ag2Se 立方 微斜长石 KAlSi3O8三斜 碲银矿 Ag2Te-Ⅲ 单斜 高透长石 KAlSi3O8单斜 刚玉 Al2O3三方 正长石 KAlSi3O8单斜 3·2莫来石 3Al2O3·2SiO2正交 钾石膏 K2Ca(SO4)2·2H2O 单斜 2·1莫来石 2Al2O3·SiO2正交 钾盐 KCl 立方 勃姆石 AlO(OH) 正交 羟铁云母 KFe3[AlSi3O10](OH)2单斜 水铝石 AlO(OH) 正交 铁羟铁云母 KFe3[FeSi3O10](OH)2单斜 (三)水铝矿 Al(OH)3单斜 铁透长石 KFeSi3O8单斜 块磷铝矿 AlPO4六方 铁微斜长石 KFeSi3O8三斜 蓝晶石 Al2SiO5三斜 氟金云母 KMg3[AlSi3O10]F2单斜
黄玉 Al2(SiO4)(OH) 正交 金云母 KMg3[AlSi3O10](OH)2单斜 叶蜡石 Al2Si4O10(OH)2单斜 硝石 KNO3正交 地开石 Al2Si2O5(OH)4单斜 单钾芒硝 KS2SO4正交 高岭石 Al2Si2O5(OH)4三斜 锂辉石 LiAl(SiO3)2单斜 珍珠陶土 Al2Si2O5(OH)4单斜 钙铁辉石 LiAl(SiO3)2四方 砷华 As2O3立方 透锂长石 LiAlSi4O10单斜 白砷石 As2O3单斜 高堇青石 Mg2Al3(AlSi5O18) 六方 雄黄矿 AsS 单斜 低堇青石 Mg2Al3(AlSi5O18) 正交 雌黄 As2S3单斜 尖晶石 MgAl2O4立方 黑铋金矿 Au2Bi 立方 镁铝榴石 Mg3Al2Si3O12立方 钡长石 BaAl2Si2O8单斜 菱镁矿 MgCO3三方 毒重石 BaCO3正交 氯镁石 MgCl2三方 菱钡镁石 BaMg(CO3)2三方 镁铬矿 MgCr2O4立方 钡钠长石 BaNaAl4Si4O16正交 氟镁石 MgF2四方 重晶石 BaSO4正交 方镁石 MgO 立方 金绿宝石 BeAl2O4正交 水镁石 Mg(OH)2六方 铍石 BeO 六方 泻盐矿 MgSO4·7H2O 正交 铋华 α-Bi2O3单斜 无水钠镁矾 MgSO4·3Na2SO4单斜 辉铋矿 Bi2S3正交 斜顽火石 MgSiO3单斜 碲铋矿 Bi2Te3三方 原顽火辉石 MgSiO3正交 珍珠云母 CaAl[Al2Si2O10](OH)2单斜 高斜顽火石 MgSiO3三斜 钙长石 CaAl2Si2O8三斜 镁橄榄石 Mg2SiO4正交 钙铝黄长石 Ca2Al2SiO7四方 氟块硅镁石 Mg2SiO4·MgF2正交
钙铝榴石 Ca3Al2Si3O12立方 氟硅镁石 3Mg2SiO4·MgF2正交 硬柱石 CaAl2Si2O7(OH)2·H2O 正交 滑石 Mg3Si4O10(OH)2单斜 钙柱石 Ca4Al6Si6O24CO3四方 镁闪石 Mg7[Si8O22](OH)2单斜 黝帘石 Ca2Al3(SiO4)3OH 正交 直闪石 Mg7[Si8O22](OH)2正交 斜黝帘石 Ca2Al3(SiO4)3OH 单斜 镁钛矿 MgTiO3三方 硬硼钙石 CaB3O4(OH)3·H2O 单斜 锰印度石 Mn2Al3(AlSi5O18) 六方 赛黄晶 CaB2Si2O8正交 锰尖晶石 MnAl2O4立方 方解石 CaCO3三方 斜煌岩 Mn2Al2Si3O12立方 球霰石 CaCO3六方 菱锰矿 MnCO3三方 霰石 CaCO3正交 氯锰矿 MnCl2三方 铁黄长石 Ca2Fe2SiO7四方 锰磁铁矿 MnFe2O4立方 钙铬榴石 Ca3Fe2Si3O12立方 锰铁橄榄石 MnFeSiO4正交 萤石 CaF2立方 锰三斜辉石 MnFe(SiO3)2三斜 钙铁辉石 CaFe(SiO3)2单斜 方锰矿 MnO 六方 钙铁榴石 Ca3Fe2Si3O12立方 软锰矿 MnO2四方 钙铁橄榄石 CaFeSiO4正交 方铁锰矿 Mn2O3立方 铁透闪石 Ca2Fe5[Si8O22](OH)2单斜 黑锰矿 Mn3O4四方 钙镁电气石 CaMg4Al5B3Si6O27(OH)4三方 硫锰矿 MnS 立方 白云石 CaMg(CO3)2三方 方硫锰矿 MnS2立方 透辉石 CaMg(SiO3)2单斜 蔷薇辉石 MnSiO3三斜 钙镁橄榄石 CaMgSiO4正交 锰橄榄石 Mn2SiO4正交 镁黄长石 Ca2MgSi2O7四方 红钛锰矿 MnTiO3三方 氟透闪石 Ca2Mg5[Si8O22]F2单斜 钼华 MoO3正交
锰钙辉石 CaMn(SiO3)2单斜 辉钼矿 MoS2六方 钙蔷薇辉石 CaMn(SiO3)2三斜 钨锰矿 MnWO4单斜 钙锰橄榄石 CaMnSiO4正交 铵矾 (NH4)2SO4正交 钼钨钙矿 CaMoO4四方 钠云母 NaAl2[AlSi3O10](OH)2单斜 针钠钙石 Ca2NaH(SiO3)3三斜 冰晶石 Na3AlF6单斜 石灰 CaO 立方 钠明矾石 NaAl3(SO4)2(OH)6三方 羟钙石 Ca(OH)2六方 硬玉 NaAl(SiO3)2单斜 碳酸磷灰石 Ca10(PO4)6CO3·H2O 六方 低霞石 NaAlSiO4六方 氯磷灰石 Ca5(PO4)3Cl 六方 高三斜霞石 NaAlSiO4立方 氟磷灰石 Ca5(PO4)3F 六方 低钠长石 NaAlSi3O8三斜
高钠长石/歪长
NaAlSi3O8三斜 羟磷灰石 Ca5(PO4)3OH 六方
石
陨硫钙石 CaS 立方 钠柱石 Na4Al3Si9O24Cl 四方 硬石膏 CaSO4正交 方沸石 NaAlSi2O6·H2O 立方 石膏 CaSO4·2H2O 单斜 钠沸石 Na2Al2Si3O10·2H2O 正交 硅灰石 CaSiO3 三斜 硼砂 Na2B4O7·10H2O 单斜 假银星石 CaSiO3 三斜 四水硼砂 Na2B4O7·4H2O 单斜 钙橄榄石 Ca2SiO4正交 钠铝黄长石 NaCaAlSi2O7四方 钙钛矿 CaTiO3正交 碳酸钠钙石 Na2Ca2(CO3)3正交 榍石 CaTiSiO5单斜 氟浅闪石 NaCa2Mg5[AlSi7O22]F2单斜 钙钒榴石 Ca3V2Si3O12立方 氟碱锰闪石 Na2CaMg5[Si8O22]F 单斜 白钨矿 CaWO4四方 岩盐 NaCl 立方 锌黄长石 Ca2ZnSiO7四方 氟盐 NaF 立方
菱镉矿 CdCO3三方 钠闪石 Na2Fe3Fe2[Si8O22](OH)2单斜 方镉石 CdO 立方 绿辉石(霓石) NaFe(SiO3)2单斜 硫镉矿 CdS 六方 镁电气石 NaMg3Al6B3Si6O27(OH)4三方 方硫镉矿 CdS 立方 氟镁钠石 NaMgF3正交 镉硒矿 CdSe 六方 钠硝石 NaNO3三方 方铈矿 CeO2立方 镁钠闪石 Na2mg3Fe2[Si8O22](OH)2单斜 钴方解石 CoCO3三方 蓝闪石Ⅰ Na2mg3Fe2[Si8O22](OH)2单斜 砷钴铁矿 (Co5Fe5)As2正交 蓝闪石Ⅱ Na2mg3Fe2[Si8O22](OH)2单斜 辉砷钴矿 CoAsS 立方 无水芒硝 Na2SO4正交 铁硫砷钴矿 (Co,Fe)AsS 正交 芒硝 Na2SO4·10H2O 单斜 方硫钴矿 CoS2立方 红砷镍矿 NiAs 六方 硫钴矿 Co3S4立方 砷镍矿 NiAs2正交 方硒钴矿 CoSe2立方 辉砷镍矿 NiAsS 立方 钴橄榄石 Co2SiO4正交 镍磁铁矿 NiFe2O4立方 绿铬矿 Cr2O3三方 绿镍矿 NiO 立方 绿松石 CuAl6(PO4)4(OH)8·4H2O 三斜 硫铅镍矿 β-Ni3Pb2S2三方 砷黝铜矿 Cu12As4S13立方 硫镍矿 Ni3S4立方 铜盐 CuCl 立方 方硫镍矿 NiS2立方 黄铜矿 (CuFeS2)CuFeS1.90四方 镍矾 NiSO4·4H2O 四方 方黄铜矿 CuFe2S3正交 镍橄榄石 Ni2SiO4正交 高斑铜矿 Cu5FeS4立方 碲镍矿 NiTe2六方 低斑铜矿 Cu5FeS4四方 白铅矿 PbCO3正交 透视石 CuH2SiO4三方 氯铅矿 PbCl2正交
碘铜矿 CuI 立方 氟氯铅矿 PbFCl 四方 铜硝石 Cu2(NO3)(OH)3正交 钼铅矿 PbMoO4四方 黑铜矿 CuO 单斜 正方铅矿 PbO 四方 赤铜矿 Cu2O 立方 铅黄 PbO 正交 褐铜矾 Cu2O(SO4) 单斜 铅丹(红铅) Pb3O4四方 孔雀石 Cu2(OH)2CO3单斜 方铅矿 PbS 立方 蓝铜矿 Cu3(OH)2(CO3)2单斜 硫酸铅矿 PbSO4正交 蓝辉铜矿
Cu1.79S 立方 硒铅矿 PbSe 立方 (富铜)
铜蓝矿 CuS 六方 碲铅矿 PbTe 立方 高蓝辉铜矿 Cu2S-Ⅰ 立方 钨铅矿 PbWO4四方 辉铜矿 Cu2S-Ⅲ 正交 砷铂矿 PtAs2立方 胆矾 CuSO4·5H2O 三斜 硫铂矿 PtS 四方 黝铜矿 Cu12Sb4S13立方 硫钌锇矿 RuS2立方 硒铜矿 Cu2Se 立方 方锑矿 Sb2O3立方 红硒铜矿 Cu3Se2四方 锑华 Sb2O3正交 蓝硒铜矿 CuSe 六方 黄锑矿 Sb2O4立方 铁印度石 Fe2Al3(AlSi5O18) 六方 辉锑矿 Sb2S3正交 铁堇青石 Fe2Al3(AlSi5O18) 正交 石膏岩 SeO2四方 铁尖晶石 FeAl2O4立方 α-方英石 SiO2四方 贵榴石 Fe3Al2Si3O12立方 β-方英石 SiO2立方 砷铁矿 FeAs2正交 热液石英 SiO2四方 菱铁矿 FeCO3三方 β-鳞石英 SiO2六方
陨氯铁 FeCl2三方 锡石 SiO2四方 陨硫铬铁 FeCrS4立方 硫锡矿 SnS 正交 黑钨矿 Fe·5Mn·5WO4单斜 菱锶矿 SrCO3正交 硫镍铁矿 Fe5.25Ni3.75S8立方 天青石 SrSO4正交 硫镍铁矿 Fe4.75Ni5.25S8立方 付黄碲矿 TeO2四方 紫硫镍矿 FeNi2S4立方 方钍石 ThO2立方 方铁矿 Fe0.953O 立方 钍石 ThSiO4四方 赤铁矿 Fe2O3三方 金红石 TiO2四方 磁铁矿 Fe3O4立方 锐钛矿 TiO2四方 硫铁矿 FeS 六方 板钛矿 TiO2正交 硫铁矿 Fe3S4立方 沥青铀矿 UO2立方 黄铁矿 FeS2 立方 水硅铀矿 USiO4四方 磁黄铁矿 Fe0.98S 六方 硫钨矿 WS2六方 磁黄铁矿 Fe0.885S 六方 磷钇矿 YPO4四方 水绿矾 FeSO4·7H2O 单斜 锌尖晶石 ZnAl2O4立方 硒铁矿 FeSe2正交 菱锌矿 ZnCO3三方 斜铁辉石 FeSiO3单斜 红锌矿 ZnO 六方 正铁辉石 FeSiO3正交 闪锌矿 ZnS 立方 铁橄榄石 Fe2SiO4正交 纤锌矿 ZnS 六方 铁滑石 Fe3Si4O10(OH)2单斜 锌矾 ZnSO4正交 铁闪石 Fe7[Si8O22](OH)2单斜 皓矾 ZnSO4·7H2O 正交 碲铁矿 FeTe2正交 方硒锌矿 ZnSe 立方 钛铁矿 FeTiO3三方 硅锌矿 Zn2SiO4三方
钨铁矿 FeWO 4 单斜 钨锌矿 ZnWO 4 单斜 低二氧化锗 GeO 2 四方 斜锆石 ZrO 2 单斜 高二氧化锗
GeO 2
六方
锆石
ZrSiO 4
四方
正多面体的数学和结晶学参数
Mathematic and Crystallographic Parameters of Regular Polyhedrons
正多面体的数学和结晶学参数
Mathematic and Crystallographic Parameters of Regular Polyhe
正多面体名称 (Name of regular polyhedron) 正四面体(Regular tetrahedron)
正六面体(Regular hexahedron)
正八面体(Regular octahedron)
正十二面体 (Regular dodecahedron)
正二十面体 (Regular icosahedron)
图形符号 T O O I I 面形 正三角形 正方形 正三角形 正五边形 正三角形 正三面角 正三面角 直三面角 正四面角 正三面角 正五面角 面数? 4 6 8 12 20 棱数k 6 12 12 30 30 顶点数e 4 8 6 20 12 顶点到中心距离d 0.5443a 0.8660a 0.7071a 1.4103a 0.95105a 棱长a (顶点到中心距离d )
1.8472 1.1547 1.4142 0.7091 1.0515 表面积S 多面体 1.7321a 2 6a 2
3.4641a 2 20.6458a 2 8.6603a 2 体积V 多面体 0.1179a 3 a 3
0.4714a 3 7.6631a 3 2.1817a 3 外接球表面积S 外接球 3.7229a 2 9.4242a 2 6.2831a 2 24.9938a 2 11.3662a 2 外接球体积V 外接球 1.2410a 3 2.7205a 3 1.4809a 3 11.7496a 3 3.6033a 3 中心原子半径r 0.0443a 0.3660a 0.2071a 0.9103a 0.45105a 配位原子半径R
0.5a 0.5a 0.5a 0.5a 0.5a r /R 0.0886 0.7320 0.4142 1.8206 0.9021 R /r 11.2867
1.3661
2.4142
0.5493
1.1085
点群符号 m 3m m 3m
对称要素
∧ = 90° ∧ = 90° ∧= 90°
∧= 63.43° ∧= 63.43° ∧ = 70.53° ∧= 70.53° ∧= 70.53° ∧= 41.81° ∧= 41.81° ∧= 19.47° ∧= 28.97°
∧= 28.97° ∧= 36° ∧= 36° - ∧= 19.47°
∧= 19.47°
∧= 37.38° ∧= 37.38° - ∧= 45° ∧= 45° ∧= 31.72° ∧= 31.72° 相邻对称轴之间的夹
角
-
∧= 34.88°
∧= 34.88°
∧= 20.90°
∧= 20.90°
晶体学基础与晶体结构习题与答案 1. 由标准的(001)极射赤面投影图指出在立方晶体中属于[110]晶带轴的晶带,除了已在图2-1中标出晶面外,在下列晶面中哪些属于[110]晶带?(1-12),(0-12),(-113),(1-32),(-221)。 图2-1 2. 试证明四方晶系中只有简单立方和体心立方两种点阵类型。 3. 为什么密排六方结构不能称作为一种空间点阵? 4. 标出面心立方晶胞中(111)面上各点的坐标。 5. 标出具有下列密勒指数的晶面和晶向:a)立方晶系(421),(-123),(130),[2-1-1],[311]; b)六方晶系(2-1-11),(1-101),(3-2-12),[2-1-11],[1-213]。 6. 在体心立方晶系中画出{111}晶面族的所有晶面。 7. 在立方晶系中画出以[001]为晶带轴的所有晶面。 8. 已知纯钛有两种同素异构体,密排六方结构的低温稳定的α-Ti和体心立方结构的高温稳定的β-Ti,其同素异构转变温度为882.5℃,使计算纯钛在室温(20℃)和900℃时晶体中(112)和(001)的晶面间距(已知aα20℃=0.29506nm,cα20℃=0.46788nm,aα900℃=0.33065nm)。 9. 试计算面心立方晶体的(100),(110),(111),等晶面的面间距和面致密度,并指出面间距最大的面。 10.平面A在极射赤平面投影图中为通过NS及核电0°N,20°E的大圆,平面B的极点在30°N,50°W处,a)求极射投影图上两极点A、B间的夹角;b)求出A绕B顺时针转过40°的位置。 11. a)说明在fcc的(001)标准极射赤面投影图的外圆上,赤道线上和0°经线上的极点的指数各有何特点,b)在上述极图上标出(-110),(011),(112)极点。 12. 图2-2为α-Fe的x射线衍射谱,所用x光波长λ=0.1542nm,试计算每个峰线所对应晶面间距,并确定其晶格常数。 图2-2 13. 采用Cu kα(λ=0.15418nm)测得Cr的x射线衍射谱为首的三条2θ=44.4°,64.6°和81.8°,若(bcc)Cr的晶格常数a=0.28845nm,试求对应这些谱线的密勒指数。
竞赛要求: 初赛要求:晶体结构。晶胞。原子坐标。晶格能。晶胞中原子数或分子数的计算及与化学式的关系。分子晶体、原子晶体、离子晶体和金属晶体。配位数。晶体的堆积与填隙模型。常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。 决赛要求:晶体结构。点阵的基本概念。晶系。宏观对称元素。十四种空间点阵类型。 第七章晶体学基础 Chapter 7. The basic knowledge of crystallography §7.1 晶体结构的周期性和点阵 (Periodicity and lattices of crystal structures) 一、.晶体 远古时期,人类从宝石开始认识晶体。红宝石、蓝宝石、祖母绿等晶体以其晶莹剔透的外观,棱角分明的形状和艳丽的色彩,震憾人们的感官。名贵的宝石镶嵌在帝王的王冠上,成为权力与财富的象征,而现代人类合成出来晶体,如超导晶体YBaCuO、光学晶体BaB2O4、LiNbO3、磁学晶体NdFeB等高科技产品,则推动着人类的现代化进程。 世界上的固态物质可分为二类,一类是晶态,一类是非晶态。自然界存在大量的晶体物质,如高山岩石、地下矿藏、海边砂粒、两极冰川都是晶体组成。人类制造的金属、合金器材,水泥制品及食品中的盐、糖等都属于晶体,不论它们大至成千万吨,小至毫米、微米,晶体中的原子、分子都按某种规律周期性地排列。另一类固态物质,如玻璃、明胶、碳粉、塑料制品等,它们内部的原子、分子排列杂乱无章,没有周期性规律,通常称为玻璃体、无定形物或非晶态物质。 晶体结构最基本的特征是周期性。晶体是由原子或分子在空间按一定规律周期重复排列构成的固态物质,具有三维空间周期性。由于这样的内部结构,晶体具有以下性质: 1、均匀性:一块晶体内部各部分的宏观性质相同,如有相同的密度,相同的化学组成。晶体的均匀性来源于晶体由无数个极小的晶体单位(晶胞)组成,每个单位里有相同的原子、
三极管的工作原理集团标准化工作小组 #Q8QGGQT-GX8G08Q8-GNQGJ8-MHHGN#
项目一三极管的工作原理 三极管,全称应为半导体三极管,也称晶体管、晶体三极管,是一种电流控制电流的半导体器件其作用是把微弱信号放大成辐值较大的电信号,也用作无触点开关。晶体三极管,是半导体基本元器·件之一,具有电流放大作用,是电子电路的核心元件。三极管是在一块半导体基片上制作两个相距很近的PN结,两个PN结把整块半导体分成三部分,中间部分是基区,两侧部分是发射区和集电区,排列方式有PNP和NPN两种。三极管是电流放大器件,有三个极,分别叫做集电极C,基极B,发射极E。分成NPN 和PNP两种。我们仅以NPN三极管的共发射极放大电路为例来说明一下三极管放大电路的基本原理。下图是各种常用三极管的实物图和符号。 一、三极管的电流放大作用 下面的分析仅对于NPN型硅三极管。如上图所示,我们把从基极B流至发射极E的电流叫做基极电流Ib;把从集电极C流至发射极E的电流叫做集电极电流 Ic。这两个电流的方向都是流出发射极的,所以发射极E上就用了一个箭头来表示电流的方向。三极管的放大作用就是:集电极电流受基极电流的控制(假设电源能够提供给集电极足够大的电流的话),并且基极电流很小的变化,会引起集电极电流很大的变化,且变化满足一定的比例关系:集电极电流的变化量是基极电流变化量的β倍,即电流变化被放大了β倍,所以我们把β叫做三极管的放大倍数(β一般远大于1,例如几十,几百)。如果我们将一个变化的小信号加到基极跟发射极之间,这就会引起基极电流Ib的变化,Ib的变化被放大后,导致了Ic很大的变化。如果集电极电流Ic是流过一个电阻R的,那么根据电压计算公式 U=R*I 可以算得,这电阻上电压就会发生很大的变化。我们将这个电阻上的电压取出来,就得到了放大后的电压信号了。 二、三极管的偏置电路 三极管在实际的放大电路中使用时,还需要加合适的偏置电路。这有几个原因。首先是由于三极管BE结的非线性(相当于一个二极管),基极电流必须在输入电压大到一定程度后才能产生(对于硅管,常取)。当基极与发射极之间的电压小于时,基极电流就可以认为是0。但实际中要放大的信号往往远比要小,如果不加偏置的话,这么小的信号就不足以引起基极电流的改变(因为小于时,基极电流都是0)。如果我们事先在三极管的基 极上加上一个 合适的电流 (叫做偏置电 流,上图中那 个电阻Rb就 是用来提供这 个电流的,所 以它被叫做基 极偏置电 阻),那么当 一个小信号跟 这个偏置电流 叠加在一起 时,小信号就
几种典型晶体结构的特点分析 徐寿坤 有关晶体结构的知识是高中化学中的一个难点,它能很好地考查同学们的观察能力和三维想像能力,而且又很容易与数学、物理特别是立体几何知识相结合,是近年高考的热点之一。熟练掌握NaCl 、CsCl 、CO 2、SiO 2、金刚石、石墨、C 60等晶体结构特点,理解和掌握一些重要的分析方法与原则,就能顺利地解答此类问题。 通常采用均摊法来分析这些晶体的结构特点。均摊法的根本原则是:晶胞任意位置上的原子如果是被n 个晶胞所共有,则每个晶胞只能分得这个原子的1/n 。 1. 氯化钠晶体 由下图氯化钠晶体结构模型可得:每个Na +紧邻6个- Cl ,每个- Cl 紧邻6个+ Na (上、下、左、右、前、后),这6个离子构成一个正八面体。设紧邻的Na +-a ,每个Na +与12个Na +等距离紧邻(同层4个、上层4个、下层4个),距离为a 2。由均摊法可得:该晶胞中所拥有的Na +数为4216818=?+? ,-Cl 数为44 1 121=?+,晶体中Na +数与Cl -数之比为1:1 2. 氯化铯晶体 每个Cs +紧邻8个-Cl -紧邻8个Cs +,这8个离子构成一个正立方体。设紧邻 的Cs +与Cs +间的距离为 a 2 3 ,则每个Cs +与6个Cs +等距离紧邻(上、下、左、右、前、后)。在如下图的晶胞中Cs +数为812 164112818=+?+?+?,- Cl 在晶胞内其数目为8, 晶体中的+Cs 数与- Cl 数之比为1:1,则此晶胞中含有8个CsCl 结构单元。
3. 干冰 每个CO 2分子紧邻12个CO 2分子(同层4个、上层4个、下层4个),则此晶胞中的CO 2分子数为42 1 6818=?+? 。 4. 金刚石晶体 每个C 原子与4个C 原子紧邻成键,由5个C 原子形成正四面体结构单元,C-C 键的夹角为'28109?。晶体中的最小环为六元环,每个C 原子被12个六元环共有,每个C-C 键被6个六元环共有,每个环所拥有的C 原子数为211216=?,拥有的C-C 键数为16 1 6=?,则C 原子数与C-C 键数之比为 2:11:2 1 =。 5. 二氧化硅晶体 每个Si 原子与4个O 原子紧邻成键,每个O 原子与2个Si 原子紧邻成键。晶体中的
第一章晶体结构 在自然界的固态物质中,具有规则几何外形的晶体很早就引起了人们的关注,尽管目前对非晶态物质的研究日趋活跃,但迄今为止,人们对固体的了解大部分来自对晶体的研究。本章主要讨论晶体中原子排列的几何特征,并简要地介绍X射线衍射的原理和方法。 §1.1晶体的共性 如果将大量的原子聚集到一起构成固体,那么显然原子会有无限多种不同的排列方式。而在相应于平衡状态下的最低能量状态,则要求原子在固体中有规则地排列。若把原子看作刚性小球,按物理学定律,原子小球应整齐地排列成平面,又由各平面重叠成规则的三维形状的固体。 人们很早就注意一些具有规则几何外形的固体,如岩盐、石英等,并将其称为晶体。显然,这是不严格的,它不能反映出晶体内部结构本质。事实上,晶体在形成过程中,由于受到外界条件的限制和干扰,往往并不是所有晶体都能表现出规则外形;一些非晶体,在某些情况下也能呈现规则的多面体外形。因此,晶体和非晶体的本质区别主要并不在于外形,而在于内部结构的规律性。迄今为止,已经对五千多种晶体进行了详细的X射线研究,实验表明:组成晶体的粒子(原子、离子或分子)在空间的排列都是周期性的有规则的,称之为长程有序;而非晶体内部的分布规律则是长程无序。 各种晶体由于其组分和结构不同,因而不仅在外形上各不相同,而且在性质上也有很大的差异,尽管如此,在不同晶体之间,仍存在着某些共同的特征,主要表现在下面几个方面。1.自范性 晶体物质在适当的结晶条件下,都能自发地成长为单晶体,发育良好的单晶体均以平面作为它与周围物质的界面,而呈现出凸多面体。这一特征称之为晶体的自范性。
2. 晶面角守恒定律 由于外界条件和偶然情况不同,同一类型的晶体,其外形不尽相同。图1-1-1给出理想石英晶体的外形,图1-1-2是一种人造的石英晶体,表明由于外界条件的差异,晶体中某组晶面可以相对地变小、甚至消失。所以,晶体中晶面的大小和形状并不是表征晶体类型的固 有特征。 那么,由晶体内在结构所决定的晶体外形的固有特征是什么呢?实验表明:对于一定类型的晶体来说,不论其外形如何,总存在一组特定的夹角,如石英晶体的m 与m 两面夹角为60°0′,m 与R 面之间的夹角为38°13′,m 与r 面的夹角为38°13′。对于其它品种晶体,晶面间则有另一组特 征夹角。这一普遍规律称为晶面角守恒定律,即同一种晶体在相同的温度和压力下,其对应晶面之间的夹角恒定不变。 3. 解理性 当晶体受到敲打、剪切、撞击等外界作用时,可有沿某一个或几个具有确定方位的晶面 图1-1-1 理想石英晶体 图1-1-2 一种人造石英
2.4 放大电路的组成及工作原理 参考教材:《模拟电子技术基础》孙小子张企民主编西安:西安电子科技大学出版社 一、教学目标及要求 1、通过本次课的教学,使学生了解晶体管组成的基本放大电路的三种类型, 掌握放大电路的组成元器件及各元器件的作用,理解放大电路的工作原理。 2、通过本节课的学习,培养学生定性分析学习意识,使学生掌握理论结合生 活实际的分析能力。 二、教学重点 1、共发射极放大电路的组成元器件及各元器件作用; 2、共发射极放大电路的工作原理。 三、教学难点 1、共发射极放大电路的组成元器件及各元器件作用; 2、共发射极放大电路的工作原理。 四、教学方法及学时 1、讲授法 2、1个学时 五、教学过程 (一)导入新课 同学们,上节课我们已经学习了晶体管内部载流子运动的特性以及由此引起的晶体管的一些外部特性,比如说晶体管的输入输出特性等,在这里,我要强调一下,我们需要把更多的注意力放在关注晶体管的外部特性上,而没有必要细究内部载流子的特点。由晶体管的输出特性,我们知道,当晶体管的外部工作条件不同时,晶体管可以工作在三个不同的区间。分别为:放大区、截止区、饱和区,其中放大区是我们日常生活中较为常用的一种工作区间。大家是否还记得,晶体管工作在放大区时所需要的外部条件是什么吗(发射结正偏,集电结反偏)?这节课,我们将要进入一个晶体管工作在放大区时,在实际生活中应用的新内容学习。 2.4放大器的组成及工作原理 一、放大的概念 放大:利用一定的外部工具,使原物体的形状或大小等一系列属性按一定的比例扩大的过程。日常生活中,利用扩音机放大声音,是电子学中最常见的放大。其原理框图为: 声音声音 扩音器原理框图 由此例子,我们知道,放大器大致可以分为:输入信号、放大电路、直流电源、输出信号等四部分,它主要用于放大小信号,其输出电压或电流在幅度上得到了放大,输出信号的能量得到了加强。对放大电路的基本要求:一是信号不失真,二是要放大。
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话::: 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞) 中,处于不同位置的微粒在该单元中所占的份额也有 所不同,一般的规律是:顶点上的微粒属于该单元中 所占的份额为18 ,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12 ,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个C l -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的 Cl -围成的空间构型为正八面体。每个N a +周围与其最近且距离相等的Na + 有12个。见图1。 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4 因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。 2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与 一个Cs +距离最近且相等的Cs +有6个。晶胞中平均Cs +个数:1;晶胞中平 均Cl -个数:8×18 = 1。 因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4 个C 原子紧邻,因而整个晶体中无单个分子存在。由共价键构成的最小 环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环 共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6× 112 = 12 ,平均C —C 键数为6×16 = 1。 C 原子数: C —C 键键数 = 1:2; C 原子数: 六元环数 = 1:2。 2.二氧化硅晶体结构与金刚石相似,C 被Si 代替,C 与C 之间插氧,即为SiO 2晶体,则SiO 2晶体中最小环为12环(6个Si ,6个O ), 最小环的平均Si 原子个数:6×112 = 12;平均O 原子个数:6×16 = 1。 即Si : O = 1 : 2,用SiO 2表示。 在SiO 2晶体中每个Si 原子周围有4个氧原子,同时每个氧原子结合2个硅原子。一个Si 原子可形 图 1 图 2 NaCl 晶体 图3 CsCl 晶体 图4 金刚石晶体
绝缘栅场效应晶体管工作原理及特性 场效应管(MOSFET是一种外形与普通晶体管相似,但控制特性不同的半导体器件。它的 输入电阻可高达1015W而且制造工艺简单,适用于制造大规模及超大规模集成电路。场效应管也称为MOS t,按其结构不同,分为结型场效应晶体管和绝缘栅场效应晶体管两种类型。在本文只简单介绍后一种场效应晶体管。 绝缘栅场效应晶体管按其结构不同,分为N沟道和P沟道两种。每种又有增强型和耗尽 型两类。下面简单介绍它们的工作原理。 1、增强型绝缘栅场效应管 2、图6-38是N沟道增强型绝缘栅场效应管示意图。 在一块掺杂浓度较低的P型硅衬底上,用光刻、扩散工艺制作两个高掺杂浓度的N+区, 并用金属铝引出两个电极,称为漏极D和源极S如图6-38(a)所示。然后在半导体表面覆盖 一层很薄的二氧化硅(SiO2)绝缘层,在漏-源极间的绝缘层上再装一个铝电极,称为栅极G 另外在衬底上也引出一个电极B,这就构成了一个N沟道增强型MOS f。它的栅极与其他电 极间是绝缘的。图6-38(b)所示是它的符号。其箭头方向表示由P(衬底)指向N(沟道)。 源极s tiffiG m 引纯 ? N旳道增强型场效应管紡拘示胃图低州沟道壇强型场效应管符号 图6-38 N沟道增强型场效应管 场效应管的源极和衬底通常是接在一起的(大多数场效应管在出厂前已联结好)。从图6-39(a) 可以看出,漏极D和源极S之间被P型存底隔开,则漏极D和源极S之间是两个背靠背的PN结。当栅-源电压UGS=0寸,即使加上漏-源电压UDS而且不论UDS的极性如何,总有一个PN结处于 反偏状态,漏-源极间没有导电沟道,所以这时漏极电流ID - 0。 若在栅-源极间加上正向电压,即UGS> 0,则栅极和衬底之间的SiO2绝缘层中便产生一个垂直于半导体表面的由栅极指向衬底的电场,这个电场能排斥空穴而吸引电子,因而使栅极附近的P型衬底中的空穴被排斥,剩下不能移动的受主离子(负离子),形成耗尽层,同 时P衬底中的电子(少子)被吸引到衬底表面。当UGS数值较小,吸引电子的能力不强时,漏-源极之间仍无导电沟道出现,如图6-39(b)所示。UGS增加时,吸引到P衬底表面层的电子 就增多,当UGS达到某一数值时,这些电子在栅极附近的P衬底表面便形成一个N型薄层, 且与两个N+区相连通,在漏-源极间形成N型导电沟道,其导电类型与P衬底相反,故又称 为反型层,如图6-39(c)所示。UGS越大,作用于半导体表面的电场就越强,吸引到P衬底
学士学位论文 题目方解石晶体结构特征及环境意义 学生 指导教师教授 年级 2007级 专业资源勘查工程 系别资源系 学院地理科学学院 哈尔滨师范大学 2011年5月
方解石晶体学特征及环境意义 摘要:方解石( CaCO3)是分布最广的矿物之一,是碳酸盐岩成岩过程中充填胶结作用最常见和最重要矿物之一,它还是一种非常重要的环境矿物。方解石晶体形貌、结构与化学成分可以反映其成岩流体中的成分、介质温度与压力等,同时,方解石能有效除去废水中的磷,已有研究表明方解石可有效去除水中磷酸盐 ,且成本低廉, 但对它的除磷机理仍存在较大争议, 为此本文总结了方解石去除水中磷酸盐的机理及影响因素为我国水污染的防治提供理论和技术支撑。 关键词:方解石晶体结构除磷环境意义 一、方解石的晶体结构特征 方解石化学式为CaCO3,三方晶系;D63d-R3c;菱面体晶胞:a rh=0.637nm,a=46。07′;z=6;如果转换成六方(双重体心)格子,则:ah=0.499nm,c h=1.706nm;z=6.具体结构特征如下图1: 图1 方解石的晶体结构 二、方解石的形态和颜色 常见完好晶体。形态多种多样,不同聚型达200种以上。主要呈平行[0001]发育的柱状及平行{0001}发育的板状和各种状态的菱面体或复三方偏三角面体。方解石常依(0001)形成接触双晶,更常依(0112)形成聚片双晶,这一聚片双晶纹在解理面上的方位与白云石不同,在自然界,这种聚片双晶的出现,可用以说明方解石形成后,曾遭受地质应力的作用。普通方解石为白色或无色,含有其他颜色亦不少,条痕白色。 方解石的集合体形态也是多种多样的。由片状(板状)或纤维状的方解石,呈平行或近似平行的连生体,分别称为层解石和纤维方解石,如图2-1。还有致密块状(石灰岩)、粒状(大理石)、土状(白垩)及晶簇状等,如图2-2:
1.4 晶向指数和晶面指数 一晶向和晶面 1 晶向 晶向:空间点阵中各阵点列的方向(连接点阵中任意结点列的直线方向)。晶体中的某些方向,涉及到晶体中原子的位置,原子列方向,表示的是一组相互平行、方向一致的直线的指向。 2 晶面 晶面:通过空间点阵中任意一组阵点的平面(在点阵中由结点构成的平面)。晶体中原子所构成的平面。 不同的晶面和晶向具有不同的原子排列和不同的取向。材料的许多性质和行为(如各种物理性质、力学行为、相变、X光和电子衍射特性等)都和晶面、晶向有密切的关系。所以,为了研究和描述材料的性质和行为,首先就要设法表征晶面和晶向。为了便于确定和区别晶体中不同方位的晶向和晶面,国际上通用密勒(Miller)指数来统一标定晶向指数与晶面指数。 二晶向指数和晶面指数的确定 1 晶向指数的确定方法 三指数表示晶向指数[uvw]的步骤如图1所示。 (1)建立以晶轴a,b,c为坐标轴的坐标系,各轴上的坐标长度单位分别是晶胞边长a,b,c,坐标原点在待标晶向上。 (2)选取该晶向上原点以外的任一点P(xa,yb,zc)。 (3)将xa,yb,zc化成最小的简单整数比u,v,w,且u∶v∶w = xa∶yb∶zc。 (4)将u,v,w三数置于方括号内就得到晶向指数[uvw]。 图1 晶向指数的确定方法 图2 不同的晶向及其指数 当然,在确定晶向指数时,坐标原点不一定非选取在晶向上不可。若原点不在待标晶向上,那就需要选取该晶向上两点的坐标P(x1,y1,z1)和Q(x2,y2,z2),然后将(x1-x2),(y1-y2),
(z 1-z 2)三个数化成最小的简单整数u ,v ,w ,并使之满足u ∶v ∶w =(x 1-x 2)∶(y 1-y 2)∶(z 1-z 2)。则[uvw ]为该晶向的指数。 显然,晶向指数表示了所有相互平行、方向一致的晶向。若所指的方向相反,则晶向指数的数字相同,但符号相反,如图3中[001]与[010]。 说明: a 指数意义:代表相互平行、方向一致的所有晶向。 b 负值:标于数字上方,表示同一晶向的相反方向。 c 晶向族:晶体中原子排列情况相同但空间位向不同的一组晶向。用
晶体三极管知识 晶体三极管作为重要的半导体器件,其基本结构和工作原理需要掌握。下面具体介绍。 三极管的基本结构是两个反向连结的pn接面,如图1所示,可有pnp和npn 两种组合。三个接出来的端点依序称为射极( emitter, E )、基极(base, B)和集极(collector, C),名称来源和它们在三极管操作时的功能有关。图中也显示出 npn与pnp三极管的电路符号,射极特别被标出,箭号所指的极为n型半导体, 和二极体的符号一致。在没接外加偏压时,两个pn接面都会形成耗尽区,将中 性的p型区和n型区隔开。 (a) (b) 图1 pnp(a)与npn(b)三极管的结构示意图与电路符号。 三极管的电特性和两个pn接面的偏压有关,工作区间也依偏压方式来分类,这里 我们先讨论最常用的所谓 "正向活性区” (forwad active),在此区EB极间的pn接面维持在正向偏压,而BC极间的pn接面则在反向偏压,通常用作放大器的三极管都以此方式偏压。图2(a)为一pnp三极管在此偏压区的示意图。EB接面的空乏 区由于在正向偏压会变窄,载体看到的位障变小,射极的电洞会注入到基极,基极的电子也会注入到射极;而BC接面的耗尽区则会变宽,载体看到的位障变大,故本身是不导通的。图2(b)画的是没外加偏压,和偏压在正向活性区两种情形 下,电洞和电子的电位能的分布图。 三极管和两个反向相接的pn二极管有什么差别呢?其间最大的不同部分就在 于三极管的两个接面相当接近。以上述之偏压在正向活性区之pnp三极管为例, 射极的电洞注入基极的n型中性区,马上被多数载体电子包围遮蔽,然后朝集电极 方向扩散,同时也被电子复合。当没有被复合的电洞到达BC接面的耗尽区时, 会被此区内的电场加速扫入集电极,电洞在集电极中为多数载体,很快藉由漂移电流到达连结外部的欧姆接点,形成集电极电流IC。IC的大小和BC间反向偏压的大小 关系不大。基极外部仅需提供与注入电洞复合部分的电子流IBrec,与由基极注入 射极的电子流InB? E (这部分是三极管作用不需要的部分) 。InB? E在射极与与电 洞复合,即InB? E=I Erec o pnp三极管在正向活性区时主要的电流种类可以清楚地在图3(a)中看出。
湖北省高等教育自学考试课程考试大纲 课程名称:结晶学和矿物学课程代码:08926 第一部分课程性质与目标 一、课程性质与特点 “结晶学及矿物学”是地质、材料、珠宝等专业的专业基础课。该课程的性质特点是:理论性强,同时又具有实践性。在“结晶学”中,空间抽象概念多,因此理性思维很重要,但又要通过实践来建立空间概念;在“矿物学”中,各矿物具体特征多,因此归纳类比思维很重要,同时要通过实践认识矿物的各种物理现象及其内在联系。 二、课程目标与基本要求 结晶学目标:掌握有关晶体对称的基础理论,基本要求:学会从晶体的宏观形态分析晶体的对称及晶体定向、单形名称及符号;矿物学目标:掌握矿物成分、结构、形态、物性、成因、用途的基础知识及其它们之间的相互联系,重点掌握三十种左右常见矿物的鉴定特征,基本要求:掌握肉眼鉴定矿物的技能,学会对一些矿物物理现象进行成因理论分析。三、与本专业其他课程的关系 该课程是专业基础课。该课程以“数学”“物理”“化学”“普通地质学”课程为基础,该课程又是后续的“岩石学”“宝石学”等的基础。 第二部分考核内容与考核目标 第一单元结晶学(第一章~第十章) 第一章晶体及结晶学 (一)重点:深入理解晶体的定义,理解晶体的基本性质。 识记:晶体的概念;理解:晶体概念中格子构造的含义;应用:从晶体结构中画出空间格子的方法。 识记:晶体的六大基本性质;理解:晶体基本性质与格子构造的关系;应用:从
格子构造分析某一基本性质的成因。 (二)次重点:理解空间格子要素及其性质。 识记:结点、行列、面网、最小平行六面体的概念;理解:相互平行的行列、面网上结点间距的关系,面网间距与面网密度的关系;应用:最小平行六面体的形状与晶胞参数的关系。 第二章晶体的测量与投影 (一)重点:面角守恒定律及其意义, 识记:面角守恒定律;理解:面角守恒定律的内因;应用:面角守恒定律的意义。 (三)一般:极射赤平投影的原理,利用吴氏网进行晶体投影。 识记:投影球、投影面、投影轴、极距角、方位角的概念;理解:投影球、投影面、投影轴、极距角、方位角的空间关系和含义;应用:利用极距角、方位角在吴氏网进行晶体投影。 第三章晶体的宏观对称 (一)重点:熟练掌握对称面、对称轴、对称中心和旋转反伸轴,理解对称要素的组合定律,熟练掌握晶体对称分类体系。 识记:对称面、对称轴、对称中心和旋转反伸轴的概念,对称型的概念;理解:能熟练地确定对称型及晶系;应用:能运用对称要素组合定律判断对称型对否。 (三)一般:理解晶体对称的特点。理解晶体的对称定律。 识记:晶体对称的3 个特点,理解:晶体对称特点的含义。 识记:晶体的对称定律的概念;理解:能用几何图形说明晶体的对称定律。 第四章晶体定向与结晶符号 (一)重点:熟练掌握晶体定向的原则、各晶系晶体定向方法和晶体常数特点。掌握一些重要对称型的国际符号及其与对称型的一般符号(全面符号)的转换。掌握晶面的米氏符号。 识记:晶体定向的原则、各晶系晶体定向方法和晶体常数特点;理解:能熟练地确定对称型、晶系后进行晶体定向。 识记:对称型的国际符号的书写方法;理解:各晶系对称型国际符号三个序号位对应的方向;应用:国际符号与一般符号(全面符号)的转换。 识记:晶面米氏符号的表示方法;理解:能从坐标系中确定某晶面的米氏符号。 (二)次重点:理解整数定律的含义。
单结晶体管工作原理 双基极二极管又称为单结晶体管,它的结构如图1所示。在一片高电阻率的N型硅片一侧的两端各引出一个电极,分别称为第一基极B1和第二基极B2。而在硅片是另一侧较靠近B2处制作一个PN结,在P型硅上引出一个电极,称为发射极E。两个基极之间的电阻为RBB,一般在2~15kW之间,RBB一般可分为两段,RBB = RB1+ RB2,RB1是第一基极B1至PN结的电阻;RB2是第一基极B2至PN结的电阻。双基极二极管的符号见图1的右侧。 图 1 双基极二极管的结构与符号等效电路 将双基极二极管按图2(a)接于电路之中,观察其特性。首先在两个基极之间加电压UBB,再在发射极E和第一基极B1之间加上电压UE,UE可以用电位器RP进行调节。这样该电路可以改画成图2(b)的形式,双基极二极管可以用一个PN结和二个电阻RB1、RB2组成的等效电路替代。 当基极间加电压UBB时,RB1上分得的电压为 式中称为分压比,与管子结构有关,约在0.5~0.9之间。
2.当UE=UBB+UD时,单结晶体管内在PN结导通,发射极电流IE突然增大。把这个突变点称为峰点P。对应的电压UE和电流IE分别称为峰点电压UP和峰点电流IP。显然,峰点电压 Up=UBB+UD T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 式中UD为单结晶体管中PN结的正向压降,一般取UD=0.7V。T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 在单结晶体管中PN结导通之后,从发射区(P区)向基压(N区)发射了大量的空穴型载流子,IE增长很快,E和B1之间变成低阻导通状态,RB1迅速减小,而E和B1之间的电压UE也随着下降。这一段特性曲线的动态电阻为负值,因此称为负阻区。而B2的电位高于E的电位,空穴型载流子不会向B2运动,电阻RB2基本上不变。T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 当发射极电流IE增大到某一数值时,电压UE下降到最低点。特性由线上的这一点称为谷点V。与此点相对应的是谷点电压UV和谷点电流IV。此后,当调节RP使发射极电流继续增大时,发射极电压略有上升,但变化不大。谷点右边的这部分特性称为饱和区。T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 综上所述,单结晶体管具有以下特点:T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 (1)当发射极电压等于峰点电压UP时,单结晶体管导通。导通之后,当发射极电压小于谷点电压UV时,单结晶体管就恢复截止。T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 (2)单结晶体管的峰点电压UP与外加固定电压UBB及其分压比有关。而分压比是由管子结构决定的,可以看做常数。T58838电子-技术资料-电子元件-电路图-技术应用网站-基本知识-原理-维修-作用-参数-电子元器件符号-各种图纸 对于分压比不同的管子,或者外加电压UBB的数值不同时,峰值电压UP也就不同。(3)不同单结晶体管的谷点电压UV和谷点电流IV都不一样。谷点电压大约在2~5V之间。
《结晶学基础》第七章习题 7001 试说明什么是单晶?什么是多晶? 7002 有一AB晶胞,其中A和B原子的分数坐标为A(0,0,0),B(1/2,1/2,1/2),属于:------------------------------------ ( ) (A) 立方体心点阵 (B) 立方面心点阵 (C) 立方底心点阵 (D) 立方简单点阵 7004 从CsCl 晶体中能抽出________点阵,结构基元是________,所属晶系的特征对称元素是________。 7005 某AB 型晶体属立方ZnS 型,请回答下列问题: (1) 从该晶体中可抽取出什么空间点阵? (2) 该晶体的结构基元为何? (3) 正当晶胞中含有几个结构基元? (4) 应写出几组B 原子的分数坐标? (5) 晶胞棱长为a,求在C3轴方向上A—A 最短距离; (6) 晶胞棱长为a,求在垂直C4轴的方向上B-B 最短距离。 7007 有一个A1 型立方面心晶体,试问一个立方晶胞中可能含有多少个A 和多少个B。7010 点阵参数为432 pm的简单立方点阵中,(111),(211)和(100)点阵面的面间距离各是多少? 7011 从某晶体中找到C3,3C2,σh,3σd等对称元素,该晶体属________晶系是_____点群。7012 7013 7014 属于立方晶系的点阵类型有________________,属于四方晶系的点阵类型有____________。
7015 晶体宏观外形中的对称元素可有________,________,________,______四种类型;晶 体微观结构中的对称元素可有________,________,________,________, ________, ________,______七种类型;晶体中对称轴的轴次(n )受晶体点阵结构的制约,仅限于 n =_________;晶体宏观外形中的对称元素进行一切可能的组合,可得________个晶体学点 群;分属于________个晶系,这些晶系总共有________种空间点阵型式,晶体微观结构中的 对称元素组合可得________个空间群。 7016 某一晶体,其空间群为94D -I 422,试给出: (1) 该晶体所属晶系; (2) 所属点阵类型; (3) 所属点群; (4) 晶胞形状特征。 7017 一晶体属于空间群P 2/c , (1) 给出该晶体所属晶系和点阵类型; (2) 给出该晶体所属点群的熊夫利记号; (3) 写出该晶体所具有的独立的宏观对称元素和派生的宏观对称元素。 7018 给出在三个坐标轴上之截距分别为 (2a ,3b ,c ) , (a ,b ,c ) , (6a ,3b ,3c ) , (2a , -3b ,-3c )的点阵面的指标。 7019 写出晶体中可能存在的全部宏观对称元素。 7020 试写出立方晶系和单斜晶系的特征对称元素。 7021 现有两种晶体,实验测得这两种晶体的空间群分别为172h D -C m c m 1222和42 d D -P 421c ,指出晶体所属的晶系分别为___________和_________,晶体的点阵类型分别为____________ 和____________, 这两种晶体的全部宏观对称元素分别为____________和____________。 7022 晶体的宏观对称操作集合构成____________个晶体学点群; 晶体的微观对称操作集合 构成____________个空间群。 7023 没有四方F 和四方C ,因为四方F 可以化为___________, 四方C 可以化为 _________。 7025 立方晶系的晶体可能属于哪些点群? 7026 与a 轴垂直的面的晶面指标是:----------------------------------- ( ) (A) (112) (B) (100)
第六章 晶格动力学 6.1 密度泛函微扰理论 固体物理性质的变化依赖于他们的晶格动力学行为:红外、拉曼和中子散射谱;比热,热膨胀和热导;和电声子相互作用相关的现象如金属电阻,超导电性和光谱的温度依赖关系是其中的一部分。事实上,借助于声子对这些问题的了解最令人信服地说明了目前固体的量子力学图像是正确的。 晶格动力学的基础理论建立于30年代,玻恩和黄昆1954年的专题论文至今仍然是这个领域的参考教科书。这些早期的系统而确切地陈述主要建立了动力学矩阵的一般性质,他们的对称和解析性质,没有考虑到和电子性质的联系,而实际上正是电子性质决定了他们。直到1970年才系统地研究了这些联系。一个系统电子的性质和晶格动力学之间的联系的重要性不仅在原理方面,主要在于通过使用这些关系,才有可能计算特殊系统的晶格动力学性质。 现在用ab initio 量子力学技术,只要输入材料化学成分的信息,理论凝聚态物理和计算材料科学就可以计算特殊材料的特殊性质。在晶格动力学性质的特殊情况下,基于晶格振动的线性响应理论,大量的ab initio 计算在过去十年中通过发展密度泛函理论已经成为可能。密度泛函微扰理论是在密度泛函理论的理论框架之内研究晶格振动线性响应。感谢这些理论和算法的进步,现在已经可以在整个布里渊区的精细格子上精确计算出声子色散关系,直接可以和中子衍射数据相比。由此系统的一些物理性质(如比热、熱膨胀系数、能带隙的温度依赖关系等等)可以计算。 1 基于电子结构理论的晶格动力学 从固体电子自由度分离出振动的基本近似是Born-Oppenhermer (1927) 的绝热近似。在这个近似中,系统的晶格动力学性质由以下薛定谔方程的本征值ε和本征函数()ΦR 决定。 ()()()222 2I I I E M εΦΦ???-+= ???? ∑R R R R (6.1.1) 这里I R 是第I 个原子核的坐标,I M 是相应原子核的质量,{}I ≡R R 是所有原子核坐标的集合,()E R 是系统的系统的限位离子能量,常常称为Born-Oppenhermer 能量表面。()E R 是在固定原子核场中运动的相互作用电子系统的基态能量。他们依赖参量R 作用在电子变量上的哈密顿量为 ()()222221 22I BO N i j iI i I i i j Z e e H E m ≠?=-+-+-?-∑∑∑R R r R r r r (6.1.2) 这里I Z 是第I 个原子核的电荷数,e -是电子电荷,()N E R 是不同核之间的静电相互作用: ()2 2 I J N I J I J Z Z e E ≠= -∑ R R R (6.1.3) 系统的平衡几何排布由作用在每一个原子核上为零决定: ()0I I E ?≡-=?R F R (6.1.4) 而振动频率ω由Born-Oppenhermer 能量的Hassian 本征值决定,由原子核的质量标度为: 20ω-= (6.1.5) 这样系统平衡几何排布和振动性质的计算实际是计算Born-Oppenhermer 能量表面的一阶和二阶微分。实现这一目标的基本工具是Hellmann-Feynman 定理:依赖于参数λ哈密顿量H λ本征值的一阶微分由哈密顿量微分的期待值给出: E H λλ λλψψλλ ??=?? (6.1.6) λψ是对应于本征值E λ哈密顿量H λ的本征函数:H E λλλλψψ=。在Born-Oppenhermer 中原子核的坐标作 为方程(2)中电子哈密顿量的参数。在电子基态作用在第I 个原子核上的力为 ()()()()BO I I I E H ψψ??=-=??R R F R R R R (6.1.7) (),ψr R 是Born-Oppenhermer 哈密顿量的电子基态波函数。这个哈密顿量通过电子-离子相互作用依赖 于R ,电子-离子相互作用仅仅通过电子电荷密度耦合到电子自由度。在这种情况下Hellmann-Feynman 定理表述为
典型的晶体结构 1.铁 铁原子可形成两种体心立方晶胞晶体:910℃以下为α-Fe,高于1400℃时为δ-Fe。在这两种温度之间可形成γ-面心立方晶。这三种晶体相中,只有γ-Fe能溶解少许C。问:1.体心立方晶胞中的面的中心上的空隙是什么对称?如果外来粒子占用这个空隙,则外来粒子与宿主离子最大可能的半径比是多少? 2.在体心立方晶胞中,如果某空隙的坐标为(0,a/2,a/4),它的对称性如何?占据该空隙的外来粒子与宿主离子的最大半径比为多少? 3.假设在转化温度之下,这α-Fe和γ-F两种晶型的最相邻原子的距离是相等的,求γ铁与α铁在转化温度下的密度比。 4.为什么只有γ-Fe才能溶解少许的C? 在体心立方晶胞中,处于中心的原子与处于角上的原子是相接触的,角上的原子相互之间不接触。a=(4/3)r。 ①②③ 1.两个立方晶胞中心相距为a,也等于2r+2r h[如图①],这里r h是空隙“X”的半径,a =2r+2r h=(4/3)r r h/r=0.115(2分) 面对角线(2a)比体心之间的距离要长,因此该空隙形状是一个缩短的八面体,称扭曲八面体。(1分) 2.已知体心上的两个原子(A和B)以及连接两个晶体底面的两个角上原子[图②中C和D]。连接顶部原子的线的中心到连接底部原子的线的中心的距离为a/2;在顶部原子下面的底部原子构成晶胞的一半。空隙“h”位于连线的一半处,这也是由对称性所要求的。所以我们要考虑的直角三角形一个边长为a/2,另一边长为a/4[图③],所以斜边为16 /5a。(1分)r+r h=16 /5a=3/5r r h/r=0.291(2分) 3.密度比=42︰33=1.09(2分) 4.C原子体积较大,不能填充在体心立方的任何空隙中,但可能填充在面心立方结构的八面体空隙中(r h/r=0.414)。(2分) 2.四氧化三铁 科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图b所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中正四面体空隙数与O2-数之比为2:1,其中有12.5%正四面体空隙填有Fe3+,有50%正八面体空隙没有被填充。 Fe3O4中三价铁离子:亚铁离子:O原子=2:1:4 晶胞拥有8个正四面体空隙,4个O2-离子;所以2:1 一半三价铁离子放入正四面体空隙,即一个三价铁离子,所以为1/8=12.5%晶胞实际拥有4个正八面体空隙,其中已经有一个放Fe3+,另外一个Fe2+占据一个正八面体空隙,所以50%的正八面体空隙没有被填充。