热原和细菌内毒素资料讲解
- 格式:doc
- 大小:17.00 KB
- 文档页数:4

热原和细菌内毒素的检查方法我呀,就跟您唠唠这热原和细菌内毒素的检查方法。
您可别一听这名字就觉得头疼,其实啊,这里面也有不少有意思的事儿。
先说这热原,热原这东西啊,就像个隐藏在暗处的小捣蛋鬼。
那咋检查它呢?这就有一套法子。
咱得先准备好一些东西,就像准备打仗前得把武器啥的都备好一样。
得有合适的实验动物,这动物啊,那也是精挑细选的,得健康,看着就活蹦乱跳的那种。
把这热原注射到动物体内,然后就盯着这动物的反应,就像盯着一个调皮孩子看他会不会闯祸一样。
要是这动物体温突然升高了,嘿,那热原可能就藏在这儿呢。
再说说细菌内毒素,这细菌内毒素也不是个好惹的主儿。
检查它的方法和热原还有点不一样呢。
咱有一种试剂,那试剂就像个专门抓细菌内毒素的小警察。
把这试剂和可能含有细菌内毒素的东西放一块儿,要是这试剂变色了或者有啥特殊反应了,就像小警察发现了小偷立马拉警报一样,那就说明有细菌内毒素在里面。
我记得有一次啊,我在实验室里看一个小伙子检查热原。
那小伙子啊,眼睛瞪得大大的,死死盯着那实验动物,那神情就像在守护着什么宝贝似的。
我就问他:“小伙子,这么紧张呢?”他转过头来,脸上有点红扑扑的,说:“老师啊,我就怕一个不小心错过啥反应,这热原可不好找呢。
”我就笑着跟他说:“别太担心,按步骤来,总能发现它的踪迹。
”还有一回,是检查细菌内毒素的时候。
有个小姑娘拿着那试剂,手都有点微微颤抖,可能是怕操作不好。
我就走过去拍拍她的肩膀,说:“闺女啊,放轻松,这就跟做饭似的,按照菜谱一步一步来,准没错。
”她听了我的话,深吸一口气,然后就稳稳地操作起来了。
这热原和细菌内毒素的检查方法啊,虽然有点复杂,但只要您用心去了解,就像了解一个老朋友一样,慢慢就会掌握其中的窍门儿了。

细菌内毒素检查法一、细菌内毒素检查法的定义:●本法是利用鲎试剂与细菌内毒素产生凝聚反应的机理,以判断供试品中的细菌内毒素限度是否符合规定的一种方法。
二、背景介绍:●1、细菌内毒素●2、热原●3、鲎1、细菌内毒素●细菌内毒素是一种革兰氏阴性细菌细胞壁的产物,当其死亡或菌体裂解时释放出的一类具有多种生物活性的毒性物质特性:●(1).致热性:内毒素作用人体细胞,使之释放内源性热原,刺激下丘脑体温调节中枢,引起发热反应。
●(2).耐热性:需250度干热30分钟才能彻底灭活。
●(3).分子极性:多糖链亲水,脂肪链疏水,在水中呈不均匀分布。
●(4).鲎反应:能与鲎试剂发生多级酶促反应,形成凝胶。
2、热原2.1热原是指临床上引起哺乳动物发热反应的物质2.2细胞分裂素(IL-1, IL-2, IL-6, IL-8 )内源性热原{产生细胞分裂素的物质内毒素热原外源性热原{非内毒素热原(病毒、细菌、真菌、抗体-抗原复合物、细胞分裂素)2.3热原和内毒素的关系:2.3.1热原是否就是内毒素?在学术上仍有争议,热原不仅是细菌内毒素。
但在药检的范畴,细菌内毒素是主要的热原物质,可以说无内毒素就无热原,控制内毒素就是控制热原。
3、鲎3.1鲎(horseshoe crab)是一类与三叶虫(现在只有化石)一样古老的动物。
鲎的祖先出现在地质历史时期古生代的泥盆纪,当时恐龙尚未崛起,原始鱼类刚刚问世,随着时间的推移,与它同时代的动物或者进化、或者灭绝,而惟独只有鲎从4 亿多年前问世至今仍保留其原始而古老的相貌,所以鲎有“活化石”之称。
又具有很高的药用价值。
3.2鲎试剂鲎的血液中含有铜离子,它的血液是蓝色的。
鲎血液颜色呈蓝色,是因为鲎血浆的主要成分是血蓝蛋白。
这种蓝色血液的提取物——“鲎试剂”。
鲎试剂是由海洋生物鲎的血液提取物制成的“鲎试剂”,能够准确、快速地检测人体是否因细菌感染而致病;鲎试剂在制药行业中,用于检测细菌内毒素。
目前使用的鲎试剂分为美洲鲎试剂和东方鲎鲎试剂两大类。




内毒素知识介绍(2010-01-16 10:00:17)转载分类:精彩推荐展示标签:抗体细胞因子蛋白酶试剂盒信号转导凋亡生化试剂干细胞生物ips细菌内毒素,英文称作Enolotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。
内毒素的主要化学成分为脂多糖中的类脂A细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin 最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。
细菌英文叫Bacteria :为原核生物中的一类单细胞微生物由二分裂法繁殖。
若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。
这两类细菌细胞壁的结构和化学组成存在很大差异。
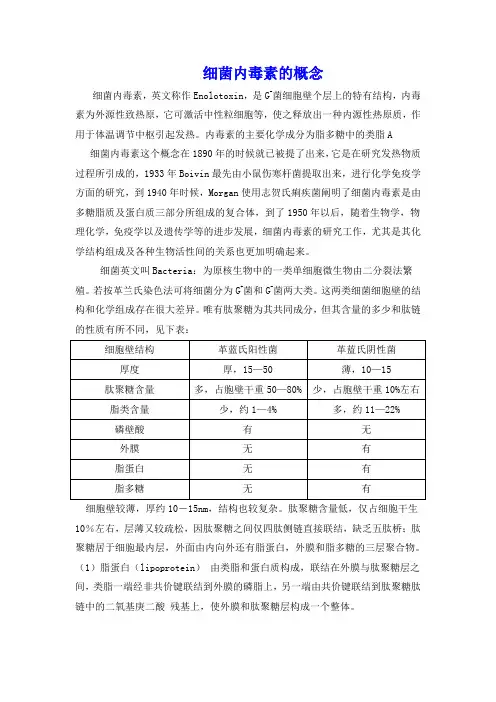
唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:关于细菌细胞壁结构,尤其G+/G-菌不同之处见下图所示:由以上结构模式图可以发现,G+菌与G-菌有不同之处,其中对于G-菌来说:细胞壁较薄,厚约10-15nm,结构也较复杂。
肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。
(1)脂蛋白(lipoprotein)由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸残基上,使外膜和肽聚糖层构成一个整体。
(2)外膜(outer membrane)是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。

细菌内毒素的概念细菌内毒素,英文称作Enolotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。
内毒素的主要化学成分为脂多糖中的类脂A细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。
细菌英文叫Bacteria:为原核生物中的一类单细胞微生物由二分裂法繁殖。
若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。
这两类细菌细胞壁的结构和化学组成存在很大差异。
唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:细胞壁较薄,厚约10-15nm,结构也较复杂。
肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。
(1)脂蛋白(lipoprotein)由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸残基上,使外膜和肽聚糖层构成一个整体。
(2)外膜(outer membrane)是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。
外膜中间有微小孔道,容许水溶性的小分子通过,以进行细胞内外的物质运输和交换。
除此之外,外膜还能防止胰蛋白酶和溶菌酶等进入,起到保护性屏障作用。

内毒素知识介绍(2010-01-16 10:00:17)转载分类:精彩推荐展示标签:抗体细胞因子蛋白酶试剂盒信号转导凋亡生化试剂干细胞生物ips细菌内毒素,英文称作Enolotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。
内毒素的主要化学成分为脂多糖中的类脂A细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin 最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。
细菌英文叫Bacteria :为原核生物中的一类单细胞微生物由二分裂法繁殖。
若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。
这两类细菌细胞壁的结构和化学组成存在很大差异。
唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:关于细菌细胞壁结构,尤其G+/G-菌不同之处见下图所示:由以上结构模式图可以发现,G+菌与G-菌有不同之处,其中对于G-菌来说:细胞壁较薄,厚约10-15nm,结构也较复杂。
肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。
(1)脂蛋白(lipoprotein)由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸残基上,使外膜和肽聚糖层构成一个整体。
(2)外膜(outer membrane)是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。

细菌内毒素计算公式
摘要:
1.细菌内毒素的概念和含义
2.细菌内毒素的来源和生成
3.细菌内毒素的检测方法和计算公式
4.细菌内毒素的危害和应用
5.细菌内毒素的防治措施
正文:
一、细菌内毒素的概念和含义
细菌内毒素(Endotoxin)是一种由细菌产生的外源性致热原,主要存在于G-菌细胞壁的脂多糖成分中。
当细菌死亡解体后,脂多糖成分会被释放,进一步分解为内毒素。
内毒素可以激活中性粒细胞等免疫细胞,导致机体释放出一系列细胞因子,如肿瘤坏死因子、白细胞介素(IL-1)、IL-6、IL-8、前列腺素、凝血素、干扰素、血小板激活因子等。
二、细菌内毒素的来源和生成
细菌内毒素主要来源于G-菌,如大肠杆菌、铜绿假单胞菌等。
这些细菌在生长过程中,其细胞壁中的脂多糖成分会不断生成和释放。
当细菌死亡或受到外界压力时,脂多糖成分会被分解,释放出内毒素。
三、细菌内毒素的检测方法和计算公式
目前,检测细菌内毒素的方法主要有鲎试剂法、凝胶法、比浊法等。
其中,鲎试剂法是最常用的一种方法。
鲎试剂法的计算公式如下:
内毒素含量(EU/ml)=(C×V×1000)/(S×M)
其中,C 为鲎试剂的浓度(IU/ml),V 为供试品的体积(ml),S 为鲎试剂的灵敏度(EU/ml),M 为供试品的质量(g)。
四、细菌内毒素的危害和应用
细菌内毒素在体内过量积累时,会导致发热、低血压、心动过速、休克、多器官功能衰竭甚至死亡。
然而,在适量范围内,细菌内毒素可以激活免疫系统,对机体产生有益作用。
因此,细菌内毒素在医学和科研领域具有广泛的应用。
热原和细菌内毒素
一、热原(progon)
医院临床在使用药品注射剂时,常有发生冷感、寒战、发热、头痛、恶心、
呕吐、肤色灰白、休克、严重时导致死亡,这种症状称为热原反应。
为提高药品质量和用药安全,人们对热原进行了广泛的研究,直到1923年
Seibert提出了用家兔检测热原的方法。在1942年美国药典首先将家兔热原检
查项收入药典成为法定方法,中国药典1953年版开始收载该方法,随后的世界
各国药典都以动物热原检查法作为药品质量监测的方法之一。
家兔热原检查法的优点,可在规定时间里观察到家兔的体温变化,相应反应
了热原质引起哺乳类动物复杂的体温反应过程。所以,在半个多世纪以来热原检
查法,为保障药品质量和用药安全发挥了重要作用。
但随着制药工业的发展和临床用药的要求,该方法的局限性越来越明显。这
种热原检查法,只局限于某种药物进入体内(血循环)是否能引起体温变化或热
原反应作为判断药品是否污染热原的方法,已不能满足医药工业发展的需要。其
缺点:
①标准化程度低,无法判断检查样品中存在的热原质到底是什么或是哪一种
物质。
②由于试验动物家兔是处在被细菌污染的环境中,通过吸入或皮肤感染细菌
内毒素而被免疫,导致动物的个体差异较大。
③试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗
生素、生物制品等),实验结果难以判断。
④设备及实验费用昂贵(如建设动物房、水电、动物饲料等耗费),做一种
药品需要280元/次,而鲎试剂仅28元/次。
综上情况分析,鲎试验法可避免以上动物热原检查法的不足,该技术的成功
和应用真可谓是药品质量监控一场大革命。
什么是热原?目前国内外仍未有统一的认识,但从国内外文献报道中,一个
共同的意见,都普遍认为:它是指细菌内毒素的脂多糖。
欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热
原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。在药
品生产质量管理规范(GMP)条件下,药品生产的质量控制一般可以接受的观点
是:不存在细菌内毒素意味着不存在热原。
二、细菌内毒素(Endotoxin)
细菌内毒素是革兰氏阴性菌细胞壁上的一种脂多糖(Lipoply Saccharide)
和微量蛋白(Protein)的复合物,它的特殊性不是细菌或细菌的代谢产物,而
是细菌死亡或解体后才释放出来的一种具有内毒素生物活性的物质。其化学成分
广泛分布于革兰氏阴性菌(如大肠杆菌、布氏杆菌、伤寒杆菌、变形杆菌、沙门
氏菌等)及其它微生物(如衣原体、立克次氏体、螺旋体等)的细胞壁层的脂多
糖,其化学成份主要是由O-特异性链、核心多糖、类脂A三部分组成。
<一>、O—特异性链:位于脂多糖分子最外层的多糖链,是由3—5个单糖(一
般不多于25个)连成为一个多糖链。其单糖包括戊糖、氨基戊糖、已糖、氨基
已糖、脱氧已糖等,单糖的种类、位置和排列顺序和空间构型,因菌种不同而异。
因此,它决定菌体热原的特异性。
<二>核心多糖:核心多糖的变异性较小,位于类脂A和0—特异性链(内层)
之间,在结构上分为内核心和外核心。外核心含有数种己糖,包括葡萄糖、半乳
糖、乙酰氨基葡萄糖等组成。内核心含有庚糖及特殊的酮糖(3-脱氧-D-甘露糖-
辛酮糖KDO)。这部分结构对不同菌株的LPS基本相似,而且KDO是以不耐酸的
酮糖链与类脂A的氨基葡萄糖连接,是构成内毒素脂多糖的核心部分。
<三>类脂A:位于LPS分子结构的外层,是由氨基葡萄糖、磷酸和脂肪酸(10
—18C)组成,故称之为糖磷脂,也是细菌外膜的一种,形成单体聚合物。具有
疏水性(强)和亲水性(弱)的双相性。但是,类脂A可从O-特异链及核心多
糖分离出来,游离的类脂A可自身凝聚成大分子的复合体而难溶于水,并具有生
物活性。所以,类脂A(Lipida)是内毒素多种生物活性或毒性反应的主要基团。
该基团没有种属特异性,所以各属细菌的类脂A结构相似,其毒性反应相似。如
发热、血液流动力学改变、弥漫性血管内凝血,并导致休克等。(附图2)
由于类脂A有4条主链和2条支链的脂肪酸与内酰胺连接组成,所以提纯的
内毒素LPS是极为不稳定的。这就要求内毒素应在低温条件下保存,在工作中内
毒素稀释应尽可能地缩短时间,并要现配现用。
三、内毒素的生物活性与疾病的相关性
据文献报道,在很早期(约19世纪末)的意大利学者Centanne通过菌属自
溶的方法,从革兰氏阴性杆菌中提取出一种类似毒素的物质,因为这种物质对动
物体产生致热活性的同时,亦产生出一种病理学病性反应,而被命名为致热毒素
(Pyrotoxina)。同时由德国的Buchner也从多种细菌中提取到相似的致热毒素,
并证实了这种毒素在导致白细胞数目的改变同时,具有增强机体对细菌感染时的
免疫能力。因此建立了“发热疗法”。
在美国纽约的临床医师,William B·Coley用加热法杀死录杆菌和化脓性
链球菌,将上清滤液用于各种恶性肿瘤(特别是肉瘤)的治疗,取得较好的疗效。
他将这种细菌上清液命名为Coley氏毒素。此后murrayJ.Shear 证实Coley氏
毒素中具有抗肿瘤作用的物质为内毒素。
直到1933年Boivin等学者在研究鼠伤寒杆菌的致病机理时,从鼠伤寒杆菌
中提取出内毒素。在50年代以后,对内毒素的化学成分和化学结构的研究得到
迅速发展。经过大量实验表明,内毒素具有极强的生物学活性,特别是革兰氏阴
性菌感染和静脉注射提取的内毒素溶液时,可导致动物体发生内毒素休克和死
亡。
内毒素的致病机理,主要是由于革兰氏阴性杆菌(如大肠杆菌、沙门氏杆菌、
伤寒杆菌,布氏杆菌、变形杆菌金黄色葡萄球菌等)和其它微生物(病毒、立克
次氏体、衣原体螺旋体等)感染时,这类菌属随病灶渗液进入血液循环,并扩散
到各种组织器官和体液细胞内繁殖,这类菌属在体内死亡和解体后,才稀放出大
量的细菌内毒素脂多糖(LPS),据初步实验表明,当机体内毒素浓度國值 >
0.005ng/ml时,可诱生内源性热原质如肿瘤坏死因子、白细胞介素和β2—干扰素
等。这些因子刺激体温调节中枢导致机体发热,细菌内毒素直接或间接作用于肝
脏和胰腺时,可使肝细胞损伤,使糖原异生酶(如葡萄糖—6—6磷酸酶、糖原
合成酶)的活性降低,抑制糖原的异生和分解。同时内毒素作用于胰腺导致胰腺
功能障碍,并形成胰岛素抵抗,造成血糖升高致使并发心肌炎和心肌肿大的系列
高血糖症状。所以,革兰氏阴性菌属感染或在病灶中的细菌进入体液细胞繁殖,
当其死亡或解体后产生的内毒素,可多次进入血液,引起反复发作,其病理变化
极为广泛,几乎所有的器官和组织都可被侵犯,而引起各器官的功能障碍。其中
以网状内皮系统最常见,淋巴、脾、肝、肾、骨髓中均有上皮细胞增生,形成肉
芽肿,以肝脏有肉芽肿外,还可发生冲血、水肿和肝细胞坏死,最终导致肝硬化
的发生。其它器官亦有相似的毒性反应。
所以,加强对药品和人体液中的细菌内毒素监测,对确保人体健康具有十分
重要的意义。湛江博康海洋生物有限公司研制的定量鲎试剂和天津大学无线电厂
研制的细菌内毒素检测定系统,为广大医药学科学工作者提供了方便。