仪器分析第5章伏安分析法
- 格式:doc
- 大小:48.01 KB
- 文档页数:11



仪器分析讲义绪论(Introduction)仪器分析是化学类专业必修的基础课程之一。
通过本课程的学习,要求学生把握经常使用仪器分析方式的原理和仪器的简单结构;要求学生初步具有依照分析的目的,结合学到的各类仪器分析方式的特点、应用范围,选择适宜的分析方式的能力。
分析化学是研究物质的组成、状态和结构的科学。
它包括化学分析和仪器分析两大部份。
化学分析是指利用化学反映和它的计量关系来确信被测物质的组成和含量的一类分析方式。
测按时需利用化学试剂、天平和一些玻璃器皿。
它是分析化学的基础。
仪器分析是以物质的物理和物理化学性质为基础成立起来的一种分析方式,测按时,常常需要利用比较复杂的仪器。
它是分析化学的进展方向。
仪器分析与化学分析不同,具有如下特点:(1)灵敏度高,检出限量可降低。
如样品用量由化学分析的ml、mg级降低到仪器分析的µL、µg级,乃至更低。
它比较适用于微量、痕量和超痕量成份的测定。
(2)选择性好。
很多仪器分析方式能够通过选择或调整测定的条件,使共存的组分测按时,彼其间不产生干扰。
(3)操作简便、分析速度决,易于实现自动化。
(4)相对误差较大。
化学分析一样可用于常量和高含量成份的分析,准确度较高,误差小于千分之儿。
多数仪器分析相对误差较大,一样为5%,不适于常量和高含量成份的测定。
(5)需要价钱比较昂贵的专用仪器。
§1-1.仪器分析方式的内容和分类(Classification of Instrumental Analysis)分类:1.光学分析法以物质的光学性质为基础的分析方式(1) 分子光谱: 红外吸收可见和紫外分子荧光拉曼光谱(2) 原子光谱: 原子发射AES 原子吸收AAS 原子荧光AFS(3) X射线荧光: 发射吸收衍射荧光电子探针(4) 核磁共振顺磁共振2.电化学分析法溶液的电化学性质用于确信物质化学成份的方式(1)电导法:电导分析法电导确信物质的含量电导滴定法溶液的电导转变确信容量分析的滴定终点。

1。
简述仪器分析法的特点。
答:1.仪器分析法灵敏度高。
2.仪器分析法多数选择性较好.3.仪器分析法分析速度较快,利于批量样品分析。
4.易于使分析工作自动化。
5.相对误差较大。
6.设备复杂、价格昂贵,对仪器工作环境要求较高。
第二章电分析导论1.计算[Cu2+]= 0.0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0.337V)2。
已知电极反应Ag++ e—=Ag的EθAg+,Ag为0.799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0。
490V,求Ag2C2O4的溶度积常数。
3。
已知电极反应Zn2++ 2e—=Zn的EθZn2+,Zn=-0.763V,Zn(CN)42-的稳定常数为5×1016。
求电极反应Zn(CN)42—+ 2e—=Zn + 4 CN—的标准电极电位EθZn(CN)2—,Zn.4答案:1。
计算[Cu2+] = 0。
0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0。
337V)解:电极反应为:Cu2++ 2e—=Cu按照能斯特方程,铜电极的电位为:E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[αCu2+ /αCu]金属的活度为常数,作为1,在非精度的情况下,可以认为αCu2+=[Cu2+]。
则求得(25℃时)E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[Cu2+]=0。
344+(0.059/2)•lg0.0001=0.226V2。
已知电极反应Ag++ e-=Ag的EθAg+,Ag为0。
799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0.490V,求Ag2C2O4的溶度积常数.解:根据能斯特方程:EθAg2C2O4,Ag= E Ag+,Ag=EθAg+,Ag + 0.059lg[Ag+]= EθAg+,Ag + 0.059lg(Ksp/[C2O42-])1/2已知EθAg2C2O4,Ag为0.490V,EθAg+ ,Ag为0。

电化学分析法:根据物质在溶液中的电化学性质及其变化来进行分析。
光学分析法:基于光作用于物质后所产生的辐射信号或所引起的变化来进行分析。
色谱分析法:依据不同物质在固定相和流动相中分配系数的差异实现混合物的分离后进行检测而进行分析;电位分析:是通过在零电流条件下测定两电极间的电位差(电池电动势)所进行的分析测定。
指示电极应满足的条件(1)电极电位与其响应的离子活度之间应严格符合能斯特方程式;(2)对离子活度的变化响应要快;选择性和重现性要好;(3)便于收藏和使用。
扩散电位(液接电位E L)电解质的盐溶液中当从浓度高的一侧向浓度低的一侧扩散时,在组成盐的阴、阳两种离子的淌度存在差别的情况下,淌度高的离子就领先,淌度低的离子就迟后,因为这种关系溶液中就产生了电位差,这就是扩散电位。
道南电位:两个溶液用渗透膜隔开,仅容许一个离子通过,造成两相界面电荷分布不均匀,产生界面电位称为道南电位。
相界电位:由于离子的迁移,改变了膜-液界面的电荷分布,从而在膜的表面(称相界面)形成了双电层,产生了电位降,这种电位称为相界电位;电位选择性系数Kij:在相同的测定条件下,待测离子和干扰离子产生相同电位时待测离子的活度αi与干扰离子活度(αj)n/m的比值;法拉第电解定律:物质在电极上析出产物的质量W与通过电解池的电量Q成正比;恒电流库仑滴定用恒定电流,以100%的电流效率进行电解,在电解池中产生一种滴定剂,该滴定剂瞬时与被测定物质进行定量的化学反应(滴定反应),可借助于指示剂或其他电化学方法来指示反应的化学计量点,由于滴定剂由电解产生,产生的滴定剂的量可由所消耗的电量求得,这种方法称为库仑滴定法伏安分析法:以测定电解过程中的电流-电压曲线为基础的电化学分析方法极谱分析法(polarography):采用滴汞电极的伏安分析法;极谱波:记录下的电流为纵坐标,电压为横坐标的电解曲线,称为极谱曲线,也称极谱波或极谱图;残余电流:达到电解电位以前出现的微小且稳定的电流i r。



第二章气相色谱分析例1:在一根90米长的毛细管色谱柱上测得各组分保留时间:正十四烷15.6min ;正十五烷21.95min ;正十六烷31.9min 。
计算色谱柱的死时间及载气平均速度。
解:方法一:同系物保留值之间存在以下关系:,11,r rn n n n=-+ ''''()(1)(1)()//R n R n R n R n t t t t -+=以()R M t t -代替'Rt 可推导出: 2(1)(1)()(1)()()(1)()()R n R n R n M R n R n R n R n t t t t t t t t -++--=---将正十四烷、正十五烷、正十六烷的保留时间代入公式:231.915.621.95min (31.921.95)(21.9515.6)M t ⨯-=--- 得4.40minM t = 载气的平均流速/Mu L t -=, 即90100/(4.4060)/34.09/u cm s cm s -=⨯⨯=方法二:直接用甲烷测定死时间。
即以甲烷的保留时间作为死时间。
例2:在一根2m 长的色谱柱上,A 、B 、C 、三组分的保留时间分别为2.42min 、3.21min 、5.54min ;峰宽分别为0.12min 、0.21min 、0.48min 。
另测得甲烷的保留时间为1.02min 。
求:(1)A 、B 、C 组分的调整保留时间;(2)A 与B 、B 与C 组分的相对保留时间; (3)A 、B 、C 组分的容量因子;(4)A 、B 、C 组分的有效塔板数和塔板高度; (5)A 与B 、B 与C 组分的分离度;解:(1)'(1)(1)R R M tt t =-'()()(2.42 1.02)min 1.40min R A R A M t t t =-=-= '()()(3.21 1.02)min 2.19min R B R B M tt t =-=-= '()()(5.54 1.02)min 4.52min R C R C M tt t =-=-=(2) ''2,1(2)(1)/R R r t t =, 2.19/1.40 1.56B A r ==, 4.52/2.19 2.06C B r ==(3) '1(1)/R M k t t ='()/ 1.40/1.02 1.37A R A M k t t === '()/ 2.19/1.02 2.15B R B M k t t === '()/ 4.52/1.02 4.43CR C M k t t ===(4)'216(),/R eff t n H L nw=='()22()1.416()16()2178,0.12R A eff A A tn w ===()/2100/21780.092A A eff A H L n cm ==⨯= '()22()2.1916()16()17400.21R B eff B B t n w ===()/2100/17400.115B B eff B H L n cm cm ==⨯= '()22()4.5216()16()14190.48R C eff C C t n w ===()/2100/14190.141C C eff C H L n cm ==⨯=(5)(2)(1)212()R R t t Rw w -=+()(),2()2(3.21 2.42)4.790.210.12R B R A A BB At t R w w -⨯-===++()(),2()2(5.54 3.21) 6.750.480.21R C R B B CC Bt t R w w -⨯-===++第三章 高效液相色谱分析例1:高效液相色谱法分离两个组分,色谱柱长30cm 。

仪器分析课程教案一、课程简介1. 课程目的:使学生掌握常用仪器分析方法的基本原理、仪器构造及操作技能,培养学生分析问题和解决问题的能力。
2. 课程内容:涵盖光学分析、电化学分析、色谱分析、质谱分析等常用仪器分析方法。
3. 适用对象:高等院校化学、化工、生化、药学专业本科生。
二、教学目标1. 知识与技能:(1)掌握各类仪器分析方法的基本原理;(2)了解仪器分析方法在实际中的应用;(3)学会使用常见仪器进行分析操作。
2. 过程与方法:(1)通过实验操作,培养学生的动手能力;(2)通过问题讨论,提高学生的分析问题、解决问题的能力。
3. 情感、态度与价值观:(1)培养学生对仪器分析学科的兴趣;(2)树立学生科学探究的精神。
三、教学方法1. 讲授与实验相结合:理论讲授为基础,实验操作作为实践环节,使学生更好地理解仪器分析方法。
2. 问题驱动:引导学生思考实际问题,激发学生的学习兴趣,提高学生的分析问题、解决问题的能力。
3. 小组讨论:鼓励学生相互交流、探讨,培养学生的团队合作精神。
四、教学内容1. 第一章:光学分析法(1)紫外-可见光谱分析;(2)红外光谱分析;(3)拉曼光谱分析。
2. 第二章:电化学分析法(1)电位分析法;(2)电导分析法;(3)库仑分析法。
3. 第三章:色谱分析法(1)气相色谱分析;(2)液相色谱分析;(3)色谱-质谱联用分析。
4. 第四章:质谱分析法(1)质谱仪器的基本原理;(2)质谱图的解析;(3)质谱分析在实际中的应用。
5. 第五章:原子光谱分析法(1)原子吸收光谱分析;(2)原子荧光光谱分析;(3)原子发射光谱分析。
五、教学安排1. 课时:32学时,包括16次理论讲授和16次实验操作。
2. 教学方式:讲授与实验相结合。
3. 教学评价:课堂表现、实验报告、课程论文相结合。
六、第六章:流动分析法(1)溶液的配制与处理;(2)流动分析仪器的构造及操作;(3)流动分析在环境监测中的应用。

《仪器分析》课后习题答案参考第一章电位分析法1~4 略5.(1)pMg x=5.4(2)3.65×10-6– 4.98×10-66. -17%7. 4.27×10-4%8.(1)=5.4×10-4lg=-2.31=5.0×10-3(2) Cl- =1.0×10-2 mol/L9. pH x ==5.74R入=1011Ω10. Cx=8.03×10-4 mol/L第二章电重量分析和库仑分析法1. 1.64 V2. -1.342,0.2383. 1.08 V,0.4V,7333 s4. Co先析出,阴极电位应维持在-0.313 – -0.795V之间阴极电位应维持在-0.455 – -0.795V之间5 Bi:0.283-0.190V(vs.SHE);-0.005 - -0.098(vs. Ag/AgCl)Cu:0.310-0.159V(vs.SHE);0.022 - -0.129(vs. Ag/AgCl)Ag:0.739-0.444V(vs.SHE);0.451 – 0.156(vs. Ag/AgCl)控制阴极电位大于0.310V(vs.SHE),可以使Ag分离,Cu2+和BiO+不能分离。
6 ,7 , ,89.10. t= 4472s11 6.1×10-4 mol/Lpt阴极产生OH-,改变pH使副反应发生,故pt阴极应用玻璃砂芯套管隔离第三章 伏安法和极谱分析法1~3 略4. 当pH=7时,当pH=5时,5. (1) 线性回归方程: y =6.0733x + 0.3652(2)0.536 mmol/L6. M C x 41023.2-⨯=7. 22.7 μA8. 0.0879. 1.75 ×10-3mol/L10. -0.626 V11. 5.9×10-3第四章气相色谱法1~14 略15. 8.5%,20.6%,60.9%16. 2.15%,3.09%,2.75%,6.18%,85.84%17. (1)4.5, (2)48mL,(3)5.4min,(4)103,(5)1866,(6)1.07nm18. (1)8.6,(2)1.4419. (1)n有效(A) = 636.59n有效(B) = 676(2) 2 m20.(1)0.45 ,(2)7111121.(1)4,(2)4,(3),22. (1)3236,2898,2820,3261,(2)3054(3)0.33m第五章高效液相色谱法1~16 略17. 26.24%,27.26%18. 1600,6.7,7.3,1.1,0.8,7 m19. 0.63,2.38,2.65,4.034021,3099,2818,3394,595,1535,1486,217820. 5.1%21. 0.47%第六章原子发射光谱仪1~8 略9. 2.57 eV10. 0.573%。
课后习题答案第一章:绪论1.解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法。
(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
第三章光学分析法导论1.解释下列名词:(1)原子光谱和分子光谱;(2)原子发射光谱和原子吸收光谱;(3)统计权重和简并度;(4)分子振动光谱和分子转动光谱;(5)禁戒跃迁和亚稳态;(6)光谱项和光谱支项;(7)分子荧光、磷光和化学发光;(8)拉曼光谱。
答:(1)由原子的外层电子能级跃迁产生的光谱称为原子光谱;由分子的各能级跃迁产生的光谱称为分子光谱。
(2)当原子受到外界能量(如热能、电能等)的作用时,激发到较高能级上处于激发态。
但激发态的原子很不稳定,一般约在108 s内返回到基态或较低能态而发射出的特征谱线形成的光谱称为原子发射光谱;当基态原子蒸气选择性地吸收一定频率的光辐射后跃迁到较高能态,这种选择性地吸收产生的原子特征的光谱称为原子吸收光谱。
(3)由能级简并引起的概率权重称为统计权重;在磁场作用下,同一光谱支项会分裂成2J+1个不同的支能级,2J+1称为能级的简并度。
(4)由分子在振动能级间跃迁产生的光谱称为分子振动光谱;由分子在不同的转动能级间跃迁产生的光谱称为分子转动光谱。
第二章 气相色谱分析1、色谱柱柱长增加,其它条件不变时,会发生变化的参数有(C ) A.相对保留值 B.分配系数 C.保留时间2、衡量固定相选择性的参数是(A ) A.相对保留值 B.分配系数 C.分配比例:在柱长为2m 的5%的阿皮松柱、柱温为1000C ,记录纸速度为2.0cm/min 的色谱条件下,测定苯的保留时间为1.5min ,半峰宽为0.20cm ,求理论塔板数及理论塔板高。
2)min/0.220.0min5.1(54.5cm cm n ==3102.1⨯mm mmH 7.1102.120003=⨯=例:下列各项对柱的塔板高度有何影响?试解释 (1)减小进样速度:(2)提高载气的流速;(3)减小填料的粒度;(1)减小进样速度,将使所有的分子并非同时进入色谱柱,造成柱前谱峰扩宽。
而使H 增大。
(2)增高载气流速,将会因流速值不同,而增大 或减小H (因为板高方程中的后两项相反的效果产 生竞争. (3)降低填料的粒度,将增大填粒的比表面积,且降低了液膜的厚度,因此,从公式可知,可减少C 项和A 项,就整体而言,会降低H 。
在1m 长的填充色谱柱上,某镇静药物A 及其异构体B 的保留时间分别为5.80min和6.60min ;峰底宽度分别为0.78min 及0.82min ,空气通过色谱柱需要1.10min 。
计算:(1)组分B 的分配比; (2)A 与B 的分离度;(3)该色谱柱的平均有效理论塔板数和塔板高度; (4)A 、B 两组分完全分离时,所需的柱长。
有效h r r R l 221212116⎪⎪⎭⎫⎝⎛-=第四章电位分析法玻璃膜钠离子选择性电极对氢离子的选择性系数为1×102。
用该离子选择性电极测定1×10-4mol·L-1钠离子时,要使测定的百分误差小于1%,试液的pH值应控制为多大?第五章伏安分析法第六章点解和库伦分析法第七章原子发射光谱分析第八章原子吸收光谱分析。
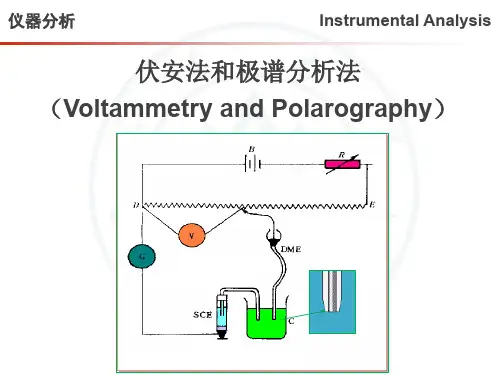
仪器分析讲课提纲 42 第5章 伏安与极谱分析法 教学时数:4学时 教学要求: 1、理解极谱分析原理、极化和去极化电极基本概念,极谱过程的特殊性。 2、理解半波电位、扩散电流方程式及影响扩散电流的因素。 3、掌握极谱定量分析方法, 4、掌握极谱干扰电流及其消除方法。 5、了解极谱分析方法的特点和应用。 6、了解近代极谱分析方法及其应用。 教学重点与难点: 重点:极谱分析法的原理、特点,产生浓差极化的条件,半波电位,极谱定量分
析方法,极谱干扰电流及消除方法,循环伏安法,溶出伏安法。 难点:极化原理,干扰电流及消除方法。 5.1 极谱分析的基本原理 一、伏安分析与极谱分析 伏安与极谱分析从广义上讲也是一种电解分析,更是利用待定溶液在电解池中的电解反应堆来进行测定的一类特殊形式的电解方法,并以记录电流-电压曲线来进行定性定量分析。 极谱分析是一种在特殊条件下进行的电解过程。 极谱分析与电解分析的区别在于: 仪器分析讲课提纲 43 1. 激谱分析中溶液是静止的,以利产生浓差极话,而电解分析是在搅拌溶液中进行,以利于扩散。 2. 极谱分析是利用被测物质所产生的氧化还原电流的强度进行定量分析(定性分析原理形同虚设,皆根据φ析)而电解分析是将被测离子还原为金属或氧化为金属氧化物,最后称重进行定量分析。 3、极谱分析是一种微量成分的分析方法,而电解分析是常量成分以测定电解过程中的电流--电压曲线(伏安曲线)为基础的一类分析电化学分析法称为伏安法。通常将采用滴汞电极作工作电极的伏按法称为极谱法。 二、极谱波 极谱波可分为如下几部分: ①残余电流部分 ②电流上升部分 ③极限电流部分 在排除了其他电流的影响以后,极限电流减去残余电流后的值,称为极限扩散电流,简称扩散电流(用id 表示)。id 与被测物( )的浓度成正比,它是极谱定量分析的基础。 当电流等于极限电流的一半时相应的滴汞电极电位,称为半波电位(用E1/2 表示)。不同的物质具有不同的半波电位,这是极谱定性分析的根据。 三、极谱过程的特殊性 1.电极的特殊性 仪器分析讲课提纲 44 电极的特殊性表现在极谱分析是用一个通常是面积很小的滴汞电极,另一个通常是面积很大的饱和甘汞电极(而一般电解分析使用二个面积大的电极)。极化电极也可以是其他的固体微电极,但通常情况下,均使用滴汞电极,因为它有如下优点: ①汞滴的不断下滴,电极表面吸附杂质少,表面经常保持新鲜,测定的数据重现性好; ②氢在汞上的超电位比较大; ③许多金属可以和汞形成汞齐; ④汞易提纯。 缺点是: ①汞易挥发且有毒; ②汞能被氧化; ③汞滴电极上残余电流大,限制了测定灵敏度。 2.电解条件的特殊性 电解条件的特殊性表现在极谱分析是溶液保持静止并且使用了大量的电解质。溶液保持静止,则对流切向运动可忽略不计;加入大量电解质,则可消除离子的电迁移运动。 5.2 极谱定量分析 一、尤考维奇方程式 id = 607 n D 1/2 m 2/3 t1/6 c 仪器分析讲课提纲 45 id ---- 平均极限扩散电流(μA); n---- 电极反应中的电子转移数; D---- 电极上起反应物质在溶液中的扩散系数(cm 2 /s); m---- 汞流速度(mg/s); t ---- 滴汞周期(s); c---- 被测物质的浓度( mmol/L ) ; 被称为尤考维奇方程式,该式定量的阐明了极限扩散电流与浓度的关系。 各项因素不变时,可合并为一个常数 K = 607nD1/ 2m2 / 3t1/ 6 ,尤考维奇常数 则在一定浓度范围内,扩散电流与被测物质浓度成正比: id = K.c 二、影响扩散电流的因素 1 .毛细管特性 所以,在一定实验条件下,扩散电流也与汞柱高度的平方根成正比。 2 .滴汞电极电位 滴汞电极电位的改变对滴汞周期τ 的影响较为显著。因为不同电位时汞同溶液间的表面张力不同 3 .温度 实验证明,室温时,温度每升高一摄氏度,将使扩散电流约增加 1.3% ,所以,在极谱法中要求温度固定。 4 .溶液组分 仪器分析讲课提纲 46 扩散系数与溶液的黏度有关,黏度越大,物质的扩散系数越小,因此扩散电流也随之减小。溶液组分不同其黏度也不同,对扩散电流的影响也随之不同。 三、定量分析法 扩散电流的大小在极谱图上通常用波高来表示 : h=Kc 波高的测定 平行线法 三切线法 1、直接比较法: 将浓度为 Cs 的标准溶液及浓度为 Cx 的未知溶液在相同的实验条件下,分别作出极谱图,测得其波高。由式: hs =KCs hx =KCx 两式相除得: c x =hxcs/h s 2、工作曲线法 配制一系列含有不同浓度的被测离子的标准溶液,在相同实验条件下作极谱图,测得波高。以波高为纵坐标,浓度为横坐标作图,可得一直线。然后在上述条件下测定未知溶液的波高,从标准曲线上查得溶液的浓度。 3、标准加入法 取一定体积为 Vx 的未知溶液,设其浓度为 Cx ,作出极谱图。然后加入浓度 Cs 的标准溶液Vs , 在相同条件下作出极谱图。分别测量加入前、后的波高为h 、 H. 仪器分析讲课提纲
47 5.3 极谱定性分析 一、极谱波方程式与半波电位 极谱波的电流与滴汞电极电位之间的数学表达式称为极谱波方程式。不同的反应类型具有不同的极谱波方程式。简单金属离子的极谱波方程式如下: Ede = E1/2 + (RT/nF)ln(id-i)/i 式为滴汞电极电位Ede 与电流i 之间的关系式,称为还原波方程式。 二、半波电位的特性及其影响因素 1.半波电位的特性 ①当温度和支持电解质浓度一定时,则半波电位数值一定,而与在电极上进行反应的离子浓度无关。 ② 半波电位的数值与所用仪器(如毛细管,检流计)的性能无关。 ③ 半波电位与共存的其它反应离子无关。 2. 半波电位的影响因素 (1)支持电解质的种类 (2)溶液的酸度 (3)温度 (4)络合物的形成 (5) 半波电位与标准电极电位的关系 ① E1/2 与E0 基本相等 ② E1/2 较E0 为正 仪器分析讲课提纲 48 ③E1/2 较E0 为负
5.4 干扰电流及其消除方法 一.残余电流 在进行极谱分析时,外加电压虽未达到被测物质的分解电压,但仍有微小的电流通过电解池,这种电流称为残余电流。 残余电流(ir)有以下两部分组成: (1)电解电流 (if ) : 电解电流是由于溶液中微量的易被还原的杂质在滴汞电极上还原时所产生的。 (2)电容电流(ic)电容电流来源于滴汞电极同溶液界面上双电层的充电过程。 在测定扩散电流时,对残余电流一般采用作图的方法加以扣除。 二、迁移电流 迁移电流是指主体溶液中的离子,受静电引力的作用达到电极表面,在电极上还原而产 生的电流。消除迁移电流的方法是在溶液中加入大量支持电解质。 三、极谱极大 极谱极大也称为畸峰,是极谱波中的一种异常或特殊现象。 极大可用表面活性剂来抑制,抑制极大的表面活性剂称为极大抑制剂,常用的极大抑制剂有明胶,聚乙烯醇及某些有机染料等。 四、氧波 仪器分析讲课提纲 49 溶解在溶液中的氧,能在滴汞电极上发生电极反应而产生极谱波,称为氧波。 第一个氧波的半波电位约为 -0.2V(vs SCE), 第二个氧波的半波电位约为 -0.8V (vsSCE) 。两个还原波占据了从 0 ~ -1.2V 的整个电位区间,这正是大多数金属离子还原的电位范围。氧将重叠在被测物质的极谱波上而干扰测定。 除氧的方法有以下几种: ① 在溶液中通入惰性气体如:N2、 H2 或 CO 2 . 从而消除氧波。 N 2 或 H 2 可用于任何溶 液,而 CO 2 只能用于酸性溶液。 ②在中性或碱性溶液中,可加入亚硫酸钠除氧: ③在强酸性溶液中,加入 而生成大量 气体以驱氧。 ④在弱酸性溶液中,利用抗坏血酸除氧效果也很好。 五、氢波,叠波和前波 1.氢波 溶液中的氢离子在滴汞电极上还原而产生的极谱波,称为氢波。如果被测物质的极谱波与 氢波近似,则氢波对测定会有干扰。 2.叠波 两种物质的半波电位如果相差不大(小于0.2V) , 那末这两种物质的极谱波就会重叠起来,这种情况称为叠波。 3 .前波 仪器分析讲课提纲 50 当溶液中存在着一种较待测物质的半波电位为正且浓度很大(其量大于被测物质的 10倍)的物质时,由于该种物质的扩散电流很大,故掩盖了待测物质的波,这种干扰成为前波。 六、底液及其选择 1 .底液的组成 (1) 支持电解质(以消除迁移电流); (2) 极大抑制剂(以消除极大); (3) 除氧剂(以消除氧波); (4) 其它有关试剂,如用以控制溶液酸度,改善波形的缓冲剂,络合剂等等。 2 .底液的选择 选择底液的原则: ( 1 )使极谱波的波形较好,也就是使极谱波的波形较陡,波的上下都有良好的平台,最好是可逆的极谱波。 ( 2 )干扰少。 ( 3 )成本低,操作简便。 ( 4 )最好能同时测定几种元素。 17.5 现代极谱分析技术 一.、可逆波与不可逆波 1.可逆波 电极反应的速度较快,比电活性物质从溶液向电极表面扩散的速度来得快。极谱波上任何