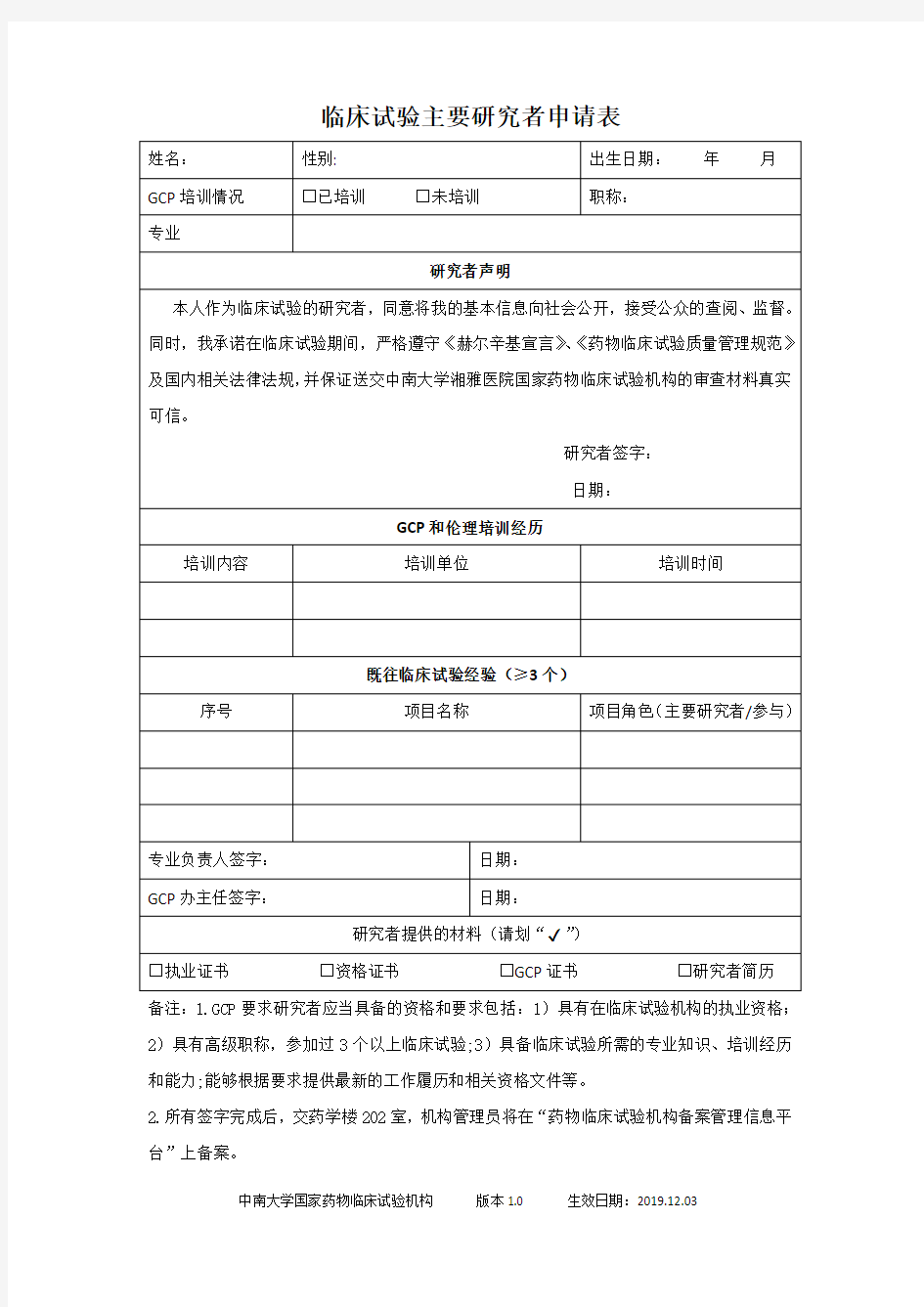
临床试验主要研究者申请表
备注:1.GCP要求研究者应当具备的资格和要求包括:1)具有在临床试验机构的执业资格;2)具有高级职称,参加过3个以上临床试验;3)具备临床试验所需的专业知识、培训经历和能力;能够根据要求提供最新的工作履历和相关资格文件等。
2.所有签字完成后,交药学楼202室,机构管理员将在“药物临床试验机构备案管理信息平台”上备案。
中南大学国家药物临床试验机构版本1.0 生效日期:2019.12.03
药物临床试验研究者的职责 第一条负责临床试验的研究者应具备下列条件: (一)在医疗机构中具有相应专业技术职务任职和行医资格; (二)具有试验方案中所要求的专业知识和经验; (三)对临床试验方法具有丰富经验或者能得到本单位有经验的研究者在学术上的指导; (四)熟悉申办者所提供的与临床试验有关的资料与文献; (五)有权支配参与该项试验的人员和使用该项试验所需的设备。 第二条研究者必须详细阅读和了解试验方案的内容,并严格按照方案执行。 第三条研究者应了解并熟悉试验药物的性质、作用、疗效及安全性(包括该药物临床前研究的有关资料),同时也应掌握临床试验进行期间发现的所有与该药物有关的新信息。 第四条研究者必须在有良好医疗设施、实验室设备、人员配备的医疗机构进行临床试验,该机构应具备处理紧急情况的一切设施,以确保受试者的安全。实验室检查结果应准确可靠。 第五条研究者应获得所在医疗机构或主管单位的同意,保证有充分的时间在方案规定的期限内负责和完成临床试验。研究者须向参加临床试验的所有工作人员说明有关试验的资料、规定和职责,确保有足够数量并符合试验方案的受试者进入临床试验。 第六条研究者应向受试者说明经伦理委员会同意的有关试验的详细情况,并取得知情同意书。 第七条研究者负责作出与临床试验相关的医疗决定,保证受试者在试验期间出现不良事件时得到适当的治疗。 第八条研究者有义务采取必要的措施以保障受试者的安全,并记录在案。在临床试验过程中如发生严重不良事件,研究者应立即对受试者采取适当的治疗措施,同时报告药品监督管理部门、卫生行政部门、申办者和伦理委员会,并在报告上签名及注明日期。 第九条研究者应保证将数据真实、准确、完整、及时、合法地载入病历和病例报告表。
阿美宁病例报告表(Case Report Form) 受试者姓名:________________________________ 家庭地址:__________________________________ 联系电话:__________________________________ 试验中心名称:______________________________ 申办单位:江苏豪森药业股份有限公司
在正式填表前请认真阅读下列填表说明 病例报告表填写说明: 1?筛选合格者填写病例报告表。 2?病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。 3?填写记录一律用钢笔或碳素签字笔。 4?患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。 5?表中凡有“□”的项,请在符合的条目上划“/'。表格中所有栏目均应填写相应的文字或数字,不得留空。 6?所有检验项目因故未查或漏查,请填写ND ;具体合并用药剂量和时间不明,请先写NK。 7?试验期间应如实填写合并用药记录表、不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。 8 ?临床试验应严格按照临床试验方案要求进行。试验不同时期需完成的检查和需记录的 项目,请对照临床流程图执行。
受试者知情同意书 敬爱的患者: 我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。 温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪 是通过XXXXXXXXXXXXXXXXXXXXXXXXXX机XXX 主要用于XXXXXXXXXXXX治疗。具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。其注册标准已经XX 省食品药品监督管理局备案,其 技术指标经XX省医疗器械检验所检测合格。现拟进行临床验证。 在临床观察过程中,请您在可能的前提下积极配合临床医生按方案要求进行临床试验观察。本仪器是安全的,无任何风险和副作用的,医生和使用单位将会尽力防止由于本试验可能带来的伤害,如果产生由于本次试验因素给您带来任何不良影响,您将会得到及时、必要的治疗,所需要的费用由生产该仪器的企业承担,并将会按有关规定得到相应的补偿。 绝大多数患者能从本研究中获益。您将有权在任何时间询问有关本研究的任何问题。您 参加本研究完全是自愿的,您将有权决定在任何时间退出本研究,将不会再任何方面影响医 生对您的治疗,您的权利将得到充分的保障。医生和研究单位将尽力防止由于本研究可能带来的伤害。 本研究的所有资料将是保密的,有关您的个人资料不会出现在总结报告或发表文献中。伦理委员会将公正此项研究是安全和合乎道德的,并在赫尔辛基宣言指导下进行。 志愿受试者声明: 作为受试者,我已了解以上情况,同意参加本研究,按照临床试验方案的要求,按时用药,按时复诊,及时报告出现的不良反应。我有权随时退出该项试验。但在无特殊情况下,尽可能完整的接受本次临床试验研究。 受试者签字:研究者签字: 期:期:
知情同意书 尊敬的病友: 您现在所患疾病是××××××,且(如有额外标准,请说明,例如:已经服用××药物××年以上),我们邀请您参加一项临床研究。参加这项研究完全是您自主的选择。本知情同意书将提供给您一些信息,请您仔细阅读,并慎重做出是否参加本想研究的决定。如有任何关于本项研究的疑问,您可以请您的医生或研究人员给予解释。您可以和家人及朋友讨论,以帮助您决定是否自愿参加此项临床研究。您有权拒绝参加本研究,也可随时退出研究,且不会受到处罚,也不会失去您应有的权利。 如果您同意参加,我们将需要您签署本知情同意书并注明日期。您将获得一份已签字并注明日期的副本,供您保存。 您参加本次研究是自愿的,本项研究已通过本院医学伦理委员会审查。 【研究名称】××××××(名称必须与申请表、自查表、研究方案和立项证明文件中的名称一致) 【研究单位】中山大学附属第三医院××科(如为多中心研究,请标注为“×××医院为研究牵头单位,中山大学附属第三医院医院为参与单位”) 【主要研究者】×××(即主要研究医师、项目负责人,一般不超过2人) 【研究资助者】(若为本院医生自己发起的则写为“研究者自发”,若为厂家发起的则写为“厂家名称”;若为科研课题支撑的就写课题资助单位) 【为什么要进行该项研究?】 (请描述研究目的和背景,语言须通俗易懂。主要回答:本项目的研究对象面临的问题和本课题组拟解决的问题,邀请患者/健康人参与本项目的原因)
【本研究如何进行?】(请描述研究的设计及过程,以下仅为示例,请根据实际研究内容填写) 本研究为×××××研究(例如:多中心、随机、对照、干预性研究或单中心、队列、非干预性研究等),您将被随机分配到治疗组和对照组,治疗组将接受××治疗,以及××××检查;对照组将进行××常规治疗,以及××××的检查。您需要根据医生的×××安排定期回来随访。治疗和随访期间研究人员将使用相关的临床观察表格,收集您所有需要观察的数据,在××时候(时间点,例如:在您接受研究开始时或在您服药1个星期后等)采集您×××ml血液,留取×××尿液进行研究分析(必须注明采集的血/尿标本是否为临床常规检查项目的剩余标本),最后汇总数据并进行统计分析。 【参加研究的条件】(如有多个组别并且各组的入组标准、排除标准不同,请分别列举,例如,对照组:1.入选标准为×× 2.排除标准为××;治疗组:1. 入选标准为××2.排除标准为××) 本研究计划招募××名研究对象。 1.入选标准为:×××× 2.排除标准为:×××× 3.中途退出标准为:××××(例如,受试者主动撤回知情同意书) 【我参加本研究的时间将有多长?】(请根据实际情况填写,阐述研究每个阶段的时间和随访次数) 您参加本研究的时间将持续×年(×周),在此期间,您须到科室进行××次访视。本研究由以下部分组成: 【我有哪些责任?】(请根据实际的研究内容进行填写,以下仅为范例)如果您决定参加本研究,您必须按医生和您约定的随访时间来医院就诊。您的随访非常重要,因为医生将判断您接受的治疗是否真正起作用,并及时指导您。您必须按医生指导用药,并请您及时、客观地填写您的治疗记录。并将正在服用的其他药物带来,包括您有其他合并疾病须继续服用的药物。 【每次研究访视将会做什么?】(如无需随访,可省略此项)
研究者手册模板 研究者手册(Investigator's Brochure )是有关试验用器械在进行人体研究时已有的临床与非临床资料。它必须包含到某一时间为止对受试器械的所有研究资料,通常也包括相似器械的材料。 临床研究资料手册主要用作: 1?给研究负责人提供所有有关被试器械的信息及研究结果。 2?作为受试器械已获得正式核准的标志。 3?包括所有最新的对受试器械所作研究的总结,这可用于新药临床试验或器械上市许可证的申请。 研究者手册的内容通常包括如下内容: 1.封面页:包括器械名称,公司名称,完槁或更新日期以及资料整理者姓名; 2 .目录:列出所有的标题及副标题以及相应的页码; 3.保密声明; 4.试验用医疗器械基本信息。至少应当包括:试验用医疗器械的名称;研究者手册的版本和日期,若有修订,应当提供适当的修订历史概述;试验用医疗器械的申办者或生产企业名称和地址。 5.试验用医疗器械的概要说明。至少应当包括: (1).试验用医疗器械的特点、结构组成及图示、作用机理、规格型号及划分等相关信息,以便能够全面识别和追溯试验用医疗器械;
(2).试验用医疗器械的适用范围、预期用途,包括所建议的临床适应 症和禁忌症、预定的使用人群; (3).试验用医疗器械中所用材料的介绍,尤其是与组织或体液接触的 试验用医疗器械材料,包括药械结合产品、人和/或动物组织或它们的衍生物或其他生物活性物质的详情; (4).试验用医疗器械安装和使用说明及标签样稿和样品(图片),包 括必要的储存和处理要求,使用前安全性和性能检查以及使用后要采取的有关措施等; (5).使用试验用医疗器械所必需的培训; (6).在使用试验用医疗器械的过程中可能涉及的必要医疗措施说明。 6.支持试验用医疗器械预期用途和临床试验设计理由的概要和评价,至少包括: (1).文献综述。相关科学文献和/或未发表的数据和报告的评论性综述以及所查询的文献清单。该综述应能证明开展该临床试验的合理性; (2)?该试验用医疗器械临床前生物学研究、非临床实验室研究和动物 实验的数据摘要和评价,以证明该试验用医疗器械在人类受试者中使用的合理性; (3).与该试验用医疗器械类似特性的医疗器械以往临床试验中有关发 现的摘要和相关临床经验的总结。同时应当描述试验用医疗器械与类似特性的医疗器械在工作原理、结构组成、制造材料、技术参素和预期用途等方面的异同;
临床试验主要研究者(PI)工作指南 一.项目立项的准备与申报 1. 若您与申办者或CRO有意向在我院开展药物临床试验(有SFDA批件),请申办者或CRO将资料交药理基地主任或秘书。 2.项目立项审核:参见《药物临床试验运行流程》 3.请您根据项目的具体情况并参照如下人员组成组建研究团队: Ⅰ期临床研究团队应包括:研究医师、病区护士、相关科室人员、药物管理人员。 Ⅱ/Ⅲ/Ⅳ期临床研究团队应包括:研究医师、病区护士、相关科室人员、药物管理人员。 4.您的研究团队与申办者或CRO召开研究者会议,主要解决以下问题: 4.1试验方案、CRF、知情同意书定稿 4.2病例数的分配 4.3建立并统一各诊断标准、疗效判断评价标准等 4.4讨论各单位检测仪器、试剂的一致性问题,或设立中心试验室 4.5统计专家制订“统计计划书” 4.6确定研究进度(各中心同期进行试验) 4.7监查员及监查计划 4.8成立协调委员会 二.项目伦理答辩及协议审核 1. 由申办者或CRO将伦理申报资料交药理基地办公室秘书。 2. 您需在伦理会上进行方案介绍和答疑,汇报幻灯应侧重研究背景、方案设计、受试者权益保护措施等内容。 3. 请参照《吉林省医疗服务价格》与申办者初步拟定协议和经费,交药理基地办公室秘书。
三.启动会的召开 1.申办者准备试验材料,交研究医师或研究护士;试验药物交药剂科管理(苏兴国) 2.由您和申办者共同确定启动会召开的时间、地点和参加人员,原则上研究团队的所有人员和药理基地代表应参与启动会,必要时还可邀请相关人员参加。启动会需解决如下问题: 2.1 项目组熟悉方案设计,对操作细节进行讨论; 2.2由PI进行人员分工及授权; 2.3研究助理或研究护士根据方案制定SOP; 2.4 监查员就药物收发、CRF填写、标本寄送、随机方式、SAE报告等内容进行培训。 3.启动经费到位后即可开始筛选受试者。 四.项目实施 1. PI负责制,药理基地协助并定期质控。 2. 如试验中发生SAE,请在获知该事件的24小时内通知药理基地、申办者和国家食品药品监督管理局。 3. 对项目进行时间较长的项目,您还需组织撰写中期总结和年度总结并报伦理委员会。 五.项目结题及试验材料归档 1. 研究团队或申办者按照“临床试验资料归档目录”进行试验材料的归档与退还,各经办人核对“临床试验资料归档目录”后签名确认。 3. 您将组织研究小组对临床试验进行讨论和总结。 4.您与申办者或CRO将负责共同审核临床研究的总结并将总结报告交药理基地审核,签字、盖章。 5.临床研究结束后您有义务追踪研究药物的后续信息(如是否获批上市,是否获专利等)及时反馈至药理基地。
新版药品GCP 满分:100得分:86.0单选题 (共25题,共50.0分) 得分:44.0 1. 描述监查策略、方法、职责和要求的文件。 2. 伦理审查意见的文件应包括哪些内容: 3. 临床试验中何种试验记载的数据是不属于源数据: 4. 在设盲临床试验方案中,下列哪项规定不必要?
5. 可识别身份数据机密性的保护措施有: 6. 病例报告表中具体用药剂量和时间不明,应填写什么符号 7. 试验开始前,申办者和研究者的职责分工协议不应包括: 8. 《药物临床试验质量管理规范》适用的范畴是
9. 由申办者设立的,定期对临床试验的进展、安全性数据和重要的有效性终点进行评估,并向申办者建议是否继续、调整或者停止试验的委员会。 10.风险最小化的措施有: 11.关于试验用药品的供给和管理,以下不属于申办者职责的是:
12.临床试验的科学性和试验数据的可靠性主要取决于: 13.没有能力给予知情同意的成人参加临床试验,知情同意应符合以下哪些要求: 14.在什么阶段,申办者在可向研究者和临床试验机构提供试验用药品? 15.关于申办者与研究者和临床试验机构签订的合同,以下哪种说法是错误的:
16.由申办者委派的稽查员撰写的,关于稽查结果的书面评估报告。 17.本法规要求申办者应当从研究者和临床试验机构获取的伦理委员会相关信息和文件是: 18.试验设计中减少或者控制偏倚所采取的措施包括: 19.为建立和记录计算机化系统从设计到停止使用,或者转换至其他系统的全生命周期均能够符合特定要求的过程。
20.受试者接受试验用药品后出现的所有不良医学事件,可以表现为症状体征、疾病或实验室检查异常,但不一定与试验用药品有因果关系。 21.药物临床试验的哪些信息必须告知受试者: 22.指在临床试验中建立的有计划的系统性措施,以保证临床试验的实施和数据的生成、记录和报告均遵守试验方案和相关法律法规。 23.在有关临床试验方案下列哪项是正确的?
临床试验参与者管理研究 开展临床试验的主要目的是验证药品的安全性和有效性,是药品研究工作的重要环节,也是整个药品研究工作中花费较大的环节。目前,国内的临床试验水平还没有达到国际先进水平,如何在现有条件下快速、高效地进行临床试验,最大程度节约试验成本,是必须解决的问题。该研究从临床试验参与者的角度进行分析,给临床试验中各参与者的管理提供一些建议。 标签:临床试验;参与者;管理 [Abstract] The purpose of clinical trials is to determine the effect of drugs,which is an important process of new drug research and development and takes much money. Clinical trials in our country have not reached the advanced international level now. Under the existing conditions,how can we take clinical trials more efficiently is a question must be solved. This paper researches the management of participants in clinical trials and provides some advice in clinical trials in our country. [Key words] Clinical trials;Participants;Management 临床试验是指在人体(患者和健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验用药品的吸收、分布、代谢和排泄,目的是确定试验用药品或其他干预措施的疗效与安全性[1]。临床试验质量关系到药品的质量安全以及受试者、志愿者的生命健康,必须对试验全过程进行质量控制。申办者、合同研究组织、伦理委员及伦理委员会、研究者、临床试验协调研究者、受试者及志愿者是临床试验的主要参与者,贯穿临床试验的全过程。我国已建立起符合国际通行标准的临床试验管理法规,但是在标准化操作规程(SOP)等方面与发达国家仍有不小差距。为保证临床试验质量,需要参与临床试验的所有人员、组织机构严格遵循临床试验方案、GCP、标准操作规程等规定。该研究从临床试验参与者的角度进行分析,归纳出存在的问题,最后提出一些解决问题的方法和建议。 1各参与者的职责及出现的问题 1.1申办者 申办方是临床试验的发起者,对整个试验的启动、管理、财务和监查负责。审办方也可以聘请对自己负责的监查员,对试验进展情况进行监查和报告并对数据进行核实。目前,申办者聘任的监查员多为企业内部员工,采用水平管理模式,存在问题主要包括以下几个方面:①缺少独立的临床试验管理部门。部分企业的临床试验管理是由研发部门甚至是市场销售部兼管,缺少系统有效的监督管理,工作效率低。②缺少资金投入。长时间来,我国企业药品研发主要是仿制药研发。自主知识产权的新药研发周期长,资金投入大,大环境决定企业药物研发临床试验的预算费用有限,影响临床试验的进行。③缺少有经验临床试验经验的监管人
临床试验递送资料目录(药物类别)
备注: 1.文件夹请使用打孔的硬皮文件夹; 2.药品类须提供所有研究者履历(签名)及所有成员的GCP证书复印件; 3.伦理批件:提供组长单位的批件(必要时提供其他参加单位伦理批件); 4.按要求注明版本号及日期,所有文件若有英文版本则一并提供中文翻译版本; 5.所有材料一式三份,并加盖申办方及CRO红章,超过一页须同时加盖骑缝章。清单中所列项目请按原 顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除; 6.递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。落款是主要研究者。申办方或CRO 在空白处盖章。(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容) 7.另有增加的项目请续在最后; 8.提供电子版文件一份; 9. 受理申请表只需递交一份。
临床试验递送资料目录(器械及诊断试剂类别) 资料递交说明:1.文件夹请使用打孔的硬皮文件夹;2.伦理批件:提供其他参加单位伦理批件;3.按要求注明版本号;所有文件若有英文版本则一并提供中文翻译版本;4.所有材料一式三份,并加盖申办方及CRO红章,清单中所列项目请按原顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;5另有增加的项目请续在最后;6递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。落款是主要研究者。申办方或CRO在空白处盖章。(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容);7.提供电子版文件一份;8.立项申请表只需递交一份。
审评中心对现阶段研究者发起的临床试验(IIT) 的认识 杨志敏,主任药师,国家食品药品监督管理总局药品审评中心临床审评一部 随着药物研发全球化趋势的加剧和我国药物创新能力的不断增强,近年来在我国开展的临床研究数量呈递增趋势。据统计,2005 -2010 年我国共有 1 999项临床研究在美国Clinical Trials.Gov 进行注册,其中2005年为144 个,2006 年为198 个,2007年为278 个,2008 年为368 个,2009 年为466 个,2010 年为545 个,登记的研究中大部分为研究者或学术机构发起的临床研究(investigator-initiatedclini-cal trial,IIT)。从总体数量分析,除了以药品注册为目的的临床研究之外,由研究者发起的各类研究已开始占有越来越重要的地位。另一方面,由于越来越多的临床单位参与或主导高水平的国际多中心研究,如IPASS 研究、INTEREST 研究、EACH 研究,获得国际学术界和同行的高度认可,更加激发了国内研究者开展临床研究的热情,从而不断探索和研究更多更好的治疗方案,获得更加充分和科学的研究数据,通过循证医学方法提升临床治疗水平,为患者带来更多临床获益。
目前我国对研究者发起的临床研究的认识和监管工作刚刚起步,研究和借鉴国外的管理模式是现阶段必要的工作。为此,本文就欧美等国家和地区研究者发起研究的相关情况进行概要性介绍,力求为制定和完善我国的相关法律法规体系,提高我国研究者发起研究的管理水平和研究质量发挥一定作用。 IIT 是指由研究者申请发起的一个或一系列临床研究。其与制药公司发起的临床研究最大区别在于,IIT 中制药公司不承担主导角色和申办者职责,仅直接或间接提供试验药、对照药或部分经费。其研究范围常常是制药企业申办的研究(industry-sponsoredtrial,IST)未涉及的领域,例如罕见病研究、诊断或治疗手段比较、上市药物新用途等。研究者发起的临床研究与制药企业发起的临床研究并行,互为补充,才能更好地推进药物研究的深度和广度,更多地获得研究数据,为循证医学提供依据。 各国研究者发起的临床研究监管现状 1.美国 美国FDA 将临床研究分为新药临床试验(investigational new drug,IND)和非注册临床试验(Non-IND)。IND 试验需在获得FDA 许可并经机构审查批准后方可开始,并在FDA 的监管下开展;Non-IND试验只需通过机构审查批准,即可在研究所在中心监管下开展,并不需要另行通
临床试验术语 临床试验 代表含义: 指任何在人体(病人或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性。 Ⅰ临床研究 代表含义: 首次在人体进行研究药物的周密试验计划,受试对象是少量(开放20~30例)正常成年健康自愿者。目的是观察药物在人体内的作用机制。 Ⅱ临床研究 代表含义: 在只患有确立的适应症的病患者(盲法不小于100对)上进行的研究,目的是找出最佳的剂量范围和考虑治疗可行性 Ⅲ临床研究 代表含义: 确定研究药物的有效性和安全性、受益和危害比率。(试验组不小于300例。) Ⅳ临床研究 代表含义: 新药获准注册上市后的大型研究,检察普遍临床使用时的不良反应和毒性。 药品临床试验管理规范 代表含义: 对临床试验的设计、实施和执行,监查、稽查、记录、分析和报告的标准。该标准是数据和报告结果的可信和精确的保证;也是受试者权益、公正和隐私受保护的保证。 伦理委员会 代表含义: 是指一个由医学,科学专业人员及非医学,非科学人员共同组成的独立体,其职责是通过对试验方案、研究者资格、设备、以及获得并签署受试者知情同意书的方法和资料进行审阅、批准或提出建议来确认临床试验所涉及的人类受试者的权益、安全性和健康受到保护,并对此保护提供公众保证。 申办者 代表含义: 发起一项临床试验,并对该试验的启动、管理、财务和监查负责的
公司、机构或组织。 研究者 代表含义: 实施临床试验并对临床试验的质量及受试者安全和权益的负责者。研究者必须经过资格审查,具有临床试验的专业特长、资格和能力。 协调研究者 代表含义: 在多中心临床试验中负责协调参加各中心研究者工作的一名研究者。 监查员 代表含义: 由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据。 合同研究组织 代表含义: 一种学术性或商业性的科学机构。申办者可委托其执行临床试验中的某些工作和任务,此种委托必须作出书面规定。 研究中心 代表含义: 指实际实施试验相关活动的场所。 多中心研究 代表含义: 是由多位研究者按同一试验方案在不同地点和单位同时进行的临床试验。 安全性研究 代表含义: 观察评估药物副反应 有效性研究 代表含义: 观察评估药物有效性 预防研究 代表含义: 例如疫苗、抗生素 治疗研究 代表含义: 一般药物治疗研究、外科步骤 研究者手册 代表含义: 是有关试验药物在进行人体研究时已有的临床与非临床研究资料试验方案
新版药品GCP 单选题 题目说明: 1.受试者被告知可影响其做出参加临床试验决定的各方面情况后,确认同意自愿参加临床试验的过程。 A.研究者手册 B.知情同意 C.病例报告表 D.知情同意书 2.由申办者委派的稽查员撰写的,关于稽查结果的书面评估报告。 A.监查报告 B.监查计划 C.稽查计划 D.稽查报告 3.对于生物等效性试验,试验用药品的留存样品不得由哪方保存? A.具备条件的独立第三方 B.申办者或者与其利益相关的第三方 C.临床试验机构或其委托的具备条件的独立第三方 D.临床试验机构 4.紧急情况下,预计许多受试者没有能力给予知情同意,临床试验应符合以下哪些要求: A.如果不可能事先获得受试者的同意,必须得到其监护人的同意 B.如有可能,在受试者有能力时,事先获得其在未来失能期间参加研究的同意 C.其他三项均是 D.如果无法获得受试者或其监护人的同意,临床试验不能纳入该受试者 5.关于研究者和临床试验机构应当具有完成临床试验所需的必要条件,以下哪一项描写错误? A.确保临床试验数据的真实、完整和准确 B.监管所有研究人员执行试验方案,并采取措施实施临床试验的质量管理。 C.不需要采取质量管理的措施 D.确保所有参加临床试验的人员充分了解试验方案及试验用药品 6.由申办者设立的,定期对临床试验的进展、安全性数据和重要的有效性终点进行评估,并向申办者建议是否继续、调整或者停止试验的委员会。 A.伦理委员会 B.独立数据监查委员会 C.申办方 D.合同研究组织 7.《药物临床试验质量管理规范》适用的范畴是 A.为申请药品注册而进行的药物临床试验 B.新药非临床试验研究 C.人体生物等效性研究
药物临床试验研究者的职责 在进行药物临床试验的过程中,首先临床试验研究者应该清楚的知晓自己的职责所在。并且在试验过程中严格遵守,才可以安全有效的完成工作。 一、药物临床试验研究者必须详细阅读和了解试验方案的内容,并严格按照方案执行。 二、研究者应了解并熟悉试验药物的性质、作用、疗效及安全性(包括该药物临床前研究的有关资料),同时也应掌握临床试验进行期间发现的所有与该药物有关的新信息。 三、研究者必须在有良好医疗设施、实验室设备、人员配备的医疗机构进行临床试验,该机构应具备处理紧急情况的一切设施,以确保受试者的安全。实验室检查结果应准确可靠。 四、药物临床试验研究者应获得所在医疗机构或主管单位的同意,保证有充分的时间在方案规定的期限内负责和完成临床试验。研究者须向参加临床试验的所有工作人员说明有关试验的资料、规定和职责,确保有足够数量并符合试验方案的受试者进入临床试验。 五、研究者应向受试者说明经伦理委员会同意的有关试验的详细情况,并取得知情同意书。 六、药物临床试验研究者负责作出与临床试验相关的医疗决定,保证受试者在试验期间出现不良事件时得到适当的治疗。 七、研究者有义务采取必要的措施以保障受试者的安全,并记录在案。在临床试验过程中如发生严重不良事件,研究者应立即对受试者采取适当的治疗措施,同时报告药品监督管理部门、卫生行政部门、申办者和伦理委员会,并在报告上签名及注明日期。 八、药物临床试验研究者应保证将数据真实、准确、完整、及时、合法地载入病历和病例报告表。 九、药物临床试验研究者应接受申办者派遣的监查员或稽查员的监查和稽查及药品监督管理部门的稽查和视察,确保临床试验的质量。 十、研究者应与申办者商定有关临床试验的费用,并在合同中写明。研究者在临床试验过程中,不得向受试者收取试验用药所需的费用。 十一、临床试验完成后,研究者必须写出总结报告,签名并注明日期后送申办者。
临床监查员专业术语、缩略语中英对照表 缩略语英文全称中文全称 ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应 AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者 BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator’s Brochure研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on Harmonization 国际协调会议 IDM Independent Data Monitoring 独立数据监察 IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会 IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会 IVD In Vitro Diagnostic 体外诊断 IVRS Interactive Voice Response System 互动语音应答系统
药物临床试验GCP培训考核试题 第一部分单选题(每题2分) 1 保障受试者权益的主要措施是:C A有充分的临床试验依据B试验用药品的正确使用方法 C伦理委员会和知情同意书D保护受试者身体状况良好 2 下列哪一类人员不必熟悉和严格遵守《赫尔辛基宣言》?D A临床试验研究者B临床试验药品管理者 C临床试验实验室人员D非临床试验人员 3 下列哪一项不是伦理委员会的组成要求?D A至少有一人为医学工作者B至少有5人参加 C至少有一人应从事非医学专业D至少有一人来自药政管理部门 4 伦理委员会的工作应:D A接受申办者意见B接受研究者意见 C接受参试者意见D是独立的,不受任何参与试验者的影响 5 经过下列哪项程序,临床试验方可实施?D A向伦理委员会递交申请 B已在伦理委员会备案 C试验方案已经伦理委员会口头同意 D试验方案已经伦理委员会同意并签发了赞同意见 6 伦理委员会做出决定的方式是:C A审阅讨论作出决定B传阅文件作出决定 C讨论后以投票方式作出决定D讨论后由伦理委员会主席作出决定 7 在伦理委员会讨论会上,下列什么人能够参加投票?A A参加会议的伦理委员会委员B非医学专业委员 C非委员的专家D非委员的稽查人员 8 伦理委员会书面签发其意见时,不需附带下列哪一项?C A出席会议的委员名单B出席会议的委员的专业情况 C出席会议委员的研究项目D出席会议委员的签名 9 伦理委员会从下列哪个角度审阅试验方案?A A保护受试者权益B研究的严谨性 C主题的先进性D疾病的危害性 10 下列哪项不是知情同意书必需的内容?C A试验目的B试验可能的受益和可能发生的危险 C研究者的专业资格和经验D说明可能被分配到不同组别 11 下列哪项不是受试者的权利?C A自愿参加临床试验B自愿退出临床试验 C选择进入哪一个组别D有充分的时间考虑参加试验 12 受试者在任何阶段有权退出试验,但退出后无权要求下列哪一项?D A不受到歧视B不受到报复 C不改变医疗待遇D继续使用试验药品 13 关于签署知情同意书,下列哪项不正确?D A 受试者在充分了解全部试验有关情况后同意并签字 B 受试者的合法代表了解全部试验有关情况后同意并签字 C见证人在见证整个知情过程后,受试者或其合法代表口头同意,见证人签字D无行为能力的受试者,必须自愿方可参加试验
研究者发起的临床试验 运行管理规定和流程 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
研究者发起的临床试验是指本中心的研究人员作为主要研究者(PI)发起或承担的对已上市的药品、医疗器械或诊断试剂等开展的临床研究,本中心参照国内、外开展临床试验的规范和要求,结合我中心开展临床试验的特点,制定本制度与流程。 步骤一:申请者递交临床试验申请材料 步骤二:项目立项审核 1.PI提出研究小组成员 2.机构主任会议对项目进行初步审核,同意后由办公室秘书转送相应的学术委员会秘书; 3.学术委员会主任主持召开审评会议。 步骤三:主持或召开研究者会议 遵照有关规定主持开展临床试验工作。 2.若本单位为该项目的组长单位,PI主持召开研究者会议;若为参加单位,主要研究者应参加研究者会议。 步骤四:伦理委员会审核 申请者按照附件1要求准备伦理申报材料,将申报材料交伦理委员会进行伦理审评。 步骤五:临床协议及经费审核 1.取得伦理批件后,资助方和主要研究者拟订经费预算,签字确定后递交本机构办公室秘书呈经费小组。 2.经费管理小组审核试验协议及经费预算,协议通过后由本机构办公室秘书交至主管院长签字生效。如无任何经费资助,研究者需签署无任何经费资助的声明附件6。 步骤六:临床试验材料及药品的交接 申请者应尽快将临床试验材料交项目研究小组,药品管理参照本机构“药物的接收、保存、分发、回收、退还的SOP”,由研究者派专人负责接收、保管、分发、回收和退还。 步骤七:启动会的召开 申请者负责召开项目启动会附件7。 步骤八:项目实施 1.研究者遵照GCP规范、试验方案及相关SOP实施临床试验; 2.本机构质控员视具体情况对试验项目质量进行监督管理,对存在的问题提出书面整改意见,研究者予以整改并给予书面答复; 潘莹) 4.申请人对本试验的涉及的伦理,数据的真实性、可靠性负责。 步骤九:资料归档 1.项目结束后,参照本机构“资料管理制度”,由申请者将试验资料及时整理,自行保存,保存期限5年以上; 2.研究小组进行数据收集、分析,撰写总结报告。
医院临床试验主要研究者的职责 1.主要研究者即为项目负责人,应详细阅读和了解申办者提供的临床试验材料,与申办者合作制定临床试验方案,并熟悉该试验的方案及其他相关资料,确保在试验过程中严格执行试验方案。 2.项目负责人将为研究人员制定明确的职责,并填写职责授权书。一旦发生职责调整或研究人员更换,项目负责人需要求新的研究人员填写职责授权书。 3.主要研究者有权支配临床试验相应的医疗设施、实验室设备、人员配备等,有权支配处理紧急情况的一切设施,以确保临床试验的顺利进行,保证受试者的安全。 4.主要研究者应保证有足够的从事临床研究的时间,并在方案规定的期限内负责和完成临床试验。 5.主要研究者根据试验方案,审查专业相应的SOP是否完备,如果不完备,组织人员修改完善。 6.主要研究者负责定期和申办者委派的监查员会晤,认真接受监查员的检查。 7.主要研究者应具备可靠的受试者来源,确保受试者的人选数量和速度,保证试验的进度和质量。 8.主要研究者负责或授权研究者发现和筛选合适的受试者,向受试者及其家属说明经伦理委员会同意的有关试验的详细情况,并负责受试者书面知情同意的签署。
9.主要研究者应了解并熟悉试验药物的性质、作用、疗效及安全性(包括该药物临床前研究的有关资料),同时也应随时掌握临床试验进行期间发现的所有与该药物有关的新信息。 10.主要研究者负责组织参加临床试验的所有工作人员学习临床试验的各项管理制度和相应SOP。向参加临床试验的所有工作人员说明有关试验的资料、规定和职责。 11.主要研究者负责任命试验用药的药品管理员,由其管理临床试验用药物。 12.主要研究者负责协调研究人员之间的工作并定期评估试验的进程。 13.主要研究者应采取与临床试验相关的医疗措施,保证受试者在试验期间出现不良事件时得到适当而及时的治疗,以保障受试者的安全,并记录在案。 14.在发生不良事件或严重不良事件时,主要研究者应按报告流程逐级上报,并在报告上签名及注明日期。 15.试验进行中,主要研究者指派质量管理员定期对CRF的填写进行检查和指导。 16.主要研究者应采用标准操作规程,对临床试验进行质量控制和质量保证,负责接待申办者派遣的监查员或稽查员的监查或稽查及药品监督管理部门的检查或视察,确保临床试验的质量。 17.中止一项临床试验必须由主要研究者通知受试者、申办者、伦理委员会和药品监督管理部门,并阐述理由。
临床试验专业负责人授权委托书 即日起,委托同志(身份证号:)作为(项目名称)的主要研究者,遵循药物临床试验质量管理规范(GCP)、国家有关临床试验的法律法规、机构及本专业组的制定的管理制度、标准操作规程及主要研究者职责。 该委托书有效期为20XX年XX月XX日至国家食品药品监督管理总局及卫生行政部门对此项目的最终核查结束。 特此说明! 委托人(签名): 职务:XXXXX 专业负责人 签名日期: 本人XXXXX,同意接受专业负责人的委托,承担(项目名称)的主要研究者的工作,本人清楚并愿意承担此项目临床试验期间的责任。 被委托人(签名): 签名日期:
附件: 专业负责人职责 一、目的 明确药物临床试验专业组负责人职责,提高试验管理水平,保证试验安全、有序、及时、保质保量地完成。 二、范围 肿瘤科专业组负责人。 三、内容 1.熟悉和遵从药物临床试验质量管理规范(GCP)、国家有关临床试验的法律法规、机 构及本专业组的制度和标准操作规范。 2.药物临床试验机构的授权下,负责与申办者的接洽工作和试验项目的洽谈。 3.与申办者和统计人员共同制定临床试验方案、知情同意书和病例报告表。 4.参与临床试验协议的商谈及签订工作。 5.对临床试验全过程负责,确保有良好的医疗设施、实验设备和研究团队来处理临床 试验中的紧急情况。 6.监督试验经费的使用和临床试验进度、合同的履行情况。 7.负责本专业研究人员及资源的调配工作。 8.负责本专业的研究人员的培训。 9.指导研究者对不良事件的处理。 10.督促和监督申办者在临床试验中履行相关的责任与义务。 11.负责完成总结报告或分中心小结报告的撰写工作。 12.接受相关方面的稽查以及卫生监督管理部门的视察。 四、参考资料 国家食品药品监督管理局令第3号发布《药物临床试验质量管理规范》,2003
《药物临床试验质量管理规范》考核题库 一 . 单选题 1 .实施临床试验并对临床试验的质量和受试者的安全和权益的负责者。 A . 研究者 B . 协调研究者 C . 申办者 D . 监查员 2 .在多中心临床试验中负责协调各参加中心的研究者的工作的一名研究者。 A . 协调研究者 B . 监查员 C . 研究者 D . 申办者 3 .伦理委员会应成立在 A . 申办者单位 B . 医疗机构 C . 卫生行政管理部门 D . 监督检查部 4 .下列哪一类人员不必熟悉和严格遵守《赫尔辛基宣言》? A . 临床试验研究者 B . 临床试验药品管理者 C . 临床试验实验室人员 D . 非临床试验人员 5 .《药物临床试验质量管理规范》何时开始施行? A . 1998.3 B . 1998.6 C . 1996.12
D . 2003.9 6 .下列哪一项不是申办者在临床试验前必须准备和提供的? A . 试验用药品 B . 该药临床研究资料 C . 该药的质量检验结果 D . 该药的稳定性试验结果 7 .以下哪一项不是研究者具备的条件? A . 承担该项临床试验的专业特长 B . 承担该项临床试验的资格 C . 承担该项临床试验的所需的人员配备 D . 承担该项临床试验的组织能力 8 .任何在人体进行的药品的系统性研究,以证实或揭示试验用药 品的作用、不良反应及/或研究药品的吸收、分布代谢和排泄,目的 是确定试验用药品的疗效和安全性。 A . 临床试验 B . 临床前试验 C . 伦理委员会 D . 不良事件 9 .关于知情同意书内容的要求,下列哪项不正确? A . 须写明试验目的 B . 须使用受试者能理解的语言 C . 不必告知受试者可能被分配到试验的不同组别 D . 须写明可能的风险和受益 10 .病人或临床试验受试者接受一种药品后出现的不良反应事件,但不一定与治疗有因果关系。 A . 不良事件