钠及其化合物知识点及习题小结
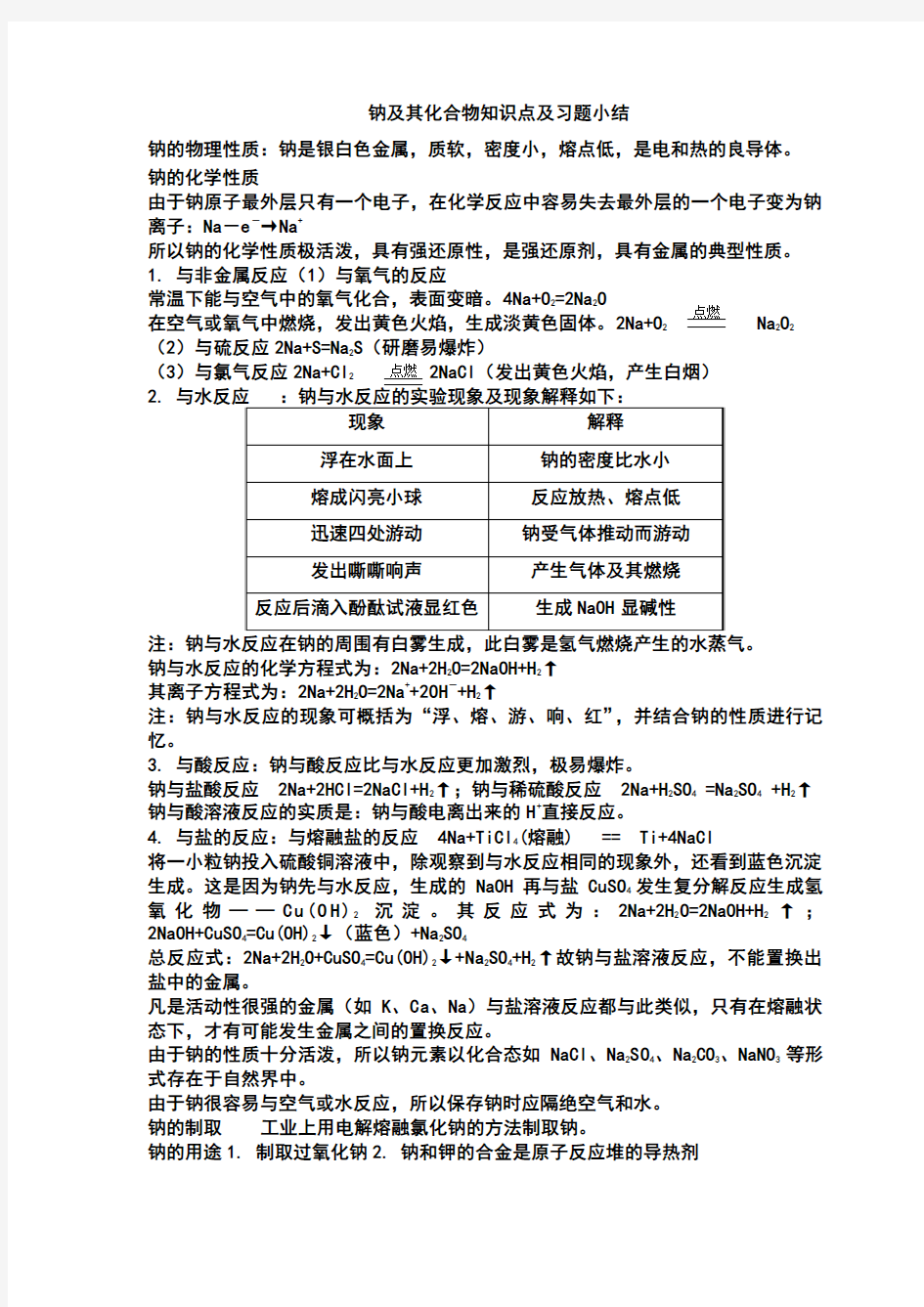
钠的物理性质:钠是银白色金属,质软,密度小,熔点低,是电和热的良导体。 钠的化学性质
由于钠原子最外层只有一个电子,在化学反应中容易失去最外层的一个电子变为钠离子:Na -e -→Na +
所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1. 与非金属反应(1)与氧气的反应
常温下能与空气中的氧气化合,表面变暗。4Na+O 2=2Na 2O 在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。2Na+O 2 Na 2O 2 (2)与硫反应2Na+S=Na 2S (研磨易爆炸)
(3)与氯气反应2Na+Cl 2
2NaCl (发出黄色火焰,产生白烟) 2.
钠与水反应的化学方程式为:2Na+2H 2O=2NaOH+H 2↑
其离子方程式为:2Na+2H 2O=2Na ++2OH -+H 2↑
注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
3. 与酸反应:钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应 2Na+2HCl=2NaCl+H 2↑;钠与稀硫酸反应 2Na+H 2SO 4 =Na 2SO 4 +H 2↑ 钠与酸溶液反应的实质是:钠与酸电离出来的H +直接反应。
4. 与盐的反应:与熔融盐的反应 4Na+TiCl 4(熔融) == Ti+4NaCl
将一小粒钠投入硫酸铜溶液中,除观察到与水反应相同的现象外,还看到蓝色沉淀生成。这是因为钠先与水反应,生成的NaOH 再与盐CuSO 4发生复分解反应生成氢氧化物——C u (O H )2沉淀。其反应式为:2Na+2H 2O=2NaOH+H 2↑;2NaOH+CuSO 4=Cu(OH)2↓(蓝色)+Na 2SO 4
总反应式:2Na+2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑故钠与盐溶液反应,不能置换出盐中的金属。
凡是活动性很强的金属(如K 、Ca 、Na )与盐溶液反应都与此类似,只有在熔融状态下,才有可能发生金属之间的置换反应。
由于钠的性质十分活泼,所以钠元素以化合态如NaCl 、Na 2SO 4、Na 2CO 3、NaNO 3等形式存在于自然界中。
由于钠很容易与空气或水反应,所以保存钠时应隔绝空气和水。
钠的制取 工业上用电解熔融氯化钠的方法制取钠。
钠的用途1. 制取过氧化钠2. 钠和钾的合金是原子反应堆的导热剂
点燃 点燃
3. 用于电光源(高压钠灯)射程远,透雾能力强,
4. 作还原剂制取某些金属 3Na+AlCl 3 =Al+3NaCl (历史上制铝),4Na+TiCl 4(熔融) ==Ti+4NaCl (现代制钛)。碱金属中的钾、铷、铯的制取也用不如它们活泼的钠,原因是什么呢?我们以制钾为例来说明。沸点,KCl :1500℃、Na :882.9℃、NaCl :1410℃、K :774℃。我们将熔融态的KCl 与Na 共热,可得到钾蒸气:KCl+Na=NaCl+K ↑,及时分离出K 蒸气,反应就不断向右进行了。
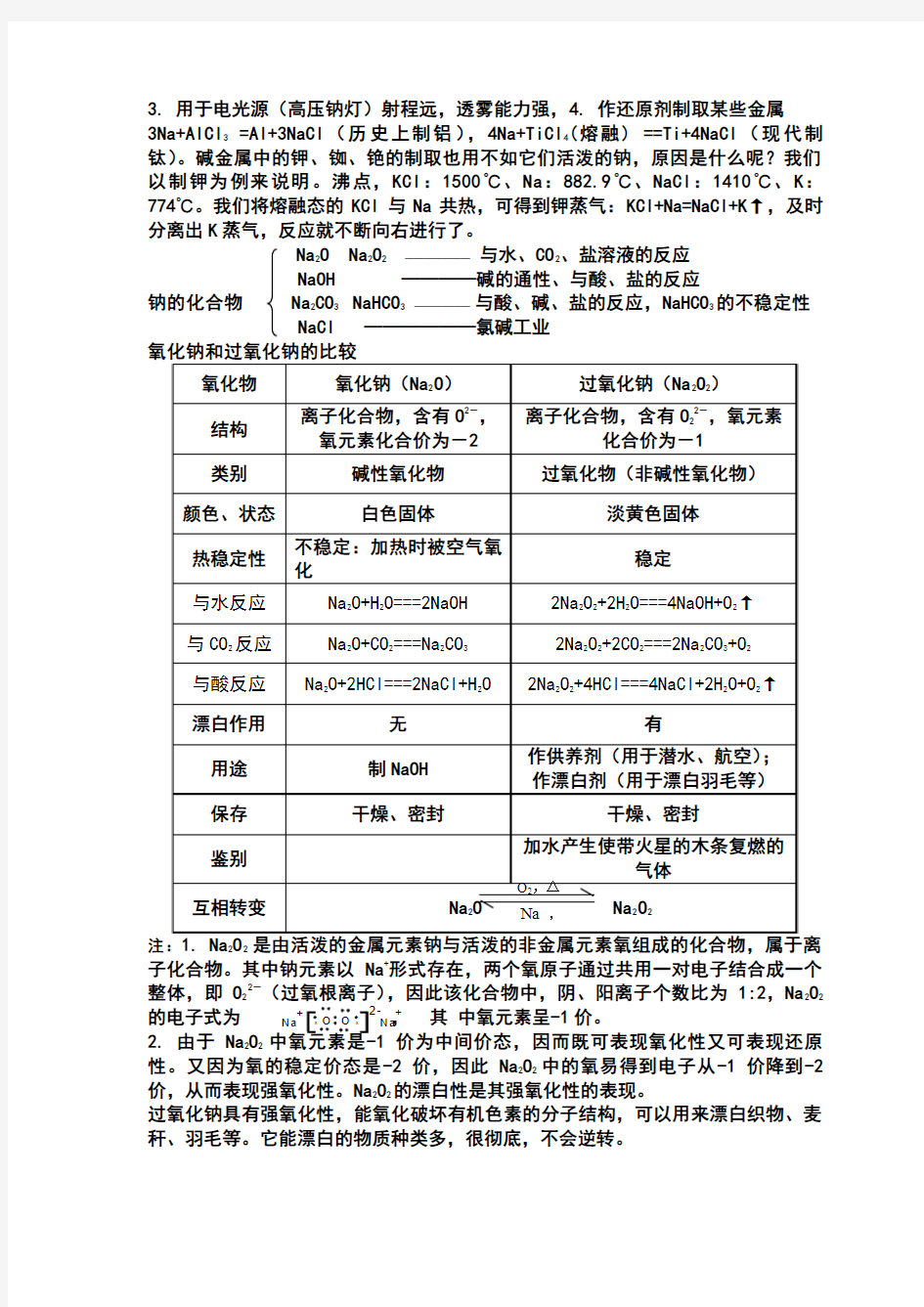
Na 2O Na
2O 2 ——————— 与水、CO 2、盐溶液的反应
NaOH ————碱的通性、与酸、盐的反应
钠的化合物 Na 2CO 3 NaHCO 3 —————— 与酸、碱、盐的反应,NaHCO 3的不稳定性 NaCl ——————氯碱工业
注:22子化合物。其中钠元素以Na +形式存在,两个氧原子通过共用一对电子结合成一个整体,即O 22-(过氧根离子),因此该化合物中,阴、阳离子个数比为1:2,Na 2O 2
的电子式为, 其 中氧元素呈-1价。 2. 由于Na 2O 2价为中间价态,因而既可表现氧化性又可表现还原性。又因为氧的稳定价态是-2价,因此Na 2O 2中的氧易得到电子从-1价降到-2价,从而表现强氧化性。Na 2O 2的漂白性是其强氧化性的表现。
过氧化钠具有强氧化性,能氧化破坏有机色素的分子结构,可以用来漂白织物、麦秆、羽毛等。它能漂白的物质种类多,很彻底,不会逆转。
N a N a
++
3. Na2O2与H2O反应过程如下:
2Na2O2+4H2O===4NaOH+2H2O2(非氧化还原反应)2H2O2===2H2O+O2↑(氧化还原反应)总反应式为:2Na2O2+2H2O===4NaOH+O2↑。显然,反应物H2O中的氢、氧两元素的化合价始终没有发生任何变化。反应的实质是-1价氧元素发生了自身氧化还原反应;Na2O2既是氧化剂,又是还原剂;O2是氧化产物。该反应电子转移的方向数目可表示如下:
单线桥法:2Na2O2+2H2O = 4NaOH 双线桥发:2Na2O2+4H2O===4NaOH+2H2O
4. Na2O2与CO2的反应,相当于在上边反应的基础上增加CO2与NaOH的反应,所以必须是潮湿的CO2才与Na2O2反应。
5. Na2O2是不是碱性氧化物?碱性氧化物是指和酸反应生成盐和水的氧化物。它有以下特征:(1)与酸反应只生成盐和水;(2)与水直接或间接化合生成相应的碱;(3)与酸性氧化物反应生成相应的含氧酸盐;(4)反应中元素的化合价未发生变化。过氧化钠与酸、水或CO2反应时,除生成相应的盐和碱外,还生成了氧气,氧元素的化合价也发生了变化:
2Na2O2+2H2SO4 === 2Na2SO4 +2H2O+O2↑ 2Na2O2+2H2O === 4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2所以,Na2O2是金属氧化物,但不是碱性氧化物。
氢氧化钠(NaOH)
1、俗称烧碱、火碱、苛性钠。
2、主要物理性质:白色固体,易吸收空气中的水而潮解,易溶解于水,并且放出大量的热,水溶液有涩味,有强腐蚀性。
3、主要化学性质:为一元强碱,具有碱的通行。
(1)NaOH溶于水后完全电离,能与酸碱指示剂或试纸作用。
(2)与酸酐发生反应:如CO2、SO2、SiO2等。反应方程式分别为:
2NaOH+ CO2 === Na2CO3 + H2O;2NaOH+ SO2 === Na2SO3 + H2O;
2NaOH+ SiO2 === Na2SiO3 + H2O
(3)与两性物质反应:如Al2O3、A l(O H)3等。反应方程式分别为:
Al2O3 + 2NaOH===2NaAlO2 + H2O Al(OH)3 + NaOH===NaAlO2 + 2H2O (4)与单质反应放出氢气:如铝、硅。反应方程式为:
2Al + 2NaOH +2H2O===2NaAlO2 + 3H2↑ Si+ 2NaOH +H2O===Na2SiO3 + 2H2↑(5)与盐发生复分解反应:如NH4Cl、CuSO4、NaHCO3、Ca(HCO3)2等。
例如:NH4Cl与NaOH溶液共热:NH4Cl+NaOH==NaCl+H2O +NH3↑;
NaHCO3溶液与NaOH溶液反应:NaHCO3+NaOH==Na2CO3 + H2O
应注意:①盛NaOH的试剂瓶需用橡胶塞,不能用玻璃塞。
②NaOH碱性很强,贮存时若未密闭,表层易变质生成碳酸钠。
③称量NaOH要放在小烧杯或表面皿里,动作要迅速。不能放在量筒、量杯、纸上称量。
④不慎将浓NaOH溶液沾在皮肤上,应先用大量水冲洗,然后再涂上硼酸稀溶液。
⑤在实验室里常用NaOH溶液吸收氯气,在工业上常用NaOH溶液吸收含一氧化氮和二氧化氮的尾气,以消除污染。
⑥实验室制取少量的NaOH溶液可在饱和的Na2CO3溶液中撒入石灰粉,加热、过滤。
1、食盐不仅是常用的调味品,而且是人体必需的物质,它对人体的血液循环和新陈代谢都有着重要作用。人体缺盐会使人感到头晕、倦怠、全身无力,学习和工作效率降低,长期缺盐甚至会导致心脏病。虽食盐对人体有重要作用,但也不能过多摄入,过多摄入食盐可能引发肾脏疾病和高血压病等。健康成年人摄入食盐量以每天2~6g 为宜。
2、工业上用电解饱和食盐水的方法来制取NaOH 、Cl 2和H 2,并以它们为原料生产
一系列化工产品,称为氯碱工业。原理:2NaCl+ 2H 2O 2NaOH+Cl 2↑+H 2↑
焰色反应
1. 某些金属或它们的化合物在灼烧时,火焰呈现特殊的颜色叫做焰色反应。
2. 焰色反应是元素的性质,与价态无关,是物理变化。
3. 焰色反应的操作步骤:①洗②烧③蘸④烧⑤洗⑥烧
注:观察钾的焰色时,要透过蓝色的钴玻璃片。因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰。
4. 钠、钾等金属的焰色
K (K +)紫色(透过蓝色钴玻璃),Na (Na +)黄色,Cu (Cu 2+)绿色,Ca (Ca 2+)砖红色。
通电
钠及化合物习题
1、下列反应中,Na2O2只表现强氧化性的是()
A. 2Na2O2+2CO2===2Na2CO3+O2
B. 5Na2O2+2MnO4-+16H+===10Na++2Mn2++5O2↑+8H2O
C. Na2O2+MnO2===Na2MnO4 D。 2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O
2、将a1gNa2O溶于b1g水中,a2gNa2O2溶于b2g水中,均得到溶质质量分数为8%的溶液,若a1:a2=31:39,则b1:b2为()A. 1:1 B. 1:2 C. 2:3 D. 1:3
3、将钠、钾分别投入相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为()
A. 2338
:
2239 B. 2238
:
2339
C. 11:
2339
D. 2339
:
2238
4、下列物质混合后,溶液中溶质的质量分数最大的是()
A. 4.6g 钠投入45.4g 水中
B. 6.2g 氧化钠投入42.2g 水中
C. 7.8g 过氧化钠投入42.2g 水中
D. 8g烧碱投入42g 水中
5、将含Na2CO3 10.6g的Na2CO3溶液100mL逐滴滴加到100g 4.56%的盐酸中,将100g 4.56%的盐酸逐滴滴加到含Na2CO3 10.6g的Na2CO3溶液100mL中,两者所产生的气体的质量比是()A. 1:1 B. 2:5 C. 5:2 D. 2:1
6、向0.1mol/LNaOH溶液中通入过量的CO2后,溶液中存在的主要离子是()
A. Na+、CO32-
B. Na+、HCO3-
C. HCO3-、CO32-
D. Na+、OH-
7、用 1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中CO3-和HCO3-浓度之比约是( )
A.1∶3
B.2∶1
C.2∶3
D.3∶2
8、 NaHCO3和Na2 CO3·10H2O晶体的混合物10g,溶于水制成200mL溶液,其中
=0.50mol/L。若将10g的这种混合物,加热到质量不变为止,减少的质量为( )
A.5.3g
B.4.7g
C.5.0g
D.4.0g
9、 2 mol NaHCO3和一定量的Na2O2固体在密闭容器中加热,使其充分反应,测得150℃时,容器中仅剩余两种气体,则容器中剩余的固( )
A.只有Na2CO3
B.一定为Na2CO3和NaOH
C.可能有Na2O2
D.可能有NaOH
10、2.1g CO和H2组成混合气体与足量的O2充分反应后,立即通入足量的Na2O2固体
中,固体质量增加()
A、2.1g
B、3.6 g
C、7.2 g
D、不可确定
11、将 4.34g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体。该混合气体通过电火花引燃,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为()
A.1∶1∶1 B.1∶1∶2 C.1∶2∶2 D.4∶3∶2
12、用纯净的铂丝蘸取某无色溶液在无色火焰上灼烧,火焰呈黄色,说明该溶液中金属离子()
A.只有Na+
B.可能有Na+、也可能有K+
C.一定有K+
D.一定有Na+、也可能有K+
13、下列六种物质:①Na2O ②Na2O2 ③NaCl ④Na2CO3溶液⑤NaOH ⑥NaHCO3,其中不能与CO2反应的是 ( )
A.①④
B.②③
C.③⑥
D.⑤⑥
14、有镁、铝混合粉末10.2g,将它溶于500mL4 mol/L的盐酸中,若要使沉淀质量达到最大值,则需要加入2mol/L的NaOH溶液的体积为 ( )
A.1500mL B.1000mL C.500mL D.100mL 15、下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,
不会引起产物种类改变的是 ( )
A. Na和O2
B. NaOH和CO2
C. Na2O2和CO2
D. C和O2
16、现有X、Y、Z、W等4种钠的化合物,它们之间的相互关系如下:
X W + CO2↑+H2O,Z+CO2→W+O2↑,Z+H2O→Y+O2↑,W + Ca(OH)2→CaCO3↓+Y。则X、Y、Z、W的化学式依次为__ __、___ _、__ __、_ __
17、碱金属氢化物为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,写出其化学方程式;MH能与水剧烈反应MH+H2O=MOH+H2↑,MH与液氨也有类似反应,写出反应方程式。
18、在宇宙飞船中,为了使宇航员得到良好的生存环境,一般在飞船机内安装了盛有Na2O2颗粒的装置,它的用途是产生O2,如果用KO2代替Na2O2也能达到同样的目的,反应产物也很相似。(1)写出KO2与CO2反应的化学方程式。
(2)计算用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2质量比为1:(精确到小数点后的一位小数,相对原子质量:Na-23,K-39)。
19 、将 5.0g碳酸钠、碳酸氢钠和氢氧化钠
固体混合物完全溶解于水,制成稀溶液,然
后向该溶液中逐滴加入1.0mol/L的硫酸,所
加入硫酸的体积与产生CO2的体积(标况下)
关系如图所示:
(1)写出从开始加入硫酸到A点所发生反应
离子方程式;
(2)当加入35mL硫酸时,产生二氧化碳的
物质的量为 mol;(3)计算原混合物
中氢氧化钠的质量分数。
20、现有Na2CO3和NaHCO3的混合物13.7g,用过量的盐酸处理,共收集到气体6.6g,求混合物中NaHCO3的质量分数。
21、碳酸氢钠受热易分解为碳酸钠。现加热5.00g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物的质量减少了0.31g,则原混合物中碳酸钠的质量分数是多少?