实验7--沉淀法制备纳米氧化锌粉体
- 格式:doc
- 大小:1.67 MB
- 文档页数:7
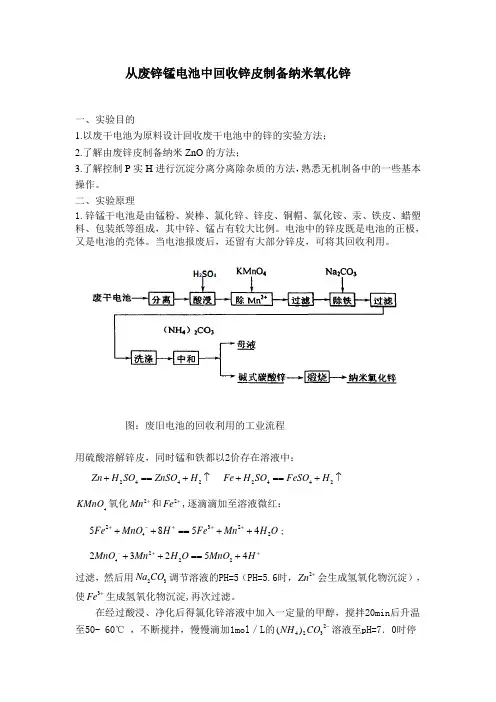
从废锌锰电池中回收锌皮制备纳米氧化锌一、实验目的1.以废干电池为原料设计回收废干电池中的锌的实验方法;2.了解由废锌皮制备纳米ZnO 的方法;3.了解控制P 实H 进行沉淀分离分离除杂质的方法,熟悉无机制备中的一些基本操作。
二、实验原理1.锌锰干电池是由锰粉、炭棒、氯化锌、锌皮、铜帽、氯化铵、汞、铁皮、蜡塑料、包装纸等组成,其中锌、锰占有较大比例。
电池中的锌皮既是电池的正极,又是电池的壳体。
当电池报废后,还留有大部分锌皮,可将其回收利用。
图:废旧电池的回收利用的工业流程用硫酸溶解锌皮,同时锰和铁都以2价存在溶液中:2442Zn H SO ZnSO H +==+↑ 2442Fe H SO FeSO H +==+↑4KMnO 氧化2Mn +和2Fe +,逐滴滴加至溶液微红:423225854Fe MnO H Fe Mn H O +-+++++==++;422223254MnO Mn H O MnO H -++++==+过滤,然后用23Na CO 调节溶液的PH=5(PH=5.6时,2Zn +会生成氢氧化物沉淀),使3Fe +生成氢氧化物沉淀,再次过滤。
在经过酸浸、净化后得氯化锌溶液中加入一定量的甲醇,搅拌20min 后升温至50- 60℃ ,不断搅拌,慢慢滴加1mol /L 的2423()NH CO -溶液至pH=7.0时停止滴加。
保持2h 后,过滤、洗涤、烘干得到高纯碱式碳酸锌。
2.对制得的高纯碱式碳酸锌进行定性检验,检验产品中是否含有3Fe +、Cl -以及2Cu +。
a .3Fe +的鉴定根据3Fe +在酸性溶液中与SCN -反应生成血红色的36()Fe SCN -b .Cl -的鉴定利用生成不溶于硝酸的AgCl 沉淀来鉴定C .2Cu +的鉴定常用亚铁氰化钾法:246262[()][()]Cu Fe CN Cu Fe CN +-+==(红棕色沉淀)3.制备纳米氧化锌从碱式碳酸锌制备纳米氧化锌的关键是控制煅烧温度与时间。

化学实验知识:“纳米氧化锌材料的制备和性能研究实验技术探究”近年来,纳米技术的发展给材料研究带来了全新的可能性。
纳米材料具有比传统材料更优异的性能,因此受到研究人员的广泛关注。
其中,纳米氧化锌材料具有很高的应用价值。
为了更好地研究纳米氧化锌材料的制备和性能,本文将探讨一项“纳米氧化锌材料的制备和性能研究实验技术”的研究。
1、纳米氧化锌材料的制备纳米氧化锌材料主要通过化学方法制备,包括沉淀法、水热法和蒸发沉积法等多种方法。
其中较为常用的是沉淀法和水热法。
本实验以水热法为例进行介绍。
制备步骤:(1)首先将一定比例的Zn(NO3)2和NaOH加入去离子水中,形成Zn(OH)2。
(2)加入NH4HCO3,在搅拌的情况下形成沉淀。
(3)将沉淀用去离子水洗涤至中性,然后加入一定比例的聚乙烯吡咯烷酮(PVP)。
(4)将混合液放入高压釜中,在一定的温度下进行水热处理。
(5)水热处理完成后将混合液冷却至室温,然后离心分离,干燥得到纳米氧化锌材料。
2、纳米氧化锌材料的性能研究(1)结构性能的研究通过X射线衍射(XRD)和透射电子显微镜(TEM)等手段对纳米氧化锌材料的结构进行研究。
XRD可以得到样品的晶体结构信息,TEM 可以获得纳米材料的形貌和尺寸信息。
(2)光学性能的研究主要通过紫外-可见吸收光谱(UV-Vis)和光致发光谱(PL)等手段对纳米氧化锌材料的光学性能进行研究。
UV-Vis可以获得样品的吸收光谱信息,PL可以得到样品的荧光光谱信息。
(3)电学性能的研究主要通过电化学工作站测试纳米氧化锌材料的电化学容量和循环伏安曲线等信息,以研究材料的电化学性能。
总之,纳米氧化锌材料的制备和性能研究是一个极具挑战性的领域,需要仔细设计实验方案,安全施行实验。
此外,实验过程中的每一步都需要仔细操作,以获得可靠、准确的实验结果。
未来,基于对纳米氧化锌材料性能的深入研究,人们应该可以将其应用到更多的领域,促进相关技术的发展。


纳米ZnO 的制备方法王少艳一、液相沉淀法1、化学试剂和仪器ZnCl2 (AR) ,NH4OH ,CH3 (CH2) 2CH2OH(AR) ,C2H5OH(AR) ,DBS-Na (CP) .搅拌器2、实验方法取ZnCl2 加入二次水加热80 ℃溶解配制成溶液,此溶液为A 液,再取等当量的111 倍NH4OH 加入少量C2H5OH 及DBS-Na ,配置成B 溶液. 在大烧杯内,在搅拌条件下让A 溶液和B 溶液混合,适当控制反应时间,生成白色沉淀,测定pH = 7. 沉淀物经洗涤、过滤后,进行CH3 (CH2) 2CH2OH 共沸蒸馏、烘干,在550 ℃下煅烧2 h 。
二、溶胶凝胶法1、试剂与仪器草酸为化学纯;氧化锌为基准试剂;无水乙醇、柠檬酸、乙酸锌、乙醇、丙酮、柠檬酸三铵均为分析纯。
9422 型定时恒温磁力搅拌器; ZK282A 型真空干燥器;SX224210 型箱形电阻炉;2、实验方法1)乙酸锌+ 柠檬酸系列乙酸锌水溶液滴加柠檬酸无水乙醇溶液,成白色溶胶;磁力搅拌,成白色凝胶;加热到70~80 ℃,溶剂蒸发,得白色干凝胶;烘箱中干燥20 h 左右,得白色干胶;研磨,得白色粉末;600 ℃热处理2 h ,体积明显减小,得微灰粉末。
2)乙酸锌+ 柠檬酸三铵系列柠檬酸三铵固体在搅拌下加入乙酸锌水溶液中,70~80 ℃水浴保温5min ,成透明溶液;滴加无水乙醇,搅拌,保温10min ,成白色溶胶状;滴加硝酸,搅拌,成微黄溶液,70~80 ℃水浴保温4 h ,成黄色凝胶;烘箱中干燥20h 左右,得黄色干胶;热处理2 h ,得蓬松微灰粉末。
三、均匀沉淀法1、反应机理本实验以尿素为沉淀剂,与锌的含氧酸盐反应。
反应过程如下。
1)尿素的水解反应:CO(NH2)2+ 3H23·H2O + CO2↑2)OH-的生成:NH3·H2O = NH4+ + OH-3)CO32 -的生成:2NH3·H2O + CO2= 2NH4+ + CO32 -4)形成中间产物碱式碳酸锌:3Zn2 + + CO32 - + 4OH- + H2O = ZnCO3·2Zn(OH)2·H2O ↓5)煅烧得产物ZnO :ZnCO3·2Zn(OH)2·H2O = 3ZnO + 3H2O ↑+ CO2↑2 实验部分1)主要试剂和仪器中国产高压反应釜;日本产Rigaku D/ max - Ⅲ型X射线衍射仪,Cu 靶,λ= 0. 15418 nm。

纳米氧化锌的制备方法
1.方法步骤为:
(1)氧化锌溶液配制:将氧化锌置入自身重量5~10倍、40℃~75℃的去离子水中,搅拌均匀制成氧化锌溶液;(2)充气反应:向氧化锌溶液通入CO?气体,同时搅拌,加热升温到85℃~90℃,保温240~450分钟,然后停止通入CO?气
2.
2.1
(1
2.2
在可溶性锌盐中加入沉淀剂后,当溶液离子的溶度积超过沉淀化合物的溶度积时,即有沉淀从溶液中析出。
沉淀经热解得纳米氧化锌。
常见的沉淀剂为氨水、碳酸铵、和草酸铵。
不同的沉淀剂,其反应生成的沉淀产物也不同,故其分解的温度也不同。
此法操作简单易行,对设备要求不高,成本较低,但粒度分布较宽,分散性差,洗涤原溶液中阴离子较困难。
3.溶胶-凝胶法
实验原料和制备工艺
醋酸锌,柠檬酸三铵,无水乙醇,保护胶,乳化剂,蒸馏水。
以醋酸锌为原料,柠檬酸三铵为改性剂,配置一定浓度的醋酸锌溶液,搅拌均匀后,置于恒温水槽中,在搅拌加热的条件下,均匀的加入无水乙醇,2h后醋酸锌完全溶。

纳米ZnO2的制备实验报告班级:应091-4组号:第九组指导老师:翁永根老师成员:任晓洁 2邵凯 2孙希静 2【实验目的】1.了解纳米氧化锌的基本性质及主要应用2.通过本实验掌握纳米氧化锌的制备方法3.对于纳米氧化锌的常见产品掌握制备原理和方法,并学会制备简易产品。
4.通过本实验复习并掌握EDTA溶液的配制和标定,掌握配位滴定的原理,方法,基准物质的选择依据以及指示剂的选择和pH的控制。
5.掌握基础常用的缓冲溶液的配制方法和原理。
6.加深对实验技能的掌握及提高查阅文献资料的能力。
【实验原理】1. 超细氧化锌是一种近年来发展的新型高功能无机产品,晶体为六方结构,其颗粒大小约在1~100纳米。
纳米氧化锌由于颗粒小、比表面积大而具有许多其表面电子结构和晶体结构发生变化,产生了宏观物体所不具有的特殊的性质,呈现表面效应、体积效应、量子尺寸效应和宏观隧道效应以及高透明度、高分散性等特点。
近年来发现它在催化、光学、磁学、力学等方面展现出许多特殊功能,使在陶瓷、化工、电子、光学、生物、医药等许多领域有重要的应用价值,具有普通氧化锌所无法比较的特殊性和用途。
纳米氧化锌在纺织领域可用于紫外光遮蔽材料、抗菌剂、荧光材料、光催化材料等。
纳米氧化锌一系列的优异性和十分诱人的应用前景。
2. 纳米氧化锌的制备方法主要有:水热法,均相沉淀法,溶胶一凝胶法,微乳液法,直接沉淀法3. 本工艺是将锌焙砂(主要成份是ZnO,主要伴生元素及杂质为铁,铜,铅,镍,铬,镍,此外,还含有其它微量杂质,因而用锌焙砂直接酸浸湿法生产活性氧化锌,必须利用合理的酸浸及除杂工艺,分离铅,脱铁、锰,除钙、镁等重金属)与硫酸反应,生产出粗制硫酸锌,加高锰酸钾、锌粉等,经过提纯得到精制硫酸锌溶液后,再经碳化母液沉淀,制得碱式碳酸锌,最后经烘干,煅烧制成活性氧化锌成品。
4. 氧化锌含量的测定采用配位滴定法测定,用NH3-NH4Cl缓冲溶液控制溶液pH≈10,以铬黑T为指示剂,用EDTA标准溶液进行滴定,其主要反应如下:在氨性溶液中:Zn2++4NH3⇋Zn(NH3)42+加入EBT(铬黑T)时:Zn(NH3)42++EBT(蓝色)⇋Zn-EBT(酒红色)+4NH3滴定开始-计量点前:Zn(NH3)42++EDTA⇋Zn-EDTA+4NH3计量点时:Zn-EBT(酒红色)+EDTA⇋Zn-EDTA+EBT(蓝色)5.活性ZnO的应用:因为活性ZnO具有抗菌,除臭以及除异味等多种作用,本实验制备系列产品,看是否具有除异味的功效,在活性氧化锌中掺杂一定量的银,对常见皮肤病有一定的治疗功效,制备治疗脚气的产品。

均匀共沉淀法制取zno1. 简介均匀共沉淀法是一种常用的制备纳米氧化锌(ZnO)的方法。
该方法具有操作简单、反应时间短、较高产率和纯度等特点。
因此被广泛应用于氧化锌的制备。
2. 均匀共沉淀法的原理均匀共沉淀法是一种通过均匀混合两种不同用途的盐溶液制备氧化锌纳米粒子的方法。
在该方法中,先将氧化锌前体溶于溶液中,然后加入NH4OH,用于提高pH值,促进Zn2+ 沉淀生成Zn(OH)2,并形成胶体粒子。
接着,将其他金属离子的溶液与Zn(OH)2混合,进一步沉淀形成氧化物混合物。
最后,为了获得氧化锌,还需要将混合物进行煅烧处理。
3. 实验过程在实验过程中,首先需要制备两种不同的盐溶液,一种是氧化锌前体,另一种是含其他金属离子的盐溶液。
然后将两个溶液均匀混合,再利用氨水溶液调节pH值。
当pH值为8左右时,混合物开始沉淀。
接着需要连续搅拌20-30分钟,以保证混合物充分均匀混合。
此时,将混合物加入醇类溶剂中,然后以高温(> 300°C)煅烧,在高温下还原并生成氧化锌样品。
4. 实验优势该方法有许多实验优势,包括:4.1 粒子的尺寸和分散性较好,分布范围窄,对于研究粒子的表面结构和性能具有优势;4.2 操作简单,适用于规模化制备;4.3 可以轻易地通过改变混合液体中含量和浓度,来调控最终得到的纳米ZnO的性质,并优化其光电性能;4.4 纳米氧化锌制备过程中的化学反应具有容易控制的化学反应动力学,可以通过单一反应温度调控合成过程。
5. 结论均匀共沉淀法制备氧化锌是一种非常普遍的方法,适用于制备纳米ZnO。
该方法具有高效、简单、灵活和易于控制反应动力学特性等优点。
在未来,该方法将继续被研究和改进,以提高其效率和应用范围,并促进氧化锌在各种领域中的使用。

实验十一 沉淀法制备纳米氧化锌粉体实验一、 实验目的1、了解沉淀法制备纳米粉体的实验原理。
2、掌握沉淀法制备纳米氧化锌的制备过程和化学反应原理。
二、实验原理氧化锌是一种重要的宽带隙(3.37eV )半导体氧化物,广泛的应用在陶瓷、化工、电子、光学、生物、医药等许多领域。
制备纳米氧化锌的化学方法包括沉淀法、溶胶—凝胶法、水热法、微乳液法等方法。
本实验采用沉淀法制备纳米氧化锌粉体。
沉淀法是指包含一种或多种离子的可溶性盐溶液,当加入沉淀剂(如OH -,CO32-等)后,或在一定温度下使溶液发生水解,形成不溶性的氢氧化物、氧化物或盐类从溶液中析出,并将溶剂和溶液中原有的阴离子洗去,得到所需的化合物粉料。
制备氧化锌常用的原料是可溶性的锌盐,如硝酸锌Zn(NO 3)2、氯化锌ZnCl 2、醋酸锌ZnAc 2。
常用的沉淀剂有氢氧化钠(NaOH )、氨水(NH 3·H 2O )、尿素(CO(NH 2)2)等。
用NaOH 作沉淀剂一步法直接制备纳米氧化锌的反应式如下:22)(2OH Zn OH Zn →+-+--→+242)(2)(OH Zn OH OH Zn--++↓→OH O H ZnO OH Zn 2)(224该实验方法过程简单,不需要后煅烧处理就可以得到氧化锌晶体,而且可以通过调控Zn 2+/OH -的摩尔比控制氧化锌纳米材料的形貌。
三、原料及设备仪器1、原料:硝酸锌Zn(NO3)2·6H2O、氢氧化钠NaOH、蒸馏水、乙醇2、设备仪器:磁力搅拌器、离心机、温度计、烧杯、烧瓶、电子天平。
四、实验步骤1、在室温下,在烧杯中称取0.3g Zn(NO3)2·6H2O(0.001mol),然后加入40mL蒸馏水搅拌5min配成无色澄清的溶液。
2、在室温下,在烧杯中称取0.8gNaOH(0.02mol),然后加入40mL蒸馏水,搅拌5min配成无色澄清的溶液。
3、在室温下,将Zn(NO3)2溶液快速滴加到NaOH的溶液中,搅拌得到白色的悬浊溶液。

纳米氧化锌材料的制备纳米氧化锌材料近年来受到广泛关注,因其在光电、催化、生物、传感等领域具有重要应用前景。
本文将介绍纳米氧化锌材料的制备方法,包括溶液法、固相法、气相法等,同时讨论不同制备方法对纳米氧化锌材料的形貌、结构、性质等方面的影响。
一、溶液法制备纳米氧化锌材料溶液法是一种较为常见的纳米材料制备方法,其操作简单、成本相对较低。
在溶液法中,常用的制备纳米氧化锌材料的方法包括沉积-沉淀法、水热法、溶胶-凝胶法等。
下面将逐一介绍这些方法。
1. 沉积-沉淀法:该方法主要是通过沉积-沉淀过程制备纳米氧化锌材料。
首先将锌盐(如氯化锌、硫酸锌等)按一定比例溶解于溶剂中,然后加入碱液或沉淀剂,生成氧化锌沉淀。
最后通过离心、洗涤和干燥等步骤得到纳米氧化锌材料。
该方法制备的纳米氧化锌材料通常具有较大的比表面积和较好的分散性。
2. 水热法:水热法是一种在高温高压条件下制备纳米氧化锌材料的方法。
将锌盐和碱液混合后,加入反应容器中,在高温水热条件下反应一定时间后,即可得到纳米氧化锌材料。
水热法制备的纳米氧化锌材料形貌较为均一,具有较高的结晶度和比表面积。
3. 溶胶-凝胶法:溶胶-凝胶法是一种溶胶和凝胶形成的过程,通过溶胶状态和凝胶状态发生的变化来制备纳米氧化锌材料。
在该方法中,首先通过将锌盐在溶剂中溶解制备溶胶,然后加入适量的沉淀剂或表面活性剂,形成凝胶。
最后通过干燥或煅烧处理得到纳米氧化锌材料。
溶胶-凝胶法制备的纳米氧化锌材料通常具有较好的孔隙结构和较高的比表面积。
二、固相法制备纳米氧化锌材料固相法是一种通过在固相反应中制备纳米氧化锌材料的方法。
常见的固相法包括热分解法、高能球磨法等。
1. 热分解法:热分解法是一种通过在高温下使固态反应发生,从而制备纳米氧化锌材料的方法。
该方法在惰性气氛中将锌源与氧源加热,其反应过程中生成气体或溶于惰性气氛中从而得到纳米氧化锌材料。
热分解法制备的纳米氧化锌材料形貌较为均一,可以调控成不同形状的颗粒。

实验名称纳米ZnO的制备及光催化处理含铬废水一、摘要和引言纳米氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。
由于晶粒的细微化,其表面电子结构和晶体结构发生变化,产生了宏观物体所不具有的表面效应、体积效应、量子尺寸效应和宏观隧道效应以及高透明度、高分散性等特点。
这种特殊的性质使得它在光催化效应方面有了极高的效率。
由于其价格相对低廉,可能成为代替TiO2的新型光催化剂。
实验室和工业中有很多方法来制备氧化锌并用来处理含铬废水的溶液。
如今,我们要制取少量氧化锌并处理含铬废水,研究其催化效率和实际应用价值。
二、实验目的和要求(1)掌握一步沉淀法制备材料的原理、方法、步骤;(2)用一步沉淀法制备纳米ZnO粉体;(3)熟悉离心搅拌器、离心机、烘干箱等仪器的使用;(4)利用纳米ZnO光催化原理处理含铬废水,直接以太阳光为光源,对含铬废水进行处理,使六价铬光催化还原为三价铬。
三、实验原理化学沉淀一步法是利用锌盐与强碱在一定温度下直接反应而生成纳米氧化锌粉体的制备方法,其反应时在较低温度和常压下于敞开容器中进行的。
此方法可免去热分解工艺过程,不仅工艺简单,而且产品的分散性好,如果直接用于涂层还可以免去干燥过程,被视为最简单的方法。
试验发现【1】,只有强碱水溶液在特定温度下于无机盐溶液反应才能直接生成氧化锌。
试验发现【2】,在一步法制备过程中,主要有一下几个因素对纳米氧化锌的形成、粒度等产生较大的影响。
反应温度:反应温度的影响最大。
在选择反应温度时,应尽可能降低温度值。
以节约能源。
但反应温度在50度以下时,生成物中夹杂有锌的胶体出现,不能得到纯净的纳米氧化锌产物。
反应时间:反应时间的影响也比较显著。
反应时间的长短将影响产品的产率、粒度等。
因此,反应时间的选取应以达到纳米氧化锌获得良好结晶为目标。
在其他条件变化时,反应时间不应过长。
反应时间短于20分时。
生成物中也夹杂有锌的胶体出现,同样不能得到纯净的氧化物。

实验报告纳米氧化锌的制备一、实验目的:1、了解纳米ZnO的性质及应用。
2、掌握制备纳米ZnO的原理和方法,并比较不同方法的优缺点.3、掌握检验纳米ZnO光催化性能的一般方法。
4、查阅资料,计算产品的利润.二、纳米ZnO的性质:纳米级ZnO同时具有纳米材料和传统ZnO的双重特性。
与传统ZnO产品相比,其比表面积大、化学活性高,产品细度、化学纯度和粒子形状可以根据需要进行调整,并且具有光化学效应和较好的遮蔽紫外线性能,其紫外线遮蔽率高达98%。
同时,它还具有抗菌抑菌、祛味防酶等一系列独特性能.纳米ZnO粒子为球形,粒径分布均匀,平均粒径20~30纳米,所有粒子的粒径均在50纳米以下。
纳米ZnO粉体的BET比表面积在35m2/g以上。
由于纳米ZnO具有比表面积大和比表面能大等特点,自身易团聚;另一方面,纳米ZnO表面极性较强,在有机介质中不易均匀分散,这就极大地限制了其纳米效应的发挥。
因此对纳米ZnO 粉体进行分散和表面改性成为纳米材料在基体中应用前必要的处理手段。
三、实验原理:制备纳米ZnO的方法有很多。
按物质的原始状态分为固相法、液相法、气相法3类。
固相法包括沉淀法;气相法包括化学气相沉积法、气相反应合成法、化学气相氧化法、喷雾热分解法; 3液相法包括溶胶—凝胶法、微乳液法、水解加热法、水热法等.本次试验采用沉淀法制备纳米ZnO。
本实验以锌焙砂(主要成分为氧化锌、锌并含有少量铁、铜、铅镍、镉等杂质,杂志均以氧化物形式存在)和硫酸为主要原料,制备七水硫酸锌,以碳酸氢铵为沉淀剂,采用碱式碳酸锌分解法制备活性氧化锌。
四、实验仪器与试剂:仪器:分析天平、托盘天平、温度计、蒸发皿、胶头滴管、马弗炉、烧杯、量筒、玻璃棒、恒温水浴锅、布氏漏斗、抽滤机、坩埚、研磨、200目筛子、石棉网、药匙、锥形瓶、洗瓶、滤纸、真空泵、PH试纸。
试剂:锌焙砂、去离子水、3mol/l硫酸溶液、碳酸氢铵、0。
1mol/l高锰酸钾溶液、锌粉、氧溶液、水合肼。
氧化锌纳米粉体的低温化学法合成和性能研究一、实验目的1.了解一些常规低温液相化学方法制备纳米材料的基本原理和方法。
2.了解纳米ZnO的发光性能,熟悉荧光仪的使用方法。
二、实验原理1.氧化锌纳米粉体的制备(1)溶胶凝胶法溶胶凝胶法是60年代发展起来的一种制备玻璃,陶瓷等无机材料的新工艺。
其基本原理是用金属醇盐水解直接形成溶胶或者经解凝形成溶胶,然后使溶胶聚合凝胶化,再将凝胶干燥焙烧去除有机成分,最后得到无机材料。
由于该方法具有化学均匀性好、产品纯度高、颗粒细、烧结温度低和可容纳不溶性组分或不沉淀组分等优点,许多人用此法产生团聚块等缺点。
柠檬酸溶胶凝胶是以柠檬酸和无机金属盐做原料,所涉原料便宜,同时具有溶胶凝胶法的优点,因此它被广泛用来制备纳米材料。
(2)化学沉淀法化学沉淀法是一种制备纳米材料的洁净的方法,其基本原理是一定条件下在包含一种或多种金属离子的可溶性溶液里加入沉淀剂,形成不溶性的氢氧化物、水合氧化物或盐类从溶液中析出,并将溶剂和溶液中原有的阴离子洗去,经热分解或脱水即得到所需的氧化物粉体。
化学沉淀法又分为共沉淀法、均相沉淀法、金属醇盐水解法。
其中均相沉淀法是较常用的方法,它通常是以尿素的缓慢水解来生成沉淀剂氨水,从而克服了由外部向溶液中加沉淀剂而造成沉淀剂不均匀性,结果沉淀不能在整个溶液中均匀出现的缺点。
(3)燃烧法燃烧法是以金属的硝酸盐和有机物为原料,利用硝酸和有机物之间的氧化还原反应热来合成金属氧化物的新方法。
和溶胶凝胶法相比,燃烧法具有反应时间短、所用试剂便宜、设备操作简单等优点。
人们用此方法成功合成了超导材料及钙钛矿半导体材料。
但溶胶凝胶法和燃烧法都涉及到有机物的燃烧,会产生大量污染环境的气体。
(4)水热法水热法是另一种制备纳米材料的洁净的方法。
它是在特制的密闭反应器(高压釜)中,采用水溶液或有机溶剂作为反应体系,通过对反应体系加热至临界温度(或接近临界温度),在反应体系中产生高压的环境而进行无机合成和材料制备的一种有效方法。
2003年6月 云南化工 Jun.2003 第30卷第3期 Yunnan Chemical Technology V ol.30,No3 均匀沉淀法制备纳米氧化锌和片状氧化锌粉体李东英,安黛宗,刘珩(中国地质大学材料科学与化学工程学院,武汉430074)摘 要: 以氯化锌、尿素为原料,采用均匀沉淀法在一定条件下制备得到纳米级氧化锌粉体。
并以TEM、S EM、XRD等测试手段对产物的粉体结构、形貌进行了研究。
结果表明,在200℃下热处理得到的氧化锌粉体结晶性能良好;在较大的反应物浓度及反应物浓度比下可以得到较小的晶体粒径,平均为20nm,且分散性好;在较小的浓度及较小的浓度比下得到的晶体粒径较大,并呈片状生长。
阐述了浓度对于粒径大小的影响并得出片状氧化锌微晶生长的最佳条件。
关键词: 均匀沉淀法;片状氧化锌;纳米氧化锌中图分类号: O614.24 文献标识码: A 文章编号: 1004-275X(2003)03-0037-03Preparation of Nanometer-ZnO and Sheet-ZnO By Uniform-Precipitation MethodL I Dong-ying,AN Dai-zong,LIU Hen g(School of M aterial Science and C hemical Engineering,China University of Geosciences,Wuhan430074,China)Abstract: Nanometer ZnO w as s ynthesized by uniform precipitation-method from ZnCl2and carbamide,and TEM, S EM and XRD were used to characterize the p roduct.Result indicated that pow dered ZnO w ith good crystal capabilitycould be obtained after treatment at200℃.Less granularity,bigger reactant concentration and proportion.The crystalgrew in sheet,with20nanometers at average.Effect of concentration on the granularity,and the optimal g rowing condi-tion of sheet ZnO crystals w ere discussed.Keywords: uniform precipitation method;sheet ZnO;nanometer ZnO 高性能材料的广泛应用越来越取决于对组成材料的晶粒尺寸、分布和形貌的控制。
沉淀法制备氧化锌粉体郑兴芳,郭成花,郑建国(临沂大学化学化工学院,山东临沂276005)摘要:以碳酸钠和硫酸锌为原料,采用沉淀法制备前驱体碱式碳酸锌,前驱体经过热分解得到氧化锌粉体。
采用热重分析(TG-DTG-DTA)、X射线衍射(XRD)、红外光谱(IR)和扫描电镜(SEM)等方法对前驱体和产品氧化锌进行表征。
结果表明:制备的前驱体为碱式碳酸锌Zn4(OH)6CO3;以水、乙二醇为溶剂及聚乙二醇(PEG)为分散剂,均可制备出较为纯净的氧化锌;乙二醇为溶剂和PEG为分散剂,改善了氧化锌的形貌和分散性,避免了氧化锌团聚。
关键词:氧化锌;制备;沉淀法中图分类号:TQ132.4文献标识码:A文章编号:1006-4990(2012)03-0019-03Preparation of zinc oxide powder by precipitation methodZheng Xingfang,Guo Chenghua,Zheng Jianguo(School of Chemistry and Chemical Engineering,Linyi University,Linyi276005,China)Abstract:The precursor,basic zinc carbonate was obtained by precipitation method with ZnSO4and Na2CO3as raw materials. Then ZnO powders were prepared after pyrolysis of precursor.Precursor and ZnO powders were characterized and analyzed by TG-DTG-DTA,XRD,IR,and SEM respectively.Results showed that the precursor was Zn4(OH)6CO3;pure ZnO can be both prepared by water and ethylene glycol as solvents and by PEG as dispersant;and the morphology and dispersibility of ZnO could be improved and agglomeration could be avoided with ethylene glycol as solvent and PEG as dispersant.Key words:zinc oxide;preparation;precipitation method纳米氧化锌由于其粒子尺寸小、比表面积大、具有明显的表面与界面效应等特点,在化学、光学、生物和电学等方面表现出许多独特的优异的物理和化学性能,被广泛应用于变阻器、气体敏感材料、电材料以及光材料等重要领域。
纳米氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100nm。
由于晶粒的细微化,其表面电子结构和晶体结构发生变化,产生了宏观物体所不具有的表面效应、体积效应、量子尺寸效应和宏观隧道效应以及高透明度、高分散性等特点。
利用其在光、电、磁、敏感等方面的奇妙性能,可制造气体传感器、荧光体、变阻器、紫外线遮蔽材料、图像记录材料、压电材料、压敏电阻、高效催化剂、磁性材料和塑料薄膜等。
由于纳米氧化锌一系列的优异性和十分诱人的应用前景,因此研发纳米氧化锌已成为许多科技人员关注的热点[1]。
由于纳米氧化锌的粒度小、比表面积大,在应用时特别容易产生团聚现象,所以研究纳米氧化锌有效的改性技术及在基体中达到良好的分散,以解决应用时的团聚问题;对产品的表面改性和应用进行研究,开拓高性能产品,拓宽产品应用领域,以满足不同需要,开发出适合我国国情的纳米氧化锌的生产工艺。
1微波均相沉淀的特点微波均相沉淀法具有快速加热效应、热点或表面效应、压力蒸煮器效应和离子过热效应。
与传统方法相比,微波辐射法具有反应速度快、反应条件温和、反应效率高等优点,而且产品具有较高的纯度、窄的粒径分布和均一形态。
微波介电加热过程还伴随着非热效应[2]。
2制备过程2.1反应机理以七水合硫酸锌为锌源,尿素为均相沉淀剂,采用均相沉淀法在微波辐射条件下制备纳米ZnO,反应机理[3]:2.2实验过程称取适量的硫酸锌和尿素分别溶于一定量的蒸馏水中,倒入三颈烧瓶中充分混合均匀,放入微波反应器中,接温度计和冷凝管,在不断搅拌下逐渐升温。
随着尿素的分解,溶液出现浑浊,直至出现大量白色沉淀,在一定微波辐射下反应一定时间后,停止。
将三颈烧瓶取出放入冷水中冷却至室温,然后抽滤,用pH为9的氨水和无水乙醇分别润洗、抽滤,再经真空干燥24h。
取出粉末研磨后放入马弗炉中,在450℃下灼烧2h,取出研磨后即得纳米ZnO。
实验条件见表1[2]。
表1实验条件项目指标ZnSO4浓度/mol·L-10.15ZnSO4与尿素物的质量比1∶2,1∶3,1∶4反应温度/℃93反应时间/h2焙烧时间/h2焙烧温度/℃4503结果与讨论3.1粉体的SEM 分析硫酸锌浓度0.15mol/L,温度93℃,时间2h[2],在不同硫酸锌与尿素物质的量比下制备纳米ZnO。
2001年6月第31卷第3期 西北大学学报(自然科学版)Jou rnal of N o rthw est U n iversity (N atu ral Science Editi on ) Jun .2001V o l .31N o.3 收稿日期:1999211205 基金项目:陕西省教委重点科研资助项目(96JZK 18) 作者简介:祖 庸(19372),女,安徽巢县人,西北大学教授,从事纳米材料的制备、改性和应用研究。
沉淀法制备纳米氧化锌的研究祖 庸,李晓娥,樊 安,刘超峰(西北大学化学工程学系,陕西西安 710069)摘要:通过实验和理论分析,对均匀沉淀法和直接沉淀法制备纳米ZnO 进行了比较。
结果表明:以硝酸锌为原料、尿素为均匀沉淀剂制得的纳米ZnO 粒径小、分布窄、分散性好,收率大体相等,远优于直接沉淀法制备的纳米ZnO 。
关 键 词:纳米氧化锌;均匀沉淀法;直接沉淀法中图分类号:TQ 13 文献标识码:A 文章编号:10002274(2001)0320232203 纳米粒子具有许多特殊的性能,如量子效应、宏观量子隧道效应、表面效应、小尺寸效应等[1],因而赋予纳米ZnO 许多新的性质和用途。
如用于制造气体传感器、荧光体、紫外线屏蔽材料、变阻器、图像记录材料、压电材料、精密陶瓷材料、化妆品及医药材料等。
纳米ZnO 的制备方法很多[2~8],我们采用沉淀法进行制备,沉淀法可制得颗粒细、分布窄、纯度高的纳米粒子,且产品综合成本低、工艺简单,易实现工业化生产。
本文对均匀沉淀法和直接沉淀法制备纳米ZnO 进行了比较,认为均匀沉淀法优于直接沉淀法,并给出均匀沉淀法制备纳米ZnO 的最佳工艺条件。
1 沉淀法制备纳米ZnO 的原理1.1 直接沉淀法(D P M )[3]该法的原理是在可溶性锌盐溶液中加入沉淀剂后,溶液中离子的浓度积超过沉淀化合物的溶度积时,即有沉淀从溶液中析出。
经过滤、洗涤、干燥、热处理后,得到纳米ZnO 。
以尿素为沉淀剂制备纳米氧化锌粉体刘超峰胡行方祖庸摘要:本文以尿素、硝酸锌为原料,采用均匀沉淀法制备了纳米级ZnO. 以TG--DTA热分析、红外光谱及XRD、TEM、激光衍射粒度分析仪等测试手段, 对纳米级ZnO的粉体结构和形貌进行了研究. 结果表明,在450C下热处理得到的纳米ZnO粉体结晶性能良好,改变反应条件, 制备了平均粒径在1580nm,粒度分布窄,分散性好的纳米ZnO粉体. 文中亦对过饱和度对粉体粒径大小的影响以及均匀沉淀法形成纳米氧化锌的机理进行了探讨. 关键词:纳米氧化锌,均匀沉淀法,成核及其生长,过饱和度分类号:TF 123Nanometer-sized Zinc Oxide Prepared by Using Ureaas Precipitating AgentLIU Chao-FengHU Xing-FangZU Yong(Shanghai Institute of Ceramics, Chinese Academy of SciencesShanghai 200050China)(Dept. of Chemical engineering Northwest UniversityXi'an 710069China)Abstract Nanometer-sized ZnO particles were prepared by using a homogeneous precipitation method, urea and zinc nitrate as the starting materials. icrostructure and morphology of nanometer-sized ZnO were investigated by means of TG-DTA, IR absorption spectra, X-ray diffractometry, TEM and Laser particle size analyzer. The results indicated thatwell-crystallized nano-ZnO was obtained with annealing temperature at 450 C. Narrow-sized, finely dispersed nano-ZnO with a size of 1580nm was available by controlling reactant conditions. The effects of supersaturation on particle sizes and formation mechanism of nano-ZnO were also discussed.Key words nanometer-sized ZnO, homogeneous precipitation method, nucleation and growth, super saturation degree1 引言高性能材料的广泛应用越来越取决于对组成材料的晶粒尺寸、分布和形貌的控制. 氧化锌粉体广泛的被用来制造功能器件(传感器,变阻器等)、色素、电记录材料、医用材料以及光催化材料等许多方面. 粒子的超细化可以显著的改善氧化锌的应用性能,而且纳米氧化锌在磁、光、电敏感材料方面呈现常规材料所不具备的特殊性能,使得高品质氧化锌的应用前景广阔. 而合成高纯度的、粒径和形貌可控的纳米氧化锌粉体是制备高性能纳米材料的第一步[1].制备纳米氧化锌的方法很多,归纳起来有溶胶-凝胶法[2]、溶液-悬浮液蒸发法[3]、溶液的气相分解法[4]、传统的陶瓷合成法[5,6]和湿化学合成[7,8]等. 以上制备纳米氧化锌的方法, 由于工艺路线复杂或有机原料的成本高或设备昂贵而使工业化生产受到限制. 均匀沉淀法既改进了直接沉淀法制备粉体中存在的反应物混合不均匀,反应速率不可控制等缺点,又克服了溶胶-凝胶法使用的金属醇盐成本高的缺点. 它还具有工艺简单、操作简便、对设备要求不高、产物纯度高、粒度和组成均匀等优点,从而使其颇具工业化潜力. 因而越来越受到关注. 本实验以尿素为均匀沉淀剂,硝酸锌为原料,采用相对简单的工艺, 首次制备了粒径可控、分散性良好的纳米氧化锌粉体,并系统地研究了制备条件对粒径大小、形貌的影响,探讨了纳米氧化锌粉体形成的机理.2 实验2.1 纳米氧化锌粉体的制备先将分析纯的尿素用二次去离子水溶解在烧杯中得到一澄清溶液,再补加适量的二次去离子水,达到所需体积. 实验中,尿素与硝酸锌的摩尔浓度比为2:1. 然后在95125C下加热溶液进行反应. 由于水溶液在100C以上沸腾,故100C以上的反应在密闭容器中进行. 溶液在加热的过程中会发生如下反应. 首先尿素在提高的温度下开始缓慢水解:(1)水解产物与硝酸锌反应生成碱式碳酸锌沉淀,(2)沉淀经过滤、洗涤, 在100~110C下真空干燥箱中干燥2h左右. 干燥后的沉淀置于马弗炉中,在450 C下煅烧3h得到氧化锌产品.(3)表1列出了纳米氧化锌粉体的制备条件.表1 纳米氧化锌粉体的制备条件Table 1 Conditions of preparing of nanometer-sized ZnONumber Urea/mol.L-1Reactanttemperature/CReactant time/h TEM micrographs Mean size/nmZ-1 1.0102 1.5a(calcined at450C) b9calcined at 550C)Z-2 1.095 6.0c80Z-30.03095 6.0d25Z-4 1.0120 1.5e35Z-5 1.0120 1.5f152.2 样品的性能表征以ULVAC TGD--5000型热重分析仪对反应生成的中间产物进行TG--DTA分析,以了解热处理过程中的各种变化;用红外光谱仪(7199--C傅立叶红外光谱仪)测定反应生成的中间产物热分解前后的变化,以得到热处理过程中基团结构变化的信息;以D/max--10型XRD进行物相结构分析;以JEM--2000CX型TEM观察晶粒尺寸和形貌;并采用激光衍射仪测定纳米氧化锌的粒度分布, 以便与透射电镜所得信息进行比较.3 结果和讨论3.1 样品的热分析及红外光谱分析图1给出了反应中碱式碳酸锌的差热和热重曲线. 从TGA曲线可以看出,在250C附近有一个强烈的放热峰,说明碱式碳酸锌在这一温度下分解,同时伴随着TG曲线在230~280C之间迅速下降,然后缓慢下降,至430C以后曲线趋于平缓,说明中间产物碱式碳酸锌基本完全分解为氧化锌. 图2给出了反应中生成的中间沉淀物分别在烘干后和在450C下锻烧3h所得产物的红外透过光谱. 从图中曲线a可以发现,未经煅烧沉淀物分别在波数为1381、830和740cm-1处出现吸收峰,这是由于CO22-的晶格振动引起的红外吸收. 对比在450C下煅烧后所得产物的红外透过光谱曲线b,原来在上述波数处出现的碱式碳酸锌的特征吸收峰全部消失,而只在波数为340cm-1处出现一个新的强烈的吸收峰,新的吸收峰的出现归因于可用经典分散理论解释的氧化锌的本征晶格吸收引起的[9]. 红外光谱分析进一步证明了在450 C下煅烧中间沉淀物分解完全.图1 中间沉淀物的TG-DTA曲线Fig. 1 TG-DTA curves of the intermediate product图2 中间沉淀物在煅烧前后的红外光谱Fig. 2 IR patterns of the intermediate product(a) Uncalcined; (b) Calcined at 450C3.2 产品的[WTHZ] X射线衍射分析图3给出了分别在Z-2、Z-3、Z-5条件下制备的氧化锌粉体的X射线衍射图. 从图中曲线可以看出,尽管是超细粉末,但它们的衍射峰仍相当尖锐,说明它的结晶性良好,其D值也与JCDPS卡片361451号一一对应,说明生成产物氧化锌具有六方晶系结构,在粉末衍射图上无其他杂质相存在.图3 中间沉淀物在450C下, 热处理3h后ZnO样品的XRD曲线Fig. 3 XRD patterns of the ZnO powder by calcining the intermediateproducts at 450 C for 3h(a) Z-2; (b) Z-3; (c) Z-53.3 氧化锌粉末的粒子形貌及粒度分析将表1中所列条件下制备的氧化锌粉体样品,置于去离子水中,以超声波分散后取样,在透射电镜下观察,其粒子形貌如图4所示. 可以看出,以均匀沉淀法制备的纳米氧化锌粉体, 晶粒尺寸在15~80nm,粒径大小均匀,分散性良好. 并且随着氧化锌粒径的增长,粒子形状也相应的由类球形、球形转变为规则的六方型,说明随着粒径的增长, 氧化锌粒子的晶格的完整性得到进一步改善. 实验中用激光衍射粒度仪对Z--5条件下制备的氧化锌粉体进行粒度分析,图5给出了其粒度分布曲线,这一数据与用透射电镜实际观察所得到信息是一致的.图4 与表1对应的在不同条件下制备的纳米氧化锌的透射电镜照片Fig. 4 TEM micrographs of ZnO particles prepared under the conditions described in table 1图5 Z-5条件下制备的纳米ZnO的粒度分布Fig. 5 ZnO particle size distribution under the condition Z-53.4 过饱和度对形成纳米氧化锌粒径的影响超细颗粒的生成过程是新相的形成及其生长过程,过程的推动力可用自由能差崐值来描述[11]. 对于从溶液中析晶形成超细颗粒的过程可用类似化学反应的方程式来表示:A(溶液)= A(晶体)(4)开始时溶液中活度为a,随着析晶的进行,A物质在溶液中的活度不断降低,最后达到平衡状态,此时溶液中A的活度为平衡活度a c,按照Van't Hoff方程.ΔG=-RTlnk+RTlnQ(5)式中k为平衡常数,平衡时产物与反应物的活度比;Q为开始析晶时产物与反应物的活度比.对于溶液析晶:(6)将(6)式代入(5),则ΔG=RTln(a c/a)(7)若不考虑活度与浓度的差异,则上式可改写为:ΔG=RTln(c c/c)(8)根据热力学第二定律:ΔG T;P<0时,析晶为自发过程,即当c c/c>0或c-c c>0时,过饱和度越大,成核速率越快. 加快成核速率降低生长速率有利于生成粒径细小的晶粒. 实际上过饱和度的增加同时也有利于核的生长,图6描述了过饱和度对成核速率I、生长速率U以及析出晶粒半径r的影响. 随着过饱和度的增加,成核速率和生长速率均增加,但进一步提高过饱和度,成核速率增长占优,由此可见, 过饱和度的提高有益于在溶液中析出细小的晶粒. 对比在相同的反应物浓度配比,分别在95、120 C下反应制备的纳米氧化锌透射电镜照片(c)、(e),氧化锌粒径由80nm下降至35nm左右. 这是因为在120 C下进行的反应, 溶液保持在密闭容器中,因而尿素水解生成的构晶组份CO2不能散失,提高了容器中CO2的分压,增加了CO2在溶液中的溶解度,亦即增加了成核所需的过饱和度,过饱和度的增加有利于在溶液中析出更为细小、均匀的沉淀. 在Z5条件下制备的纳米氧化锌,从TEM照片(f)可以看出, 其粒径尺寸更小, 这是由于在相应体积不变的情况下,增加尿素的浓度进一步提高了反应中成核所需过饱和度所致.图6 过饱和度对成核速率I, 生长速率U及晶粒尺寸r的影响[11]Fig. 6 Dependence of nucleation velocity I, growth velocity U andgrain size r on super saturation degree Δc(see ref. 11)3.5 均匀沉淀法形成纳米氧化锌的机理粒径小、粒度分布均匀是高品质超细颗粒必须具备的基本特征之一,为了达到上述目的,在制备粉体过程中,希望晶核的形成及核的生长过程得到很好的控制. 通常采用滴加沉淀剂直接与反应物反应得到沉淀的方法,很难防止沉淀剂局部浓度过高而造成溶液中局部过饱和度过大,会使溶液中同时进行均相崐成核和非均相成核,造成沉淀粒度分散不均匀. 以尿素为均匀沉淀剂制备纳米氧化锌的过程中,沉淀剂不是直接与硝酸锌反应,而是通过尿素水解生成的构晶离子OH-,CO2与硝酸锌反应. 反应(1)是慢反应,反应(2)是快反应,,尿素溶液在加热下缓慢水解是整个反应的控制步骤,因而不会造成溶液中反应物浓度的突然增大,构晶离子均匀的分布在溶液的各个部分,与反应物硝酸锌可达到分子水平的混合,因而能够确保在整个溶液中均匀的反应生成沉淀.4 结论1. 以尿素为均匀沉淀剂、硝酸锌为原料, 在不同的反应条件下制备了分散性良好、粒子平均尺寸在1580nm氧化锌粉体.2. 与一般沉淀法比较,均匀沉淀法克服了反应物在溶液中混合不均匀的缺点,保证了成核的均匀性,因而制备的粉体粒径小、粒度分布窄.3. 本实验原料易得,制备工艺简单,粉体纯度高,性能好,且易于工业化生产.作者单位:刘超峰胡行中国科学院上海硅酸盐研究所上海200050方祖庸西北大学化工系西安710069参考文献1 Gupta T K. J. Am. Ceram. Soc., 1990, 73: 1817--18402 Lauf R J, Bond W D. Ceram. Bull., 1984, 63: 278--2823 Sonder E, Quinky T C, Kinser L. Amer. Ceram. Soc. Bull., 1984, 63: 278--2864 Ivers-Tiffee E, Seitz K. Amer. Soc. Bull., 1987, 66: 1348--13885 Chen Y C, Shen C Y, Chen H Z, Jap. J. Appl. Phys., 1991, 30: 84--906 Lee N Y, Kim M S, Chung I J, J. Materials. Sci., 1991, 26: 1126--1130 and Jap. J. Appl. Phys., 1991, 30: 1017--10227 Haile S M, Johnson D W, Wiseman G H, J. Am. Ceram. Soc., 1989. 728 Dosch R G, Tuttle B A, Brooks R A. J. Mater. Res., 1986, 1: 90--939 PHILIPP H R, LEVINSON L M. J. Appl. Phys., 1976, 47: 1112--112210 Collings R J, Kleinman D A. J. Phys. Chem. Solids, 1959, 11: 190--19211 华东理工大学技术物理研究所编. 超细颗粒制备科学与技术. 上海: 华东理工大学出版社, 1996. 113-115摘自《无机材料学报》。
实验七沉淀法制备纳米氧化锌粉体一、实验目的1、了解沉淀法制备纳米粉体的实验原理。
2、掌握沉淀法制备纳米氧化锌的制备过程和化学反应原理。
3、了解反应条件对实验产物形貌的影响,并对实验产物会表征分析。
二、实验原理氧化锌是一种重要的宽带隙 eV)半导体氧化物,常温下激发键能为60 meV。
近年来,低维(0维、1维、2维)纳米材料由于具有新颖的性质已经引起了人们广泛的兴趣。
氧化锌纳米材料已经应用在纳米发电机、紫外激光器、传感器和燃料电池等方面。
通常的制备方法有蒸发法、液相法。
我们在这里主要讨论沉淀法。
沉淀法是指包含一种或多种离子的可溶性盐溶液,当加入沉淀剂(如OH--,CO32-等)后,或在一定温度下使溶液发生水解,形成不溶性的氢氧化物、氧化物或盐类从溶液中析出,并将溶剂和溶液中原有的阴离子洗去,得到所需的化合物粉料。
均匀沉淀法是利用化学反应使溶液中的构晶离子由溶液中缓慢均匀地释放出来。
而加入的沉淀剂不是立即在溶液中发生沉淀反应,而是通过沉淀剂在加热的情况下缓慢水解,在溶液中均匀地反应。
纳米颗粒在液相中的形成和析出分为两个过程,一个是核的形成过程,称为成核过程;另一个是核的长大,称为生长过程。
这两个过程的控制对于产物的晶相、尺寸和形貌是非常重要的。
制备氧化锌常用的原料是可溶性的锌盐,如硝酸锌Zn(NO3)2、氯化锌ZnCl2、醋酸锌。
常用的沉淀剂有氢氧化钠(NaOH)、氨水(NH3.H2O)、尿素(CO(NH2)2)。
一般情况下,锌盐在碱性条件下只能生产Zn(OH)2沉淀,不能得到氧化锌晶体,要得到氧化锌晶体通常需要进行煅烧高温。
均匀沉淀法通常使用尿素作为沉淀剂,通过尿素分解反应在反应过程中产生NH3 H2O与锌离子反应产生沉淀。
反应如下:O H NH CO O H NH CO 23222223)(⋅+→+ (1) OH -的生成:-++→⋅OH NH O H NH 423 (2)CO 32-的生成:O H CO NH CO O H NH 223422322++→+⋅-+ (3)形成前驱物碱式碳酸锌的反应:()↓⋅⋅→+++--+O H OH Zn ZnCO O H OH CO Zn 2232232243 (4)热处理后得产物ZnO :()O H CO ZnO O H OH Zn ZnCO 22223232+↑+→⋅⋅ (5)本实验通过Zn(NO 3)2和NaOH 之间反应得到的Zn(OH)42-进行热分解反应制备了氧化锌纳米晶体。
用NaOH 作沉淀剂一步法直接制备纳米氧化锌的反应式如下:↓→+-+22)(2OH Zn OH Zn (6)--→+242)(2)(OH Zn OH OH Zn (7)--++↓→OH O H ZnO OH Zn 2)(224 (8)该实验方法过程简单,不需要后煅烧处理就可得到氧化锌晶体,而且可以通过调控Zn 2+/OH ‾的摩尔比控制氧化锌纳米材料的形貌。
三、实验仪器与试剂仪器:恒温水浴、磁力搅拌器、离心机、温度计、烧杯、烧瓶、电子天平。
试剂:硝酸锌Zn(NO 3)2·6H 2O 、氢氧化钠NaOH 、蒸馏水、乙醇四、实验步骤用NaOH 作沉淀剂一步法直接制备纳米氧化锌。
实验方案一 产物为柱状结构1、在室温下,在烧杯中称取 g Zn(NO 3)2·6H 2O ( mol )然后加入40 mL 蒸馏水,搅拌5分钟配成无色澄清的溶液。
2、在室温下,在烧杯中称取 g NaOH mol) 然后加入40 mL 蒸馏水,搅拌5分钟配成无色澄清的溶液。
3、在室温下,将Zn(NO3)2溶液快速滴加到NaOH的溶液中,磁力搅拌5分钟得到无色透明溶液。
4、将透明溶液转移到150mL烧瓶中在80 °C 的水浴中反应2 h。
观察实验现象,并记录时间。
5、将生产的白色沉淀物分别用水和酒精洗涤3次,进行离心分离后,放在烘箱中60 °C 下干燥10 h后得到粉体。
(Zn2+/OH‾的摩尔比为1 :20)实验方案一产物 80°C产物的XRD图证明产物为六角相的氧化锌图1 以Zn(NO3)2为锌源80 °C下反应6 h得到的纳米结构ZnO的XRD图谱.实验方案一 80°C产物的SEM表征图2. NaOH浓度为 mol/L,80 °C下不同反应时间合成ZnO纳米结构的SEM照片 (A)5 min;(B)30 min;(C)6 h (Zn2+/OH‾的摩尔比为1 : 20)图1以Zn(NO3)2为锌源,NaOH浓度为 mol/L时,Zn2+/OH‾的摩尔比为1 : 20, 80 °C反应6 h所得产物ZnO的XRD图谱,全部衍射峰与标准图谱(JCPDS No. 36–1451)符合一致。
晶格常数a = nm,c = nm,与六角结构的数据相吻合。
并且从图谱中可以得出,合成的ZnO不需要煅烧就具有良好的结晶度。
实验方案一 180°C产物图3为以Zn(NO3)2为锌源,NaOH浓度为 mol/L时,Zn2+/OH‾的摩尔比为1 : 20,80 °C下水浴处理不同反应时间合成的花状结构ZnO的SEM照片。
当反应进行5 min 后,反应液中出现少量的白色沉淀,取样观察发现(图2A),花状结构的ZnO已经存在,尺寸为–μm。
图2A内高倍数放大照片,可以清楚地看到花状结构的ZnO是由许多圆锥组成,圆锥的尺寸是沿着轴向长度而降低,圆锥的表面是粗糙的。
反应30 min后,取样观察,生成的ZnO的纳米结构的形貌如图2B所示,ZnO仍为花状结构,花状结构的尺寸没有发生明显的变化,从2B内的高倍数放大照片可以看出,组成花状结构的圆锥的底部呈现六棱锥结构,六棱锥的表面是光滑的,而圆锥的顶部与反应5 min后取样观察的圆锥的顶部的形貌没有什么明显的变化,表面仍然很粗糙。
反应6 h后,取样观察发现,生成花状结构的ZnO完全是由六棱锥组成,棱锥的表面十分光滑(图2C)。
随着反应时间的延长,生成的ZnO的结晶度得到提高。
图3. NaOH浓度为 mol/L,180 °C下6 h合成ZnO纳米结构的SEM照片(Zn2+/OH‾的摩尔比为1 : 20)实验方案二产物为纳米片1、在室温下,在烧杯中称取 g Zn(NO3)2·6H2O( mol)然后加入40 mL蒸馏水,搅拌5分钟配成无色澄清的溶液。
2、在室温下,在烧杯中称取 g NaOH mol) 然后加入40 mL 蒸馏水,搅拌5分钟配成无色澄清的溶液。
3、在室温下,将Zn(NO3)2溶液快速滴加到NaOH的溶液中,磁力搅拌得到白色的悬浊溶液。
4、将悬浊溶液转移到150mL烧瓶中在80 °C 的水浴中反应2 h。
5、将白色沉淀物分别用水和酒精洗涤3次,进行离心分离后,放在烘箱中60 °C下干燥10 h后得到粉体。
(Zn2+/OH‾的摩尔比为1 :4)实验方案二 80°C产物图4是Zn(NO3)2浓度为 mol/L时,Zn2+/OH‾的摩尔比为1 : 4,80 °C下反应6 h生成的ZnO纳米结构的电镜照片。
低放大倍数的SEM照片(图4A)可以看出,产物为形貌均一的球形聚集体,尺寸为1–3 μm。
通过高放大倍数的照片(图4B)可以清楚地看到球形聚合体是由ZnO纳米片组成,纳米片的厚度为10–20 nm,侧向尺度为几百纳米到一微米。
从扫描电镜照片中可以清楚的看到纳米片的表面十分光滑,但纳米片边缘不平滑。
有趣的是这些球形聚合体是沿某些特定方向生长的,如图4–9A上箭头所示。
这种聚合体结构是很难分散开的,若想得到一些分散的纳米片,必须经过长时间的超声震荡。
透射电镜照片(图4C)进一步证明了这种片状结构,不过从透射电镜照片中可以明显地看到,纳米片的表面存在很多小孔,而且纳米片的边缘也是十分不规则的。
单个纳米片的选区电子衍射(SAED)花样(图4C内),证明ZnO纳米片是单晶,并且纳米片沿[001]和[100]方向生长。
从高分辨透射电镜(HRTEM)照片上可以清楚地看到纳米片表面原子排列规则,晶面间距为 nm与ZnO(002)晶面相对应,这说明ZnO纳米片具有很好的结构性和生长方向性。
图4. Zn(NO3)2浓度为L时,80 °C下反应6 h生成的ZnO纳米结构的SEM(A,B),TEM(C)和HRTEM(D)照片 (Zn2+/OH‾的摩尔比为1 : 4)。
实验方案二 180 °C产物图5. Zn(NO3)2浓度为L时,180 °C下反应6 h生成的ZnO纳米结构的SEM(A),TEM(B)和HRTEM照片。
(Zn2+/OH‾的摩尔比为1 : 4)。
五、思考题1、NaOH与锌盐的浓度比及反应时间、反应温度对产物有何影响2、为什么实验反应产物能够直接得到氧化锌晶体而不是氢氧化锌相关资料:利用X射线衍射仪(XRD)测定产物的晶体结构;利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察产物的形貌。
相关资料用尿素作沉淀剂进行沉淀反应实验步骤:1、在室温下,在烧杯中称取 g Zn(NO3)2·6H2O( mol)然后加入40 mL蒸馏水,搅拌5分钟配成无色澄清的溶液。
2、用蒸馏水配制40 mL尿素( g)溶液,使尿素与硝酸锌的摩尔比为3:1,并将尿素溶液倒入烧瓶,与锌盐溶液混合均匀。
3、将混合后的溶液在90~100 °C加热反应3 h。
4、将反应所得沉淀过滤,洗涤(用蒸馏水洗涤)。
5、将洗涤后的滤饼放入80 °C的烘箱内干燥,得前驱物碱式碳酸锌,呈白色粉末状。
6、将前驱物放入马弗炉内450℃煅烧2 h,即得纳米氧化锌粉体。