药物合成反应复习
- 格式:doc
- 大小:3.93 MB
- 文档页数:13

合成药生产操作基础知识培训一、药物合成反应1.酯化反应:酯化反应是一种羧酸和醇反应,生成酯类化合物的过程。
在药物合成中,酯化反应常用于制备酯类药物。
2.脱水反应:脱水反应是指将分子中的水分离出去,常见的是醇的脱水反应,例如通过加热使醇失去一个水分子转化为烯烃。
3.氧化反应:氧化反应是指一种物质与氧气反应生成氧化物的过程,常见的氧化反应在药物合成中是将一个化合物中的亲电子氢氧化为氢氧根离子。
4.还原反应:还原反应是指将一个物质中的氧化物还原为较低化合价状态的过程。
在药物合成中,还原反应通常用于制备具有生理活性的药物。
二、反应条件控制1.温度控制:温度对合成反应的速度和产物收率有重要影响。
合成药物过程中,根据反应物性质和反应类型,选择合适的反应温度。
2.时间控制:合成药物需要一定的反应时间来达到预期产物。
不同的反应需要不同的反应时间,通常需要进行试验确定最佳反应时间。
3.压力控制:在一些反应中,需要控制反应体系的压力。
高压反应可以提高速率和收率。
4.光照控制:一些反应需要在光照条件下进行,例如光催化反应。
光照条件的控制对反应结果至关重要。
三、反应物配制和操作1.反应物准备:根据药物合成反应的需要,准备好反应物和反应溶剂。
准确称取或配制反应物,确保配比准确。
2.反应设备:根据反应类型和规模,选择合适的反应设备。
常见的反应设备有反应釜、流程反应器等。
3.反应条件控制:将反应物加入反应设备中,设置好反应条件,如温度、压力等。
如果需要,可以加入催化剂或助剂来促进反应。
4.反应监控:对反应进行实时监控,如温度、pH值、浓度等参数的测量和记录,确保反应进行正常。
四、分离和纯化1.反应结束后,需要将产物从反应物和杂质中分离出来。
常见的分离方法有结晶、蒸馏、萃取等。
2.结晶是将溶液中的产品通过降温或者添加溶剂使其结晶出来,进而分离出来。
结晶的条件和操作需要控制得当,以得到高纯度的产物。
3.蒸馏是利用物质气化和凝结的不同温度进行分离的方法,常见的有常压蒸馏和真空蒸馏。
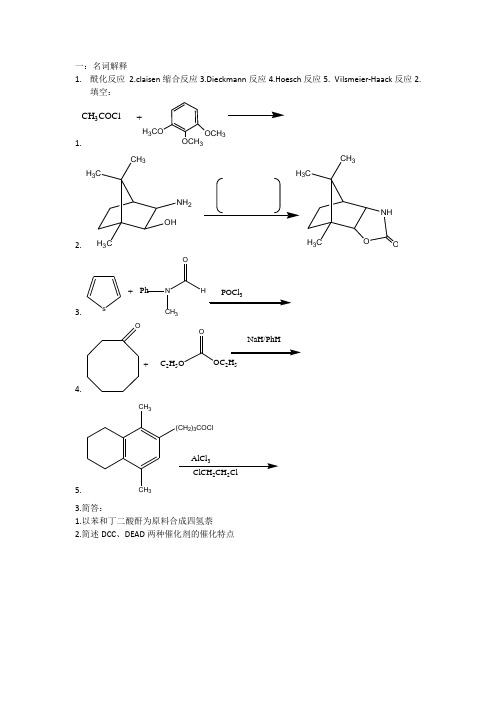
1.酰化反应2.claisen缩合反应3.Dieckmann反应4.Hoesch反应5. Vilsmeier-Haack反应2.填空:1.H3COOCH3OCH3CH3COCl+2. H3CCH3H3COHNH23CCH3H3CNHO O3. s +Ph NCH3HOPOCl4. O+C2H5OOOC2H5NaH/PhH5. CH3CH3(CH2)3COCl223.简答:1.以苯和丁二酸酐为原料合成四氢萘2.简述DCC、DEAD两种催化剂的催化特点1.重氮化反应2.Collins 试剂 ;3.Eatard 试剂:4.Jones 试剂5.Oppenmauer 氧化:6.Woodward 氧化7.Lindlar 催化剂8.Clemmensen 还原二、填空1. OHOH O HMnO 2CH 2Cl 22.3. H C H C COCH 3Zn-Hg HCl4. PhC Cl C Ph H LiAlH 45. ℃H/Ni100Kg/cm 200℃、 6.C NO 2OCF CO H7.CH 3CH 38.CH 3KMnO4CH2CH 2CH 39.10.11.12.13.三、简答1.KMnO4的氧化能力与反应的pH值之间的关系如何?其主要用途有哪些?2.比较LiAlH4与NaBH4在应用围反应条件的异同?3.以原料合成终产物4.由对二甲苯制备2-硝基-1,4-苯二甲酸。
5.以苯酚为起始原料合成解热镇痛药对乙酰氨基酚。
一、名词解释题1.亲核重排反应2.Beckmann重排3.Arndt-Eistert反应4.Fries重排5. -键迁移反应6.重排反应二、填空题1.2.3.4.5.6.7.8.9.10.三、简答题1. Pinacol重排属于哪类重排反应?简述其反应机制及影响反应的因素。
2.基团的迁移能力或顺序在不同重排反应中有所不同,写出Wagner-Meerwein重排和Stevens重排中各自基团的迁移顺序。

《药物合成反应》复习题一、写出下列缩写所代表的结构式和名称1、NBS:2、DMSO;3、DCC;4、THF;5、DMAP。
6、NCS:7、DMF;8、HMT;9、PPY;10、HMPA/HMPTA。
11、TCC 12、LTA 13、DEAD 14、TsCl 15、DDQ二、解释下列反应并各举一例说明1、Friedel-Crafts(傅-克)反应:2、Oppenauer氧化反应:3、Clemmensen反应:4、Wittig反应:5、Baeyer-Villiger(拜义尔-威力奇)反应:6、Williamson反应:7、Ullmann反应:8、Gabrieal反应:9、Mannich反应:10、Dalton反应:11、Perkin(柏琴)反应:12、Hofmann(霍夫曼)重排:13、Reformatsky(雷福尔马茨基)反应14、Darzens(达参)缩合15、Cannizzaro(康尼查罗)反应16、Beckmann(贝克曼)重排三、完成下列反应1、2、3、()()()4、()5、6、7、( )( );8、9、( );10、11、12、13、BrCHO( )( )14、15、( )COOH NH 2NaNO 2 H 2SO 4( )COOHOAc16、(H 2C)5NHOMe 2SO 4( )17、 18、19、HOMeHO Me OHMnO 220、NNH OO H 3COCO HOMeDMSO/DCC H 3PO 421、22、23、( )C(CH 2OH)4C(CH 2Br)424、25、26、27、28、29、30、四、判断题1、卤代烃的活性顺序: 苄卤,卤乙烯,叔卤代烷,仲卤代烷,伯卤代烷2、常用酰化剂(RCO-)的反应活性顺序:RCOX, (RCO)2O, RCOOR ’, RCONR ’23、氧化顺序由易到难排列:李良助,C HO H 2COHR C R OR C OHO,4、以下负离子都是亲核试剂,其碱性的大小次序为:NH 2- , HO - , RO - , I - , Ac - .5、F-C 烷基化反应中常用Lewis 酸催化剂的活性顺序:AlCl 3,FeCl 3,BF 3 ,SnCl 4 ,ZnCl 2 ;6、将下列化合物按消去HBr 难易次序排序:7、F-C 烷基化反应常用质子酸的活性次序:HF H 2SO 4 P 2O 5 H 3PO 4 8、卤代烃的活性顺序: ①叔卤代烷 仲卤代烷 伯卤代烷 ②RF RCl RBr RI五、合成题1、由少于碳五的有机物合成2、由指定原料合成目标产物丁卡因,其余试剂任选。

1、靶分子:(Target Molecule):就合成设计而言,凡是所需合成的有机分子均可成为“靶分子”,或者是最终产物,或者是有机合成中的某一个中间体。
2、合成子(Synthons): 反合成分析时,目标分子切割成的片段(Piece)叫合成子3、逆合成分析:也称为反合成分析,即由靶分子出发,用你想切断、连接、重排和官能团互换、添加、除去等方法,将其变换成若干中间产物或原料,然后重复上述分析,直到中间体变换成所有价廉易得的和橙子等价试剂为止。
6、逆向切断(dis):用切断化学键的方法把靶分子骨架剖析城不同性质的合成子,成为逆向切断。
7、逆向官能团转化(con):在不改变靶分子基本骨架的前提下变换官能团的性质或所处位置的方法,包括逆向官能团转换(FGI)、逆向官能团添加(FGA)二、重要的化学反应1、卤化反应:在有机化合物分子中简历碳-卤键的反应称为卤化反应。
2、烃化反应:用烃基取代有机分子中的氢原子,包括在某些官能团或碳架上的氢原子,均称烃化反应。
3、酰化反应:在有机化合物分子中的碳、氧、氮、硫等原子上引入酰基的反应。
4、缩合反应:两个或多个有机化合物分子通过反应形成一个新的较大分子的反应或同一个分子发生分子内的反应形成新分子都可称为缩合。
5、重排反应:在同一分子内,某一原子或基团从一个原子迁移至另一个原子而形成新分子的反应。
6、氧化反应:有机物分子中氧原子的增加,氢原子的清除,或者两者兼而有之,不包括形成C-X、C-N、C-S的反应。
7、还原反应:在化学反应中,使有机物分子中碳原子总的氧化态降低的反应称为还原反应。
1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。

07/08第二学期药物合成反应试题班级姓名学号一、填空题(0.5分×40=20分)1、轨道的节越多,它的能量越高。
2、1S轨道呈球对称,对应于氢原子的电子的最低可能的轨道。
3、写出以下原子的基态电子结构:Be: 1S22S2 C: 1S22S22Px12Py1F: 1S22S2SPx22Py22Pz1 Mg: 1S22S22Px22Py22Pz23S24、据分子轨道理论,两个原子轨道重叠形成两个分子轨道,其中一个叫成键轨道,具有比原来的原子轨道更低的能量;一个叫反键轨道,具有较高的能量。
5、场效应和分子的几何构型有关,而诱导效应只依赖于键。
6、碳-碳键长随S成分的增大而变短,键的强度随S成分的增大而增大。
7、判断诱导效应(-Is)强弱:-F,-I,-Br,-Cl。
-F>-Cl>-Br>-I8、判断诱导效应(+Is)强弱:-C(CH3)3>-CH(CH3)2>-CH2CH3>-CH3。
9、一般情况下重键的不饱和程度愈大,吸电性愈强,即-Is诱导效应愈大。
10、在共轭体系中,形成共轭体系的原子以及和这些原子直接结合的原子都在同一平面里;各个键上的电子云密度在一定程度上都趋于平均化。
11、布朗斯特酸的定义是给出质子的物质,路易斯酸的定义是有空轨道的任何一种物质。
12、卤素对双键亲电加成的活性顺序是:Cl2>Br2>I2。
13、卤素对双键亲电加成是按分步机理进行的,X+先对双键做亲电进攻,而后X _再加上去。
14、判断共轭类型,并用箭头标明电子云偏移方向:π-π共轭p-π共轭p-π共轭15、溴素或氯对烯烃的加成一般属于亲电加成机理。
16、在卤素对烯烃的加成反应中,当双键上有苯基取代时,同向加成的机会增加。
17、CH C CH33CH3BBr3BrBBr2C CCHCHC3HC C CH3C3BrBBr2BrClCH2Cl2CH3CH3CH3Br Br18、应用次卤酸酯(ROX)作为卤化剂对烯烃加成,其机理相同于次卤酸的反应,但可在非水溶液中进行反应,根据溶剂的亲核基团的不同,可生成相应的β-卤醇衍生物。
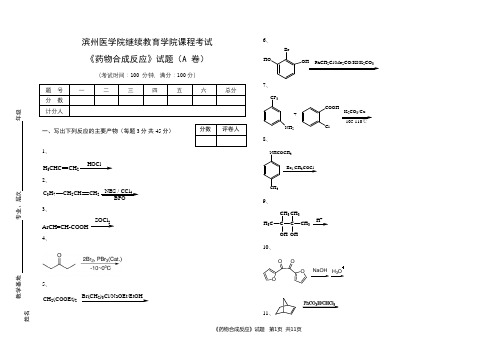
滨州医学院继续教育学院课程考试《药物合成反应》试题(A 卷)(考试时间:100 分钟,满分:100分)一、写出下列反应的主要产物(每题3分 共45分) 1、HOClH 3CHC CH 22、C 3H 7CH 2CH CH 2NBS / CCl 43、2ArCH=CH-COOH ArCH=CH-COCl4、5、CH 2(COOEt)2Br(CH 2)3Cl/NaOEt/EtOHCOOEtCOOEt6、HOOHBrPhCH Cl/Me CO/KI/K CO7、CF 3NH 2+COOHClK CO /Cu8、NHCOCH 3CH 3Br 2,CH 3COCl9、H 3CC CCH 3CH 3OH CH 3OHH+H 3CC C CH 3OCH 3CH 310、OCHOO COOH OHOCNOOOOH 3ONaOAc11、12、13、14、15、二、名词解释(每题2分共20分)1、卤化反应2、Williamson反应3、活性亚甲基4、Wagner-Meerwein重排5、Favorski重排6、Beckmann重排7、拜耳-魏立格氧化重排8、Stevens重排9、Wittig重排10、Claisen重排三、简答题(共35分)1、卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?(8分)2、什么是Dalton反应?根据下式写出其反应机理?(10分)2C CR1OHBrC CR1BrOR23、何为Hofmann重排?按照下式写出其反应机理?(10分)R C NHORNH2or X2/NaOH4、常用的卤化试剂有哪些?并各举两例。
(7分)。

药物合成反应一、名词解释1.Friedel-Crafts反应羧酸及羧酸衍生物在质子酸或LEWIS酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
2.Claisen反应和Dieckmann反应羧酸酯与另一分子具有α-活泼氢的酯进行缩合的到β-酮酸酯的反应成为Claisen反应。
Dieckmann反应为发生在同一分子的Claisen反应。
3.α-羟烷基化反应含α-活泼氢的醛或酮,在碱或酸的催化下发生自身缩合,或与另一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物的反应,成为α-羟烷基化反应。
但该类化合物不稳定,易发生消除生成α,β-不饱和醛酮。
这类反应又称为醛醇缩合反应(Aldol缩合)。
4.α-氨烷基化反应具有活性氢的化合物与甲醛(或其他醛)、胺进行缩合,生成氨甲基衍生物的反应成为α-氨烷基化反应,亦称Mannich反应。
5.β-羰基烷基化反应(Michael反应)活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合生成β-羰烷基类化合物的反应称之。
6.羰基烯化反应(Wittig反应)醛或酮与磷叶立德反应合成烯烃的反应称之。
7.Wagner-Meerwein重排醇与酸反应时,主要生成取代或消除产物;但在许多情况下,特别是当β-碳原子上有两个或三个烷基或芳基时,所得产物往往发生重排,此类重排称之。
8.Pinacol重排连乙二醇类用酸处理时重排生成醛或酮的反应称之。
9.二苯基已二酮-二苯基乙醇酸重排(Benzil-Benzilicacid)α-二酮类用碱处理发生重排生成α-羟基酸盐的反应称之。
10.Beckmann重排肟类化合物在酸性催化剂作用下,羟基向氢原子迁移,生成取代酰胺的反应称之。
11.Hofmann重排未取代的酰胺与次溴酸钠(或溴与氢氧化钠)作用下,得到比反应物少一个碳原子的伯胺的反应称之。
12.化学还原法-Birch反应芳香族化合物在液氨中用钠(钾或锂)还原,生成非共轭二烯的反应称之。

药物合成反应试题及答案1. 以下哪种试剂常用于还原醛基团?A. 硼氢化钠B. 硫酸C. 硫酸铵D. 硝酸答案:A2. 请列举两种常用的有机合成反应类型。
答案:1) 取代反应;2) 加成反应。
3. 描述硝化反应的基本原理。
答案:硝化反应是指在有机化合物中引入硝基(-NO2)的过程,通常通过与硝酸和硫酸的混合物在较低温度下进行。
4. 以下哪种溶剂不适合作为有机合成反应的介质?A. 乙醇B. 水C. 甲苯D. 四氢呋喃答案:B5. 请解释什么是保护基团。
答案:保护基团是指在有机合成过程中,为了防止某些官能团在反应中被反应掉,而暂时将其转化为另一种官能团的化学基团。
6. 写出一个简单的酯化反应方程式。
答案:CH3COOH + CH3OH → CH3COOCH3 + H2O7. 以下哪种反应是不对称合成?A. 还原反应B. 氧化反应C. 酯化反应D. 聚合反应答案:A8. 描述一个常见的有机合成反应的步骤。
答案:1) 选择合适的起始原料;2) 选择合适的试剂和反应条件;3) 进行反应;4) 纯化产物;5) 鉴定产物。
9. 以下哪种化合物是手性分子?A. 乙醇B. 乙烷C. 丙醇D. 异丙醇答案:D10. 请列举两种常用的有机合成催化剂。
答案:1) 硫酸;2) 氯化铝。
11. 描述一个简单的氧化反应过程。
答案:例如,醇的氧化反应,可以通过使用铬酸或过氧化氢作为氧化剂,在酸性条件下将醇氧化为醛或酮。
12. 以下哪种反应是消除反应?A. 酯化反应B. 还原反应C. 取代反应D. 消去反应答案:D13. 请解释什么是立体化学。
答案:立体化学是指分子中原子的空间排列方式及其对分子性质的影响。
14. 以下哪种化合物是芳香族化合物?A. 环己烷B. 环戊烷C. 苯D. 环丙烷答案:C15. 描述一个简单的还原反应过程。
答案:例如,酮的还原反应,可以通过使用硼氢化钠作为还原剂,在非质子溶剂中将酮还原为醇。

药物合成反应期末试题题目一根据下列反应方程式,完成以下问题: 1. 给出反应之间的步骤数。
2. 标记发生取代反应的反应步骤。
3. 确定是否存在立体异构体的反应步骤。
反应方程式:CH₃CH₂OH + HBr → CH₃CH₂Br + H₂O解答1.给出反应之间的步骤数:1步。
2.标记发生取代反应的反应步骤:第一个反应步骤。
3.确定是否存在立体异构体的反应步骤:不存在立体异构体的反应步骤。
题目二根据下列反应方程式,回答以下问题: 1. 写出反应机理中的中间体,并对其进行标记。
2. 标记发生氧化还原反应的反应步骤。
3. 写出反应中产生的氧化物。
反应方程式:2 Fe +3 Cl₂ → 2 FeCl₃解答1.写出反应机理中的中间体,并对其进行标记:无中间体。
2.标记发生氧化还原反应的反应步骤:整个反应是一个氧化还原反应。
3.写出反应中产生的氧化物:Cl₂是氧化剂,所以氧化物是Cl₂。
题目三根据下列反应方程式,回答以下问题: 1. 写出反应中类似于胺的物质的结构。
2. 标记发生亲核取代反应的反应步骤。
3. 写出反应中生成的副产物。
反应方程式:CH₃NH₂ + HBr → CH₃NH₃⁺ + Br⁻解答1.写出反应中类似于胺的物质的结构:CH₃NH₂。
2.标记发生亲核取代反应的反应步骤:整个反应是一个亲核取代反应。
3.写出反应中生成的副产物:副产物是Br⁻。
题目四根据下列反应方程式,回答以下问题: 1. 写出反应中生成的有机产物的结构。
2. 标记发生消失反应的反应步骤。
反应方程式:CH₃CH₂OH → CH₃CHO + H₂解答1.写出反应中生成的有机产物的结构:有机产物是CH₃CHO。
2.标记发生消失反应的反应步骤:整个反应是一个消失反应。
题目五根据下列反应方程式,回答以下问题: 1. 写出反应中生成的无机产物的结构。
2. 标记发生加成反应的反应步骤。
3. 写出反应中生成的副产物。
反应方程式:CH₃CH=CH₂ + HBr → CH₃CHBrCH₃解答1.写出反应中生成的无机产物的结构:无机产物是HBr。

药物合成反应知识点总结药物合成是一门综合化学、生物学、医学等学科知识的交叉学科,在药物研发、制备方面有着重要的地位。
掌握合成反应知识对于开发新药物、改进药物生产工艺以及合成新型医用化合物有着重要的意义。
下面将对药物合成反应知识点进行总结。
一、酯化反应酯化反应是一种醇和酸酐进行酯键形成的反应,常用于制备药物中的酯类化合物。
酯化反应通常需要酸性催化剂,如硫酸、氯化锌等。
常见的酯化反应包括醋酸乙酯和苯酚反应,以及异丁酸和异丁醇反应等。
酯化反应在药物合成中具有重要的应用价值,可以制备许多重要的药物原料和药物分子。
二、取代反应取代反应是指一种功能团被另一种功能团取代的化学反应。
在药物合成中,取代反应可用于引入新的官能团或者进行位置选择性修饰。
常见的取代反应包括亲电取代反应、芳香核烷基取代反应、核烷基取代反应等。
取代反应技术在药物合成中的应用广泛,可以实现对目标分子的精准调控。
三、溴化反应溴化反应是一种以溴化试剂为催化剂,将氢原子直接溴化的反应。
在药物合成中,溴化反应通常用于芳香环的溴化,在合成多种药物原料和中间体中具有重要应用价值。
溴化反应可以通过光化学、热化学等多种途径进行,是药物合成中不可或缺的反应类型。
四、氢化反应氢化反应是指将双键或者芳香环上的芳香核加氢生成饱和化合物的化学反应。
在药物合成中,氢化反应通常用于去除分子中的双键或者芳香环,改变化合物的性质和活性。
常见的氢化反应包括氢气加压氢化反应、催化氢化反应等。
氢化反应在药物合成中应用广泛,可以制备众多的药物原料和合成中间体。
五、缩合反应缩合反应是指将两个或者更多的分子通过断裂键和形成新键,生成较大的分子的化学反应。
在药物合成中,缩合反应可以用于合成多种多样的药物原料和药物分子。
常见的缩合反应包括醛缩合、酮缩合、酰胺缩合等。
缩合反应技术在药物合成中的应用非常广泛,是药物研发和制备的重要手段之一。
六、水解反应水解反应是指利用水分子将化合物中的官能团断裂,生成新的化合物的化学反应。

2015年药物合成反应复习题一、名词解释35=15 41.化学试剂DMSO:二甲基亚砜,分子式为CH32SO2.化学试剂DMF:N,N-二甲基甲酰胺3.化学试剂THF:四氢呋喃4.化学试剂NBS:N-溴代丁二酰亚胺/N-溴代琥珀酰亚胺,溴化剂,具有高度的选择性,只进攻弱的C—H键即与双键或苯环相连的α-H;5.化学试剂 DMAP:4-二甲氨基吡啶,是一种超强亲核的酰化作用催化剂6.化学试剂DCC:二环己基碳二亚胺,通常作为反应脱水剂7.化学试剂 MCPBA:间氯过氧苯甲酸,用于环化反应和Baeyer-Villiger氧化反应8.Bz2O2引发剂:过氧苯甲酰,是一种常用的自由基聚合反应的引发剂;9.释电子基:能增加相邻基团电子云密度的基团;10.吸电子基:能减少相邻基团电子云密度的基团;11.活性亚甲基:邻位连有羰基或其他强吸电子基的亚甲基结构;12.质子酸:水溶液中能电离出质子的酸;13.Lewis酸:含有空轨道、能够接受外来电子对的分子或离子;14.亲核反应:负性基团首先进攻的反应;15.亲电反应:正性基团首先进攻的反应;16.马氏规则:当发生亲电加成反应时,亲电试剂中的正电基团总是加在取代最少的碳原子上,而负电基团则会加在取代最多的碳原子上;17.卤化反应:有机化合物分子中建立碳—卤键的反应;18.烃基化反应:有机分子中氢原子被烃基取代的反应;19.Williamson反应:卤代烃和醇在碱的存在下生成醚的反应;20.Gabriel反应:邻苯二甲酰亚胺和卤代烃在碱性条件下反应,然后肼解得伯胺的反应;21.Leuckart还原反应:用甲酸及其铵盐对醛酮进行还原烃化反应22.Fridel-Crafts烷基化反应:在三氯化铝的催化下,卤代烷和芳烃反应在环上引入烃基的反应;23.酰化反应:有机物分子中氢原子被酰基取代的反应;24.Fridel-Crafts酰基化反应:酰氯、酸酐等酰化剂在Lewis酸或质子酸催化下,对芳烃进行亲电取代生成芳酮的反应;25.缩合反应:两个或多个有机化合物分子通过反应形成一个新的较大分子的反应,或同一分子发生分子内的反应形成新分子的反应;26.Reformatsky反应:醛或酮和α-卤代酸酯在锌的作用下生成β-羟基酯的反应;27.Mannich反应:具有活性氢的化合物与甲醛、胺进行缩合生产氨甲基衍生物的反应;28.Michael反应:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化下发生加成缩合,生成β-羰烷基化合物的反应;29.Wittig反应:醛或酮与含磷试剂反应,使羰基氧被亚甲基取代成烯烃的反应;30.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成β-芳基丙烯酸类化合物的反应;31.Darzen环氧化反应:醛或酮与α-卤代酸酯在碱催化下缩合生成αβ-环氧羧酸酯的反应;32.Diels-Alder反应:1,3-丁烯和乙烯衍生物在加热情况下生成环己烯骨架的反应;33.Beckmann重排反应:醛肟或酮肟在酸性催化剂作用下重排成取代酰胺的反应;34.重排反应:指在同一分子内,某一原子或基团从一个原子迁移至另一个原子而形成新分子的反应;35.Hofmann重排反应:氮原子无其他取代基的酰胺在次卤酸作用下脱羧生成伯胺的反应;36.Lindlar还原剂:钯吸附在硫酸钡温和氢化催化剂;37.Birch还原反应:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应;38.Clemmensen还原反应:锌汞齐盐酸反应将羰基还原成亚甲基的反应;39.Wolff-黄鸣龙还原反应:肼在碱性条件下还原羰基成亚甲基的反应;40.Collins氧化剂:三氧化铬吡啶复合物的二氯甲烷溶液;41.Jones氧化剂:三氧化铬硫酸的丙酮溶液;42.CAN氧化剂:硝酸铈铵氧化剂43.逆合成分析法:也称为反合成分析,即由靶分子出发,用逆向切断、连接、重排和官能团互换、添加、除去等方法,将其变换成若干中间产物或原料,然后重复上述分析,直到中间体变换成所有价廉易得的合成子等价试剂为止;44. 极性反转45.合成子:是指组成靶分子或中间体骨架的各个单元结构的活性形式;根据形成碳碳键的需要,合成子可以是离子形式,也可以是自由基或周环反应所需的中性分子;二、简答题35=15 41.卤化反应的机理主要包括哪几种答:卤化反应的机理主要包括亲电加成、亲电取代、亲核取代以及自由基反应;2.醇的卤置换反应常见的卤化剂有哪些3.答:氢卤酸、含磷卤化物、含硫卤化物常用卤化剂:卤素、N-卤代酰胺、次卤酸酯、次卤酸、卤化氢等;4.什么是马氏规则5.答:马氏规则:当发生亲电加成反应时,亲电试剂中的正电基团总是加在连氢最多取代最少的碳原子上,而负电基团则会加在连氢最少取代最多的碳原子上; 6.烯烃和卤素加成反应属于什么类型的反应什么样的基团优先加成7.答:亲电加成反应;正离子优先进攻;8.次氯酸和烯烃进行亲电加成反应时,卤素加到哪个碳原子上,为什么答:卤素加在含氢较多的碳原子上,因为次卤酸中卤原子带正电性;9.按照马氏法则,卤化氢对烯烃加成,氢和卤素分别加到双键的哪个碳上答:氢加到含氢较多的双键碳上;而卤素加到取代较多的碳原子上;10.光照或高温条件下,溴化氢对烯烃的加成是什么类型的反应结果如何11.答:自由基加成;溴倾向于加在含氢较多的烯烃碳原子上,属反马氏规则;12.芳烃的卤化反应属于什么类型的反应为什么需Lewis酸催化13.答:亲电取代反应;因为在Lewis酸的作用下卤素分子发生极化,产生卤素正离子;14.碱催化酮的α卤取代,易产生什么产物为什么15.答:α-多取代产物,反应不停留在α-单取代阶段,易在同一个α位上继续进行反应,直至所有α-氢原子都被取代为止;因为卤素取代后,吸电子基有利于α-氢质子的脱去,促进烯醇氧负离子的生成及其卤代反应;16.醇羟基烃化反应主要有哪几种烃化剂答:卤代烃、芳基磺酸酯、环氧乙烷、烯烃、其他烃化剂如CF3SO2OR等; 17.酚羟基烃化反应主要有哪几种烃化剂为什么水杨酸用碘甲烷烃化仅得到水杨酸甲酯18.答:卤代烃、硫酸二甲酯、重氮甲烷、烷氧磷盐;因为酚羟基上的氢和羧基中的羰基氧形成分子内氢键;19.付-克烃基化反应属于什么类型的反应为什么会出现烃基的多取代20.答:亲电取代反应;因为烃基是给电子基团使苯环上的电子云密度增大,当苯环上连有一个烃基时,将有利于继续烃化而得到多烃基衍生物;21.醇的酰化常采用的酰化剂有哪些答:羧酸、羧酸酯、酸酐、酰氯、酰胺等;22.为什么经常采用混合酸酐作为酰化剂混合酸酐参与醇酰化反应得到什么样的酯答:因为单一酸酐种类较少,应用上有局限性,而混合酸酐易制备且酰化能力较单一酸酐强,所以更具实用价值,应用更广泛;混合酸酐参与酰化反应时酸性弱的酰基参与酰化作用;23.付-克酰基化反应属什么类型的反应为什么不发生多取代24.答:亲电取代反应;酰基是吸电子基团,使苯环上电子云密度降低,难以进一步反应;25.1,3,5-三甲苯酰化属于什么反应为什么可以发生二取代答:付-克酰基化反应;因为均三甲苯中存在三个供电子基团,不仅可以抵消酰基的吸电子效应,而且由于立体位阻使得羰基不能与苯环共轭,从而显现不出酰基对苯环的钝化作用,可以发生二取代;26.醇醛缩合属于什么类型的反应为什么易脱水成α,β不饱和的羰基化合物答:亲核加成;由于生成的双键和羰基共轭稳定,易脱水成α,β不饱和的羰基化合物;27.Diels-Alder反应属于什么类型的反应什么样的反应物对反应有利28.答:4+2环加成分子协同反应;双烯体电子云密度高有利,亲双烯体电子云密度低有利;29.重排反应根据机理分哪几类答:亲核重排、亲电重排、自由基重排三类;30.Pinacol重排反应按反应机理属于什么重排反应反应中芳基和烷基哪个优先迁移31.答:亲核重排;芳基比烷基优先;32.Beckmann重排属于什么类型的反应中间体是什么33.答:亲核重排;中间体是亚胺;34.Hofmann重排属于什么类型的反应中间体是什么35.答:亲核重排;中间体是异氰酸酯;36.Claisen重排属于什么类型的反应反应物是什么37.答:3,3-σ迁移重排反应;反应物是烯丙基芳基醚;38.Cope重排属于什么类型的反应反应物是什么答:3,3-σ迁移重排反应;反应物是1,5-二烯;39.“CrO3Py2-CH2Cl2”是什么试剂参与什么反应40.答:Collins试剂;参与醇的氧化和烯丙位亚甲基的氧化;41.“CrO3-H2SO4-丙酮”是什么试剂参与什么反应42.答: Jones试剂;参与仲醇的氧化;43.活性MnO2是什么试剂主要参与什么反应44.答:温和性氧化剂;主要用于苄醇的氧化;45.什么是均相催化氢化反应与非均相催化氢化有何不同46.答:均相催化氢化反应是催化剂溶解在溶剂中的催化反应;与非均相催化氢化不同的是以分子的形式参与反应, 所需摩尔量少;47.什么是Lindlar催化剂有何特点48.答:Lindlar催化剂是金属钯吸附在硫酸钡上并加入少量抑制剂醋酸铅或喹啉而成的催化剂;特点是选择性还原炔烃为顺式烯烃;49.Clemmensen和黄鸣龙反应的条件有什么异同答:不同点:Clemmensen反应在酸性介质中进行而黄鸣龙反应在碱性介质中进行;相同点:都是把羰基还原成亚甲基;50.Collins氧化剂和Jones氧化剂有何异同答:相同点:都是三氧化铬作为氧化剂;不同点:Collins是三氧化铬吡啶复合物的二氯甲烷溶液,而Jones氧化剂是三氧化铬硫酸的丙酮溶液;51.Claisen重排和Cope重排有何异同答:相同点:两者均为3,3- σ迁移重排反应;不同点:Claisen重排的反应物是烯丙醚,而Cope重排的反应物是1,5-二烯;反应属于什么类型反应产物是什么用钠和醇在液氨中将芳香环还原成1,4-环己二烯的有机还原反应;34. 什么是催化转移氢化有何特点催化转移氢化属于非均相催化氢化,是在催化剂的作用下有机化合物作为供氢体加成到有机化合物的不饱和基团上的反应;其特点是在金属催化剂存在下,用有机化合物作为供氢体以代替气态氢作为反应氢源;35. Sandmeyer反应属于什么类型反应是何种化合物的转化反应芳香重氮盐化合物的卤置换反应;三、反应机理题28=161.写出苯乙烯与氯气反应的碳正离子反应机理;2.写出次卤酸和烯烃的桥型正离子反应机理;3.写出溴乙烷对苯的烷基化反应机理;EtBr AlCl3Et AlCl3BrEtEtHH Et4.写出三氯化铝催化酰氯对苯的酰化反应机理;5.写出羧酸与胺脱水生成酰胺的反应机理;6.写出下列转化的反应机理;7.写出下列转变的反应机理;Ph3P CH2CH3COCH3H3C CH3CCH2 8.写出下列转变的反应机理;O ClCH2COOC2H5t-BuOK/t-BuOHCHCOOC2H5O9.写出下列转化的反应机理;10.写出下列转化的反应机理;四、合成题45=201. 以间氯硝基苯为起始原料合成FCl ;2. 以苯为起始原料合成;3.2;4. 以甲苯为起始原料合成COOHBr;5. 以乙酰乙酸乙酯为起始原料合成CH 32CH 2C 6H 56. 以乙酰乙酸乙酯为起始原料合成CH 3CH 2CH 2CHCOOH CH 3; 7. 以丙二酸二乙酯和1,4-二溴丁烷为起始原料合成COOC 2H 5;8. 以苯和丁二酸酐为起始原料合成O;9. 以1,4-二甲苯和丁二酸酐为起始原料合成CH 3CH 3;10. 以环己酮和吗啡啉为起始原料合成; 11. 以环己酮和α卤代酸乙酯为起始原料合成CHO;12. 以环己酮和α氰基乙酸为起始原料合成CH 2COOH;13. 以1,3-丁二烯和丙烯醛为起始原料合成CH 3;14. 以1,3-丁二烯和丙烯醛为起始原料合成HOOC HOOCCOOH;五、完成反应215第一章1.I2/AcOAg/Et2OIOAc2. PhHC CH2NBS/H2OPhCH(OH)CH2Br3.OH1molBr2/CS20~5 o CHO Br4. N NH2220~50o C NBrNH25.Ph(CH2)4COPh NBS/CCl4PhBr(CH2)2COPh6. CH3CH32mol Br2/hv125C, 2hCH2BrCH2Br7. COCH3Br2/cat.AlCl3/Et2OoCOCH2Br8. HO(CH2)6OH KI/PPA100~120C, 5h I(CH2)6I9.CH3CH2C(CH3)2OH gas HClCH3CH2C(CH3)2Cl10. O2N CO2H5,0.5h O2N COCl1. Br22. Br23. SbF34. NaI5.1. NaNO2/HCl,2. HPF6或HBF46.1. NaNO2/HCl,2. HPF6或HBF4第二章1. Ph2CHOCH2CH2NMe22.3. HO OHBrPhCH2Cl/(CH3)2CO/KI/K2CO3BrBnO OBn4. HOOCOHOH2N2OCH3OCH3COOCH35.CH2NHCH3HC CCH2Cl6. H2N CONHHCHO/MeOH/H2/NiN CH3H2NOC7. COCH3HCOONH4180~185CNH29.ClEtOH3oClEt10.CH2(CO2Et)2Cl NaOEt CH(CO2Et)2 1. EtBr2.Me2SO43. ClCH2CH2Ph4. i-PrOH5. n-BuBr6. CH3I7. PhCH2Br 8.ClCH23NCH32第三章1. i-PrOH O OCOOMeMeOOCTi(OPr-i)470o C,3hO OCOOPr-ii-PrOOC2.H 3CCH 3CH 3COCl (C 2H 5)3COHAgCN/HMPA30minH 3C CH 3CH 3COOCEt 33. HOCH 2OHAc 2O/PyAcOCH 2OAc4.5.COClCH 3CH 3CF 3SO 3HCH 3H 3CCOCH 36. (CH 2)2COCl3O7.8. NHO50%NaOH/CHCl 3NHOCHO9.10.1. AlCl 32.AlCl 3PhCO2O5.AcCl6.NHCH32第四章49.2CH3CHO5%NaOH15~18C CH3CH(OH)CH2CHO52.CHOH3CO2KCN/EtOHCHCOH3COOCH3OH54.Zn BrCH2COOEt OEt2O OHCH2COOEt55.RMgX HCHORCH2OH56. OC4H9MgXC4H9(CH2)2OH57.COCH3H3COHCHO/(CH3)2NH.HClOCH3COCH2CH2N(CH3)259.CH3CH3O3r.t.CH3CH3CH2CH2OH60.H3CO COCH2CH2COOCH3Ph3P CH2CH3SOCH3o.63.CHO CH2(COOH)2CHCHCOOH65.COCH3(H3C)2HCH2C ClCH2COOC2H5i-PrONao66. NO220o C NO2Diels-Alder50.CHOO2N PhCOCH3H2SO4/HOAcCHCHCOPhO2N53. 2C6H5CHO NaCN/EtOH/H2OpH 7~8,PhCH(OH)COPhCH3COCH3CH2(CN)2/H2NCH2CH2COOH/PhHCN62.H3COH3CO CHOCH3NO2AcONH4/AcOH22o C, 3h H3CO CHCHNO2H3CO64. CHO(PhCH2CO)2OPhCH2COONaC CPhPhH65. HCHO/HCOOH第五章68. MeOHOH0.4mol/L SnCl4/CH2Cl2O70. PhHC CPhOHOHCH3HCl(g)oPh COCHPhCH373.CH3OCH2CH2CONH22CH3OCH2CH2NHCOOMe69.PhOH OHPhH2SO4/Et2Or.t., 3hOPhPh第六章75. ArCH2CH3CAN/HNO390C, 70min ArCOCH376.CH3CH3Na2Cr2O7/H2OoCOOHCOOH78.OHHO CrO3/H2SO4/H2O/CH2Cl2-5~0C , 2hOO79. H2CrO4/Et2O/H2O/MnCl225CO80.OHOHDMAP/HCrO3ClCHOOH81. CH NOHKMnO4NCOPh82.CHO Ag2O/THF/H2O25CCOOH83. OKMnO4/KOH0CCOOHO84. OHOOC(CH2)4COOH85. OAcPhCO3H/PhH0COOAc86. CH3I2/AcOAg/AcOH/H2OCH3OHOH87.CH2PhCN/H2O2/K2CO3/CH3OHO碱性条件88. KMnO4/冠醚/PhHr.t.OCOOH89.42<50C, 4hCOOHCOOH91.1) 1.5molO3/CH2Cl2, -70o C2) Me2S, 0o CCHOCHO94. NH过量MnO2/PhH81CN92.CH2CH2MeO OMe105C ,18hCHCHMeO OMe93.H3C CH3DDQo异构第七章95. H3CO CHCHCOOHH2/5%Pd-CNaH2PO2CH2CH2COOHH3CO96. COOHCOOHNH2NH2/K3Fe(CN)3HOOCCH2CH2COOH97. CHCHCNNaBH4/BiCl395%乙醇CH2CH2CN101. Ph C PhOAlCl3/LiAlH4/Et2OPh2CH2102.OHCON(CH3)2/HCOOHN(CH3)2103. PhHC CHCOOEt LiAlH4-AlCl3/Et2O CHCHCH2OH104.COORO2NNaBH4/AlCl3(CH3OCH2CH2)2OO2N CH2OH105. CH3(CH2)10COOEtNa/EtOH/Tol.CH3(CH2)10CH2OH Bouveault-Blanc107.(CH3)3CCOOH(CH3)3CCH2OH98. NH2CH3Li/NH3/EtOHNH2CH399.OH(CH 2)5CH 3OZn-Hg/HClOH(CH 2)6CH 3106.MeCNMe CH 2NH 2。

药物合成反应知识点总结
1. 反应类型:药物合成反应包括的主要反应类型有酯化反应、烷基化反应、脱水反应、氧化反应、还原反应、加成反应、消除反应等。
2. 催化剂:药物合成反应中的催化剂通常有酸、碱、酶、金属催化剂等,催化剂的选择需考虑反应条件和底物的特性。
3. 反应条件:药物合成反应的反应条件包括温度、压力、溶剂、反应时间等。
合适的反应条件能够促进反应的进行并提高产率和选择性。
4. 底物结构:药物合成反应的底物结构对反应的结果具有决定性作用。
在合成过程中需要考虑控制底物的反应平衡、控制副反应的发生等。
5. 反应机理:药物合成反应的反应机理能够解释反应的过程和产物的形成。
熟悉反应机理有助于合理设计反应方案和优化反应条件。
6. 优化:药物合成反应需要在保证质量的前提下,尽可能提高产率和选择性。
反应过程中常用的优化手段包括溶剂优化、催化剂优化、反应条件优化、步骤优化等。
7. 安全:药物合成反应过程中需要注意安全问题,防止操作失误、燃爆等危险事故的发生。
正确选择催化剂、控制反应条件、严格执行实验操作规程等都是提高反应安全的措施。

第一章绪论1、药物合成反应中反应类型有哪些?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a。
亲核试剂、b.亲电试剂);自由基反应;协同反应2、药物合成反应主要研究对象:化学合成药物3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性"是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小2、硝化试剂的活泼中间离子为:硝酰正离子NO2○,+3、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar—X+N2 (X:Cl,Br,—CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生.5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C-NO2、N-NO2和O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些? NaNO2+HCl/H2SO4第三章卤化反应1、Ph上取代基对卤化反应的影响①催化剂的影响;②芳环结构的影响;③反应温度的影响;④卤化剂的影响;⑤反应溶剂影响2、醇与HCl 发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇氢卤酸的活性顺序:HI >HBr >HCL3、NBS 的应用(N —溴代丁二酸亚胺) ①N-卤代酰胺与不饱和烃的卤取代反应机制:RCH 2CH=CH 2+NBSRCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N-卤代酰胺与不饱和烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的 催化下,N —卤代酰胺与烯烃加成易制备—卤代醇的重要方法。

药物合成知识试题及答案一、选择题(每题2分,共10分)1. 以下哪个不是药物合成中常用的反应类型?A. 取代反应B. 加成反应C. 氧化反应D. 还原反应答案:C2. 药物合成中,哪种催化剂通常用于促进酯化反应?A. 硫酸B. 盐酸C. 氢氧化钠D. 氢氧化钾答案:A3. 在药物合成中,哪个术语指的是将一个分子中的官能团替换为另一个官能团?A. 取代B. 消除C. 保护D. 还原答案:A4. 以下哪个化合物不是药物合成中常用的溶剂?A. 乙醇B. 丙酮C. 甘油D. 己烷答案:C5. 在药物合成中,哪种类型的反应通常涉及到碳碳双键的断裂?A. 加成反应B. 消除反应C. 取代反应D. 氧化反应答案:B二、填空题(每空1分,共10分)1. 在药物合成中,_______反应通常用于增加分子的极性。
答案:取代2. 药物合成中,_______是一种常用的还原剂,用于将醛或酮还原为醇。
答案:硼氢化钠3. 药物合成中,_______是一种常用的保护基团,用于保护羟基。
答案:甲氧基甲基(MOM)4. 在药物合成中,_______是一种常用的氧化剂,用于将醇转化为醛。
答案:铬酸5. 药物合成中,_______是一种常用的反应条件,用于促进反应的进行。
答案:无水三、简答题(每题5分,共20分)1. 简述药物合成中保护基团的作用。
答案:保护基团在药物合成中用于暂时阻止某些官能团参与反应,以避免不希望发生的副反应,确保目标化合物的合成。
2. 解释药物合成中为什么需要进行官能团转换。
答案:官能团转换是为了改变分子的化学性质或物理性质,使其符合药物设计的要求,如提高生物利用度、增强稳定性或改善药理作用。
3. 描述药物合成中常用的一种绿色化学技术。
答案:绿色化学技术在药物合成中包括使用无毒无害的原料、减少副产品的产生、使用可再生资源、提高原子经济性等。
4. 举例说明药物合成中如何进行立体选择性控制。
答案:立体选择性控制可以通过使用手性催化剂、手性辅助剂或手性起始材料来实现,确保目标化合物具有正确的立体构型。

药物合成反应知识点总结
药物合成反应是化学制药领域中的重要知识点,以下是一些可能有用的药物合成反应知识点总结:
1. 卤化反应:卤化反应是药物合成中常用的反应之一,主要用于将药物分子中的醇或酮羟基转化为卤代烃。
卤代烃的优点是具有广泛的药物合成应用,可以用于制备多种药物分子。
2. 烃化反应:烃化反应是将药物分子中的羟基或酮基转化为烃基的反应。
烃化反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
3. 缩合反应:缩合反应是药物合成中常用的反应之一,主要用于将两个或多个分子缩合成为一个分子。
缩合反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
4. 氧化反应:氧化反应是药物合成中常用的反应之一,主要用于将药物分子中的不饱和键氧化为饱和键。
氧化反应可以用于制备多种药物分子,例如杀虫剂、抗生素等。
5. 还原反应:还原反应是药物合成中常用的反应之一,主要用于将药物分子中的氧化剂还原为还原剂。
还原反应可以用于制备多种药物分子,例如维生素、甾体激素等。
6. 重排反应:重排反应是药物合成中常用的反应之一,主要用于将药物分子中的官能团进行重排。
重排反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
7. 官能团保护反应:官能团保护反应是药物合成中常用的反应
之一,主要用于保护药物分子中的某些官能团,避免在合成过程中受到破坏。
官能团保护反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
药物合成反应是化学制药领域中的重要知识点,掌握这些反应可以有助于更好地理解和设计药物合成路线。

药物合成复习题一、描述乙醇和乙酸之间的反应过程,以及产物的命名。
乙醇和乙酸之间的反应过程是酸酐合成反应。
乙醇和乙酸在催化剂存在下进行酯化反应,生成乙酸乙酯,并伴随着水的生成。
乙醇的结构式为CH3CH2OH,乙酸的结构式为CH3COOH,催化剂常采用硫酸(H2SO4)或者磷酸(H3PO4)。
乙酸乙酯的命名遵循酯的命名规则,将乙醇的甲基取代羟基部分的“ol”替换为“yl”,将乙酸的羧基部分的“oic acid”替换为“ate”,得到乙酸乙酯的命名为乙酸乙酯(ethyl acetate)。
二、描述水合肼的合成过程及应用。
水合肼合成过程是由氨和水的反应生成,反应物为氨和水,在催化剂存在下进行反应,生成水合肼,并伴随着氢气的生成。
水合肼广泛应用于某些化学工业过程中,比如用作还原剂、氧化剂和稳定剂。
水合肼的还原性较强,可将硝酸酯还原为相应的胺,用作染料还原剂和炸药的中和剂。
水合肼的氧化性较强,可以将某些物质氧化为高氧化态,用于钢铁工业中的除磷剂。
此外,水合肼还可以作为稳定剂运用在橡胶生产和硫化橡胶制品中。
三、描述苯甲酸的合成过程及应用。
苯甲酸合成过程是苯与溴乙酸酯发生酯交换反应,生成苯乙酸酯,随后苯乙酸酯氧化为苯甲酸,反应物为苯、溴乙酸酯和氧。
催化剂一般采用硫酸(H2SO4)或者高锰酸钾(KMnO4)。
苯甲酸是一种重要的有机酸,被广泛应用于医药、化学品和涂料等领域。
在医药领域中,苯甲酸可用于合成一些药物,如苯酚、水楊酸等。
在化学品领域中,苯甲酸可作为试剂和合成其他化学品的原料。
在涂料领域中,苯甲酸可以作为聚合物的助剂,提高涂料的附着性和耐候性。
四、描述巴豆酸的合成过程及毒性。
巴豆酸合成过程是由巴豆酚经过酰化反应生成。
巴豆酸的结构式为C21H1604。
巴豆酚的分子式为C29H3004,在催化剂存在下,巴豆酚与酸反应生成巴豆酸。


第一章卤化反应1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围?3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。
(1)卤素对双键的离子型加成(2)芳香环上的取代(3)方向化合物侧链上的取代(4)卤化氢对醇羟基的置换(5)NBS 的取代反应4 比较X2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。
怎样判断加成方向5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何?6 预测Br2/CCl4 于下列各种烯烃进行溴化反应的相对速度的次序。
CH2=CH2 (CH3)2C=CH2 HOOC-CH=CH-COOH (CH3)2C=C(CH3)2 CH3CH2=CH2 CH2=CH-CN7 对比下列反应的条件有何不同?结合反应机理加以说明:H3C CH2 CH 2Br(1)H3C CH CH 2H3C CHBr CH 3CH 3Cl CH 3(2)CH 2ClRH 2C CH CH 2(3) R H 2C CH CH 2BrRH 2C C CH 2OH8 下列反应选用何种氯化剂为好?说明原因。
(1) H3C C CH CH3 H3CC CH CH 2BrCH 3 CH 3(2)H3 C HC CH COOH H3C HC CH COCl(3) HO (CH 2 )6 OH IH2C(CH 2)4 CH 2 OH(4) H3CCO C H 2CH 2 COOH H3 CCO CH2CHCOBrBr(5) H3 CO CH2 OHH3CO CH 2 ClH2C C (CH 2 )6 COOHCl(6)H2 C HC (CH 2)6 COOHBr H2C (CH 2)6 COOHCOOHCOOHCOCl(7)Cl Cl HO OHNCl Cl NNCOClHO OHN9 完成下列反应,写出主要的试剂及反应条件:OHOH(1)COOH COClCH 3 CF3(2)(3) CH3COOHFXH2COOH(4) O COOH O I10 完成下列反应,写出其主要生成物(1) H3C C CHCH3Ca(OCl) 2/HOAc/H 2OH3C(2)HC CH2NBS/H 2O(3) CH3 C CH 2HBr/Bz2O2(4) OH 48%HBr(5) C H 2CH=CHCH2CH=CHBrCH 2=CH-COO-CH-CH 2 1molBr2/CCl4(CH 3)2C=CHCH 2CH=CH 2第二章烃化反应一烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?二用卤代烃对氨基和羟基的烃化反应各有何特点?烃化剂及被烃化物的结构对反应有何影响?三用于制备较纯的伯胺的方法有那几种?四举例说明“还原烃化”、“羟乙基化”的机理、特点及反应中的注意事项。
第一章 卤化反应一、烯丙型、苄基型化合物自由基卤化反应卤化试剂:NBS 、卤素 溶剂:CCl4、氯仿、苯、石油醚或反应底物自身二、芳香环上的亲电卤化反应 (一)卤素单质为卤化剂的亲电取代反应 (二)氢卤酸及其盐为卤化剂的卤化反应(三)胺氮卤化剂为卤化剂的卤代反应(N-氯代丁二酰亚胺NCS ,N-溴代丁二酰亚胺NBS ,N-溴代乙酰胺NBA ,N-氯代乙酰胺NCA )(四)次卤酸及其衍生物的卤化剂的卤化反应三、芳香烃卤甲基化反应(Blanc 反应 )卤甲基化试剂:甲醛-卤化氢、多聚甲醛-卤化氢、卤甲醚等。
质子酸:硫酸、磷酸、乙酸和Lewis acid 等均可催化反应。
四、不饱和烃与卤素的亲电加成反应机理:1桥金属离子历程2碳正离子历程OEt O NBS O Br Br CH 3Br hv / Br 2160 ~ 180o C Br Br 85%+Cl 23Cl +HCl MeO CONMe 2MeO CONMe 2Cl TBHP / HCl +MeO CONMe 250%35 : 65S H 3C S H 3C X X = Cl 94% Br 83%NXS / solvent 4H 3CO H 3CO H 3CO Cl Cl t-BuOCl / (C 2H 5)3N-3HF 0o C / CH 2Cl 265%4%++HCHO +HClZnCl 2Cl五.不饱和烃与卤化氢、氢卤酸的亲电加成六、羰基化合物α-位卤化反应卤化剂:X2、N-卤代酰胺、 次卤酸酯、硫酰卤 溶剂:CCl4, CHCl3, Et2O, AcOH七、羟基的置换卤化反应 卤化剂:卤化氢、氢卤酸、卤化磷、含硫卤化物(基本规律:1苄醇=烯丙醇>叔醇>仲醇>伯醇2HI>HBr>HCL>HF)二章 硝化反应直接硝化(电子云密度高的芳烃)HO Br HO 2+2Me H H Et Me H H Et Me H H Et Cl Cl Cl OAc Me H H Et AcO Cl + 52% 13% 33%LiCl 69% 8% 21%LiCl CH 3CH=CH 2CH 3CHBrCH 3CH 3CH 2CH 2Br 无过氧化物过氧化物Markovnikov 加成反Markovnikov 加成O MeOOC HO Br 2O MeOOC HOBrROH +HXRX +H 2O第四章 氧化反应一、Baeyer-Villiger 贝耶尔-菲林格氧化(酮类化合物用过氧酸氧化生成酯)机理:酮羰基先与过氧酸发生亲核加成,然后远羰基上的一个烃基带着一对电子迁移到过氧键的氧原子上,同时过氧键异裂,脱去过氧酸中的羧酸而形成酯。
二、 Sharpless 不对称环氧化反应在过渡金属配合物催化下,用烷基过氧化氢作氧化剂,可选择性地对烯丙醇的双键进行环氧化。
用四异丙醇钛提供金属配位中心,在反应中引入不对称结构的酒石酸导引实现了氧化反应的对映选择性,形成了Sharpless 反应。
三) Sharpless 不对称环氧化反应R 、R'重排顺序:叔碳>苯环-环己烷~苄基>-CH 2>CH3三、Oppenauer 氧化反应可逆,加大丙酮量(既作溶剂又作氧化剂)氧化特点:第五章 还原反应一、克莱门森还原锌粉在HCl 、CH3COOH 中可还原多种化合物,锌汞齐与盐酸的组合可将醛、酮中的羰基还原为亚甲基。
锌粉在氢氧化钠介质中是芳香硝基化合物发生双分子还原生成氧化偶氮化合物,偶氮化合物,氢化偶氮化合物等还原产物。
氢化偶氮苯在酸作用下,发生重排,生成联苯胺。
二、凯希涅-吴尔夫-黄鸣龙法是一种联氨还原羰基为亚甲基的化学还原方法。
反应是将羰基化合物转化为腙之后,不经分离直接在强碱村不在下强热,分子中的氮转化为氮气排除,腙还原为亚甲基。
机理:醇钠或氢氧化钾首先夺取腙氨基上的氢,同时N-H 键上的健电子转移形成N=N ,此时碳表现出亲核性而与溶剂中的氢结合生成偶氮化合物,碱进一步夺取最后一个氢放出碳负离子,进而从化水中夺取氢完成还原反应。
优点:1 不会生成副产物醇或不饱和化合物2 可用分子量较大的羰基化合物的还原,不影响收率3用于对酸敏感的化合物4受空间效应影响小。
条件:温度高170~180°C 沸点高的二乙二醇缩水化合物,常压进行。
操作方便,R H C HO R 'R C R 'H 3C H C OH CH 3CH 3CCH 3O +Al(O-iPr)3+a)烯丙位易氧化b)甾醇烯丙位氧化,双键位移HO O CH 33O O O Al(O-ipr)360%O 383%黄体酮OH O O Tol OH O时间短,收率高。
反应体系中过多水对反应有极大的影响,造成腙的水解羰基呗还原成醇,产品纯度降低,少量水会催化。
第六章 烃基化反应一、Williamson 醚合成方法结论:醇在碱的条件下与卤代烷生成醚(亲核取代反应)二、卤代烃作为烃基化试剂的N-烃化 反应通式R 可以是脂肪基、脂环基或芳香基,X 为卤素(Cl 、Br 、I )。
Gabriel 反应概念:以邻苯二甲酰亚胺和烃基化剂为原料,在碱性条件下经N-烃基邻苯二甲酰亚胺,再水解形成伯胺。
反应通式:R 为烷基、烯丙基、苄基等, X 为卤素(Cl 、Br 、I )、OTf 、OMs 等。
水解方式:(1)酸性条件水解;(2)水合肼肼解三、芳烃的Friedel-Crafts烃基化反应 (亲电取代反应)概念:反应是在路易斯酸或质子酸催化下完成的,烃基化剂可以是卤代烃、醇或不饱和烃等。
反应通式卤代烃活性顺寻:RF<RCL<RBr<RI四、 Grignard 试剂为烃基化剂概念:有机卤化物与金属镁在无水乙醚中反应生成有机镁化合物,即Grignard 试剂。
反应通式:ROH +R' X R-O-R'+HX B反应机理:第七章 酰化反应 O-酰化1. 羧酸为酰化剂采用质子酸、Lewis 酸、强酸型离子交换树脂或者负载Lewis 酸的树脂进行催化。
属可逆反应,应除生成之水。
可逆反应2. 羧酸酯为酰化剂酯可以与醇、羧酸和酯发生交换反应,与醇的交换反应称为醇解。
酸催化的反应机理:碱催化的反应机理一般要求R ’OH 的酸性比R ’’OH 的酸性强 各类醇的相对酸性强度:甲醇 > 一级醇 > 二级醇 > 三级醇3.酸酐为酰化剂 酸酐为一强酰化剂,多用在反应困难或位阻较大的醇羟基酰化上,反应时常用酸或碱进行催化。
酸催化碱催化: +RCOOH RCOOR'+H 2O Cat.R'OH RCOOR' + R''OH RCOOR'' + R'OH (醇解)R O R'O H R O R OH 'R O R'OH 2O R''R'OH R OOHH R O R''O R R'O +R''O R O O O R'R''R'O R O R''O R O R O O +R O R'O R O +R'OH R O R O O R O R O O H H O R R O H R'H R O R'O R O R'O +H R O R O O +N N CORR OR'O N +RCOO4.酰卤为酰化剂酰卤很活泼,可酰化位阻大的醇以及酚,在不易制备(混)酸酐的情况下,酰卤法更具优越性。
反应一般要加入有机或无机碱作缚酸剂。
第二节 氮原子上的酰化反应胺类化合物(脂肪胺或者芳胺) 可以采用羧酸、羧酸酯、酸酐、酰氯、烯酮酰化,氨基氮上的电子云密度越大、空间位阻越小,反应的活性就越强。
1. 羧酸为酰化剂一般需要在强热条件并有脱水剂存在时反应。
2. 酸酐作为酰化试剂酸酐的酰化活性比较强,反应是不可逆的,可加入催化量的酸或碱催化反应。
阿莫西林的工业生产:OH O O3CH 3OH O CH 3H 2SO 4AlCl 398%77%CHO OH CHO O O CH 3OO O NaOH,H 2O,r.t.,1h 91%RCOCl +N N COR Cl RCOOR'N HCl +.OH HN O +Cl Cl O K 2CO 3r.t.1h then reflux 2h O HN C O O Cl CH 3CH 3R OH O +R'R''NHNHR'R''R NR'R''O +H 2O R C O C R O O +R'NH 2R C NH 2R'C R O R NHR'O R OH O +也可以使用混合酸酐如羧酸-羧酸酐、羧酸-磺酸酐、羧酸-磷酸酐以及羧酸-碳酸酐等作为酰化剂。
4. 酰卤作为酰化试剂常用的酰卤是酰氯,活性高,酰化反应进行很剧烈。
一般加入有机或无机碱作为反应的缚酸剂。
第三节 C 原子酰基化一、芳烃的C-酰化1. Friedel-Crafts 酰化反应 酰化剂在质子酸或Lewis 酸催化下对芳烃进行亲电取代形成芳酮的反应。
4. Vilsmeier-Haauc 反应以N-取代的甲酰胺为甲酰化剂在三氯化氧磷的作用下,在芳环或芳杂环上引入甲酰基的反应。
N H O OCH 3O N O H 2N S COOH CH 3CH 3N O NH S COOH 3CH 32..Cat.Dan's salt N Cl Cl N H 2N Cl Cyclohexane, Py +N HN Cl N Cl 84%N O O Cl H 2N CF 3223N O O N H CF 381%+COR + RCOZLewis 酸Z = Hal, R'COO, R'O, OH N R R CHO POCl 3N R R'CHO-----POCl 2Cl C N H R R'2+N R R'CH Cl N R R'CH Cl OPOCl 2NR"2H CH NRR'2NR"2H C NRR'NR"2CHO _H H 2O _.第八章 缩合反应一、Aldol 缩合反应含有活性α-氢的醛或酮,在碱或酸的催化下发生自身缩合,或与另一分子的醛或酮发生交叉缩合,生成β-羟基醛或β-羟基酮的反应,称Aldol 缩合(醛醇缩合,羟醛缩合)。
β-羟基醛或β-羟基酮不稳定,易脱水生成α,β-不饱和醛或酮。