福大高等有机第三章反应机理
- 格式:ppt
- 大小:2.83 MB
- 文档页数:120




一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。



高中化学说课稿有机化学反应机理讲解高中化学说课稿:有机化学反应机理讲解一、引入有机化学是高中化学中的重要组成部分,也是学生们学习的难点和重点内容之一。
有机化学的反应机理是理解有机化合物性质和反应过程的基础。
本篇说课稿将重点讲解有机化学反应机理的相关知识。
二、反应机理的概述有机化学反应是指有机化合物之间或有机化合物与其他物质之间发生的化学反应。
反应机理则是指反应进行的详细步骤和转化过程。
理解反应机理有助于揭示反应的本质和规律。
三、反应机理中的关键概念1. 电子推动力电子推动力是指电子密度的变化导致有机化合物反应发生。
电子推动力可以通过电子的吸电子性或释电子性来判断。
具有吸电子基团的化合物通常是亲电子试剂,而具有释电子基团的化合物则具有亲核性。
2. 亲核试剂和亲电试剂亲核试剂是指在反应过程中能够捐赠一对电子的化合物,常见的亲核试剂有醇、胺等。
亲电试剂则是指在反应过程中能够接受一对电子的化合物,如卤代烃、酸等。
3. 中间体和过渡态中间体是指在反应过程中形成但不作为最终产物的中间物质。
中间体可以是离子性的也可以是非离子性的。
过渡态则是指反应物与产物之间的高能垒状态,是反应达到平衡的临界状态。
四、常见有机反应机理讲解1. 反应机理:取代反应取代反应是最基本的有机反应之一。
取代反应的反应机理可以通过下面的例子进行讲解:示例:甲烷与溴气的取代反应反应方程式:CH₄ + Br₂ → CH₃Br + HBr反应机理:溴气(Br₂)作为亲电试剂,通过攻击甲烷(CH₄)中的碳原子,形成一个自由基CH₃。
这个自由基CH₃与溴气反应,产生溴代甲烷(CH₃Br)和氢溴酸(HBr)。
2. 反应机理:加成反应加成反应是有机化学中的另一类重要反应。
加成反应的反应机理可以通过下面的例子进行讲解:示例:丙烯与氢气的加成反应反应方程式:C₃H₄ + H₂ → C₃H₆反应机理:氢气(H₂)作为亲核试剂,通过攻击丙烯(C₃H₄)中的碳碳双键,形成一个过渡态。


肥达反应应用的是什么原理简介肥达反应是一种重要的有机合成反应,其原理基于取代亲核试剂与含有酯和醛/酮官能团的底物之间的加成反应。
该反应在有机合成中广泛应用,在药物合成、天然产物合成以及材料科学等领域都有重要的应用。
原理肥达反应的原理是通过亲核试剂与底物发生取代反应,形成新的碳-碳键以及其他化学键。
亲核试剂通常是富电子的化合物,如 Grignard 试剂、有机金属试剂和有机硼试剂等。
而底物则是含有酯和醛/酮官能团的化合物。
在反应中,亲核试剂中的亲核部分攻击底物中的部分正电荷,形成中间体。
然后,中间体与底物中的其他部分反应,生成最终产物。
这个过程中的关键步骤是亲核试剂的加成反应和消除反应,以及中间体的稳定性。
应用肥达反应在有机合成中广泛应用,可以实现多样化的化学转化。
以下是肥达反应在不同领域的应用示例:1.药物合成:肥达反应可以用于合成药物的关键中间体和目标化合物。
例如,通过肥达反应合成新型药物分子的研究已经取得了显著的进展。
这些药物分子可以具有潜在的抗癌、抗菌、抗病毒等活性。
2.天然产物合成:天然产物合成通常需要多步反应以合成复杂的化合物结构。
肥达反应在天然产物合成中作为重要的反应步骤经常被应用。
通过肥达反应,可以实现天然产物中酯和醛/酮官能团的引入、功能团的修饰以及环部分的构建等。
3.材料科学:肥达反应在材料科学中有重要的应用。
一些有机合成的方法可以用于合成具有特定结构和性能的聚合物和物质。
通过肥达反应合成的聚合物可以具有特定的溶解性、热稳定性以及光学和电学性质,广泛应用于材料设计和功能材料的制备。
结论肥达反应是一种重要的有机合成反应,其原理基于取代亲核试剂与酯和醛/酮官能团的底物之间的加成反应。
该反应在药物合成、天然产物合成以及材料科学等领域都有重要的应用。
通过肥达反应,可以合成具有复杂结构和特定性能的化合物,推动着有机合成和材料科学的发展。




此文档仅供采集于网络,若有侵权请联系网站删除1.Arndt-Eister 反响酰氯与重氮甲烷反响,而后在氧化银催化下与水共热获取酸。
反响机理重氮甲烷与酰氯反响第一形成重氮酮(1),( 1)在氧化银催化下与水共热,获取酰基卡宾( 2),( 2)发生重排得烯酮(3),( 3)与水反响生成酸,若与醇或氨(胺)反响,则得酯或酰胺。
反响实例2.Baeyer----Villiger 反响反响机理过酸先与羰基进行亲核加成,而后酮羰基上的一个烃基带着一对电子迁徙到-O-O- 基团中与羰基碳原子直接相连的氧原子上,同时发生O-O 键异裂。
所以,这是一个重排反响拥有光学活性的3--- 苯基丁酮和过酸反响,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁徙,可是还是有必定的选择性,按迁徙能力其次序为:醛氧化的机理与此相像,但迁徙的是氢负离子,获取羧酸。
反响实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,此中三氟过氧乙酸是最好的氧化剂。
这种氧化剂的特色是反响速率快,反响温度一般在10~40 ℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反响机理在酸作用下,肟第一发生质子化,而后脱去一分子水,同时与羟基处于反位的基团迁徙到缺电子的氮原子上,所形成的碳正离子与水反响获取酰胺。
迁徙基团假如是手性碳原子,则在迁徙前后其构型不变,比如:反响实例4.Birch 复原芬芳化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混淆液中复原,苯环可被复原成非共轭的1, 4- 环己二烯化合物。
反响机理第一是钠和液氨作用生成溶剂化点子,而后苯获取一个电子生成自由基负离子(Ⅰ),这是苯环的л 电子系统中有7 个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子还是个环状共轭系统,(Ⅰ) 表示的是部分共振式。

有机反应和反应机理总结有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。
这种变化过程称为有机反应(organicreaction)。
一级反应:就动力学而言,反应速率仅取决于化合物浓度的反应称为一级反应。
二级反应:就动力学而言,反应速率取决于两种化合物浓度的反应称为二级反应。
一、按化学键的断裂和生成分类协同反应:在反应过程中,旧键的断裂和新键的形成在同一步进行协调,这称为协同反应。
协同反应通常具有循环过渡态。
这是一个基本反应。
自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。
自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。
由于键的均裂需要能量,所以链引发阶段需要加热或光照。
链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。
链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。
离子反应:通过分子的异裂形成离子所引起的反应称为离子反应。
离子反应包括亲核反应和亲电反应。
亲核试剂的攻击引起的反应称为亲核反应。
亲核试剂是一种对原子核有显著亲和力的试剂。
亲电试剂的侵蚀引起的反应称为亲电反应。
亲电试剂是一种对电子有显著亲和力的试剂。
二、按反应物和产物的结构关系分类加成反应:两个或多个分子相互作用产生加成产物的反应称为加成反应。
取代反应:有机化合物分子中的一个原子或基团被其他原子或基团取代的反应称为取代反应。
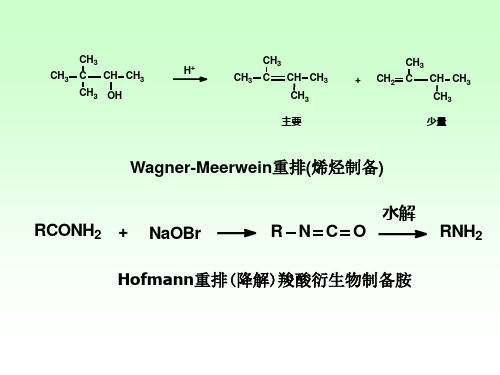
重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。
消除反应:在一个有机分子中消去两个原子或基团的反应称为消除反应。
可以根据两个消去基团的相对位置将其分类。
若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消除基团与相邻的两个碳原子相连,称为1,2-消除或消除β-消除;两个消除基团在1,3位与碳原子相连,称为1,3-消除或消除γ-消除。