糖元染色PAS法的改良
- 格式:doc
- 大小:25.50 KB
- 文档页数:3

实验十五糖类的显示方法——PAS反应
仪器设备:恒温水浴锅
器具:盖玻片、载玻片、培养皿、滤纸、镊子、吸水纸、剪刀、解剖盘、解剖针、棕色滴瓶染色缸
材料:蛙血
试剂及其配置:甲醇原液、Ringer氏生理盐水1N盐酸亚硫酸水1%亮绿甘油/PBS 封片剂Schiff”s 试剂肝素抗凝剂(每毫升生理盐水含1mg肝素钠)、1%过碘酸水溶液
a:1NHCl: 浓盐酸8.5ml定容至100毫升
b:亚硫酸水:10%偏重亚硫酸钠5毫升
1NHCl 5毫升
蒸馏水90毫升
c:Schiff”s试剂:称取0.5g碱性品红(basic fuchsin),加入到100ml煮沸的
蒸馏水中,时时搅拌,继续煮5分钟,使之充分溶解,但勿
使沸腾。
然后冷却至50℃时用滤纸过滤。
往虑液中加入10ml
1mol/L盐酸,冷却至25℃时,加入1g偏重亚硫酸钠(NaHSO3),
摇荡后塞紧玻璃塞在室温避光处静置12-24小时,使其颜色
退至淡黄色。
然后加入1g活性炭,用力摇荡1分钟,封严
瓶塞,储存于4℃冰箱备用。
使用前升至室温。
注意随时盖紧瓶口,不要过长时间暴
露在空气中,并用黑纸或暗盒避光,以避免氧化变成红色。
如变成红色即失去染色能力。
d:1%过碘酸水溶液:1g过碘酸溶解于100ml蒸馏水中
e:甘油/PBS封片剂(0.01M PBS:甘油=1:9 (V/V))
第1页共1页。

细胞PAS糖原染色1. 简介细胞PAS糖原染色是一种常用的组织学技术,用于检测细胞内是否存在糖原。
PAS (Periodic Acid-Schiff)染色方法通过使用周期酸和Schiff试剂,能够将组织中的糖原染成紫红色。
2. 原理2.1 PAS染色方法PAS染色方法主要包括以下几个步骤: 1. 取细胞或组织标本,固定并包埋。
2. 制作切片,将切片脱脂去蜡。
3. 将切片置于周期酸溶液中,在适当的时间内进行氧化处理。
周期酸能够氧化多数糖类物质,使其产生亲合Schiff试剂的位点。
4. 清洗去除周期酸。
5. 加入Schiff试剂,与氧化后的糖原结合形成紫红色沉淀。
6. 清洗去除Schiff试剂。
7. 对切片进行脱水、透明化和封片。
2.2 PAS染色结果解读•阳性反应:呈紫红色至红色,表示细胞中存在糖原。
•阴性反应:无颜色或淡黄色,表示细胞中不存在糖原。
3. 实验步骤3.1 材料准备•周期酸溶液•Schiff试剂•脱蜡剂•脱水液(不同浓度乙醇)•透明剂(如山梨醇)•封片剂3.2 实验步骤1.取已经固定并包埋的组织标本,制作切片。
2.将切片放入去蜡剂中,去除蜡质。
3.进行脱水,逐渐将切片浸泡于不同浓度的乙醇中(如70%,80%,90%和100%),每次浸泡时间约为2-5分钟。
4.将切片放入周期酸溶液中,在室温下进行氧化处理。
氧化时间根据需要可在5-30分钟之间调整。
5.清洗去除周期酸,将切片置于流动自来水下冲洗数分钟。
6.加入Schiff试剂,将切片置于试剂中静置10-15分钟。
注意避免阳光直射。
7.清洗去除Schiff试剂,将切片置于流动自来水下冲洗数分钟。
8.进行脱水,逐渐将切片浸泡于不同浓度的乙醇中,每次浸泡时间约为2-5分钟。
9.将切片置于透明剂中,使其变得透明。
10.将切片放入封片剂中,并用玻璃盖片封装。
4. 结果分析通过PAS糖原染色方法,我们可以观察到细胞中的糖原含量及分布情况。



PAS染色一、简介PAS染色法(Periodic Acid-Schiff stain)在组织学上,主要用来检测组织中的糖类。
过碘酸把糖类相邻两个碳上的羟基氧化成醛基,再用Schiff试剂和醛基反应使呈现紫红色。
随着医学实验技术的发展,糖原染色应用的范围更加广泛,如用以证明与鉴别细胞内空泡状的性质,心肌病变及其他心血管疾病的诊断,糖原累积病诊断和研究,糖尿病的诊断和研究,用于某些肿瘤的诊断等。
除用于糖原的鉴定和黏液的显示外,还可以观察肾小球基底膜、结肠杯状细胞中性黏液物质、阿米巴滋养体和霉菌的着色。
临床诊断、分类和治疗提供了重要的依据。
大贤新材料有限公司综合了国内外最新的染色技术,并经长期反复试验验证探索出一种高效、快速、染色清晰的方法。
为了追求高质量,本公司在染色的每一个环节都以高标准要求着自己。
首先,染色液的配制试剂原料如:苏木素、碱性品红红等均采自阿拉丁、sigma等国际知名公司。
其次,染色液的配制是在洁净的实验室进行的,配制方法也是在不断改良的基础上得到的新一代产品,具有染色时间快、颜色鲜艳、不容易褪色、使用寿命长等特点。
此外,本公司的染色步骤也是经本公司是在新一代染色液应用基础上进一步改良而得到的一种简便、快捷且染色清晰、稳定的操作过程。
由于本公司注重染色过程的每一个环节,结果胞核染得亮而蓝,糖原呈紫红色,未出现切片组织破坏、着色模糊或过深。
大贤新材料有限公司服务一流,工作高效。
每一个顾客的满意就是本公司的基本要求,无论什么时候有需求,本公司都会予以服务。
其次,本公司承诺会在接到样品的3-5个工作日染好寄回。
此外,为了保证染好的切片质量,本公司将精细包装,并免费赠送一个冰袋。
二、注意事项1. 切片取回后请尽快拍照。
2. 切片最好4℃保存。

三种糖原染色方法的灵敏度比较【关键词】糖原染色;过碘酸-席夫反应;高碘酸-雪夫反应;雪夫试剂;PAS 法糖原染色对鉴别诊断急性白血病、骨髓增生异常综合征等血液病具有重要价值[1]。
糖原染色法的雪夫试剂配制方法有多种,包括标准法[2]、亚硫酰氯法[3]及陈啸梅法(冷配法)[4]等典型方法。
遂对3种染色法的灵敏度进行比较,以避免选用不灵敏的方法。
1 材料与方法1.1 实验方法取同一患者的骨髓片3张,分别用标准法、亚硫酰氯法及陈啸梅法雪夫试剂进行糖原染色。
为了确定特别重要的雪夫试剂(Schiff液)质量,必须统一反应条件以进行准确比较,即3种染色法骨髓片均选用95%乙醇固定15 min、10 g/L(44 mmol/L)过碘酸22℃氧化60 min[5]、入雪夫试剂(席夫染液)中22℃水浴染色60 min[5]等最关键步骤。
1.2 患者选择及计算积分患者共20例。
其中,慢粒(CML)、原发性血小板增多症(ET)、缺铁性贫血(IDA)及特发性血小板减少性紫癜(ITP)共5例,急性淋巴细胞白血病L1型(L1)、L2型(L2)共8例,急性早幼粒细胞白血病完全缓解(M3CR)仅1例,巨幼细胞贫血(MA)、非霍奇金淋巴瘤(NHL)、溶血性贫血(溶贫)共6例,均以中性杆状核粒细胞、中性分叶核粒细胞判断阳性程度[1]及计算积分(阳性指数)[1]。
1.3 统计学分析对积分结果进行随机区组设计资料的Friedman秩和检验,以标准法为共同对照组进行多样本的两两比较。
用PEMS 3.1统计软件分析。
2 结果标准法(1组)、亚硫酰氯法(2组)及陈啸梅法(3组)积分均数及中位数依次降低(见表1),随机区组设计资料的Friedman秩和检验示校正χ2=27.564 1,P=0.000 0,说明1~3组染色积分相比较差异具有极显著性;以1组为共同对照组进行多样本的两两比较(q’检验),1组与2组q’值为1.976 4,P<0.05,1组与3组q’值为5.138 7,P<0.01。
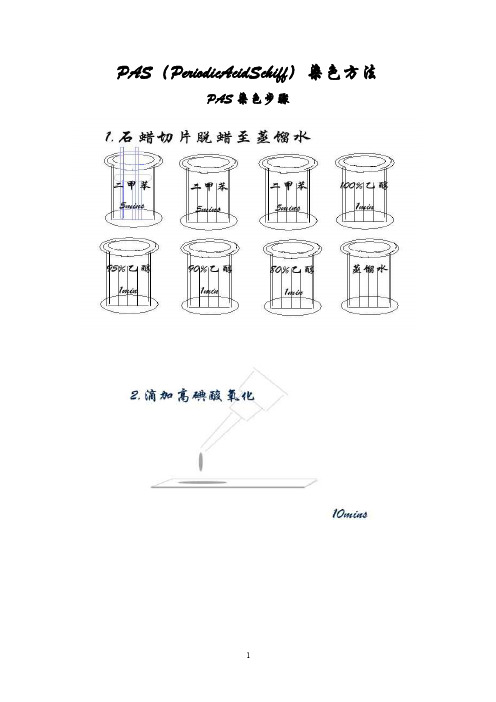
PAS(PeriodicAcidSchiff)染色方法PAS染色步骤结果:糖原,粘液和基底膜-红色/粉红色.,背景-蓝色。
未经淀粉酶消化的切片,糖原被PAS染成洋红色,经淀粉酶消化的切片消失。
试剂配制1.0.5%过碘酸水溶液过碘酸 2.5g蒸馏水500ml2.Schiff试剂Schiff试剂碱性复红(CI42500)6g蒸馏水1200ml1N盐酸60ml偏重亚硫酸氢钠12g用600ml蒸馏水溶解6g碱性复红,煮沸几分钟,冷却到50℃加入1N盐酸60ml,冷却到25℃加入12g偏重亚硫酸氢钠(高纯度化学试剂)。
液体放于暗处24小时。
加5~6g活性炭,摇动大约1分钟。
通过粗过滤纸过滤,液体应该清亮,如果液体有颜色重复加入活性炭。
蒸馏水加到液体到总量600ml,放入棕色瓶中冰箱内保存。
3.Mayer改良苏木精夜苏木精2g硫酸铝钾100g蒸馏水600ml碘酸钠0.4g冰醋酸20ml硫酸铝钾加入蒸馏水中稍加热,同时将苏木精溶于无水乙醇中,再将两种液混合,加入碘酸钠,充分溶解。
此液是一种进行性苏木精液,染色时一般不需要分化,但染色过深可以进行适当分化。
注意事项:关键是碘酸钠的使用量1)根据气候季节温度的改变,适当调整碘酸钠的使用量,配方中给出的量适合夏季(温度大约25℃)随着温度下降每降1℃碘酸钠的使用量增加0.01g,最多不能超过配方使用量的50%,过量的碘酸钠可是苏木精氧化,不仅有效时间短,还会出现核浆共染。
2)称量一定要准确,碘酸钠尽量使用精确度高的天平称量。
3)碘酸钠有有限期,除了注意有效期,还应注意有无潮解,质量不保险的碘酸钠最好不用,为了保险使用有效的碘酸钠。

骨髓细胞糖原染色(PAS)的标准操作程序【目的】保证骨髓细胞糖原染色结果的准确性。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报请专业组长及科主任签字后生效。
【方法原理】骨髓细胞化学染色是以细胞形态学为基础,运用化学反应的原理对血细胞内的蛋白质、核酸、酶类、糖类、脂类及无机盐类进行定性、定位、半定量分析的方法。
主要用于辅助诊断急性白血病类型;协助血液系统等疾病的诊断、鉴别诊断;观察疾病的疗效和预后;探讨发病机制等。
糖原染色的原理细胞内含有乙二醇基的多糖类物质被过碘酸氧化形生双醛基类物质,后者在醛基与无色品红(Schiff试剂)结合产生紫红色化合物,定位于含多糖类成分的细胞质中,沉淀物的显色深浅与乙二醇的含量成正比。
【试剂】糖原(PAS)染色液,贝索生物技术有限公司1、PAS Ⅰ液:2.5ml×5。
2、PAS Ⅱ液:2.5ml×5。
3、PAS Ⅲ液:2.5ml×5。
4、20g/L甲基绿溶液或苏木素液【操作】1、涂片滴加PAS Ⅰ液5分钟,水洗,晾干。
2、滴加PAS Ⅱ液10分钟,水洗,晾干。
3、置于PAS Ⅲ液中暗处放置30分钟,流水冲洗5分钟,晾干。
4、20g/L甲基绿溶液或苏木素液复染5分钟,水洗晾干,镜检。
【结果判断】阴性:细胞内无红色沉淀阳性:细胞内出现红色沉淀物,定位于胞质。
细胞质出现红色颗粒、块状或弥漫状红色为阳性阳性强度参考标准-细胞质无色,无颗粒+细胞质淡红色,或少量红色颗粒;2+细胞质红色,或10个以上红色颗粒;3+细胞质红色,或有粗大颗粒,可出现红色块状;4+细胞质紫红色或有粗大块状。
一般原粒细胞呈阴性反应,早幼粒细胞以下随着细胞成熟而阳性增强,成熟中性粒细胞最强;嗜酸性粒细胞颗粒不着色,细胞质为阳性,嗜碱性粒细胞阳性。
原淋巴细胞阳性程度低,随着细胞成熟阳性程度稍增加。
单核细胞仅有少量、细小颗粒。
幼红细胞为阴性。

pas染色无特殊PAS染色作为一种常用的组织学染色技术,广泛应用于病理学研究中。
它的全称是Periodic acid-Schiff染色,它通过化学反应将组织中的多糖类物质染色成粉红色,从而帮助研究人员观察和诊断组织学的变化。
在PAS染色过程中,除了标准的染色程序之外,还可以根据具体需要进行一些特殊的处理方法,以获得更准确的结果。
PAS染色的步骤包括周期酸解脱、PAS染色、亚硫酸盐洗涤和脱水再处理等。
在周期酸解脱阶段,使用周期酸对组织切片进行脱氧糖处理,去除胶原和其他蛋白质。
然后,在PAS染色步骤中,组织切片暴露在Periodic acid溶液中,使多糖物质发生氧化反应,生成与PAS试剂中的Schiff试剂结合,形成可见的粉红色沉淀物。
接下来,使用亚硫酸盐洗涤将PAS试剂中未结合的Schiff试剂去除,以减少背景染色。
最后进行脱水再处理,使组织切片逐渐脱水并固定。
在正常的PAS染色中,无特殊的处理方法被应用。
然而,在特定的病理情况下,为了满足对组织学变化的更深入观察和诊断,一些特殊的PAS染色方法可能会被采用。
首先,对于一些高度血管化的组织,可以采用透明化技术来改善观察效果。
透明化可以去除组织中的脂质和背景噪音,使观察更加清晰。
其次,对于组织中存在鲜明对比的结构,可以进行显微镜下的细胞计数。
这种方法可以通过对染色组织切片的特定区域进行计数,获取特定细胞类型的数量信息。
此外,还可以利用图像分析软件对PAS染色图像进行数字化处理,进一步提取更多的信息并进行分析。
总之,PAS染色是一种常用的组织学染色技术,可提供对多糖类物质的检测和分析。
在正常的PAS染色中,通常不需要特殊的处理方法,而对于一些特定的病理情况,可以采用透明化技术、细胞计数和图像分析等特殊方法,以获得更准确的结果。
利用PAS染色技术,研究人员可以更好地理解和诊断组织学的变化,为疾病的研究和治疗提供更多的线索。

PAS改良染色法及其在病理诊断中的应用陈锦;史炯;孟凡青;聂岭【期刊名称】《现代肿瘤医学》【年(卷),期】2015(000)021【摘要】目的:改良高碘酸-无色品红染色方法( PAS),改善PAS染色结果,为临床病理诊断提供可靠依据。
方法:脱蜡至水的病理切片。
选择2%高碘酸钠作为氧化剂,严格控制氧化剂20分钟作用时间,使用自行配制的Schiff试剂染色孵育5分钟,苏木素衬染,观察染色结果。
并将300例含头颈、肺、肾脏、肝脏及胃标本的染色结果与传统的PAS染色法染色结果相互比较。
结果:改良后PAS染色方法的PAS阳性物质(黏液、糖原等)颜色鲜艳,特异性强。
结论:影响PAS 染色的因素很多,使用2%高碘酸钠氧化液,严格控制染色温度和时间,可有效改善PAS染色结果。
%Objective:To refine the periodic acidschiff( PAS)histochemical staining method and to improve quality of staining. Methods:A modified special Schiff reagent was used,then sodium periodate as the oxidizing agent with a reaction time of 20 min. We compared the new reagent with traditional PAS staining in 300 specimens including head & necK,lung,Kidney,liver and stomach. Results:Mucus and glycogen was stained red,the nuclei was stained purple. The effect of the stain was excellent in the improved method. Conclusion:Raised concentration of oxidizing so-lution,a proper dyeing duration and coloration temperature,which improve the PAS staining of glycogen.【总页数】3页(P3069-3071)【作者】陈锦;史炯;孟凡青;聂岭【作者单位】南京大学医学院附属鼓楼医院病理科,江苏南京210008;南京大学医学院附属鼓楼医院病理科,江苏南京210008;南京大学医学院附属鼓楼医院病理科,江苏南京210008;南京大学医学院附属鼓楼医院病理科,江苏南京210008【正文语种】中文【中图分类】R730.43【相关文献】1.改良PAS染色法在急性肝损伤中的应用 [J], 张风;陶艳艳;陈高峰2.过碘酸-Schiff(PAS)染色方法的改良及其在病理诊断中的应用 [J], 祁珊珊3.改良微波姬姆萨染色法在病理诊断中的应用体会 [J], 赵一岭;黄高升4.改良PAS染色法在急性肝损伤中的应用 [J], 张风;陶艳艳;陈高峰5.改良的Ab-PABF与Ab-PAS组织化学染色法在小鼠小肠粘液染色中的应用比较 [J], 刘贤华;白晓东;粟永萍因版权原因,仅展示原文概要,查看原文内容请购买。


pas反应是检测组织内的PAR(periodic acid-Schiff)反应,又称PAS(periodic acid-Schiff)反应,是一种常用于组织学和病理学中的染色方法。
该方法通过使用碘酸和硫酸的化学反应,能够将含有多糖或糖蛋白的组织或细胞染为紫红色,从而实现对其形态和化学成分的研究。
本文将详细介绍PAS 反应的原理、操作步骤以及其在组织学和病理学中的应用。
一、PAS反应的原理PAS反应的原理基于碘酸和硫酸之间的化学反应。
在该反应中,碘酸(HIO4)能氧化多糖分子中的羟基,使其转化为醛基。
接着,硫酸(H2SO4)与醛基反应生成醛酸,然后醛酸与甘氨酸缩合,形成一种稳定的紫红色产物。
这一系列的反应使得组织或细胞中的多糖或糖蛋白能够被染色,并能够在显微镜下观察到。
二、PAS反应的操作步骤1. 组织样本制备:将待检测的组织获取并固定在10%中性缓冲福尔马林中。
随后,将组织样本进行脱水和包埋处理,以获取切片样本。
2. 切片:使用切片机将包埋的组织样本切成薄片,并将薄片置于玻璃载玻片上。
3. 烘干:将载有组织切片的玻璃载玻片放置在60-70°C的烘箱中,烘干3-4小时。
4. 去蜡:将烘干后的切片玻璃载玻片放入戊醇中,连续处理2小时,并将玻璃载玻片洗净。
5. PAS染色液的制备:按比例将碘酸和硫酸混合,在制备过程中应避免产生气泡。
6. PAS染色:将去蜡的切片用PAS染色液浸泡,温度控制在20-25°C,时间控制在10-30分钟。
7. 脱色:将染有PAS染色液的切片进行脱色处理,可以选择三氯化铁0.5%-2%溶液进行脱色处理,时间为数秒至数分钟。
8. 除色:将脱色后的切片用明胶脱色,时间为5-10分钟。
9. 水洗:将明胶脱色后的切片进行水洗,可用自来水冲洗10分钟以上。
10. 固定和封片:将水洗后的切片用半胱氨酸固定液固定,然后涂上封片剂,覆盖载玻片,用甲苯浸泡5-10分钟。
三、PAS反应的应用PAS反应在组织学和病理学中具有广泛的应用。

pas染色评分标准
PAS(Papanicolaou染色)是一种常用于细胞学研究和诊断的染色方法,尤其是用于宫颈细胞学检查和乳腺细胞学检查。
PAS染色评分标准用于评估细胞或组织中糖原含量的变化。
以下是一种常见的PAS染色评分标准:
0分:完全无糖原。
1分:非常少的糖原,仅在细胞或组织的一小部分中可见。
2分:有少量糖原,但仍限制在一小部分细胞或组织中。
3分:糖原存在于较大的比例的细胞或组织中,但仍然不是普遍存在。
4分:糖原广泛分布于细胞或组织中,几乎每个细胞都有糖原的存在。
此外,有些研究还可能使用更详细的评分标准,例如0分表示完全无糖原,1分表示糖原在细胞中存在,但数量很少,2分表示糖原在细胞中中等数量,3分表示糖原在细胞中丰富但不普遍存在,4分表示糖原在细胞中广泛普遍存在。
这些评分标准可以根据具体研究的需要进行调整和改变,并且可能在不同的研究领域或实验室之间存在差异。
最终的评分标准应根据研究目的和具体实验条件进行确定。

改良PAS染色法在急性肝损伤中的应用张风;陶艳艳;陈高峰【期刊名称】《世界中医药》【年(卷),期】2015(000)002【摘要】目的:观察改良肝脏糖原PAS染色法,并观察肝脏糖原染色在急性肝损伤中的应用。
方法:复制CCl4急性肝损伤模型,首次100%CCl43 mL/kg皮下注射,此后50%CCl4橄榄油溶液2 mL/kg每周2次共4次皮下注射,诱导大鼠急性肝损伤模型。
计算大鼠肝体比;HE染色观察肝组织炎症病理;试剂盒检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、白蛋白(Alb)。
肝脏常规PAS染色与改良PAS染色观察肝糖原染色。
结果:与正常组相比,模型组ALT、AST活性与TBil含量明显升高(P<0.05),Alb含量明显降低(P<0.05);HE染色示,模型组肝小叶结构排列紊乱,肝细胞脂肪变、气球样变明显。
常规PAS染色,正常组肝组织PAS染色阳性占肝脏面积为32.38%±5.50%;与正常组相比,模型组肝组织PAS阳性染色明显减少(P <0.01),占肝脏面积为8.60%±3.34%。
改良PAS染色提示,正常组肝脏可见大量PAS阳性染色,占肝脏面积为75.50%±9.02%;与正常组相比,模型组肝组织PAS阳性染色明显减少(P<0.01),占肝脏面积为17.61%±3.53%。
在空白对照组与模型肝组织中,肝糖原改良PAS染色阳性率明显高于常规PAS染色法(P<0.01)。
改良PAS染色肝糖原阳性染色面积更真实反映急性肝损伤程度。
结论:改良肝脏糖原PAS染色法有助于急性肝损伤程度评估。
【总页数】4页(P178-181)【作者】张风;陶艳艳;陈高峰【作者单位】上海中医药大学附属曙光医院·肝病研究所,上海,201203;上海中医药大学附属曙光医院·肝病研究所,上海,201203; 肝肾疾病病证教育部重点实验室,上海,201203;上海中医药大学附属曙光医院·肝病研究所,上海,201203; 肝肾疾病病证教育部重点实验室,上海,201203【正文语种】中文【中图分类】R-331【相关文献】1.PAS改良染色法及其在病理诊断中的应用 [J], 陈锦;史炯;孟凡青;聂岭2.改良PAS染色法在冷冻切片中的应用 [J], 杨伟平;吴文乔;邹宗楷;洪少君;黄春妹;苏海燕3.改良PAS染色法在急性肝损伤中的应用 [J], 张风;陶艳艳;陈高峰4.PAS联合D-PAS染色法在肝组织活检病理检查中的应用 [J], 李敏;曾玲5.改良的Ab-PABF与Ab-PAS组织化学染色法在小鼠小肠粘液染色中的应用比较 [J], 刘贤华;白晓东;粟永萍因版权原因,仅展示原文概要,查看原文内容请购买。
糖原PAS 染色液(培养细胞专用)简介:糖原染色是病理学中常规的染色方法之一,McManus 在1946年最先使用高碘酸-雪夫技术显示黏蛋白,该法常用来显示糖原和其他多糖,该技术不仅能显示糖原,还能显示中性黏液性物质和某些酸性物质以及软骨、垂体、霉菌、真菌、色素、淀粉样物质、基底膜等。
过碘酸(又称高碘酸)是一种强氧化剂,它能氧化糖类及有关物质中的1,2-乙二醇基,使之变为二醛,醛与Schiff 试剂能结合成一种品红化合物,产生紫红色。
Leagene 糖原PAS 染色液(培养细胞专用)专门用于培养细胞的染色,是采用Leagene 特有配方技术,大大增强了染色效果;性能稳定,特异性强;操作简捷,仅需1h; 过碘酸、苏木素浓度更低,更适用于细胞、超薄组织切片染色;无盐酸乙醇分化步骤。
该试剂适用于科研领域,不适用于临床诊断。
组成:操作步骤(仅供参考):1、 培养细胞用PAS 固定液固定。
2、 水洗、晾干。
3、入过碘酸溶液室温氧化。
4、自来水冲洗2次,蒸馏水浸洗2次。
5、入Schiff Reagent 并加盖,置于室温阴暗处浸染。
6、亚硫酸钠溶液滴洗2次,每次,该步骤亦可省略。
7、流水冲洗2min 。
8、入Mayer 苏木素染色液复染。
水洗、晾干、镜检。
编号 名称DG0011 5×20ml DG0011 5×50ml Storage试剂(A): PAS 固定液 50ml 100ml 4℃ 避光 试剂(B): 过碘酸溶液 20ml 50ml 4℃ 避光 试剂(C): Schiff Reagent 20ml 50ml 4℃ 避光试剂(D): 亚硫酸钠溶液 20ml 50ml RT 密闭试剂(E): Mayer 苏木素染色液 20ml50ml4℃ 避光使用说明书1份染色结果:PAS反应阳性物质(糖原或多糖)红色或紫红色细胞核蓝色细胞质深浅不一的红色备注:颜色深浅很大程度上取决于样品在过碘酸溶液和Schiff Reagent中作用时间的长短。

改良PAS整块染色法显示肝糖原吴雨岭;巫岳龙;杨晓红;徐富翠;赵宏贤;郑勇【期刊名称】《泸州医学院学报》【年(卷),期】2013(036)001【摘要】目的:探讨PAS整块染色过程中固定与氧化同时处理与顺序处理对肝糖原显示效果的影响.方法:取成年家兔肝脏两小块,一块作固定与氧化顺序处理,另一块作固定与氧化同时处理,Schiff氏试剂染色,两组织块行石蜡切片,观察肝细胞内PAS 反应阳性物质的深浅与分布特征.结果:两种方法均能显示肝细胞内糖原,PAS反应均为阳性,其中固定与氧化顺序处理法中PAS阳性强,阳性物质分布均匀,结构清晰.固定与氧化同时处理法中PAS阳性反应较弱,阳性物质分布不均.结论:PAS整块染色过程中固定与氧化顺序处理法优于固定与氧化同时处理法.【总页数】2页(P89-90)【作者】吴雨岭;巫岳龙;杨晓红;徐富翠;赵宏贤;郑勇【作者单位】泸州医学院形态实验室,四川泸州646000;泸州医学院形态实验室,四川泸州646000;泸州医学院形态实验室,四川泸州646000;泸州医学院形态实验室,四川泸州646000;泸州医学院形态实验室,四川泸州646000;泸州医学院显微镜室,四川泸州646000【正文语种】中文【中图分类】R329.3【相关文献】1.用改进的Pas法显示组织内糖原 [J], 张艳;陈银成2.显示心肌闰盘横纹的过锰酸钾苏木素伊红整块染色法 [J], 龚林;刘广益;等3.滋养细胞肿瘤糖原PAS整块显色及图像定量分析 [J], 黄秀琴;蒋淑萱;赵如华;马丽梅;徐琳;王继芳;李坪4.骨骼肌整块染色法的改良 [J], 姜蓉5.龙胆紫Schiff液PAS整块染色显示实验犬环杓后肌功能重建的肌糖原的定量分析 [J], 黄秀琴;马丽梅;吴平;蒋淑萱;王正强;李素华;梁伟平;陈贤明;李坪;毛一诚因版权原因,仅展示原文概要,查看原文内容请购买。

PAS染色技术的改进
钟妮娜;耿毅
【期刊名称】《中国生物学文摘》
【年(卷),期】2006(020)005
【摘要】糖类的组织化学长期以来主要靠PAS技术且沿用至今。
临床上常用于诊断细胞中糖元的丢失,黏液变性,霉菌,肿瘤等多种疾病。
作为PAS染色的主要染液Schiff氏液的配制是该染色成功的关键。
传统的Schiff氏液的配制,使用异性重亚硫酸钠等。
通常一次性大量配制备用,时间存放稍久,效果便不甚满意。
笔者在多年工作中,摸索了一种配制Schiff氏液的方法,配制只需2h,放置于4℃冰箱中3-5年可反复使用,染色效果优良。
图1参5
【总页数】1页(P57)
【作者】钟妮娜;耿毅
【作者单位】四川农业大学动物科技学院,四川雅安620514;不详
【正文语种】中文
【中图分类】Q2
【相关文献】
1.PAS染色技术的改进 [J], 钟妮娜;耿毅;彭西
2.介绍一种PAS与免疫组化双重染色技术 [J], 陈水平;郑伟;肖志芸
3.HE+PAS+改良 Warthin-Starry染色技术联合诊断放线菌病 [J], 徐炜
4.小鼠主动脉斑块大体油红O染色技术的改进 [J], 陈小翠;马依彤;孙明慧;陈邦党
5.胃泌素、CEA及AB/PAS三种免疫组化、组化以及双重染色技术在胃癌研究中的应用 [J], 邢惠清;田玉旺;王桂云
因版权原因,仅展示原文概要,查看原文内容请购买。

PAS染色在病理应用中的体会
郭惠彬
【期刊名称】《现代医药卫生》
【年(卷),期】2010(026)020
【摘要】糖原易溶于水,因此组织必须趁新鲜固定或冰冻起来,固定之前不能用水或生理盐水浸洗。
作糖原染色的切片,必须经过特殊的固定液固定后进行石蜡切片才
能把糖原保存下来。
PAS染色可显示糖原,因此在明确细胞内空泡的性质、糖原贮
积病的诊断以及某些透明细胞肿瘤的诊断等方面具有鉴别作用。
因其可显示中性粘液物质,故在癌的鉴别诊断中可有帮助,同时为明确低分化腺癌的诊断中也极为有用。
【总页数】1页(P3131-3131)
【作者】郭惠彬
【作者单位】龙岩市第二医院病理科,福建,龙岩,364000
【正文语种】中文
【中图分类】R36
【相关文献】
1.PAS改良染色法及其在病理诊断中的应用 [J], 陈锦;史炯;孟凡青;聂岭
2.过碘酸-Schiff(PAS)染色方法的改良及其在病理诊断中的应用 [J], 祁珊珊
3.PAS/AB染色在临床病理工作中的应用探讨 [J], 张杰;王可
4.PAS联合D-PAS染色法在肝组织活检病理检查中的应用 [J], 李敏;曾玲
5.自动染色机在病理常规染色中的应用体会及改进 [J], 成克伦; 姜森; 成鑫; 胡国梅
因版权原因,仅展示原文概要,查看原文内容请购买。

滋养细胞肿瘤糖原PAS整块显色及图像定量分析
黄秀琴;蒋淑萱;赵如华;马丽梅;徐琳;王继芳;李坪
【期刊名称】《中国组织化学与细胞化学杂志》
【年(卷),期】1999(000)001
【摘要】应用图像分析仪,对经过PAS整块染色的44例滋养细胞肿瘤标本进
行糖原定量测定和分析。
结果表明:滋养细胞肿瘤细胞的糖原含量和细胞增生程度成正比。
恶性葡萄胎(HM)(未化疗)和绒毛膜癌(未化疗)的糖原含量明显高于良性葡萄胎和正常绒毛,有极显著性差异(P<0.01)。
恶性葡萄胎和绒毛膜癌经化疗后,糖原含量明显降低。
结果提示:滋养细胞肿瘤糖原含量的图像分析,在该肿瘤的诊断、预测预后,指导临床治疗方面,有一定的意义
【总页数】3页(P105-107)
【作者】黄秀琴;蒋淑萱;赵如华;马丽梅;徐琳;王继芳;李坪
【作者单位】昆明医学院组织胚胎学教研室
【正文语种】中文
【中图分类】R329.24
【相关文献】
1.滋养细胞肿瘤DNA图像定量分析 [J], 黄秀琴;王继芳
2.改良PAS整块染色法显示肝糖原 [J], 吴雨岭;巫岳龙;杨晓红;徐富翠;赵宏贤;郑勇
3.新显色剂偶氮溴膦—PA与钍显色反应的研究 [J], 沙玫君;张秋萍
4.利用裂解气相色谱-质谱法研究PA66/PA6合金的定性定量分析 [J], 吴博;谢晓琼;李卫领;庞承焕;叶南飚;陈平绪;黄险波
5.龙胆紫Schiff液PAS整块染色显示实验犬环杓后肌功能重建的肌糖原的定量分析 [J], 黄秀琴;马丽梅;吴平;蒋淑萱;王正强;李素华;梁伟平;陈贤明;李坪;毛一诚
因版权原因,仅展示原文概要,查看原文内容请购买。
糖元染色PAS法的改良
秦皇岛市肿瘤医院康文喜李伟刘小兰邮编:066001
糖原是单纯的多糖,因其功能与结构和植物淀粉相似,故又称动物淀粉。
糖原是由葡萄糖组成的带分支的大分子多糖,主要储存在肝脏和肌肉的胞质内。
在一些疾病的诊断和研究中,如心肌病、心血管疾病、糖原积累病、糖尿病肿瘤(肝细胞癌、横纹肌肉瘤、骨尤文氏瘤、汗腺瘤等)的诊断,经常要做糖元染色加以确诊。
糖原的染色方法很多,最为经典的是PAS法(periodic acid Schiff)。
经多年的临床摸索和研究,在PAS染色法的基础上,我们对肝糖原染色进行了改良,结果表明,改良后的糖元染色操作方便、省时、色彩鲜艳,易于学习和掌握。
1材料和方法
材料①取人活检肝穿组织,用95%酒精固定,常规石蜡切片备用。
②无色品红液(schiff)的配制:取三角烧瓶一只,加入蒸馏水400ml 进行煮沸,煮沸后取下放置1min,然后加入碱性品红1g,轻轻摇荡3min,使碱性品红彻底溶解,待冷却至50 0C,过滤后装于另一只烧瓶内并加入亚硫酰氯1ml,塞紧瓶口,常温下置阴暗处12h,加入活性炭2g, 轻轻摇荡3min,静置待碳粉下沉,用双层滤纸过滤后,滤液装于有色瓶内放入冰箱内备用。
③高典酸液的配制:蒸馏水100ml加高典酸0.5g溶解后备用。
④偏重亚硫酸钠液的配制:蒸馏水100ml加偏重亚硫酸钠0.5g溶解后备用。
方法切片常规脱蜡脱水;0.5%高典酸液氧化5-8min,流水冲洗2min,再用蒸馏水浸洗2次;加入无色品红液于暗处常温染色5-10min;
0.5g偏重亚硫酸钠液滴洗2次,每次1min,流水冲洗2min;Mayer 苏木精复染胞核,流水冲洗10min;常规脱水透明,中性树胶封固。
结果镜下见肝组织内糖原呈鲜紫红色为(+)反应。
2讨论
本方法的原理是高典酸为一种氧化剂,它能破坏多糖分子结构的碳-碳键(c-c),切片首先用高典酸液氧化,使切片中多糖分子的1,2-乙二醇基(-CHOH- CHOH-)或1-羟基-2-氨基(-CHOH- CHNH2-)等的碳-碳键打开,暴露出二醛(CHO- CHO),后者与无色品红液作用,生成紫红色复合物而得到定位。
碱性品红属苯甲烷染料,是由副品红(pararosanilin),品红碱(rosanilin)和碱性品红Ⅱ(magentaⅡ)组成的混合物,含醌型发色团,水溶液为深红色,在与亚硫酰氯作用后醌型消失,而成为淡红色或稻草黄色,这是碱性品红内残存的色素杂质,再经活性炭吸附后就成为无色澄清的品红液。
若碱性品红内残存的色素杂质多,就需要多加一些活性炭。
无色品红在配法上用亚硫酰氯代替,亚硫酰氯作用温和,作用时间短,在5min内可使糖原显色,并且色彩鲜艳,颗粒细腻。
3注意事项
①去材要新鲜并立即固定,以免组织内的糖原丢失。
固定前不要用蒸馏水或生理盐水冲洗组织。
因为糖原易溶于水,避免用水溶性液体固定组织。
用酒精固定液能较好的保存糖原,但有使糖原流到细胞一侧的现象。
②糖元染色应做消化对照:取两张连续切片,其中一张脱蜡后用1%淀粉酶于37 0C消化30min,水洗后和未经消化处理的切片一起入0.5%高典酸液中氧化,若经消化处理的切片染色(-),未经
消化处理的切片染色(+),即可肯定为糖原。
③染液要随用随配,无色品红若暴露于空气中过久,很容易变红,如和碱性物质接触也可使无色品红立即变红而失效。