利用CRISPRCas9系统构建FGF21基因敲除小鼠模型
- 格式:ppt
- 大小:43.50 KB
- 文档页数:1

CRISPRCas9技术构建小鼠模型CRISPR小鼠实验随着CRISPR在2013年的出现,一切都发生了变化(Cong et al., 2013)!Haoyi第一次接触CRISPR是在他使用这项新技术设计小鼠模型时(Wang et al., 2013, Y ang etal., 2013)。
和其他人一样,Wenning也着迷于CRISPR,并马上加以应用。
他发现在实验中有75%的老鼠显示出了突变!本来很困难的实验居然一次成功了,这是不可思议的,但是也体现了CRISPR技术的“简单易操作”。
后来,他的经历被全世界许多人分享。
最终,这项被命名为CRISPR,以其概念简单,使用简单,性能稳定而被熟知。
在自然环境中,CRISPR-Cas9是细菌和古细菌中的获得性免疫系统。
它已被重新用于真核生物的基因组编辑,使用最广泛的CRISPR基因组编辑系统来自S. pyogenes。
而Streptococcus aureus中的另一种Cas9在编辑小鼠胚胎方面S. pyogenes的Cas9一样有效,并且由于其更小,所以更具优势(Zhang et al., 2016)。
为了编辑基因组,CRISPR/Cas系统使用了3种成分,一种约125 nt的guideRNA(gRNA)用于指定靶点;一种在靶点位置产生DNA双链断裂(DSB)的Cas9核酸内切酶以及一种供体寡核苷酸或质粒修复模板(用于敲入模型)。
用CRISPR建立小鼠模型的基础为了建立小鼠模型,将gRNA、Cas9和供体寡核苷酸或质粒组分聚集在一起,并显微注射到小鼠受精卵的细胞核或细胞质中。
或者为了避免体外处理胚胎,可以将这些成分电穿孔到怀孕雌鼠的输卵管中,这项技术称为通过输卵管核酸传递或GONAD(Gurumurty et al., 2016)。
当然,AAV也可用作载体,通过注射到卵母细胞或怀孕雌鼠的输卵管中递送CRISPR/Cas9系统(Y oon et al., 2018, Mizuno et al., 2018)。

38基于CRISPR/Cas9技术的TRPS1基因敲除小鼠模型的构建李腾雁,刘文杰,赵宏,蔡建强*(国家癌症中心/ 国家肿瘤临床医学研究中心/ 中国医学科学院北京协和医学院肿瘤医院肝胆外科,北京 100021)李腾雁 博士研究生中国医学科学院北京协和医学院肿瘤医院肝胆外科目的:基于CRISPR/Cas9技术构建敲除TRPS1基因的杂合子小鼠,并进行鉴定。
方法: C57BL/6N小鼠自行交配后,使用Cas9/sgRNA注射受精卵的方法构建基因敲除小鼠,对可遗传的小鼠基因型进行鼠尾检测,TRPS1杂合子敲除小鼠分别与野生型小鼠交配,获得具有稳定基因型的小鼠。
结果:本实验通过使用Cas9/sgRNA注射受精卵的方法,所有繁殖小鼠经鼠尾基因型鉴定,证实成功构建了18只TRPS1基因敲除的杂合子小鼠。
结论:基于CRISPR/Cas9技术成功构建了敲除TRPS1基因的杂合子小鼠。
关键词:CRISPR/Cas9;TRPS1;结直肠癌;基因敲除小鼠摘要基金支持:国家自然科学基金(81672461) ;国家自然科学基金(81972311) ;深圳市“医疗卫生三名工程”(SZSM202011010)首都卫生发展科研专项项目(2018-1-4021);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001,2017-12M-4-002) *通信作者:蔡建强************************Generation of TRPS1 knockout mice by CRISPR/Cas9-mediated gene targetingAbstractObjectives: This study aimed to construct and identify heterozygous mice knocked out of TRPS1 gene based on CRISPR/ Cas9 technology.Methods: After self-mating of C57BL/6N mice, TRPS1 knockout mice were constructed by injecting fertilized eggs with Cas9/sgRNA, and the mouse genotypes of heritable mice were detected by tail. TRPS1 heterozygous knockout mice were mated with wild-type mice to obtain mice with stable genotypes.Results: In this experiment, the fertilized eggs were injected with cas9 / sgRNA, all breeding mice were identified by tail genotype, 18 TRPS1 knockout heterozygous mice were successfully constructed.Conclusion: In this study, we successfully constructed TRPS1 knockout heterozygous mice based on CRISPR / cas9 technology, which provided a research platform for further research on the role of TRPS1 in the occurrence, development and possible liver metastasis of colorectal cancer at the animal level.Keywords: CRISPR/Cas9; TRPS1; Colorectal cancer; Gene knockout mouseLi Tengyan, Liu Wenjie, Zhao Hong, Cai Jianqiang*(National Department of Hepatobiliary Surgery, National Cancer Center/National Clinical Research Center for Cancer/ Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率均保持上升趋势。

CRISPR—CAS9基因敲除原理
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是最新出现的一种由RNA指导Cas核酸酶对靶向基因进行特定DNA修饰的技术。
CRISPR 是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。
在这一系统中,crRNA(CRISPR-derived RNA)通过碱基配对与tracrRNA(trans-activating RNA)结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶定位点剪切双链DNA达到对基因组DNA进行修饰的目的。
Cas9结合gRNA,gRNA 的长度约为80个核苷酸,包含两个区域:gRNA 5' 端前20个核苷酸对应于靶标DNA,能结合在靶DNA 上的约60个核苷酸(gRNA 长度取决于表达gRNA 的质粒)形成一个发夹结构,这个结构能帮助gRNA 与Cas9结合,并由此指导与DNA 的结合.
通过gRNA上的靶点序列,在目标基因组上找到靶点序列,并揭开双螺旋,Cas9将剪切DNA双链,造成DNA双链断裂。
Cas9使用简单,可满足多个靶点同时操作。
Insertion /deletion NHEJ HDR
gRNA
Cas9
Donor vector
基因敲除小鼠流程:。

使用 CRISPR-Cas9 创建转基因小鼠的方案虽然近年来已经开发了几种基因组编辑工具,包括锌指结构和 TALENs(转录激活物样效应物核酸酶),但没有一种能像CRISPR/Cas9系统那样高效,该系统由一个RNA引导的DNA内切酶 (Cas9) 和对应的引导RNA(CRISPR) 组成。
利用该系统,研究人员能够实现一步敲除多个基因的等位基因的突变小鼠1。
只需两三周的时间,即可创造出子携带条件性等位基因和报告基因的小鼠2,并且该方案。
特别要注意的是,该过程不需要创建修改的小鼠ES细胞过程,该过程有时会十分困难3。
随着 Cas9 敲入和敲除小鼠的发展,预计越来越多的实验室将选择 CRISPR/Cas9 系统来生成转基因小鼠模型。
使用CRISPR-Cas9创建转基因小鼠的方案动物学研究。
2016 年 7 月 18 日;37(4): 205–213.利用 CRISPR/Cas9 和单倍体胚胎干细胞系统产生基因修饰的小鼠。
图 1.在小鼠胚胎上使用 CRISPR/Cas9 基因组编辑创建转基因小鼠的示意图。
通过共注射 Cas9 mRNA 和向指导 RNA,多个基因靶标可以在小鼠胚胎中一次敲除。
(改编自Yang H,Wang H 和 Jaenisch R. Nat Protoc。
2014 年 8 月;9(8):1956-68.)Sigma-Aldrich 是为基因组编辑提供工具和定制服务的领导者,包括 ZFN 和CRISPR/cas9。
默克还提供了广泛的小鼠胚胎验证培养基和试剂组合,用于储存、转移和扩增用于在EmbryoMAX™名下创建转基因小鼠模型的小鼠胚胎。
浏览所有的基因组编辑产品浏览所有经小鼠胚胎验证的试剂小鼠胚胎和ES细胞培养基小鼠ES细胞培养基实验方案和过程成功的小鼠模型项目的提示1.了解实验目的并开展研究。
生成正确的小鼠需要完全理解被测试依据的假设。
例如,研究者可能希望验证这样的假设:突变肝脏中的转运蛋白可能会减轻特定药物的肝毒性作用。

基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法一、CRISPR/Cas9靶向基因敲除小鼠制作的基本技术原理:通过CRISPR/Cas9基因敲除技术,crRNA通过碱基配对与tracrRNA(trans-activating RNA)结合,形成双链RNA。
这一tracrRNA:crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶标的特定位点剪切双链DNA。
在与crRNA引导序列互补的位点,Cas9蛋白的HNH核酸酶结构域剪切互补链而Cas9 RuvC-like 结构域剪切非互补链,实现敲除目的基因的功能,制备基因敲除小鼠模型。
二、具体步骤如下:一)模型制作策略制作:利用生物信息学手段(NCBI&IMPC&MGI),分别仔细分析目的基因敲除后小鼠的生存能力及繁育能力,并结合邻近基因的影响,最终选择合适的敲除区域进行敲除方案的设计,出具相应的制作策略。
二)载体的设计和构建:使用麻省理工学院的CRISPR Design工具(/),依据中靶Score的高低及脱靶Score的高低设计一对长度为20bp的针对靶标DNA的寡聚核苷酸链序列用于制备sgRNA,并在该靶区域设计引物用于后续阳性小鼠的基因鉴定。
1、制备sgRNA的实验方法步骤:1)线性化pUC57-GDNA-T7载体中提pUC57-GDNA-T7载体,用BsaI线性化过夜。
胶回收保存备用。
2)引物退火及加磷酸将上下游引物(干粉)稀释,再进行引物退火及加磷酸。
3)连接&阳性菌落筛选取步骤二中的加磷酸产物与线性化载体pUC57-GDNA-T7进行连接,该连接反应在干式恒温器中进行。
对连接产物进行转化,涂板,37°C培养箱过夜培养。
再用PCR&测序的方法筛选阳性克隆,再将测序正确的克隆进行甘油菌保种,-80°C保存备用4)制备转录模板以构建好的sgRNA载体为模板进行PCR扩增,将PCR产物切胶回收,回收产物离心后倒掉上清留DNA沉淀,再溶解DNA。

使用CRISPR-CAS系统构建可遗传的基因敲除小鼠和大鼠致编辑:CRISPR-CAS系统已经成为一种细胞和模式生物中有效的基因编辑技术。
我们使用CRISPR-CAS系统,通过同时注入两种单导向RNA靶向Uhrf2,同时带入Cas9 mRNA来诱导小鼠的DNA片段缺失。
此外,我们通过一种单一的显微注射方法得到了敲除Mc3R和Mc4R两种基因的大鼠。
在小鼠和大鼠中均观察到较高的种系转移效率(突变可遗传)。
成簇有序间隔短回文重复关联蛋白系统(CRISPR-CAS系统)是一种在细菌和古细菌中演变的针对病毒和质粒入侵的基于RNA的后天免疫系统。
【Bamboo注:该系统由一段Cas基因(双链DNA核酸酶)加一段特异序列组成,Cas作用为结合导向RNA,切割目的基因,导向RNA为CRISPR序列转录而成,有二级结构】根据作用机制不同,CRISPR-CAS系统目前有三种类型。
在第二类型(下文称该系统)中,CRISPR序列转录RNA(crRNA)和反式激活RNA(TraceRNA)结合后有能力引导Cas9核酸内切酶到特定的序列,从而导致目标DNA双链缺失。
【Bamboo注:机理:摄取了病毒DNA后,CRISPR 序列在转录产物tracrRNA,表达产物CAS蛋白,RNA酶共同作用下产生导向RNA,导向RNA含有病毒DNA序列,可遗传给下一代,再遇到病毒DNA时将其剪切】之前的研究表明在哺乳动物中有多种基因工程使用RNA介导的Cas9核酸酶系统。
最近,使用该系统进行高效基因编辑已经在斑马鱼、小鼠和细菌中实现。
几个小组也证明通过该系统介导的在细胞和斑马鱼中基因靶向效率与ZFNs(锌指核酸酶)和TALENs(转录活化因子效应核酸酶)【Bamboo注:另外两种常见DNA编辑方式】相似或较高。
虽然已经有报道在单个小鼠胚胎中可使用该系统打乱多个基因,但是在动物体中尚未见该系统介导的突变种系转移。
此外,长的特异的基因组DNA片段能否被该系统敲除也是未知的。

基因敲除小鼠摘要基因敲除小鼠是一种常用的实验动物模型,可以帮助科学家研究基因在生物体发育和功能中的作用。
本文将介绍基因敲除小鼠的定义、用途以及常用的敲除方法,帮助读者了解基因敲除小鼠在生物学研究中的重要性和应用。
引言基因敲除小鼠是指通过干扰或删除特定基因,使小鼠体内该基因表达受到抑制或消失的实验模型。
这种模型被广泛应用于基因功能研究、疾病机制研究以及药物开发等领域。
基因敲除方法基因敲除小鼠的制备有多种方法,其中最常用的是胚胎干细胞敲除和CRISPR/Cas9系统。
胚胎干细胞敲除胚胎干细胞敲除是一种传统的基因敲除方法。
首先,从小鼠胚胎中获得胚胎干细胞,然后通过基因转染或基因突变等方式,使目标基因发生敲除突变。
最后,将敲除的胚胎干细胞注入到早期小鼠胚胎中,形成敲除小鼠。
CRISPR/Cas9系统CRISPR/Cas9系统是一种新兴的基因编辑技术,已经在基因敲除小鼠制备中得到广泛应用。
该系统利用Cas9核酸酶和特定的引导RNA来定向切割目标基因的DNA链,从而导致基因发生敲除或突变。
基因敲除小鼠的应用基因敲除小鼠在生物学研究中有着广泛的应用,以下是其中几个重要的应用领域:基因功能研究通过敲除特定基因,科学家可以观察与该基因相关的表型变化,从而揭示该基因在生物体发育和功能中的作用。
这对于揭示基因调控网络、疾病机制的研究具有重要意义。
疾病模型研究基因敲除小鼠常被用来构建各种疾病模型,如癌症、心血管疾病等。
这些模型可以模拟人类疾病的发生和发展过程,为相关疾病的研究提供了有力的工具。
药物开发基因敲除小鼠在药物开发中也起着重要的作用。
通过敲除特定基因可以观察药物对目标基因的影响,从而评估药物的疗效和安全性。
结论基因敲除小鼠是一种重要的实验动物模型,被广泛应用于基因功能研究、疾病模型研究以及药物开发等领域。
不同的敲除方法可根据具体实验需求选择使用。
基因敲除小鼠在解析基因功能、揭示疾病机制和评估药物疗效方面发挥着重要的作用,为生物学研究提供了强大的工具。

基因敲除小鼠研究方案基因敲除小鼠研究方案一、研究目标:通过基因敲除小鼠研究,探究目标基因在小鼠发育、生长、免疫系统等方面的功能和调控机制。
二、实验设计:1. 基因敲除小鼠模型的构建:选择合适的基因敲除技术,如CRISPR/Cas9系统,通过设计合适的sgRNA(single guide RNA)序列,引导Cas9核酸酶定点切割目标基因的DNA序列。
进而引发DNA修复机制,导致目标基因的插入、缺失或突变。
将CRISPR/Cas9系统构建为可表达载体,转染入小鼠胚胎干细胞中,克隆筛选敲除成功的细胞系。
2. 小鼠胚胎干细胞培养及注射:将敲除成功的小鼠胚胎干细胞注射到早期胚胎中,制备敲除小鼠模型。
养育敲除成功的小鼠。
3. 小鼠品系和样本采集:选择合适的小鼠品系,如C57BL/6小鼠品系。
在小鼠发育、生长、免疫等关键时期,如出生后不同天数、特定时间点等,采集合适的器官或细胞样本。
4. 小鼠表型分析:对敲除小鼠与野生型小鼠进行比较,通过外观、体重、行为、生理指标等方面的观察和实验测定,分析目标基因在小鼠生长发育等方面的影响。
5. 组织学和免疫组化分析:采集目标器官样本,进行组织学和免疫组化实验。
通过病理学检测、免疫组织化学染色等方法,观察目标基因在组织结构和免疫功能调控方面的作用机制。
6. 分子生物学实验分析:采集样本进行基因表达、蛋白质表达水平和分子机制等方面的实验分析,如实时定量PCR、Western blot等方法,研究目标基因对其他基因和信号通路的影响。
7. 数据分析:对实验获得的生物学数据进行统计学和生物信息学分析,建立基因敲除小鼠模型的相关数据库,以及通过差异分析、基因功能注释等方法,进一步探究目标基因的功能和相关调控网络。
三、预期结果:通过上述研究方案,可以获得目标基因敲除小鼠模型,并通过多个方面的分析来研究该基因对小鼠生长发育、组织结构、免疫系统等方面的功能和调控机制。
预期结果包括但不限于:敲除小鼠的表型差异和诱导的特异性疾病模型;目标基因调控的重要信号通路;基因与其他相关基因间的调控网络等。

基因敲除小鼠的制备流程基因敲除小鼠已经成为现代生命科学基础研究和药物研发领域不可或缺的实验动物模型,在生命科学、人类医药和健康研究领域中发挥着重要的作用。
基于胚胎干细胞的基因打靶技术、EGE技术(基于Crispr cas9技术)是当下比较火热的基因敲除小鼠制备技术。
利用这两种技术制备基因敲除小鼠的流程是什么样的?一、基于胚胎干细胞的基因打靶技术制备基因敲除小鼠的流程:1.课题设计,订购课题BAC菌;2.按照课题设计,完成打靶载体设计和构建;3.将重组载体电转到胚胎干细胞中,用G418筛选转染后的胚胎干细胞,得到阳性克隆;4.进一步通过PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对上一步得到的阳性克隆进行筛选,得到稳定整合外源基因的胚胎干细胞阳性克隆;5.将胚胎干细胞阳性克隆注射到小鼠囊胚中,并植入到假孕小鼠的子宫内;6.得到嵌合鼠,并获得F1阳性杂合子小鼠。
基于胚胎干细胞的基因打靶技术制备基因敲除小鼠是目前为止唯一一个可以满足几乎所有基因组修饰要求的打靶技术,但目前只应用在小鼠的基因敲除上,而且其周期长工作量大。
二、利用EGE技术(基于Crispr cas9技术)制备基因敲除小鼠的流程1.设计构建识别靶序列的sgRNA;2.设计构建致靶基因切割的EGE系统载体质粒;3.利用百奥赛图自主开发的UCA试剂盒对sgRNA/Cas9进行活性检测;4.设计构建打靶载体;5.体外转录sgRNA/Cas9 mRNA;6.小鼠受精卵原核注射sgRNA/Cas9 mRNA和打靶载体;7.获得Fo代小鼠,利用PCR对Fo代小鼠进行基因型鉴定;8.获得F1代小鼠,利用PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对F1代小鼠进行基因型鉴定。
虽然EGE技术(基于Crispr cas9技术)制备基因敲除小鼠看似比基于胚胎干细胞的基因打靶技术制备基因敲除小鼠流程繁琐,其实不然,EGE技术(基于Crispr cas9技术)系统构建简单,基因敲除/敲入效率高,速度快,可实现多基因、多物种基因敲除/敲入,最快2个月即可得到F0代阳性鼠,5个月得到F1F1代杂合子小鼠。

CRISPR/Cas9敲除细胞系构建步骤及方法一、技术简介CRISPR/Cas9是最新出现的一种由RNA指导的Cas9核酸酶对靶向基因进行编辑的技术,也是目前研究最热的基因编辑技术。
由于其具有构建方法简单快捷、基因修饰效率高、成本低廉、实验周期短、适用范围广等诸多优点,目前已成功应用于人类细胞、斑马鱼、大/小鼠等多种动植物的基因组精确修饰。
二、实验流程1. 预实验1.1 Cas9导入细胞方法:尝试各种方法,如脂质体类转染、电转、慢病毒感染、腺病毒感染等,确定高效导入Cas9方法。
1.2 药物浓度预实验:降低后续阳性克隆筛选和检测工作难度。
1.3 单克隆培养情况:确认细胞是否可以单克隆培养。
2. 基因敲除(敲入)2.1 靶点设计:一般在不同转录产物的共同外显子上设计3个靶点,靶点位置尽量在基因CDS的前1/3,ATG之后,最好能破坏重要的domain和所有的转录产物isoform。
第一批合成构建3个,效果不佳或时间紧张的可一次构建6个。
2.2 载体构建和病毒包装:根据预实验结果,选择合适的普通载体或病毒载体(普通Cas9载体、慢病毒Cas9载体和腺病毒Cas9载体)。
2.3 内源活性筛选:转染细胞或感染细胞48h后,使用Puro或Blasticidin筛选48h,提取基因组DNA。
使用T7E1酶验证打靶载体的活性,将有效的突变型PCR产物测序验证。
2.4 Donor载体(基因敲入):根据筛选的gRNA靶点位置,构建Donor普通载体或腺病毒载体,共转染/感染Cas9-gRNA和Donor。
2.5 单克隆筛选:无限稀释到每孔1个细胞的数量,每株细胞铺至少2个96孔板。
细胞数量足够后,验证内源活性并送测。
2.6 获得突变型:如需纯合子,则可能需要重复步骤3-5。

基因敲除小鼠的方法
1. CRISPR/Cas9基因编辑技术,CRISPR/Cas9技术是一种高效的基因编辑工具,可以用来精确地敲除小鼠基因。
首先,科学家设计合成一段RNA序列,使其与目标基因序列相匹配,然后将这段RNA和Cas9蛋白复合体导入小鼠胚胎内。
复合体会通过识别并切割目标基因,导致基因敲除。
2. 胚胎干细胞技术,另一种常见的基因敲除小鼠方法是利用胚胎干细胞。
科学家可以将设计好的基因敲除载体导入小鼠胚胎干细胞中,使其发生基因敲除。
然后,这些修改过的干细胞可以被植入小鼠胚胎内,从而产生基因敲除小鼠。
3. 遗传改造小鼠技术,除了CRISPR/Cas9和胚胎干细胞技术,科学家还可以利用遗传改造技术来实现基因敲除。
这种方法涉及到选择性育种和杂交,通过选择性地交配和繁殖,最终得到具有特定基因敲除的小鼠品系。
总的来说,基因敲除小鼠的方法主要包括CRISPR/Cas9基因编辑技术、胚胎干细胞技术和遗传改造小鼠技术。
这些方法都是在实验室条件下进行的,需要经过严格的实验设计和操作流程,以确保
基因敲除的准确性和有效性。
同时,这些方法也为科学家提供了强大的工具,用于研究基因在生物体内的功能和作用机制。

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言基因编辑技术近年来在生命科学领域取得了显著的进展,其中CRISPR-Cas9系统因其高效、精确的基因编辑能力而备受关注。
DUSP9作为一种在细胞信号转导过程中发挥重要作用的基因,对其功能的研究对于揭示生命活动规律、探索疾病发病机制以及新药研发等方面具有重要意义。
本研究旨在利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系,为后续研究提供可靠的实验材料。
二、材料与方法1. 材料(1)小鼠胚胎干细胞(mESCs);(2)CRISPR-Cas9系统相关质粒;(3)DUSP9基因敲除载体;(4)相关实验试剂与仪器。
2. 方法(1)设计并构建DUSP9基因敲除载体;(2)将DUSP9基因敲除载体与CRISPR-Cas9系统相关质粒共转染至mESCs中;(3)筛选并扩增转染后的细胞,获得DUSP9基因敲除的mESCs;(4)对获得的DUSP9基因敲除mESCs进行鉴定与验证。
三、实验结果1. DUSP9基因敲除载体的构建与鉴定通过PCR及测序等方法,成功构建了DUSP9基因敲除载体,并对其进行了鉴定,确认其序列正确无误。
2. CRISPR-Cas9系统介导的DUSP9基因敲除将DUSP9基因敲除载体与CRISPR-Cas9系统相关质粒共转染至mESCs后,通过筛选及扩增,成功获得了DUSP9基因敲除的mESCs。
3. DUSP9基因敲除mESCs的鉴定与验证通过PCR、Western blot及测序等方法,对获得的DUSP9基因敲除mESCs进行了鉴定与验证。
结果表明,DUSP9基因已成功被敲除,且未出现非特异性剪切。
同时,mESCs的生长状况及表型未发生明显改变。
四、讨论本研究利用CRISPR-Cas9系统成功构建了DUSP9基因敲除小鼠胚胎干细胞系。
这一研究成果为研究DUSP9基因的功能提供了可靠的实验材料。

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言随着基因编辑技术的发展,CRISPR-Cas9系统已成为一种强大的工具,用于在生物医学研究中精确地编辑基因组。
DUSP9基因作为一种重要的基因,其功能在多种生物学过程中起着关键作用。
因此,构建DUSP9基因敲除小鼠胚胎干细胞系,对于研究DUSP9基因的功能及其在疾病发生发展中的作用具有重要意义。
本文旨在详细介绍利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的过程。
二、材料与方法1. 材料小鼠胚胎干细胞(mESCs)、CRISPR-Cas9系统、相关基因编辑工具、培养基、生长因子等。
2. 方法(1)设计CRISPR-Cas9系统:根据DUSP9基因的序列信息,设计合适的CRISPR-Cas9系统,包括sgRNA和Cas9蛋白。
(2)制备mESCs细胞:培养mESCs细胞至合适的状态,以便进行基因编辑。
(3)转染与编辑:将CRISPR-Cas9系统转染至mESCs细胞中,利用Cas9蛋白对DUSP9基因进行切割。
(4)筛选与鉴定:通过PCR、Western blot、qRT-PCR等方法,筛选出成功敲除DUSP9基因的mESCs细胞,并进行鉴定。
三、实验过程1. 设计并构建CRISPR-Cas9系统,选择合适的sgRNA序列和Cas9蛋白表达载体。
2. 培养mESCs细胞至合适的状态,进行转染。
3. 观察转染后的细胞生长情况,确保Cas9蛋白的表达。
4. 利用PCR、Western blot、qRT-PCR等方法筛选出成功敲除DUSP9基因的mESCs细胞。
5. 对筛选出的细胞进行扩增培养,并保存于液氮中备用。
四、结果与讨论1. 结果(1)成功构建了CRISPR-Cas9系统,并将其转染至mESCs 细胞中。
(2)成功筛选出敲除DUSP9基因的mESCs细胞,并通过PCR、Western blot、qRT-PCR等方法进行了鉴定。
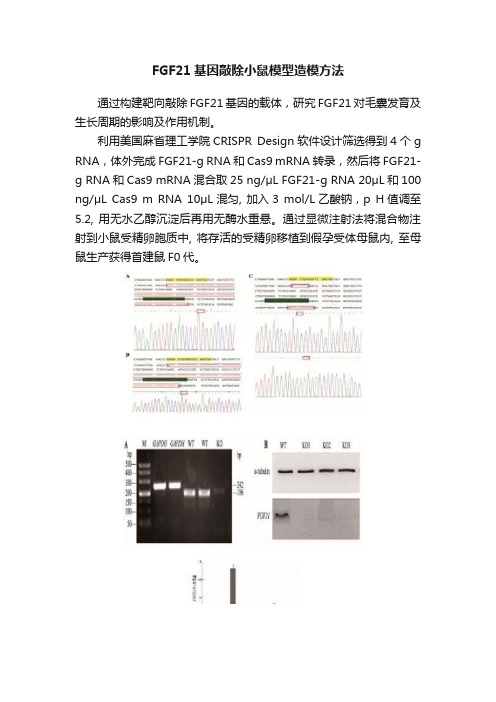

《利用CRISPR-Cas9技术构建FGF21基因敲除小鼠及其对毛发生长的作用研究》篇一一、引言随着基因编辑技术的发展,CRISPR-Cas9技术已成为现代生物学研究的重要工具。
FGF21基因作为生长因子家族的一员,在多种生理过程中发挥着重要作用。
本研究旨在利用CRISPR-Cas9技术构建FGF21基因敲除小鼠模型,并探讨其对毛发生长的作用。
二、材料与方法1. 实验材料(1)实验动物:野生型小鼠;(2)基因编辑工具:CRISPR-Cas9系统;(3)实验试剂与设备:PCR仪、显微操作仪、荧光显微镜等。
2. 方法(1)FGF21基因敲除小鼠模型的构建:设计并合成针对FGF21基因的CRISPR-Cas9系统,通过显微注射技术将该系统注入小鼠受精卵中,获得基因敲除小鼠;(2)毛发生长观察:定期观察并记录野生型小鼠与FGF21基因敲除小鼠的毛发生长情况;(3)数据分析:采用统计学方法对实验数据进行处理与分析。
三、实验结果1. FGF21基因敲除小鼠模型的构建成功通过CRISPR-Cas9技术成功构建了FGF21基因敲除小鼠模型,经PCR及测序验证,确认了基因敲除的有效性。
2. 毛发生长观察结果(1)野生型小鼠毛发生长情况:野生型小鼠毛发生长正常,毛发密度、色泽及长度均无明显异常;(2)FGF21基因敲除小鼠毛发生长情况:FGF21基因敲除小鼠出现毛发稀疏、色泽暗淡、长度较短等现象。
3. 数据分析结果通过统计学方法对实验数据进行处理与分析,发现FGF21基因敲除小鼠的毛发生长情况与野生型小鼠存在显著差异(P<0.05)。
四、讨论FGF21基因作为生长因子家族的一员,在多种生理过程中发挥着重要作用。
本研究利用CRISPR-Cas9技术成功构建了FGF21基因敲除小鼠模型,并发现该基因对毛发生长具有重要作用。
毛发生长受多种基因和环境因素的影响,而FGF21基因的缺失可能导致毛囊发育不良、毛发稀疏、色泽暗淡等现象。

第48卷第2期2022年3月吉林大学学报(医学版)Journal of Jilin University(Medicine Edition)Vol.48No.2Mar.2022DOI:10.13481/j.1671‑587X.20220201基于CRISPR/Cas9技术构建LDLR基因敲除的免疫缺陷小鼠模型及其表型分析王兆卫,吕亚楠,胡正,杨永广(吉林大学第一医院器官再造与移植教育部重点实验室,吉林长春130061)[摘要]目的目的:基于CRISPR/Cas9技术构建低密度脂蛋白受体(LDLR)基因敲除的免疫缺陷小鼠模型,并对血液胆固醇水平进行分析评价,为构建具有高脂血症的免疫系统人源化小鼠模型提供新方法。
方法方法:基于CRISPR/Cas9技术,将有效识别LDLR基因外显子2和18的sgRNA/Cas9mRNA 注射到NOD SCID小鼠的受精卵中,通过对新生小鼠基因型鉴定筛选得到基因敲除的F0代阳性(LDLR+/-,Aa)小鼠,再将此小鼠与NOD SCID(LDLR+/+,AA)小鼠繁育,鉴定得到能稳定遗传基因型的F1代(Aa)小鼠。
将F1代阳性杂合小鼠与NOD SCID小鼠繁育,获得大量基因序列完全相同的F2代(Aa)小鼠,在F2代间进行大规模繁育,获得的F3代小鼠依据基因型和性别进行分组,分别为雄性AA、雄性Aa、雌性AA和雌性Aa,对体质量进行监测,同时采集外周血进行血液胆固醇水平检测。
结果结果:通过上述构建方法获得了NOD SCID LDLR+/-(Aa)小鼠,经过8周的体质量检测,Aa杂合子基因型在生长发育过程中并不影响小鼠体质量,雌性Aa的胆固醇水平为(100.80±4.42)mg·dL-1,雄性Aa的胆固醇水平为(120.56±11.16)mg·dL-1,与阴性对照(基因型为AA的小鼠)比较,胆固醇水平明显升高(P<0.05);雌性AA的胆固醇水平为(60.78±2.11)mg·dL-1,雄性AA的胆固醇水平为(75.43±10.06)mg·dL-1,两者比较差异有统计学意义(P<0.05)。

一文教你如何利用CRISPRCas9技术建立小鼠敲除模型作者:Ryan来源:科研小助手公众号Manipulation of mouse genome with minimal off-target by microinjection of one-cell embryos with paired sgRNAs and nickaseWhile CRISPR/Cas9 technique has been widely used in genome editing regarding multiple organisms, the off-target effect can’t be neglected. Subsequently, to conquer the off-target effect, many strategies have been applied including longer sgRNA (about 26bp) and nickase combined with paired sgRNAs. Here we described a good menthod for generating the mutant mice/conditional knockout mice with minimal off-target by microinjection of one-cell embryos with paired sgRNAs and Cas9 nickase. Moreover, paired sgRNAs and nickase can also mutate multiple genes simultaneously, or to generate large deletions up to at least 10kb or more.Comparison of Cas9 and nickase (Cas9D10A)Figure 1. Cas9 nickase strategy. Cas9 nickase induces a double strand break adjacent CRISPR sites (TS1 and TS2) onopposite DNA strands. Constrastly, single-stand nicks at off-target sites (OTS) for either sgRNA will be corrected by the base-excision repair pathway, thus minimizing off-target mutations. P, PAM site.Plasmidsused in the protocolT7-Nickase(Cas9-D10A):T7-sgRNA:ReagentsPlasmids: T7-Nickase(Cas9-D10A) and T7-sgRNAmMESSAGE mMACHINE®T7 Ultra kit (Ambion, AM1345)MEGAshortscript TM Kit(Ambion, AM1354)RNeasy Mini Kit (QIAGEN,74104)MEGAclear TM Kit(Ambion, AM1908)RNAsecure TM Reagent(Ambion, AM7005)QIAprep Spin Miniprep Kit(QIAGEN, 27104)MiniElute PCRPurification Kit (QIAGEN, 28004)BsaI (NEB, R0535S)AgeI (NEB, R0552S)DraI (TAKARA, D1037A)T4 DNA Ripid ligation Kit(NEB,M2200S)PMSG (Sansheng, China,50IU/ml in normal saline, Aliquot and store at -80℃)HCG (Sansheng, China,50IU/ml in normal saline, Aliquot and store at -80℃)EmbryoMax® Injection Biffer (Millipore, MR-095-10F)ProteinaseK(Merck,1245680100, 20 mg/ml in water, Aliquot and store at -20℃)Lysis buffer (10 μMTris-H Cl, 0.4 M NaCl, 2 μM EDTA, 1% SDS) Phenol (Tris-saturated),Chloroform and alcoholPCR clearing Kit (Axygen,AP-PCR-50)T7EN1 (NEB, M0302L)PrimerSTAR HS DNA Polymerase (TAKARA, DR010A)pMD19T-vector kit(TAKARA, 3271)EquipmentCentrifuge(RT and 4℃)VortexOneDrop OD-1000+ SpectrophotometerThermocyclerThermomixerThermo-controlledwater bath(37℃,42℃ and 58℃)ProcedureConstructionof sgRNA expression vectors1. Design of paired sgRNA oligos.Select paired sgRNAs in a tail-to-tail orientation and separated by 10-30 bp, which have the sequence 5’-CCN(52-72)GG.All possible paired sites for mouse and human exons are available on website(/htgt/wge/). For each sgRNA, the 5’-GGN(19)GGmotif is preferred, however, 5’-GN(20)GG or 5’-N(21)GG are also satisfactory. BLAT or BLAST the sgRNA target sites in UCSC or ENSEMBL genome browsers to find those with few or no highly related sites in the genome.Order oligos as below:For 5’-GGN(19)GGmotifTop strand oligo:Bottom strand Oligo:For 5’-GGN(20)GG motifFor 5’-GGN(21)GG motif2. Annealing oligos prior to cloning.4.5μl Top Oligo (100 μM)4.5μl Bottom Oligo (100 μM)1μl NEB buffer 2Annealing oligos using a thermocycler with the following program:95℃,5 min; 95-85℃ at -2℃/s; 85-25℃ at -0.1℃/s; hold at 4℃.3. Preparation of T7-sgRNA plasmid.2 μg T7-sgRNA plasmid.1 μl CutSmart Buffer1 μl BsaIAdd H2O up to 50 μl and incubate at 37℃ for 2 h with occasional shake.Purify the digeston product using MinElutePCR Purification Kit.4. Ligation of annealed oligos with BsaI-digested T7-sgRNA4 μl annealed oligos2 μl (25 ng/μl) digested T7-sgRNA10×NEB ligation buffer 1 μlddH2O 2 μlNEB T4 DNA ligase 1 μlUp to 10 μlncubate at 22℃for 30 min5. Transformation and plate on Kan+plate (50 μg/ml).6. Confirm correct Insertion of sgRNA oligosby sequencing using M13-47 primer.7. Mini-prep T7-sgRNA plasmid using QIAprepSpin Miniprep Kit.Transcriptionof sgRNAs in vitro1. Ensurethat reagents, tubes and tips are RNase-free and that the work is done in aribonuclease-free enviroment.2. Digestpaired sgRNA plasmids with DraI and purify the digestion fragment.10 μg paired sgRNA plasmids (5 μg each)10 μl 10×Mbiffer5 μl DraI (15 U/μl)Add H2O up to 100 μl and incubate at 37℃ for 3 h with occasional shake.Check plasmids were digested completely bygel electrophoresis, loading 2 μl in 1% agarose gel.Two bands (1621 and 1152 bp) will beobserved. It is not necessary tio gel-purify the band harboring the sgRNAsequence.Add 4 μl RNAsecure and incubate at 60 ℃ for 10 min in a thermomixer.Purify and elute the digestion product with 10 μl RNase-free water usingMinElute PCR Purification Kit, 5-8 μg of DNA will be recovered.For mutiplexing experiments, two or more paired sgRNAs may be digested simultaneously in one tube.Alternatively, the transcription template containing the T7 promoter sgRNAsequence may be prepared by PCR amplification from a bacterial colony using thefollowing primers and PCR program:sgRNA-For:5’-TCTCGCGCGTTTCGGTGATGACGGsgRNA-Rev:5’-AAAAAAAGCACCGACTCGGTGCCACTTTTTCProgram:94℃,5min; ((98 ℃ ,10s; 72-62℃, -1℃/cycle, 15s; 72 ℃, 30s) 10 cycles, (98℃, 10s;62 ℃, 15s; 72 ℃, 30s) 25 cycles); 72 ℃, 5 min; hold at 4℃.Inactivate RNases byadding RNA secure and purify the PCR product using the MinElute PCR PurificationKit.3. Invitro transcription of sgRNAs using MEGAshortscriptTMKit.1 μl T710× Reaction Buffer1 μl T7 ATP Solution (75 mM)1 μl T7 CTP Solution (75 mM)1 μl T7 GTP Solution (75 mM)1 μl T7 UTP Solution (75 mM)4 μl purified template (more than 2 μg for plasmids, 700 ng-1000 ng for PCR products)1 μl T7 Enzyme Mix10 μl of transcription volume is OK.Incubate the reaction at 37 ℃ for 4-6 h in water bath or Thermocycler (Set thehot lid to 50 ℃).Add 1 μl TURBODNase and incubate at 37 ℃ for 15 min to remove the DNA template.4. Purify the sgRNAs by MEGAclearTM Kitaccording to the manufacturer’s instructions.RNA elutionoption 2 in the manual is preferred.Precipitatewith 5 M Ammonium Acetate and ethanol.Resuspendthe pellet using the 30 μl RNase free water.20-50 μgRNA will be obtained depending on the quality of DNA template.5.Assess sgRNA yield using the One Drop OD-1000+Spectrophotometer (or equivalent) and sgRNA quality by gel electrophoresis. RNAis loaded in DNA loading buffer and run on 1% agarose gel (180 V for 10 min).6.Aliquot and store at -80 ℃. The sgRNAs are stablefor one year without freeze-thaw cycles.Transcription of Nickase (Cas9-D10A) in vitro1. Ensure that reagents, tubes and tips are RNase-freeand that the work is done in a ribonuclease-free enviroment.2. Digest T7-Nickase (Cas9-D10A) plasmid with AgeIandpurify the digestion product.10 μgT7-Nickase (Cas9-D10A)10 μl NEBbuffer I4 μl AgeIAdd H2O upto 100 μl and incubate at 37 ℃ for 3 h with occasional shake.Add 4 μlRNAsecure and incubate at 60 ℃ for 10 min in a thermomixer.Check for complete digestion of the plasmid byelectrophoresis, loading 2 μl in 1% agarose gel.Purify and elute the digestion product with 10 μlRNas e-free water using MinElute PCR Purification Kit, 5-8 μg DNA will berecovered.3.In vitro transcribe Cas9-D10A using mMESSAGE mMACHINE® T7 Ultra Kit according to the manufacturer’s instruction.4. Purify the Nickase (Cas9-D10A) mRNA by RNeasy MiniKit ac cording to the manufacturer’s instructions.5. Assess sgRNA yield using the One Drop OD-1000+Spectrophotometer (or equivalent) and sgRNA quality by gel electrophoresis. RNAis loaded in DNA loading buffer and run on a 1% agarose gel (180V for 10 min).A yield of 30-60 μg mRNA is expected.Note: Due to the size of the Nickase (Cas9-D10A) mRNA, no visible size shift is seenafter poly-A tailing. The mRNA quality is good if a smear is not observed.6. Aliquot and store at -80 ℃. Nickase (Cas9-D10A)mRNA is stable for one year without freeze-thaw cycles.Collection of zygotes1. Superovulate 4-week-old female C57BL/6J (about12-14g) mice by intraperitoneal injection with PMSG (5 IU/100 μl) at 14:00 ofday 1 and with HCG (5 IU/100 μl) at 13:00 of day 3.2. Cross superovulated females with males (C57BL/6J orCBA).3. Identify plugged females at 9:00 of day4. Collectone-cell embryos as decribed in Reyon, D. et al, 2012.Preparation of microinjection mixture1. Thaw aliquot of the Cas9-D10A mRNA and sgRNAs onice. Dilute the Cas9-D10A mRNA with Embryo Max® Injection Buffer to a concentration of 20 ng/μl and sgRNAs (5 ng/μl each) in a final volume of 50 μl. Pipette the mixture upand down several times2. Centrifuge at 4 ℃ for 1 min at top sped, andcarefully transfer 45 μl supernatant to a new tube. Always keep the tube onice.Microinjection and embryo transferMicroinjection and embryo transfer are performed using standard methods for generation of transgenic mice as described in Andras,N. et al., 2003, Cold Spring Harb Protoc. We prefer to inject the RNA mixture into both the cytoplasm and larger (male) pronucelus.Genotyping founders1. Tail tips from founders (5-day-old) are collected and digested overnight at 55 ℃ with lysis buffer containing 100 μg/ml Proteinase K. Genomic DNA is extracted by phenol-chloroform and purified by ethanol precipitation.2. Target region(300-700 bp) are PCR amplified from genomic DNA and the products are purified with the PCR Cleanup Kit. Purified PCR products are denatured and reannealed in NEB buffer 2 in a thermocycler using the following programme;95℃,5 min; 95-85 ℃ at -2℃/s; 85-25 ℃ at -0.1℃/s; hold at 4℃.3. Hybridized PCR products are digested with 0.5 μlT7EN1 at 37℃ for 30 min and separated by 2% agarose gel. Mutant founders will yield lower molecular weight cleavage bands.4. Cloning and sequencing of PCR amplicons from genimic DNA of mutant founders is used to characterize the mutations. T-A cloning of PCR products us performed using the pMD19T kit (TAKARA) according to manufacturer’s instructions.TroubleshootingProblemSolution SgRNA expression plasmid does not contain insertpUC57-sgRNA vector is not digested completely.Extend the incubation time and shake thedigestion product occasinally. Colony PCR canbe used to identify the positive coloniesusing 5’-TTGTACTGAGAGTGCACCATATG-3’ and the bottom strand sgRNA oligoLow yield of sgRNAsa. Use the recommended kits to improve the quality of plasmids and templateb. Increase the amount of template or use the PCR product as template. Electrophoresis of sgRNAs shows more than one band a. sgRNAs can form dimers. Always keep sgRNAson ice. A low amount of dimer will not affectthe function of sgRNA.b. DNA template is incompletely digested.Circular template can produce longertranscripts. Extend the incubation time and shake the digestion product occasionally. c. DNA template contamination. Add more TURBO DNase and extend incubation time.Cas9-D10A mRNA produces a smear on an agrose gel a. Use RNAsecure to inactivate RNase contaminationb. Use the recommended kits to improve thequality of the DNA template.(QIAGEN Mini-prepand PCR clean-up kits are recommended)Time Taken4 days for the construction of sgRNA expression vectors.1 day for the in vitro transcription and preparation of sgRNAs. 1 day for the in vitro transcription and preparation of Cas9-D10A mRNA.4 days for the superovulationb of females, collection of 1-cell embryos and microinjections1 week for the genotyping of founder animals.。

⽤CRISPRCas9⽅案构建双基因敲除⿏,获得双基因敲除纯合⼦⼩⿏的交配⽅案双基因敲除⼩⿏繁殖⼯作:CRISPR/Cas9⽅案构建双基因敲除⿏,得到F0杂合⼦之后,如何建系才能获得双基因敲除纯合⼦⼩⿏?这是经常被问到的问题,下⾯就简单回答⼀下。
假设我们的⽬的基因为A和B,通常⽤CRISPR/Cas9⽅法得到的基因敲除⿏为杂合⼦,双杂合⼦⼩⿏基因型为AaBb,⼤写字母代表野⽣型(dominant),⼩写字母代表突变型(recessive)。
得到F0杂合⼦(AaBb)之后,可以⽤以下⽅案之⼀来获得双基因敲除纯合⼦⼩⿏:⽅案⼀:1.将双杂合⼦⼩⿏(AaBb)与野⽣⿏(AABB)交配,理论上将得到25%的野⽣型(AABB),25%基因A单杂合⼦(AaBB),25%基因B单杂合⼦(AABb)及25%双杂合⼦⼩⿏(AaBb)。
2.将所得到的双杂合⼦⼩⿏(AaBb)互交(inter-cross),理论上6.25%的后代将会是双基因敲除纯合⼦⼩⿏(aabb),见下图。
3.由于双基因敲除实验中⼀般都需要单基因敲除动物作为对照,所以在进⾏上⾯⼩⿏breeding的同时可以将基因A单杂合⼦(AaBB)互交,在后代中鉴定出基因A纯合⼦(aaBB),同样将基因B单杂合⼦(AABb)互交,在后代中鉴定出基因B纯合⼦(AAbb)。
⽅案⼆:将双杂合⼦⼩⿏(AaBb)与单基因纯合⼦(如aaBB)交配,所⽣⼩⿏中约25%为基因A纯合⼦⽽基因B杂合⼦(aaBb,见下图左)。
然后将aaBb⼩⿏互交,理论上后代⼩⿏中25%为双基因敲除纯合⼦⼩⿏(aabb),见下图右。
需要特别注意的⼏个问题:1)上⾯所讲的⽅法适⽤于位于不同的染⾊体两个基因的基因敲除,如果两个基因位于同⼀条染⾊体上,要通过上述⽅法得到双基因敲除纯合⼦⼩⿏很难;2)上述⽅法有赖于基因特异性的Genotyping PCR assays。
在开始set up breeding之前必须将两个⽬的基因特异性的Genotyping PCR assays 准备好;3)要事先研究⼀下⽬的基因敲除后有⽆胚胎致死性,是否影响其⽣长发育等。

CRISPR-Cas9介导基因编辑制备FoxJ1缺失小鼠气道上皮细胞和遗传修饰雪貂模型专业品质权威编制人:______________审核人:______________审批人:______________编制单位:____________编制时间:____________序言下载提示:该文档是本团队精心编制而成,期望大家下载或复制使用后,能够解决实际问题。
文档全文可编辑,以便您下载后可定制修改,请依据实际需要进行调整和使用,感谢!同时,本团队为大家提供各种类型的经典资料,如办公资料、职场资料、生活资料、进修资料、教室资料、阅读资料、知识资料、党建资料、教育资料、其他资料等等,想进修、参考、使用不同格式和写法的资料,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!And, this store provides various types of classic materials for everyone, such as office materials, workplace materials, lifestyle materials, learning materials, classroom materials, reading materials, knowledge materials, party building materials, educational materials, other materials, etc. If you want to learn about different data formats and writing methods, please pay attention!CRISPR-Cas9介导基因编辑制备FoxJ1缺失小鼠气道上皮细胞和遗传修饰雪貂模型CRISPR/Cas9介导基因编辑制备FoxJ1缺失小鼠气道上皮细胞和遗传修饰雪貂模型引言:基因编辑技术的进步引起了生命科学领域的广泛关注。