九年级化学方程式默写比赛
- 格式:doc
- 大小:13.00 KB
- 文档页数:3

化学方程式默写1.碱式碳酸铜受热分解:Cu(OH)2CO3△2CuO+H2O+CO2↑2.碳酸氢铵受热分解:NH4HCO3△NH3↑+H2O+CO2↑3.高锰酸钾制取氧气:2KMnO4△K2MnO4+MnO2+O2↑4.双氧水、二氧化锰制取氧气:2H2O2 MnO2 2H2O+O2↑5.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑6.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑7.碳完全燃烧:C+O2点燃CO28.碳不完全燃烧:2C+O2点燃2CO9.硫在氧气中燃烧:S+O2点燃SO210.铁在氧气中燃烧:3Fe+2O2点燃Fe3O411.磷燃烧,产生大量白烟(军事上做烟幕弹):4P+5O2点燃2P2O512.煤燃烧:Mg+O2点燃2MgO(军事上做照明弹)13.铝在空气中形成致密的氧化铝薄膜:4AI+3O2=2AI2O314.用灼热的铜网除去氧气:2Cu+O2△2CuO15.电解水,正氧气负氢气,体积比1:2,质量比8:1 2H2O2通电2H2↑+O2↑16.氢气燃烧:2H2+O2点燃2H2O17.二氧化碳和水反应:CO2+H2O=H2CO318.加热含有二氧化碳的水溶液:H2CO3△H2O+CO2↑19.二氧化碳通入澄清石灰水中(检验二氧化碳):CO2+Ca(OH)2=CaCO3↓+H2O20.一氧化碳(煤气)燃烧:2CO+O2点燃2CO221.甲烷(天然气)燃烧:CH4+2O2点燃CO2+2H2O22.硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓23.铁和稀盐酸或稀硫酸反应:Fe+2HCI=FeCI2+H2↑; Fe+H2SO4=FeSO4+H2↑24.镁和稀盐酸或稀硫酸反应:Mg+2HCI=MgCI2+H2↑; Mg+H2SO4=MgSO4+H2↑25.铝和稀盐酸或稀硫酸反应:2Al+6HCI=2AICI3+3H2↑; 2AI+3H2SO4=AI2(SO4)3+3H2↑26.锌和稀盐酸反应:Zn+2HCI=ZnCI2+H2↑27.铁和硫酸铜溶液反应,固体质量增加,溶液质量减少:Fe+CuSO4=Cu+FeSO4现象:铁丝表面出现红色固体,溶液由蓝色变成浅绿色28.赤铁矿炼铁:现象:红棕色固体变成黑色,生成气体能使澄清石灰水变浑浊。

初三化学方程式汇总默写版初三化学方程式之四大基本反应类型化合反应是指由两种或两种以上的物质生成一种物质的反应,也称多变一反应。
常见的化合反应有:1.二氧化碳和水反应;2.二氧化硫和水反应;3.三氧化硫和水反应;4.氧化钙和水反应;5.氧化钠和水反应;6.在高温下,碳和二氧化碳反应;7.碳在空气中燃烧;8.一氧化碳燃烧;9.硫燃烧;10.磷燃烧;11.铁在氧气中燃烧;12.铝在氧气中燃烧;13.镁在空气中燃烧;14.铜在空气中加热。
分解反应是指由一种物质生成两种或两种以上的物质的反应,也称一变多反应。
常见的分解反应有:1.高锰酸钾加热分解;2.双氧水和二氧化锰混合;3.氯酸钾和二氧化锰加热分解;4.水通电分解;5.氧化汞受热分解;6.碳酸分解;7.氢氧化铜受热分解;8.石灰石高温分解;9.碳酸氢铵受热分解。
置换反应是指一种单质和一种化合物生成另一种单质和另一种化合物的反应,也称单变化反应。
常见的置换反应有:1.锌和稀硫酸反应;2.锌和稀盐酸反应;3.铁和稀硫酸反应;4.铁和稀盐酸反应;5.铝和稀硫酸反应;6.铝和稀盐酸反应;7.镁和稀硫酸反应;8.镁和稀盐酸反应。
金属与酸反应的激烈程度由大到小排列为:铝、锌、铁、镁。
复分解反应是指两种化合物相互交换成分生成两种新的化合物的反应,也称双变化反应。
常见的复分解反应有:1.酸和某些金属氧化物生成盐和水;2.酸和碱中和生成盐和水。
三、盐与酸的反应盐和酸反应会生成新盐和新酸,其中可能会产生气体、沉淀或水。
以下是几种反应的例子:1.石灰石和稀盐酸反应2.碳酸钠和稀盐酸反应3.硝酸银和盐酸反应4.氯化钡和稀硫酸反应四、盐与碱的反应盐和碱反应会生成新盐和新碱,其中可能会产生沉淀。
以下是几种反应的例子:1.硫酸铜和氢氧化钠反应2.氯化铁和氢氧化钠反应3.碳酸钠和氢氧化钙反应4.硫酸铜和氢氧化钡反应5.硫酸镁和氢氧化钡反应6.氯化铵和氢氧化钙反应五、盐与盐的反应盐和盐反应会生成两种新盐,其中可能会产生沉淀。

书写化学方程式竞赛试题1、盐酸(HCl)+镁→氯化镁+氢气2、盐酸+铝→氯化铝+氢气3、盐酸+锌→氯化锌+氢气4、盐酸+铁→氯化亚铁+氢气5、硫酸(H2SO4)+镁→硫酸镁+氢气6、硫酸+铝→硫酸铝+氢气7、硫酸+锌→硫酸锌+氢气8、硫酸+铁→硫酸亚铁+氢气9、盐酸+氧化镁→氯化镁+水10、盐酸+氧化铝→氯化铝+水11、盐酸+氧化铜→氯化铜+水12、盐酸+氧化铁→氯化铁+水13、硫酸+氧化镁→硫酸镁+水14、硫酸+氧化钠→硫酸钠+水15、硫酸+氧化铜→硫酸铜+水16、硫酸+氧化铁→硫酸铁+水17、盐酸+氢氧化镁→氯化镁+水18、盐酸+氢氧化铝→氯化铝+水19、盐酸+氢氧化钙→氯化钙+水20、盐酸+氢氧化铜→氯化铜+水21、盐酸+氢氧化铁→氯化铁+水22、硫酸+氢氧化镁→硫酸镁+水23、硫酸+氢氧化钠→硫酸钠+水24、硫酸+氢氧化铜→硫酸铜+水25、硫酸+氢氧化铁→硫酸铁+水26、硝酸(HNO3)+氢氧化镁→硝酸镁+水27、硝酸+氢氧化铝→硝酸铝+水28、硝酸+氢氧化钙→硝酸钙+水29、盐酸+硝酸银→硝酸+氯化银沉淀30、硫酸+氯化钡→盐酸+硫酸钡沉淀31、硫酸+硝酸钡→硝酸+硫酸钡沉淀32、盐酸+碳酸钙→氯化钙+水+二氧化碳33、硫酸+碳酸钠→硫酸钠+水+二氧化碳34、盐酸+碳酸钠→氯化钠+水+二氧化碳35、盐酸+碳酸镁→氯化镁+水+二氧化碳36、氢氧化钠+二氧化碳→碳酸钠+水37、氢氧化钠+三氧化硫→硫酸钠+水38、氢氧化钙+二氧化碳→碳酸钙沉淀+水39、氢氧化钠+盐酸→氯化钠+水40、氢氧化铝+盐酸→氯化铝+水41、氢氧化铜+盐酸→氯化铜+水42、氢氧化铁+盐酸→氯化铁+水43、氢氧化镁+盐酸→氯化镁+水44、氢氧化钠+硫酸→硫酸钠+水45、氢氧化铜+硫酸→硫酸铜+水46、氢氧化铁+硫酸→硫酸铁+水47、氢氧化锌+硫酸→硫酸锌+水48、氢氧化铝+硝酸→硝酸铝+水49、氢氧化铜+硝酸→硝酸铜+水50、氢氧化铁+硝酸→硝酸铁+水51、氨气(NH3)+硫酸→硫酸銨52、氨气+盐酸→氯化銨53、氢氧化钠+硫酸铜→硫酸钠+氢氧化铜沉淀54、氢氧化钠+氯化铜→氯化钠+氢氧化铜沉淀55、氢氧化钠+硝酸铜→硝酸钠+氢氧化铜沉淀56、氢氧化钠+氯化铁→氯化钠+氢氧化铁沉淀57、氢氧化钠+硫酸铁→硫酸钠+氢氧化铁沉淀58、氢氧化钠+硝酸铁→硝酸钠+氢氧化铁沉淀59、氢氧化钙+碳酸钠→氢氧化钠+碳酸钙沉淀60、氢氧化钙+碳酸钾→氢氧化钾+碳酸钙沉淀61、氢氧化钡+硫酸钠→氢氧化钠+硫酸钡沉淀62、氢氧化钡+硫酸铜→氢氧化铜沉淀+硫酸钡沉淀63、氢氧化钡+硫酸铁→氢氧化铁沉淀+硫酸钡沉淀64、氢氧化钡+硫酸镁→氢氧化镁沉淀+硫酸钡沉淀65、氢氧化钠+氯化铵→氯化钠+水+氨气66、氢氧化钙+硫酸铵→硫酸钙+水+氨气67、硫酸铜+铁→硫酸亚铁+铜68、硫酸铜+锌→硫酸锌+铜69、硫酸铜+镁→硫酸镁+铜70、硫酸铜+铝→硫酸铝+铜71、硝酸银+铜→硝酸铜+银72、硝酸银+镁→硝酸镁+银73、硝酸银+铁→硝酸亚铁+银74、硝酸银+锌→硝酸锌+银75、硫酸亚铁+锌→硫酸锌+铁76、硫酸亚铁+铝→硫酸铝+铁77、硝酸汞+铜→硝酸铜+汞78、氯化钡+硫酸→硫酸钡沉淀+盐酸(HCl)79、硝酸钡+硫酸→硫酸钡沉淀+硝酸(HNO3)80、碳酸钠+硝酸→硝酸钠+水+二氧化碳81、铁丝在氧气中燃烧82、镁条在氧气中燃烧83、红磷在氧气中燃烧84、硫磺在氧气中燃烧85、氢气在氧气中燃烧86、甲烷(CH4)在氧气中燃烧87、酒精(C2H5OH)在氧气中燃烧88、木炭在氧气中燃烧89、一氧化碳在氧气中燃烧90、碳酸钙高温生成氧化钙和二氧化碳91、生石灰+水→氢氧化钙92、电解水93、一氧化碳+氧化铜→铜+二氧化碳94、一氧化碳+氧化铁→铁+二氧化碳95、氢气+氧化铜→铜+水96、加热高锰酸钾97、加热氯酸钾和二氧化锰98、过氧化氢中加入二氧化锰99、乙炔(C2H2)+氧气(点燃)→二氧化碳+水100、一氧化碳+四氧化三铁(高温)→铁+二氧化碳。
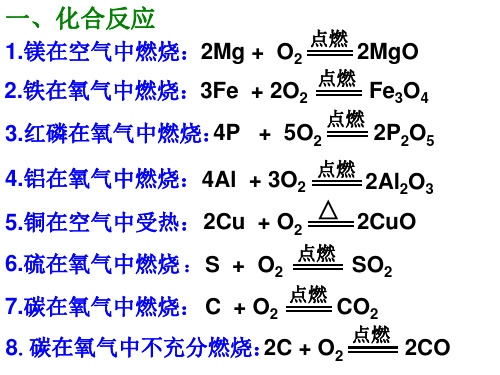

化学方程式默写(一)1.Cl2与水反应的离子方程式2.Cl2与NaOH反应的离子方程式3.工业制漂白粉的化学方程式4.实验室制Cl2的离子方程式5.酸性KMnO4与浓盐酸反应的离子方程式6.次氯酸见光分解的化学方程式7.漂白粉在空气中失效的化学方程式8.Cl2与FeCl2反应的离子方程式9.Cl2与KI反应的离子方程式10.Cl2与SO2反应的离子方程式11.KClO3与浓盐酸反应的离子方程式12.足量铁丝在Cl2中燃烧的化学方程式13.SiO2与HF反应的化学方程式14.SiO2与NaOH反应的离子方程式15.SiO2高温下与Na2CO3反应的化学方程式16.Na2SiO3与盐酸反应的离子方程式17.少量CO2与NaOH反应的离子方程式18.过量CO2与NaOH反应的离子方程式19.Na2SiO3溶液中通入足量CO2的离子方程式20.高纯硅的制备流程方程式(原料为SiO2、C、Cl2、H2):、、。
21.小苏打溶液中加入过量的澄清石灰水的离子方程式:。
化学方程式默写(二)1.SO2与CaO反应方程式2.少量SO2与NaOH反应的离子方程式3.少量SO2与澄清石灰水反应的离子方程式4.SO2与H2S反应的化学方程式5.SO2与FeCl3反应的离子方程式6.SO2与新制氯水反应的离子方程式7.SO2与酸性KMnO4反应的离子方程式8.SO2与碘水反应的离子方程式9.工业上用浓氨水处理硫酸工业尾气的化学方程式:、。
10.SO2的催化氧化方程式11.铜与浓硫酸反应的化学方程式12.碳与浓硫酸反应的化学方程式13.铜与双氧水、稀硫酸反应的离子方程式14.少量铁粉在加热条件下与浓硫酸反应的化学方程式:15.NaHSO4与Ba(OH)2反应后溶液呈中性的离子方程式:16.电解精炼铜阳极阴极17.钥匙镀锌阳极阴极化学方程式默写(三)1.N2与O2放电时的化学方程式2.NO与O2反应的化学方程式3.NO2溶于水的离子方程式4.Cu与浓HNO3反应的离子方程式5.Cu与稀HNO3反应的离子方程式6.少量铁粉与稀HNO3反应的离子方程式7.Fe2+与稀HNO3反应的离子方程式8.实验室制NH3的化学方程式9.NH3的工业制法10.NH3·H2O的电离方程式11.氨水受热分解方程式12.工业制硝酸的反应方程式:、、。
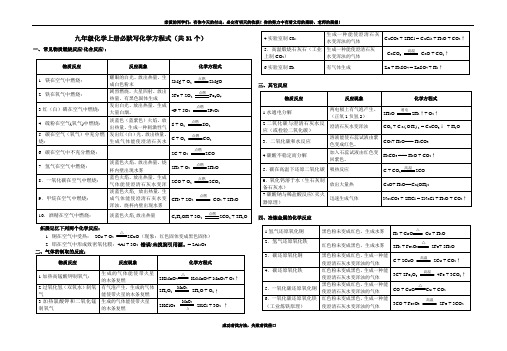
九年级化学上册必默写化学方程式(共31个)一、常见物质燃烧反应(化合反应):
拓展记忆下列两个化学反应:
1. 铜在空气中受热:2Cu + O2△
(现象:红色固体变成黑色固体)
2. 铝在空气中形成致密氧化膜:4Al + 3O2错误!未找到引用源。
= 2Al2O3
二、气体的制取的反应:
三、其它反应
四、冶炼金属的化学反应
按要求默写下列化学方程式(共31个)一、常见物质燃烧反应(化合反应):
拓展记忆下列两个化学反应:
1. 铜在空气中受热:2Cu + O2△
2CuO(现象:红色固体变成黑色固体)
2. 铝在空气中形成致密氧化膜:4Al + 3O2错误!未找到引用源。
= 2Al2O3
二、气体的制取的反应:
三、其它反应
四、冶炼金属的化学反应。

初三化学式、化学方程式竞赛(满分:120分时间: 40分钟)一、化学式(每个一分,共60分)氧气;氢气;氮气;铁;铜;汞;碳;硫;白磷;二氧化硫;一氧化碳;二氧化氮;氧化汞;氧化铜;氧化铁;氧化锌;氧化镁;氧化钙; 氧化钡;氧化钠;氧化钾;水;氧化铝;干冰;高锰酸钾;氯化钠;氯化铜;氯化钾;氯化铁;氯化银;氯化钙;氯化钡;氯化镁;氯化锌;氯化铝;氯化铵;氯酸钾;锰酸钾;硝酸钠;硝酸铜;硝酸钾;硝酸银; 硝酸钡;硝酸铵。
盐酸;硫酸.硫酸钠;硫酸铜;硫酸钾;硫酸亚铁;硫酸钙;硫酸钡;氢氧化铜;硫酸锌硫酸铝。
碳酸钠;碳酸钾;碳酸;氢氧化钙. 碳酸铜;二、化学方程式(每个化学方程式2分,共60分)1、我国自行设计和制造的长征3号火箭用液氧和液氢作推进剂,点火时发生的反应:;2、高温煅烧石灰石制取生石灰:;3、镁带在空气中燃烧:;4、硫在氧气中燃烧:;5、用固液常温型装置制氧气:;6、红磷燃烧:;7、加热高锰酸钾固体:;8、通电分解水:;9、现有氯酸钾、锌粒、二氧化锰、稀硫酸、氢氧化钠等物质,从中选出适当的物质,按下列要求写出化学方程式:置换反应:;分解反应:;10、有二氧化碳生成的分解反应、化合反应:、;11、实验室制二氧化碳的化学方程式:;12、检验二氧化碳的反应:;13、写出有水生成的分解反应、化合反应:;;14、工业炼铁的反应原理(CO还原Fe2O3):;15、铁在氧气中燃烧:;16、除去下列物质中混有的少量杂质(括号内为杂质),写出反应的化学方程式:铁粉(四氧化三铁):;CaO(CaCO3):;CO(CO2):;17、哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料。
加热铝粉使其被氧气氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体:两种是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液态),因而产生大巨大的推动力,写出其中涉及到的反应的化学方程式:(1)铝粉被氧气氧化成三氧化二铝:;(2)高氯酸铵受热分解:。

第1—5 章化学方程式默写1.镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 氢气中空气中燃烧:5. 红磷在空气中燃烧:6. 硫粉在空气中燃烧:7. 碳在氧气中完全燃烧:8. 碳在氧气中不完全燃烧:9. 一氧化碳在氧气中燃烧:10. 甲烷完全燃烧:11. 钠在氯气中燃烧:12. 氯化氢与氨气的反应:13. 二氧化碳溶解于水:14. 水在直流电的作用下分解:15. 加热碳酸氢铵: ____________16. 加热碱式碳酸铜:17. 加热高锰酸钾:18. 氯酸钾制氧气:_____19. 双氧水和二氧化锰制氧气:20. 碳酸不稳定而分解:21. 检验二氧化碳:22. 大理石与稀盐酸:_____ ____23. 铝在空气中形成致密的氧化膜24. 锌与稀盐酸反应25. 锌与稀硫酸反应26. 镁与稀盐酸反应27. 镁与稀硫酸反应28. 铝与稀盐酸反应29. 铝与稀硫酸反应30. 铁与稀盐酸反应31. 铁与稀硫酸反应32. 曾青得铁则化为铜33. “百炼成钢”的主要反应34. 高炉炼铁焦炭作用、35. CO 还原赤铁矿反应36. CO 还原磁铁矿反应37. H2还原氧化铜38. H2还原氧化铁39. 木炭还原氧化铜40. 木炭还原氧化铁41. 氢氧化钠溶液与硫酸铜溶液反应42. 铜生锈的反应第1—5 章化学方程式1. 镁在空气中燃烧: 2 Mg + O2点燃 2 MgO(白色)2. 铁在氧气中燃烧: 3 Fe + 2O2点燃Fe3O4(黑色)3. 铜在空气中受热: 2 Cu + O2∆ 2 CuO(黑色)4. 氢气中空气中燃烧: 2 H2 + O2点燃2 H2O5. 红磷在空气中燃烧:4 P + 5 O2点燃2 P2O5(白色)(白烟)6. 硫粉在空气中燃烧:S + O2点燃SO2(刺激性气味)7. 碳在氧气中完全燃烧:C + O2点燃CO28. 碳在氧气中不完全燃烧: 2 C + O2点燃2 CO(毒)9. 一氧化碳在氧气中燃烧:2 CO + O2点燃2 CO210. 甲烷完全燃烧:CH4 + 2 O2点燃CO2 + 2 H2O11. 钠在氯气中燃烧: 2 Na + Cl2点燃2 NaCl(了解)12. 氯化氢与氨气的反应:HCl + NH3 = NH4Cl(了解)(白烟)13. 二氧化碳溶解于水:CO2 + H2O = H2CO314. 水在直流电的作用下分解:2 H2O通电2 H2↑+ O2↑15. 加热碳酸氢铵:NH4HCO3∆ NH3↑ + H2O + CO2↑16. 加热碱式碳酸铜:Cu2(OH)2CO3∆ 2 CuO + H2O + CO2↑17. 加热高锰酸钾:(紫黑)2 KMnO4∆ K2MnO4 + MnO2 + O2↑2 KCl +3 O2↑18. 氯酸钾制氧气: 2 KClO3 MnO2△19. 双氧水和二氧化锰制氧气:2 H2O2MnO2 2 H2O + O2↑20. 碳酸不稳定分解:H2CO3∆ H2O + CO2↑21. 检验二氧化碳:Ca(OH)2 + CO2 = CaCO3↓+ H2O22. 大理石与稀盐酸:CaCO3 + 2 HCl = CaCl2 + H2O + CO2↑23. 铝在空气中形成致密的氧化膜 4 Al + 3 O2 = 2 Al2O324. 锌与稀盐酸反应Zn + 2 HCl = ZnCl2 + H2↑(实验室制H2)25. 锌与稀硫酸反应Zn + H2SO4 = ZnSO4 + H2↑(实验室制H2)26. 镁与稀盐酸反应Mg + 2 HCl = MgCl2 + H2↑27. 镁与稀硫酸反应Mg + H2SO4 = MgSO4 + H2↑28. 铝与稀盐酸反应 2 Al + 6 HCl = 2 AlCl3 + 3 H2↑29. 铝与稀硫酸反应 2 Al + 3 H2SO4= Al2(SO4)3 +3 H2↑30. 铁与稀盐酸反应Fe + 2 HCl = FeCl2 + H2↑31. 铁与稀硫酸反应Fe + H2SO4 = FeSO4 + H2↑32. 曾青得铁则化为铜Fe + CuSO4 = FeSO4 + Cu33. “百炼成钢”的主要反应C + O2点燃CO2(炼钢的原理)34. 高炉炼铁焦炭作用C+O2点燃CO2CO2+ C高温2 CO35. CO 还原赤铁矿反应 3 CO + Fe2O3高温2 Fe + 3 CO236. CO 还原磁铁矿反应 4 CO + Fe3O4高温3 Fe + 4 CO237. H2还原氧化铜H2 + CuO△2O38. H2还原氧化铁 3 H2 + Fe2O3△2 Fe + 3 H2O39. 木炭还原氧化铜 C + 2 CuO高温2 Cu + CO2↑40. 木炭还原氧化铁 3 C + 2 Fe2O3高温4 Fe + 3 CO2↑41. 氢氧化钠溶液与硫酸铜溶液2 NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 42. 铜生锈的反应2 Cu + O2 + H2O + CO2 = Cu2(OH)2CO3(了解)第7 章化学方程式默写1.氧化铁与稀盐酸(盐酸除铁锈)2. 氧化铁与稀硫酸(硫酸除铁锈)3. 氧化铜与稀盐酸4.氧化铜与稀硫酸5.氢氧化钠与稀盐酸6.氢氧化钠与稀硫酸7.氢氧化钙与稀盐酸8.氢氧化铝与稀盐酸(治疗胃酸过多)9.石灰石与稀盐酸(实验室制取CO2)10.碳酸钠与稀硫酸11.氯化钡和稀硫酸12.硝酸银和稀盐酸13.氧化钙和水(生石灰变熟石灰)14.氢氧化钙和二氧化碳(检验CO2)15.氢氧化钠和二氧化碳(吸收/除去CO2)16.氢氧化钙和二氧化硫(石灰浆吸收SO2)17.硫酸铜和氢氧化钠18.硫酸铜和氢氧化钙(配制农药波尔多液)19.碳酸钠和氢氧化钙(工业制烧碱)20.氯化铁和氢氧化钠21.铜和硝酸银22.铝和硝酸铜23.氯化钡和碳酸钠24.氢氧化钡和碳酸钠25.氯化钠和硝酸银26.氯化钡和硫酸钠27.碳酸氢钠和稀盐酸(治疗胃酸过多)28.加热碳酸氢铵(小苏打做发酵粉)29.煅烧石灰石30.氨水与稀硫酸31.氯化铵和氢氧化钠32.硫酸铵与氢氧化钙33.电解饱和氯化钠溶液34.侯氏制碱35.碱式碳酸铜与稀盐酸反应第7 章化学方程式1. 氧化铁与稀盐酸(盐酸除铁锈)Fe2O3+6HCl=2FeCl3+3H2O2. 氧化铁与稀硫酸(硫酸除铁锈)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O3. 氧化铜与稀盐酸 CuO+2HCl=CuCl2+H2O4.氧化铜与稀硫酸 CuO+H2SO4=CuSO4+H2O5.氢氧化钠与稀盐酸 NaOH+HCl=NaCl+H2O6.氢氧化钠与稀硫酸 2NaOH+H2SO4=Na2SO4+2H2O7.氢氧化钙与稀盐酸 Ca(OH)2+2HCl=CaCl2+2H2O8.氢氧化铝与稀盐酸(治疗胃酸过多)Al(OH)3+3HCl=AlCl3+3H2O9.石灰石与稀盐酸(实验室制取CO2)CaCO3+2HCl=CaCl2+H2O+CO2↑10.碳酸钠与稀硫酸 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑11.氯化钡和稀硫酸 BaCl2+H2SO4=BaSO4↓+2HCl12.硝酸银和稀盐酸 AgNO3+HCl=AgCl↓+HNO313.氧化钙和水(生石灰变熟石灰)CaO+H2O=Ca(OH)214.氢氧化钙和二氧化碳(检验CO2)Ca(OH)2+CO2=CaCO3↓+H2O15.氢氧化钠和二氧化碳(吸收/除去CO2)2NaOH+CO2=Na2CO3+H2O16.氢氧化钙和二氧化硫(石灰浆吸收SO2)Ca(OH)2+SO2=CaSO3↓+H2O18.硫酸铜和氢氧化钙(配制农药波尔多液)CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓19.碳酸钠和氢氧化钙(工业制烧碱)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH20.氯化铁和氢氧化钠 FeCl3+3NaOH=Fe(OH)3↓+3NaCl22.铝和硝酸铜 2Al+3Cu(NO3)2=2Al(NO3)3+3Cu23.氯化钡和碳酸钠 aCl2+Na=CO3=BaCO3↓+2NaCl24.氢氧化钡和碳酸钠 Ba(OH)2+Na2CO3=BaCO3↓+2NaOH25.氯化钠和硝酸银 AgNO3+NaCl=AgCl↓+NaNO326.氯化钡和硫酸钠 BaCl2+Na2SO4=BaSO4↓+2NaCl27.碳酸氢钠和稀盐酸(治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑28.加热碳酸氢铵(小苏打做发酵粉)2NaHCO3△2CO3+H2O+CO2↑29.煅烧石灰石 CaCO3高温CaO+CO2↑30.氨水与稀硫酸 2NH3∙H2O+H2SO4=(NH4)2SO4+2H2O31.氯化铵和氢氧化钠 NH4Cl+NaOH=NaCl+NH3↑+H2O32.硫酸铵与氢氧化钙(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O33.电解饱和氯化钠溶液2NaCl+2H2O通电2NaOH+Cl2↑+H2↑34.侯氏制碱 NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl2NaHCO3△2CO3+H2O+CO2↑35. 碱式碳酸铜与稀盐酸反应Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑(Cu2(OH)2CO3可以拆成Cu(OH)2∙CuCO3的形式)。

t Mg A m Al m B Mg t Al Al m t Mg C tMgm AlD 化学方程式典型中考竞赛题选一.选择题1.(20XX 年四川)某物质在空气中完全燃烧后,生成的气体能使澄清石灰水变浑浊,该物质一定是A 碳单质B 含碳元素的化合物C 含碳、氧元素的化合物D 含碳元素的物质2.(20XX 年江西)加热氯酸钾与二氧化锰的混合物可制得氧气。
下列各图中,与该反应事实最吻合的是A B C D3.(20XX 年泰州)室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是4.(20XX 年福州)下列化学方程式书写正确的是A Mg+O 2点燃MgO B Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOHC 2Fe+6HCl =2FeCl 3+3H 2↑D C+O 2=CO 25.(20XX 年福州)在一个密闭容器内有X 、Y 、Z 、Q 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:(A )物质X Y Z Q反应前质量/g 2 2 84 5反应后质量/g 待测24 0 14试推断该密闭容器中发生的化学反应基本类型为A 分解反应B 化合反应C 置换反应D 复分解反应6.(20XX 年全国竞赛题)50g 镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g 固体(已换算成无水硫酸盐)。
则反应产生氢气的质量是A 2 gB 3 gC 3.5gD 4.5 g7.(20XX 年南昌竞赛题)酒后驾车使交通事故增加。
为了整顿这种现象,国家有关部门开始使用一种仪器,用于检查司机是否酒后驾驶。
其原理是酒精可以与重铬酸钾(K 2Cr 2O 7)反应,重铬酸钾能把乙醇氧化成乙酸,六价的铬离子被还原成三价而由橙红色变为绿色。
主要反应可用下列化学方程式表示其中x 、y 分别是A 2、8B 11、2C 2、11D 4、9(20XX 年辽宁)有一条酸河,经分析发现是由于河水中含有的物质R 在氧气的作用下发生反应所致,其反应的化学方程式为2R+2H2O+7O2=2FeSO4+2H2SO4,则R的化学式是A FeSB Fe2S3C FeOD FeS 28.(20XX年北京东城)只含碳、氢或碳、氢、氧的物质充分燃烧后的产物均为CO2和H2O。

九年级化学方程式默写比赛时量:45分钟满分100分按照题中提示,写出对应的化学方程式:1.白磷在空气中自燃,产生大量的白烟。
2.木炭在空气中完全燃烧。
3.光亮的镁条在空气中被点燃后发出耀眼的白光。
4.弯成螺旋状的细铁丝在氧气中点燃后火星四射,生成黑色固体。
5.硫磺在氧气中燃烧,发出明亮的蓝紫色火焰,放出能使人掉眼泪的气体。
6.在双氧水中放入少量二氧化锰的粉末,产生大量无色的气体。
7.加热紫红色的固体时放出能使带火星木条复燃的气体。
8.在氯酸钾中加入少量二氧化锰后加热能快速放出氧气。
9.锌粒加入到稀硫酸中,放出一种密度非常小的气体。
10.石灰石中加入稀盐酸,会产生一种能使灭火的气体。
11.纯净的氢气在空气中安静的燃烧。
12.水在直流电的作用下,放出了两种无色气体。
13.生锈的铁钉泡在稀盐酸中,表面变得光洁,溶液逐渐变成黄色。
14.将铁棒放到硫酸铜溶液中一段时间,铁棒表面变红。
15.炽热的赤铁矿石在一氧化碳的作用下,逐渐变成铁水。
16.滴有酚酞试液的烧碱溶液中,加入稀盐酸后,红色褪去。
17.在稀硫酸中滴入氯化钡溶液产生白色沉淀,加入稀硝酸也不溶解。
18.在盛满了二氧化碳的塑料瓶中滴入几滴氢氧化钠溶液,塑料瓶会变扁。
19.用石灰水和硫酸铜溶液混合,可以得到杀虫剂波尔多液。
20.食盐水中加入硝酸银溶液,会产生不溶于稀硝酸的白色沉淀。
21.氢氧化钠溶液中加入黄色的氯化铁溶液会产生红褐色的沉淀。
22.大伯把石灰的碳铵放在一块,结果房间里呛得要死,碳铵也没有了肥效。
23.2008年奥运会的火炬燃料是丙烷(C3H8),它在空气中燃烧,生成二氧化碳和水。
24.某实验小组将绿豆大小的一块金属钠放入水中,看到钠粒在水面上游走,并生成了氢气,不得到了氢氧化钠的溶液。
25.明朝著名的宰相于谦写了一首叫《石灰吟》诗,既咏物又铭志。
在诗中提到了三个化学反应,请你写出其中的一个化学方程式。
石灰吟于谦千锤万凿出深山,烈火焚烧若等闲。

钠的化合物的反应方程式的默写一、氧化钠(化学式与物理性质) 1.氧化钠与水反应化学方程式离子方程式2.氧化钠与二氧化碳的反应化学方程式3.氧化钠与稀硫酸的反应化学方程式离子方程式二、过氧化钠(化学式、俗称与物理性质)4.过氧化钠与水反应化学方程式离子方程式5.过氧化钠与二氧化碳的反应化学方程式6.过氧化钠与稀盐酸的反应化学方程式离子方程式三、氢氧化钠(化学式与物理性质)碱的通性:a:b:碱+酸=盐+水化学方程式c:化学方程式d:化学方程式四、碳酸钠(化学式、俗称与物理性质)7.向碳酸钠中逐滴加入稀盐酸化学方程式a:b:离子方程式a:b:8.向盐酸中加入碳酸钠溶液化学方程式离子方程式9.向碳酸钠溶液中通入二氧化碳的反应化学方程式离子方程式10.碳酸钠与氢氧化钙的反应化学方程式离子方程式五、碳酸氢钠(化学式、俗称与物理性质)9.碳酸氢钠与盐酸的反应化学方程式离子方程式10.碳酸氢钠固体受热分解化学方程式11.碳酸氢钠与氢氧化钠的反应化学方程式离子方程式12.碳酸氢钠与少量氢氧化钙的反应化学方程式离子方程式13.碳酸氢钠与过量氢氧化钙的反应化学方程式离子方程式14.氢氧化钠与少量二氧化碳的反应化学方程式离子方程式15.氢氧化钠与过量二氧化碳的反应化学方程式离子方程式16.十水合碳酸钠的风化化学方程式铝及其化合物的化学方程式与离子方程式一、铝1、铝在氧气中燃烧:;2、铝在氯气中燃烧:;3、铝与硫共热:;4、铝与稀硫酸反应:;5、铝与氢氧化钠溶液反应:;6、铝与浓硫酸共热:;7、铝与浓硝酸共热:;8、铝与稀硝酸反应:;9、铝与硝酸银溶液反应:;10、铝与硫酸铜溶液反应:;11、铝与氧化铁高温下反应:;12、铝与四氧化三铁高温共热:;13、铝与氧化铜高温共热:;14、铝与二氧化锰高温共热:;二、氧化铝1、氧化铝与稀硫酸反应:;2、氧化铝与氢氧化钠溶液反应:;3、电解氧化铝的熔融液:;三、氢氧化铝1、氢氧化铝与稀硫酸反应:2、氢氧化铝与氢氧化钠溶液反应:;3、加热氢氧化铝:;四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:;2、硫酸铝的水溶液呈酸性:;3、硫酸铝溶液中加入少量的氢氧化钠溶液:;4、向硫酸铝溶液中加足量的氢氧化钠溶液;5、向硫酸铝溶液中加入少量的氢氧化钡溶液:;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:;7、向明矾溶液中加入少量的氢氧化钡溶液:;8、向明矾溶液中加入足量的氢氧化钡溶液:;9、向硫酸铝溶液中加入氨水:;10、向硫酸铝溶液中加入碳酸钠溶液:;11、向硫酸铝溶液中加入碳酸氢钠溶液:;12、向硫酸铝溶液中加入硫化钠溶液:;13、向硫酸铝溶液中加入硫氢化钠溶液:;14、向硫酸铝溶液中加入硅酸钠溶液:;15、向硫酸铝溶液中加入偏铝酸钠溶液:;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:;2、偏铝酸钠溶液滴入少量盐酸:;3、向偏铝酸钠溶液加入足量盐酸:;4、向偏铝酸钠溶液通入少量二氧化碳气体:;5、向偏铝酸钠溶液通入足量二氧化碳气体:;6、向偏铝酸钠溶液中加入硫酸铝溶液:;7、向偏铝酸钠溶液中加入氯化铵溶液:;8、向偏铝酸钠溶液中加入氯化铁溶液:;铁及其化合物化学方程式及离子方程式1、铁与非金属单质反应:(1) Fe在纯O2中燃烧:化学方程式:;(2) Fe与S的反应:化学方程式:;(3) Fe与Cl2点燃:化学方程式:;(4) Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。

初中化学方程式默写竞赛内容铁及其化合物1.铁与氧气反应:3Fe +2O 2Fe 3O 4 铁与硫反应:Fe + S FeS2.铁与盐酸反应:Fe + 2HCl = FeCl 2 + H 2↑离子方程式:Fe + 2H + = Fe 2+ + H 2↑_铁与CuSO 4溶液:Fe+CuSO 4=FeSO 4+Cu 离子方程式:Fe+Cu 2+=Fe 2++Cu_3.铁和水蒸气:_3Fe + 4H 2O (g) Fe 3O 4 + 4H 2_4.氧化亚铁与盐酸反应:FeO +2HCl=FeCl 2+H 2O 离子方程式:FeO +2H +=Fe 2++H 2O _5.氧化铁与盐酸反应:_ Fe 2O 3+6HCl=2FeCl 3+3H 2O 离子方程式:Fe 2O 3+6H +=2Fe 3++3H 2O_6.CO 还原氧化铁:_ Fe 2O 3 + 3CO 2Fe + 3CO 2_7.氯化铁与氢氧化钠溶液:FeCl 3+3NaOH = Fe(OH)3↓+3NaCl_ 离子方程式:Fe 3++3OH -= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO 4+2NaOH=Fe(OH)2↓+Na 2SO 4 离子方程式:Fe 2++2OH -= Fe(OH)2↓9.氢氧化铁加热分解:__2Fe(OH)3Fe 2O 3+3H 2O_____10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3_11.除去FeCl 2中的FeCl 3:2FeCl 3 + Fe = 3FeCl 2_离子方程式:2Fe 3+ + Fe = 3Fe 2+_12.FeCl 2和Cl 2反应:_2FeCl 2 + Cl 2 = 2FeCl 3_ 离子方程式:_2Fe 2+ + Cl 2 = 2Fe 3++2Cl -13.FeCl 3和Cu 反应:2FeCl 3+Cu =2FeCl 2+CuCl 2_离子方程式:2Fe 3++Cu =2Fe 2++Cu 2+14.氯化铁与硫氰化钾溶液反应:_ Fe 3+ + 3SCN -= Fe(SCN)3___硅及其化合物1.硅与氧气加热:Si+O 2SiO 2硅与氟气:_ Si+2F 2=SiF 4__2.硅单质与氢氟酸反应:Si+4HF=SiF 4+2H 23.硅与氢氧化钠溶液反应:Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑4.二氧化硅与氢氟酸反应:_4HF+SiO 2=SiF 4↑+2H 2O _5.二氧化硅与氧化钙高温反应:SiO 2+CaO CaSiO 3__6.二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O __7.二氧化硅与碳反应: SiO 2 + 2C Si + 2CO ↑_8.硅酸钠与盐酸反应:_ Na 2SiO 3+2HCl =H 2SiO 3↓+2 NaCl__ 离子方程式: SiO 32-+2H +=H 2SiO 3↓9.往硅酸钠溶液中通入二氧化碳:_ Na 2SiO 3+CO 2+H 2O == H 2SiO 3↓+ Na 2CO 3_10.二氧化硅与纯碱反应:SiO 2+Na 2CO 3Na 2SiO 3+CO 2↑_高温高温高温高温 高温高温11.二氧化硅与石灰石反应:_ SiO2+CaCO 3CaSiO3+CO2↑_12.加热硅酸:H2SiO3SiO2+H2O氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:_2Na+Cl2 2NaCl_铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl2 2HCl _3.氯气和水反应:Cl2 + H2O = HCl + HClO 离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:_2HClO 2HCl + O2↑_5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O _8.漂白粉漂白原理:_ Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO _9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 +2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl离子方程式:_ Cl2 + 2I- = I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr离子方程式:Br2 +2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3 + NaCl =AgCl↓ + NaNO3离子方程式:Ag++Cl-=AgCl↓溴化钠和硝酸银溶液:AgNO3 + NaBr=AgBr↓ + NaNO3离子方程式:Ag++Br-=AgBr↓_碘化钠和硝酸银溶液:AgNO3 + NaI =AgI↓ + NaNO3离子方程式:Ag++I-= AgI↓_。

化学式及化学符号默写
氢气氧气氮气氦气氖气氩气铁铜锌镁银铝碳
硫磷氯气溴单质碘单质氟气臭氧
单质
氧化钠氧化钾氧化钙氧化镁氧化钡氧化锌氧化铝氧化铜氧化亚铜氧化铁氧化亚铁四氧化三铁五氧化二磷二氧化碳一氧化碳二氧化硫
二氧化氮二氧化氯二氧化锰水双氧水
氧化物硝酸盐酸硫酸碳酸
酸
氨水氢氧化钾氢氧化钠氢氧化钙氢氧化镁氢氧化钡氢氧化锌氢氧化铝氢氧化铜氢氧化亚铁氢氧化铁
碱氯化铵氯化钾氯化钠氯化银氯化钙氯化镁氯化钡氯化锌氯化铝
氯化铜氯化铁氯化亚铁
硝酸铵硝酸钠硝酸钾硝酸银硝酸钙硝酸镁硝酸钡硝酸锌
硝酸铝硝酸铜硝酸铁硝酸亚铁
硫酸铵硫酸钾硫酸钠硫酸钙硫酸镁硫酸钡硫酸锌
硫酸铝硫酸铜硫酸铁硫酸亚铁
碳酸铵碳酸钠碳酸钾碳酸钙碳酸钡
高锰酸钾锰酸钾氯酸钾甲烷乙醇3个氧原子3个氧分子3个氧离子2个水分子2个氢原子2个氢分子铜原子2个氢离子硫酸分子5个硫酸根离子铵根离子甲烷分子4个水分子
硝酸根离子2个碳酸根离子1个铜离子2个亚铁离子双氧水分子硫离子镁离子钙离子氯离子3个铝离子2个碳酸分子氮原子氮分子
硫酸钙中的阴离子硝酸镁中的金属离子碳酸铵中的阳离子
氧化铝中铝元素的化合价氧化铁中铁元素的化合价过氧化氢中氧元素的化合价
写出下列物质(或主要成分)的化学式
大理石生石灰熟石灰(石灰浆/石灰水)石墨金刚石。

九年级化学化学方程式默写比赛试题
班级姓名得分
1. 镁在空气中燃烧:
2. 铁在氧气中燃烧:
3. 铜在空气中受热:
4. 氢气中空气中燃烧:
5. 红(白)磷在空气中燃烧:
6. 硫粉在空气中燃烧:
7. 碳在氧气中充分燃烧:
8. 碳在氧气中不充分燃烧:
9. 一氧化碳在氧气中燃烧:
10. 甲烷在空气中燃烧:
11. 酒精在空气中燃烧:
12. 水在直流电的作用下分解:
13. 加热氯酸钾(有少量的二氧化锰):
14. 加热高锰酸钾:
15. 碳酸不稳定而分解:
16. 高温煅烧石灰石:
17. 过氧化氢溶液和二氧化锰混合:
18. 氢气还原氧化铜:
19. 木炭还原氧化铜:
20. 一氧化碳还原氧化铜:
21. 一氧化碳还原氧化铁:
22. 一氧化碳还原四氧化三铁:
23. 锌和稀硫酸反应生成硫酸锌和氢气:
24. 铁和硫酸铜溶液反应生成硫酸亚铁和铜:
25. 大理石与稀盐酸反应:
26. 碳酸钠与稀盐酸反应:
27. 氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠:
28. 二氧化碳溶解于水:
29.二氧化碳通过炽热的炭层:
30.二氧化碳使澄清的石灰水变浑浊:。
九年级化学方程式默写比赛
时量:45分钟满分100分
按照题中提示,写出对应的化学方程式:
1.白磷在空气中自燃,产生大量的白烟。
2.木炭在空气中完全燃烧。
3.光亮的镁条在空气中被点燃后发出耀眼的白光。
4.弯成螺旋状的细铁丝在氧气中点燃后火星四射,生成黑色固体。
5.硫磺在氧气中燃烧,发出明亮的蓝紫色火焰,放出能使人掉眼泪的气体。
6.在双氧水中放入少量二氧化锰的粉末,产生大量无色的气体。
7.加热紫红色的固体时放出能使带火星木条复燃的气体。
8.在氯酸钾中加入少量二氧化锰后加热能快速放出氧气。
9.锌粒加入到稀硫酸中,放出一种密度非常小的气体。
10.石灰石中加入稀盐酸,会产生一种能使灭火的气体。
11.纯净的氢气在空气中安静的燃烧。
12.水在直流电的作用下,放出了两种无色气体。
13.生锈的铁钉泡在稀盐酸中,表面变得光洁,溶液逐渐变成黄色。
14.将铁棒放到硫酸铜溶液中一段时间,铁棒表面变红。
15.炽热的赤铁矿石在一氧化碳的作用下,逐渐变成铁水。
16.滴有酚酞试液的烧碱溶液中,加入稀盐酸后,红色褪去。
17.在稀硫酸中滴入氯化钡溶液产生白色沉淀,加入稀硝酸也不溶解。
18.在盛满了二氧化碳的塑料瓶中滴入几滴氢氧化钠溶液,塑料瓶会变扁。
19.用石灰水和硫酸铜溶液混合,可以得到杀虫剂波尔多液。
20.食盐水中加入硝酸银溶液,会产生不溶于稀硝酸的白色沉淀。
21.氢氧化钠溶液中加入黄色的氯化铁溶液会产生红褐色的沉淀。
22.大伯把石灰的碳铵放在一块,结果房间里呛得要死,碳铵也没有了肥效。
23.2008年奥运会的火炬燃料是丙烷(C3H8),它在空气中燃烧,生成二氧化碳和水。
24.某实验小组将绿豆大小的一块金属钠放入水中,看到钠粒在水面上游走,并生成了氢气,不得到了氢氧化钠的溶液。
25.明朝著名的宰相于谦写了一首叫《石灰吟》诗,既咏物又铭志。
在诗中提到了三个化学反应,请你写出其中的一个化学方程式。
石灰吟于谦
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。