【创新设计】2012届高考化学二轮专题复习 第11讲 金属元素及其化合物限时练习
- 格式:doc
- 大小:147.00 KB
- 文档页数:9








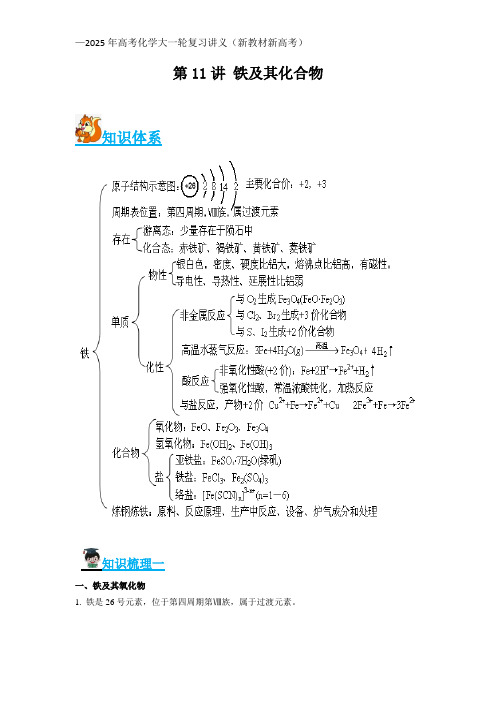
第11讲铁及其化合物知识体系知识梳理一一、铁及其氧化物1. 铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:,主要化合价:+2,+32. 铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3、化学性质(1)与非金属反应:(2)与水反应:(3)与酸反应①与非氧化性酸反应:Fe+2H+==Fe2++H2②与氧化性酸反应a、常温下,铁在冷浓硫酸,浓硝酸中发生钝化b、与浓硫酸反应:(4)与盐反应:2Fe3++Cu==2Fe2++Cu2+,Fe+2Fe3+==3Fe2+,Fe+Cu2+==Fe2++CuFeO Fe2O3Fe3O4铁的氧化物俗称 铁红 磁性氧化铁 色、态 黑色粉末 红棕色粉末 黑色晶体 铁的价态 +2+3+2 +3 水溶性 难溶于水稳定性 不稳定性6FeO+O 2=2Fe 3O 4 稳定稳定与酸的反应 Fe O +2H +=Fe 2++H 2OFe 2O 3+6H +=2Fe 3++3H 2OFe 3O 4+8H +=2Fe 3++ Fe 2++4H 2O与CO 的反应 Fe x O y +yCO=xFe+yCO 2制取高温熔融,过量的铁与氧气反应2Fe+O 2=2FeO Fe(OH)3的分解2Fe(OH)3=Fe 2O 3+3H 2O 铁在氧气中燃烧3Fe+2O 2=Fe 3O 41.高铁酸钾 ()24K FeO 是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为 ()3Fe OH 胶体,制备高铁酸钾流程如图所示。
下列叙述不正确...的是 A .反应I 的化学方程式是232Fe 3Cl 2FeCl +B .用 2FeCl 溶液吸收反应 I 中尾气所得产物可再利用C .反应 II 中氧化剂与还原剂的个数比为 2:3D .用 24K FeO 对饮用水杀菌消毒的同时,生成的 ()3Fe OH 胶体吸附杂质净化水 2.向2L 的H 2SO 4和Fe(NO 3)3的混合稀溶液中逐渐加入铁粉,产生无色气体,该气体遇到空气变为红棕色,溶液中Fe 2+的物质的量和加入Fe 粉的物质的量之间的关系如图所示,下列叙述错误的是经典典例A .开始时加入铁粉反应的离子方程式为+3+32Fe+NO +4H =Fe +NO 2H O -↑+B .加入4mol 铁粉时,溶液中有3 mol Fe 3+,2 mol Fe 2+C .加入5mol 铁粉后的溶液中加入盐酸,不会有NO 气体产生D .原溶液中H 2SO 4和Fe(NO 3)3的物质的量分别为6mol 和1mol 3.有关铁的氧化物的说法中不正确的是A .34Fe O 是黑色晶体,该晶体中每三个铁原子中有2个显+3价,1个显+2价B .FeO 、34Fe O 、23Fe O 都能与稀24H SO 反应生成盐和水,所以都是碱性氧化物C .FeO 不稳定,空气中受热易转化为34Fe OD .23Fe O 俗称铁红,常用作红色油漆和涂料4.某实验小组测定铁的氧化物x y Fe O 的化学式,已知该氧化物中铁元素只有+2和+3两种价态,实验步骤如图,下列说法正确的是20.05molCl 39.2gFe O a b x y −−−−→−−−−−−−→通入恰好反应过量盐酸步骤①步骤②溶液溶液 A .步骤①和步骤②都发生了氧化还原反应 B .溶液a 中阳离子只有3Fe +和2Fe +C .溶液b 中()()3Fe :Cl 1:3n n +-=D .计算可得该氧化物的化学式为:57Fe O二、铁的氢氧化物 化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 溶解性 难溶于水难溶于水与盐酸反Fe(OH)2+2H +===Fe 2++2H 2OFe(OH)3+3H +=== Fe 3++3H 2O知识梳理二应受热分解分解产物复杂2Fe(OH)3===Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-===Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe (OH)3(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意:①FeSO4晶体中不能有Fe3+;②配制后的FeSO4溶液中要加入少量铁粉;③配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气。

2012年高考题汇编(化学)12-02 金属及其化合物1. [2012·江苏化学卷20](14分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-13AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程的中间产物。
Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。
该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。
得到的混合物Y(17MgH2+12Al)在一定条件下释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。
1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl 2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
在上述NaOH溶液中,混合物Y中产生氢气的主要物质是(填化学式)。
(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如右下图所示。
该电池反应的化学方程式为:。
【参考答案】(1)①a+b②Al4C3+12HCl=4AlCl3+3CH4↑(2)①防止Mg Al被空气氧化②52 mol③Al(3)2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O【解析】本题以新能源、新材料为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表计算与分析的综合题,是以常见物质相关的化学知识在生产、生活中具体运用的典型试题。


元素及其化合物专题(2)金属元素及其重要化合物2012届高三化学备课组刘小锟【真题演练】1.(2011重庆高考)下列叙述正确的是A. Fe分别与氯气和稀盐酸反应所得氯化物相同B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性C. Li、Na、K的原子半价和密度随原子序数的增加而增大D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强2.(2010年全国28 15分)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。
纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。
现进行如下实验:①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D 中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:(1)能确定溶液是(写出溶液标号与相应溶质的化学式):(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:【知识框架】1.金属钠及其化合物:写出下列反应(1)Na与苯酚___________________________________(2)Na2O2与CO2的反应________________________________________(3)NaClO溶液中通少量CO2气体____________________________________(4)Na投到CuSO4溶液中____________________________________2.金属铝及其化合物:写出下列反应(1)AlCl3与过量NaOH溶液反应___________________________________(2)往NaAlO2溶液中通入少量CO2的反应________________________________________(3)Al2S3与H2O________________________________________________________________ 3.金属铁及其化合物写出下列反应(1)F e(O H)2转化为Fe(OH)3___________________________________ (2)Fe与H2O气体的反应___________________________________________4.金属铜及化合物写出下列反应 (1) C u 与浓H N O 3的反应 ___________________________________(2)Cu 与FeCl 3溶液的反应_________________________________一、【核心要点突破】 例1 (08年全国理综I·6)在溶液中加入足量Na 2O 2后仍能大量共存的离子组是A .+4NH 、Ba 2+、-Cl 、-3NOB .K +、-2AlO 、-Cl 、-24SO C .Ca 2+、Mg 2+、-3NO 、-3HCO D .Na +、-Cl 、-23CO 、-23SO 【变式训练1】(08北京卷)1mol 过氧化钠与2mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )A .Na 2CO 3B .Na 2O 2 Na 2CO 3C .NaOH 、Na 2CO 3D .Na 2O 2 、NaOH Na 2CO 3和NaHCO )2.Fe2+和Fe3+的检验(1)Fe2+的检验:方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。
【创新设计】2012届高考化学二轮专题复习第11讲金属元素及其化合物限时练习(时间:40分钟满分:60分)一、选择题(共8小题,每小题4分,共32分)1.(上海高考,22改编)实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。
发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末不可能是()。
A.Fe2O3和MnO2B.Fe2O3和V2O5C.Cr2O3和V2O5D.Fe3O4和FeO解析n(Al)=9 g27 g·mol-1=13mol,Al完全反应时转移电子的物质的量为13mol×3=1 mol,则生成金属的摩尔电子质量(转移1 mol e-生成金属的质量)为18 g·mol -1。
A项,生成Fe的摩尔电子质量为56 g3 mol=18.67 g·mol-1,生成Mn的摩尔电子质量为55 g4 mol=13.75 g·mol-1,根据平均值规律,A项正确;B项,生成V的摩尔电子质量为51 g5 mol=10.2 g·mol-1,根据平均值规律,B项正确;同理,C项不可能生成单质18 g;D项,Al完全反应时生成Fe的质量大于18 g,当氧化物粉末不足量时,生成的金属可能为18 g,D项正确。
答案 C2.向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向反应后的溶液中加入c mol·L-1氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。
再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。
则下列关系不正确的是()。
A.c=1 000b11.2V B.p=m+Vc125C.n=m+17Vc D.53m<p<179m解析向m g Mg、Al的混合物中加入适量的稀H2SO4,恰好完全反应,溶液中只有MgSO4、Al2(SO4)3两种物质,且Mg2+与Al3+的质量和为m g;向反应后的溶液中加入c mol·L-1 KOH溶液V mL,使金属离子恰好完全沉淀,发生的反应是:Mg2++2OH-===Mg(OH)2↓,Al3++3OH-===Al(OH)3↓,则得到沉淀的质量是Mg2+、Al3+的质量与KOH溶液中OH-质量的质量和,所以n=m+V×10-3×c×17=m+1.7×10-2Vc,C项错误。
答案 C3.在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1 g再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2之间的关系是()。
A.m1一定大于m2B.m1可能小于m2C.m1一定等于m2D.m1可能大于m2解析铁和铜的混合物与一定量的硝酸反应,当金属剩余时,硝酸耗尽,但生成物中有硝酸亚铁或硝酸铜或这两种物质的混合物。
若再向其中加入稀硫酸,则继续发生如下反应:3Cu+8H++2NO-3===3Cu2++2NO↑+4H2O或:3Fe+8H++2NO-3===3Fe2++2NO↑+4H2OFe+4H++NO-3===Fe3++NO↑+2H2O使金属质量减少。
所以m1一定大于m2。
答案 A4.(2011·西安二模)下列有关NaHCO3和Na2CO3性质的比较中,正确的是()。
A.热稳定性:Na2CO3<NaHCO3B.常温时在水中的溶解度:Na2CO3<NaHCO3C.等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多解析NaHCO3不稳定,受热分解;常温时在水中的溶解度为Na2CO3>NaHCO3;等物质的量的NaHCO3和Na2CO3分别与足量的稀盐酸反应,产生的CO2一样多。
答案 C5.将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中,充分反应后,其结果是()。
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变B.往溶液中滴入无色KSCN溶液,显红色C.Fe2+和Fe3+的物质的量之比为5∶1D.氧化产物与还原产物的物质的量之比为2∶5解析n(Fe)=1.12 g56 g·mol-1=0.02 mol,n(Fe3+)=25 mL×2 mol·L-11 000 mL·L-1=0.05 mol,由反应:Fe+2Fe3+===3Fe2+可知Fe3+过量,加入KSCN显红色。
溶液中n(Fe2+)=3n(Fe)=0.06 mol,溶液中n(Fe3+)=0.05 mol-2n(Fe)=0.01 mol,氧化产物与还原产物物质的量之比为1∶2。
答案 B6.(2011·北京)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是()。
A.取a g混合物充分加热,减重b gB.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体解析C项混合物与硫酸反应的产物被碱石灰吸收的不仅是二氧化碳,还有水蒸气,所以无法准确的计算。
其他几个选项的方法都可以通过计算得出结果。
答案 C7.(2011·鞍山调研)铝、铍(Be)及其化合物具有相似的化学性质。
已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是()。
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeOB.BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物可能是BeCl2C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液D.BeCl2水溶液的导电性强,故BeCl2是离子化合物解析蒸干并灼烧Na2BeO2溶液后得到的残留物为Na2BeO2;BeCl2是强酸弱碱盐,其溶液pH<7,蒸干并灼烧该溶液可得到BeO;Be(OH)2和Al(OH)3性质相似,BeCl2和AlCl3均是共价化合物。
答案 C8.浓度是影响反应能否发生的因素之一。
下列说法符合事实的是()。
A.常温下,铝片可以溶解于足量浓硫酸,也可溶解于足量稀硫酸B.常温下,铜片与浓硝酸反应,不与稀硝酸反应C.常温下,浓的氢氧化钠溶液和极稀的氢氧化钠溶液均能溶解Al(OH)3D.常温下,锌与浓硫酸和稀硫酸都能反应,但生成的气体不同解析常温下,铝在冷的浓硫酸中发生钝化;常温下,铜既能与浓硝酸反应,也能与稀硝酸反应;Al(OH)3只能溶于强碱,极稀的NaOH溶液不能溶解Al(OH)3;锌与浓硫酸反应生成的气体是SO2,与稀硫酸反应生成的气体是H2。
答案 D二、非选择题(共4小题,28分)9.(5分)A为两种固体的混合物,G和I为溶液D的组成成分,E为红褐色沉淀,J为淡黄色固体。
反应所加的试剂均足量。
(1)混合物A一定含有的元素为(写元素符号)________;(2)溶液F一定含有的阴离子为(写离子符号)________;(3)写出B+G―→J的化学方程式:____________________,写出溶液C―→溶液D的离子方程式:___________________________________________________;(4)溶液Ⅰ中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示):________________________________________________________________。
解析E为红褐色沉淀,推测应为氢氧化铁。
J是淡黄色固体,可能为过氧化钠或硫,但是在溶液中生成的淡黄色固体不可能是过氧化钠,应为硫。
D溶液中加入过量氢氧化钠有沉淀生成,向所生成的溶液F中通入二氧化碳生成沉淀H,加入盐酸后沉淀H溶解,根据这条线索可以分析有氢氧化铝生成。
根据原子守恒可推测A中含有Fe、Al、S三种元素,B为硫化氢气体,有了这些信息,就可以解决该题中的问题。
答案(1)Fe、Al、S(2)Cl-、OH-、AlO-2(3)H2S+2FeCl3===2FeCl2+S↓+2HCl 2Fe2++Cl2===2Fe3++2Cl-(4)Al3++3H2O Al(OH)3+3H+10.(5分)(2010·全国理综Ⅰ,28)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。
纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。
现进行如下实验:①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A 时,D中沉淀无变化;F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):_________________________________________________________________;(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
解析(1)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(Ⅱ)由题干和①步操作可知A为氨水;(Ⅲ)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O===AgOH↓+NH+4;AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(Ⅳ)由③步操作可知B中阴离子应为CO2-3,由于此无色无味的气体只能是CO2,B、C、D中能生成沉淀说明不能是HCO-3,而阳离子可能是常见的K+、Na+、NH+4等待定;(Ⅴ)同样②步操作D中能与氨水生成沉淀的无色溶液中常见的阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(Ⅵ)由④步操作生成的沉淀可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中常用试剂,则沉淀应为AgCl和BaSO4,其不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-,即C为BaCl2,进而推出D中阴离子应该为SO2-4,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4;其他解析可见答案。