常见的金属材料(第二课时
- 格式:ppt
- 大小:2.94 MB
- 文档页数:17


授课日期:课型:新授课题:9.1常见的金属材料(第二课时)学习目标:1、了解重要的铁矿石2、知道炼铁的原理3、了解还原反应知识点(含重点、难点):重点:炼铁的原理2、难点:炼铁的原理及还原反应板书设计:金属矿物及其冶炼一、常见的矿物二、工业炼铁铝矿: 1、反应原理铝土矿、钾长石、明矾 2、装置铁矿: 3、实验现象赤铁矿、磁铁矿、菱铁矿、黄铁矿 4、注意事项师生互动活动意图【创设情境】:【师】展示图片:【生】观察,回答自然界中的铁大多以什么形式存在?说明铁有什么性质?我们生产、生活中使用的铁及其通过地图意识到铁在自然界的存在形式结合实际生活,自然引题合金是如何得到的呢?引出课题:金属的冶炼 【师】展示常见的矿物图片【自主学习】【生】观察图片信息,阅读教材P59页,思考讨论如何从铁矿石中获得铁单质?CO 与Fe2O3反应的原理和步骤是什么?如何检验反应后的产物?用实验来说明 【分组实验】各小组按照下图装置及步骤进行实验并观察现象,同时思考并解决以下几个问题:步骤:1、通CO ;2、点燃处理尾气的酒精灯;3、点燃加热Fe2O3的酒精灯;4、停止加热Fe2O3;5、停止通CO 6、熄灭点燃尾气的酒精灯。
【问题】1、实验现象:【生】红色变黑色,石灰水变浑浊 2、如何判断反应中生成了铁? 【生】:用磁铁3、装置中右边的酒精灯起什么作用?通过图片了解如何选用矿石炼铁小组合作探究交流讨论: 按照实验步骤进行实验得出炼铁原理石灰水Fe 2O 3CO Fe迟到早退赤铁矿Fe 2O 3 70% 磁铁矿Fe 3O 4 72%菱铁矿FeCO 348% 黄铁矿FeS 2 56% A4、根据实验现象,你得出的结论是什么【生】氧化铁与一氧化碳在高温条件下发生反应生成铁和二氧化碳。
5、你能写出反应的化学方程式吗?Fe2O3+3CO高温2Fe+3CO2我们就是利用这一原理从铁矿石中获取金属铁的【师】总结讲解通CO目的:排尽装置内的空气,防止加热CO和空气的混合气体引起爆炸(排尽空气防爆炸)注意:酒精灯B的作用:处理尾气,防止CO污染大气现象:红棕色的物质变为黑色;澄清的石灰水变浑浊。



常见金属材料(第二课时)知识准备:1、大多数金属都具有,较大,熔点、沸点,具有良好的和。
除汞外,金属在常温下都是。
(填状态)2、地壳中含量最高的金属元素;导电性能最好的金属;硬度最高的金属是;熔点最高的金属;展性最好的金属;延性最好的金属。
教学过程:(引入新课)今天,妈妈到百货公司,为小丽买了一把“超轻雨伞”。
这把细小的雨伞,外表和小丽的钢骨雨伞一模一样,可是却轻巧多了!你知道小丽的新雨伞是用什么材料制造的吗?妈妈新买的“超轻雨伞”是用铝的合金制造的。
由于铝合金的密度远比钢为低,所以新买的合金雨伞较钢骨雨伞轻巧。
也由于铝合金的坚韧度比铝强,所以铝合金较适合作为雨伞的骨架。
思考1:小丽用的铝合金雨伞与钢骨雨伞相比有何优点?思考2:你觉得合金的性质与组成它们的金属相同吗?举例说明思考题答案:1.若用纯金做装饰品,因其太软而易变形;若做项链,则接口处容易脱钩。
2.铝合金雨伞比钢骨雨伞轻,携带便利。
3.合金的性质与组成它们的金属不同。
如金的合金比纯金硬度大,铝的合金比纯铝的坚硬[新课引入]上述资料告诉我们,要满足各种不同的需要,仅用纯金属是不够的。
为此,人们在生产实践中制造出了许许多多的具有特殊性能的“新型金属材料”——合金。
[板书]二、合金[设疑]那么什么是合金?合金的性质与其组分金属有何不同?合金的应用范围怎样?我们常用的合金有哪些?哪些合金最有前途?这就是我们本节课所要探讨的内容。
[设问]我们应该怎样定义合金?谈谈你的看法。
[学生发言]1.合金是不纯的金属。
2.合金是掺有其他金属的金属。
3. 两种或两种以上的金属融合在一起形成的金属材料。
[教师评价]大家善于思考,善于发言,体现了大家强烈的求知欲,希望大家继续发扬这种精神![过渡]那么,合金究竟指的什么呢?[讲解并板书]1. 其他金属(或非金属)熔合形成的有金属特性的物质。
[介绍]如我们熟知的钢铁就是一种合金。
它实际上是含有少量碳及其他金属的铁,与纯铁相比,钢有许多优良的性能、用处非常大。


第四单元第一节常见的金属材料(第二课时)学案【温故知新】(课前完成)1、我们把物质与__________发生的反应叫做氧化反应。
2、写出下列反应的化学方程式:碳在空气中充分燃烧:____________________________CO在空气中燃烧的化学方程式为:_____________________。
高温下,二氧化碳与炽热的碳反应:____________________________________3、可燃性气体在使用前必须验纯,否则与空气混合容易发生__________。
4、少数很不活泼的金属(如金、银、铂等)在自然界中以__________形式存在,其余金属都以_____________的形式存在。
5、铁元素在自然界中以___________的形式存在,常见的铁矿石有___________、__________、_____________和______________等,他们的主要成分分别是____________、____________、_____________和_______________。
6、工业炼铁的原理是氧化铁和__________在________条件下发生反应,生成___________和________。
该反应的化学方程式为_________________________。
7、____________________________________________叫做还原反应。
把夺取氧的物质叫做___________剂。
8、工业上采用__________法冶炼铝,发生反应的化学方程式为______________。
【合作探究】活动一:选择哪些铁矿石作为炼铁的原料?你选择的依据是什么?活动二:从生成物的检验和环保的角度考虑,这套还缺少什么装置?(注:CO 气体有毒,具有可燃性,实验时一定要注意安全)反思提高:1、实验装置中的酒精喷灯和酒精灯分别起到什么作用?2、实验开始时,要先通一会儿CO 后再点燃酒精喷灯,为什么?3、实验结束时,应先撤酒精喷灯,继续通CO至玻璃管冷却,为什么?活动三:完成下列反应的化学方程式一氧化碳与氧化铁反应___________________________。



第2课时金属矿物及其冶炼1.知识与技能(1)知道一些常见的金属(铁)等矿物,了解从铁矿石中将铁还原出来的方法。
(2)认识还原反应及物质的还原性。
(3)会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
2..过程与方法通过收集材料、查阅资料、讨论交流等具体探究活动培养学生的良好学习习惯和学习方法。
3.情感、态度与价值观增强热爱祖国的情感,树立为民族振兴、社会进步学习化学的志向,使学生体会学习化学的价值;保持和增强对生活中化学现象的好奇心和探究欲,培养学习化学的兴趣,树立珍惜资源、爱护环境、合理使用化学物质的观念。
【教学重点】常见铁矿石中提炼铁的原理。
【教学难点】“一氧化碳与氧化铁反应”的实验。
【教学准备】(1)金属矿物样品。
(2)仪器:铁架台、硬质玻璃管、单孔橡皮塞、酒精灯、试管、酒精喷灯、双孔橡皮塞、导气管。
(3)药品:氧化铁粉末、澄清石灰水、一氧化碳气体。
一、导入新课你知道哪些与钢铁有关的成语?“恨铁不成钢”,对铁而言,钢具有哪些更优良的性能?“百炼成钢”,为什么生铁百炼可以成钢?那么,你知道“钢铁是怎样炼成的”吗?二、推进新课活动1:知道一些常见的金属矿物【引入】或许你已经知道一些金属矿物,如果你是炼铁厂的厂长,你会选择哪种铁矿石?【板书】三、金属矿物及其冶炼1.金属矿物【投影】几种金属的矿石标本1.观察几种金属的矿石标本,了解矿石的主要成分。
2.几种常见的金属矿物。
【讲解】地球上的金属资源广泛存在于地壳和海洋中,除金、银等少数很不活泼的金属有单质形式存在外,其余都以化合物的形式存在。
【学生活动】几种常见的金属矿物的名称和主要成分。
见下表。
活动2:了解铁的冶炼方法【过渡】现在,人类每年都要向地壳和海洋索取大量的金属矿物资源,以提取数以吨计的金属。
其中,提取量最大的是铁。
把金属矿物变成金属的过程,叫做金属的冶炼。
炼铁的过程称之为铁的冶炼。
下面,我们就来学习有关铁的冶炼的知识。
【板书】2.铁的冶炼【介绍】早在春秋战国时期,我国就开始生产和使用铁器,从公元1世纪起,铁便成了一种最主要的金属材料。


《常见的金属材料》第二课时学案学习目标:1.知道一些常见金属(铁、铝等)矿物,了解从铁矿石中将铁还原出来的方法。
2.掌握含杂质的化学方程式的计算方法。
3.在理论知识的基础上,加以拓展和提高。
重点难点:有关化学方程式的计算中的含杂质问题的计算课前准备:1.从课本64-65页找到炼铁的原料、设备、及原理。
炼铁的原料:、、。
各种原料的用途?设备:,炼铁的主要反应原理:在条件下,用从含铁的矿石中将铁还原出来,常见的铁矿石有(填主要成分):赤铁矿,磁铁矿,菱铁矿等。
2.还原反应:化学上把中的被夺去的反应叫做。
3.某炼铁厂要炼铁1000t,需氧化铁多少吨?4.某生铁中含铁96%,多少吨生铁中含1000吨铁?探究学习:探究64页“活动天地”3---2,回答问题:1实验步骤:①实验前先通入一氧化碳后加热的原因是,实验后先撤酒精灯后停通一氧化碳的原因是________ ______ _ 。
②尾气处理办法。
2该实验的现象?如何判断反应中生成了什么物质?3写出CO还原Fe2O3的化学方程式,并指出氧化剂、还原剂,谁被氧化?谁被还原?4将下列不纯物质的质量转换成纯物质的质量。
(1)含Fe2O380%的赤铁矿200千克,其中含Fe2O3______千克。
(2)含杂质5%的石灰石100千克,其中含CaCO3______千克。
5赤铁矿能用于炼铁的主要成分是Fe2O3其余都是杂质,某地生产赤铁矿含杂质35%,问500t矿石中含杂质多少t?能用于炼铁的Fe2O3成分占多少t?交流共享:1炼铁的过程中,共发生了哪些化学反应?写出化学方程式。
2由一氧化碳还原氧化铁的实验装置,总结交流此类实验的步骤,注意事项。
达标测试:1.工业上大量冶炼金属常用到的一种氧化物还原剂是()A.二氧化碳 B.二氧化硫 C.一氧化碳 D.一氧化氮2.下列化合物中铁元素的质量分数最大的是()A.FeO B.Fe2O3 C.FeCO3 D.Fe3O43.(2008年眉山市)金属材料在人类活动中已得到越来越广泛的应用。

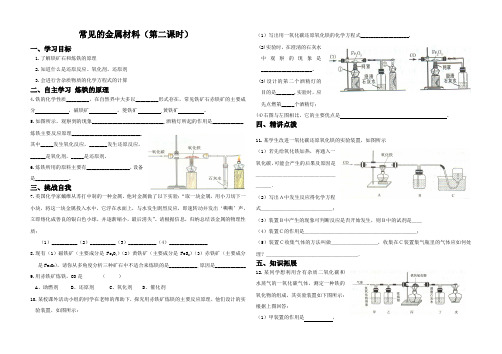
常见的金属材料(第二课时)一、学习目标1.了解铁矿石和炼铁的原理2.知道什么是还原反应、氧化剂、还原剂3.会进行含杂质物质的化学方程式的计算二、自主学习炼铁的原理4.铁的化学性质_________,在自然界中大多以_________形式存在,常见铁矿石赤铁矿的主要成分,磁铁矿,菱铁矿 ,黄铁矿。
5.如图所示,观察到的现象____________________________,酒精灯所起的作用是____________,炼铁主要反应原理___________________________,其中_____发生氧化反应,_______发生还原反应,______是氧化剂,_____是还原剂。
6.炼铁所用的原料主要有_________________,设备是_____________。
三、挑战自我7.英国化学家戴维从苏打中制的一种金属,他对金属做了以下实验:“取一块金属,用小刀切下一小块,将这一块金属投入水中,它浮在水面上,与水发生剧烈反应,即速转动并发出‘嘶嘶’声,立即熔化成善良的银白色小球,并逐渐缩小,最后消失”。
请根据信息,归纳总结该金属的物理性质:(1)__________(2)__________(3)___________(4)_______________8.现有(1)磁铁矿(主要成分是Fe3O4)(2)黄铁矿(主要成分是FeS2)(3)赤铁矿(主要成分是Fe2O3),请你从多角度分析三种矿石中不适合来炼铁的是___________,原因是____________9.用赤铁矿炼铁,CO是()A、助燃剂B、还原剂C、氧化剂D、催化剂10.某校课外活动小组的同学在老师的帮助下,探究用赤铁矿炼铁的主要反应原理,他们设计的实验装置,如图所示:(1)写出用一氧化碳还原氧化铁的化学方程式___________________.(2)实验时,在澄清的石灰水中观察的现象是____________________。


