电解原理及其应用PPT课件
- 格式:ppt
- 大小:1.30 MB
- 文档页数:35


电解池的工作原理及其应用电解池是一种利用电能使物质发生氧化还原反应并进行化学反应的装置。
它是由两个电极(阳极和阴极)和一个电解质溶液组成的。
电解质溶液通常包含可与阳离子和阴离子发生氧化还原反应的溶质。
当外部电源连接到电解池时,阳极被连接到正极,阴极被连接到负极。
在电解质溶液中,阳极会引发氧化反应,而阴极会引发还原反应。
阳极通常是一个负极性电极,它吸引阴离子,并在电解质溶液中引发氧化反应。
在氧化反应中,阴离子丧失电子,并以根据其性质而定的气体或溶液的形式释放出来。
例如,当氯化钠溶解在水中时,阳极上的氧化反应是氯离子的氧化,生成氯气气体。
阴极通常是一个正极性电极,它吸引阳离子,并在电解质溶液中引发还原反应。
在还原反应中,阳离子获取电子,并以根据其性质而定的固体、液体或气体的形式沉积下来。
例如,当铜(II)离子溶解在水中时,阴极上的还原反应是铜离子的还原,生成固体的铜金属。
电解质溶液中的阳极和阴极之间的电流通过外部电源提供的能量驱动。
在这个过程中,化学能被转化为电能。
电解质溶液中的离子传输速率和电流密度直接关系到具体化学反应的速率和效率。
电解池在许多领域中都有广泛的应用。
以下是一些常见的应用:1.金属电镀:电镀是在金属表面上涂覆一个金属层,以增加耐腐蚀性、装饰性或其他特定性能。
电解池可用于将金属阳离子溶液中的金属还原到金属固体上,形成金属电镀。
2.脱盐:在海水淡化过程中,电解池被用来去除盐分,以将海水转化为淡水。
海水中的钠离子和氯离子在阳极和阴极上发生离子交换反应,从而使海水中的盐分浓度降低。
3.电解制氢:电解池可以通过水的电解来制取氢气。
在电解过程中,水分解为氢气和氧气,氢气从阴极释放。
4.锂离子电池:锂离子电池被广泛应用于移动电子设备、电动车和储能系统中。
在充电过程中,锂离子从阳极(通常是石墨)迁移到阴极(通常是金属氧化物),在放电过程中则进行反向迁移。
这种迁移过程是通过电解池实现的。
5.电解氯碱法:电解池可以用于生产氯气、氢气和碱性溶液。

高三化学一轮复习精品教辅第26讲:电解原理及其应用【考纲要求】1. 判断某装置是否是电解池。
2. 理解电解原理、书写电解池工作时的电极反应式。
掌握电解前后溶液浓度和pH的变化。
3. 了解铜的电解精炼和电镀装置及原理。
4. 了解氯碱工业的反应原理。
5. 掌握有关电解的计算。
教与学方案一.电解1.定义。
2.电极判断:阳极相连,发生反应。
阴极相连,发生反应。
必记知识点:水中阴阳离子放电顺序阳极放电顺序:金属> S2-> I-> Br-> Cl-> OH->含氧酸根阴极得电子顺序:Ag+>Hg2+>Fe3+ (Fe3+ +e- = Fe2+) >Cu2+>H+>Pb2+>Sn2+>Fe2+> Zn2+> Al3+>Mg2+>Na+>Ca2+>K+2、原电池与电解池的比较二、电解原理的应用1.氯碱工业(电解饱和食盐水)⑴电解过程中,与电源正极相连电极上所发生的化学方程式为,与电源负极相连的电极附近,溶液的pH⑵工业食盐含Ca 2+、Mg2+等杂质。
精制过程发生反应的离子方程式为:__________。
⑶如果粗盐中SO42-含量较高,必须添加钡试剂除去它,该钡试剂可以是a、Ba(OH)2b、Ba(NO3)2c、BaCl2⑷脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl⑸若采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为。
2.电镀:利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程镀件必须作极. 镀层金属必须作极.电解质溶液中必须含有金属离子。
【例2】若要在铜片上镀银,下列说法错误的是()①将铜片接电源正极②将银片接在电源正极③在铜片上:Ag++e-=Ag④在银片上发生的反应是4OH—4e-=O2+2H2O⑤可用CuSO4溶液作电解质溶液⑥可用AgNO3溶液作电解质溶液3.电解精炼(电解精炼铜为例)阳极:阴极:【思考】电解过程中CuSO4溶液浓度如何变化?4.电解法冶炼金属(Al和Na)【例3】如图装置中,(1)当A键断开,B、C闭合时,甲为池,乙为池;(2)当A、C两键断开时,乙中铁极增重1.6g,则被氧化的铁有g;(3)将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键,闭合A键,则甲为池,乙为池,当甲中锌极减轻6.5g时,乙中共放出气体mL(标况)。


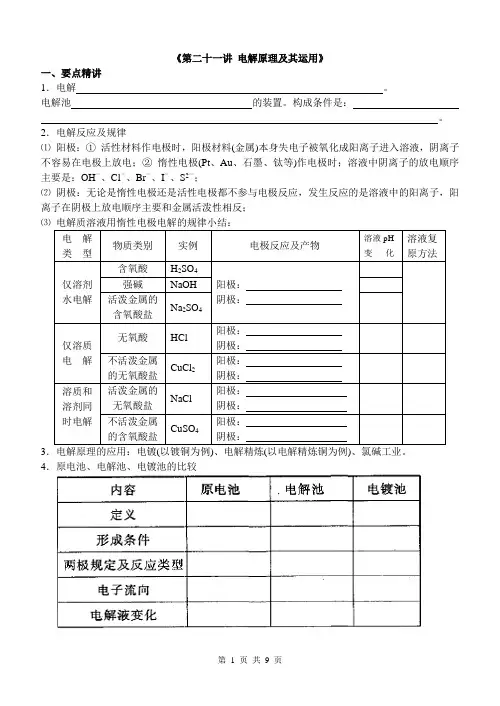
《第二十一讲电解原理及其运用》一、要点精讲1.电解。
电解池的装置。
构成条件是:。
2.电解反应及规律⑴阳极:①活性材料作电极时,阳极材料(金属)本身失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电;②惰性电极(Pt、Au、石墨、钛等)作电极时;溶液中阴离子的放电顺序主要是:OH-、Cl-、Br-、I-、S2-;⑵阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子,阳离子在阴极上放电顺序主要和金属活泼性相反;⑶34.原电池、电解池、电镀池的比较二、典型例题【例1】用惰性电极实现电解,下列说法正确的是A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1【例2】如图所示,通电后,A极上析出Ag,对该装置的有关叙述中正确的是A.P是电源的正极B.F极上发生的反应为4OH――4e-=2H2O+O2↑C.电解时,甲、乙、丙三池中,除了E、F两极外,其他电极均参加了反应D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变【例3】如下图所示,若电解5min时铜电极质量增加2.16g,试回答:⑴电源电极X名称为_______。
⑵变化:A________,B_________, C_________。
⑶通电5min时,B中共收集224mL气体(标况),溶液体积为200mL。
(设电解前后无体积变化)则通电前CuSO4溶液的物质的量浓度为__________。
⑷若A中KCl溶液的体积也是200mL,电解后,溶液的pH是___________(设前后体积无变化)。
【例4】.电解原理在化学工业中有广泛应用。
右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:(04福浙理综)(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为。



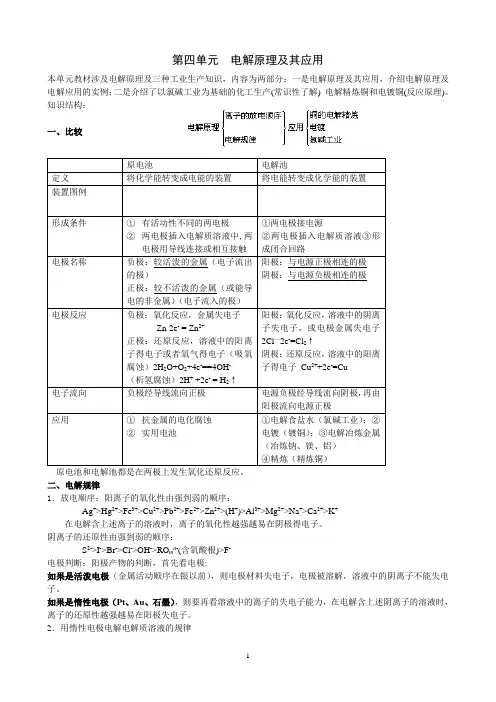
第四单元 电解原理及其应用本单元教材涉及电解原理及三种工业生产知识,内容为两部分:一是电解原理及其应用,介绍电解原理及电解应用的实例;二是介绍了以氯碱工业为基础的化工生产(常识性了解) 电解精炼铜和电镀铜(反应原理)。
知识结构:一、比较原电池和电解池都是在两极上发生氧化还原反应。
二、电解规律1.放电顺序:阳离子的氧化性由强到弱的顺序:Ag +>Hg 2+>Fe 3+>Cu 2+>Pb 2+>Fe 2+>Zn 2+>(H +)>Al 3+>Mg 2+>Na +>Ca 2+>K + 在电解含上述离子的溶液时,离子的氧化性越强越易在阴极得电子。
阴离子的还原性由强到弱的顺序:S 2->I ->Br ->Cl ->OH ->RO m n -(含氧酸根)>F -电极判断:阳极产物的判断,首先看电极: 如果是活泼电极(金属活动顺序在银以前),则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。
如果是惰性电极(Pt 、Au 、石墨),则要再看溶液中的离子的失电子能力,在电解含上述阴离子的溶液时,离子的还原性越强越易在阳极失电子。
2.用惰性电极电解电解质溶液的规律三.电解池、电镀池、电解精炼池的比较三池的原理都是电解四.氯碱工业1.反应原理设备:离子交换膜电解槽;阳极:钛网,阴极:碳钢网;离子交换膜:将电解槽阳极室与阴极室隔开。
原料:饱和食盐水。
电极反应:阳极(放电顺序:Cl->OH-):2 Cl--2e-=Cl2↑阴极(放电顺序:H+>Na+):2H++2e-=H2↑。
总反应式:2NaCl+2H2O==2NaOH+ H2↑+ Cl2↑2.食盐水的精制(1)食盐水的成分:泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,它们的存在会影响电解的顺利进行,也会影响到电解产物的质量,因此必须对食盐水进行精制。

第十一章电化学第一节、原电池原理及其应用以锌铜原电池为例,变换电极和电解质溶液(包括电解液把它换成AgNO3和CuNO3的混合溶液)。
正极变成石墨、铁等,电解质溶液变成酸或碱,同时,研究一下镁铝电极分别在酸碱条件下的原电池反应。
正极产物的判断,阳离子的放电顺序为Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+)。
一、原电池原理1.概念:将化学能转化为电能的装置2.本质氧化还原反应中还原剂失去电子经过导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
3.构成条件1)具有两个活泼性不同的金属电极(或一端是导电的非金属电极)。
2)具有电解质溶液3)形成闭合回路4)自发进行的氧化还原4.原电池的两极1)负极:一般是活泼性较强的金属,失去电子,发生氧化反应。
2)正极:活泼性较弱的金属或能导电的非金属,阳离子在该电极上得到电子,发生还原反应。
5.原电池电极的判断方法a)由组成原电池两极的电极材料判断。
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
b)根据电流方向或电子流动方向判断。
电流是由正极流向负极,电子流动方向是负极流向正极。
c)根据原电池里电解质溶液内离子的定向流动方向判断。
在原电池的电解质溶液内,阳离子移向的极是正极,阴离子移向的极是负极。
d)根据与原电池两极发生的变化来判断。
原电池的负极总是是电子发生氧化反应,其正极总是得电子发生还原反应。
e)根据现象判断。
溶解的一级为负极,增重或有气泡发出的一级为正极。
6.原电池电极反应式的书写技巧a)先确定原电池的正、负极,列出正、负极上的反应物质,正、负极得失电子数相等。
b)若负极反应生成的阳离子与电解质溶液中的阴离子不能共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上反应物是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,O2生成OH-;若电解质溶液也为酸性,则H+必须写入正极反应式中,O2生成H2O。