《质量风险管理》word版
- 格式:docx
- 大小:36.62 KB
- 文档页数:5

企业风险管理体系的构建第1步确立董事会在企业风险管理整体框架构建中的核心地位。
董事会应该组建风险管理专业委员会,专门负责企业全面风险管理工作。
树立风险管理的共同理念,正确对待风险,创立一种风险评估及激励机制,促进全体人员共同参与企业的管理活动,不断提高风险管理水平。
第2步增加机构设置,组建风险管理小组。
小组成员应具有较高的文化素质和道德修养,具有风险识别的能力,反应灵敏,严谨细致.应为企业高层管理人员提供参加企业风险管理师的培训和认证机会,通过专业而系统的学习提高管理层的素质,增强企业风险管理意识。
第3步风险管理信息系统的建立。
要想减轻风险就要减小不确定性发生的可能。
不确定性的实质就是一种信息不完全状态,这种信息包括企业自身风险与风险管理的政策信息等,是一种全方位、立体化的信息网络。
建立有效的企业风险管理信息系统是降低风险的基本途径.第4步建立全面风险评估体系,这是企业风险管理整体框架体系的核心。
风险评估先采取工作分解结构和问卷调查等方法,识别不确定风险因素,再利用层次分析、模糊数学和故障树等分析方法建立评估模型,综合分析其风险水平,掌握影响企业的关键性风险因素,提出应对方法.第5步营造风险管理的文化氛围,实施全员、全面风险管理.在企业内部环境和外部环境SWOT矩阵分析的基础上,将企业的战略思想、全生命周期的各个阶段、全体员工、风险管理技术和手段进行整合,不断提高企业全面风险管理的水平,构建适当的体系以实施既定的风险战略和政策。
第6步大力培养具有较高专业素养的风险管理人才。
这是有效实施风险管理的关键。
其一,有条件的高校应在相关专业开设风险管理有关课程。
其二,应大力加强项目管理证书论证工作,培养一支职业化的风险管理人才队伍。
其三,应重视风险管理人员的在职培训,以积累丰富的风险管理经验。
第7步变革现行风险管理体系,重组风险管理审批机制,实现“帕累托改进”.运用市场机制,有效配置审批资源和信贷项目资源,压缩风险审批管理过多的环节,建立风险管理的多元化审批机制,从而提高项目风险审批的效率,从体制上降低企业风险。

质量手册QUALITY MANUAL(依据GB/T19001-2015 idt ISO9001:2015标准)文件编号:QM01--2018受控状态:发布日期:2018年1月12日实施日期:2018年1月12日总目录0批准令0.1发布令0.2任命书1范围2引用标准和术语2.1引用标准2.2通用术语和定义2.3专用术语3概况3.1公司概况3.2手册管理4 公司的背景4.1 理解公司及其背景4.2 理解相关方的需求和期望4.3 质量管理体系范围的确定4.4 质量管理体系及其过程5 领导作用5.1 领导作用和承诺5.2 质量方针5.3 公司的角色、职责和权限6 策划6.1 风险和机遇的应对措施6.2 质量目标及其实施的策划6.3 变更的策划7 支持7.1 资源7.2 能力7.3 意识7.4 沟通7.5 形成文件的信息8 运行8.1 运行的策划和控制8.2产品和服务的要求8.3 产品和服务的设计和开发8.4 外部提供过程、产品和服务的控制8.5 生产和服务的提供8.6 产品和服务放行8.7 不合格输出的控制9 绩效评价9.1 监视、测量、分析和评价9.2 内部审核9.3 管理评审10 持续改进10.1 总则10.2不合格和纠正措施10.2 持续改进11 附录:附录1:生产工艺流程图0 批准令0.1发布令为规范公司行为,保证产品质量满足顾客和法定要求,提高公司信誉和产品竞争能力,增强顾客满意,公司建立了系统化、文件化的质量管理体系。
该体系符合GB/T19001-2015 idt ISO9001:2015标准的要求,编制了《质量手册》,规定了质量管理体系的组织结构、管理职责和质量管理体系过程的控制要求。
根据公司发展和管理提升的需要,结合2015版标准等要求,经领导层决策,发布本《质量手册》。
《质量手册》阐述了我公司新阶段的质量方针和质量目标,是实施、保持公司质量管理体系的纲领性文件和进行质量管理的公司法规,也是向顾客提供质量保证的证实文件,并作为第三方质量管理体系认证的依据,要求全体员工必须严格贯彻执行。

药品质量风险管理制度1、目的:通过运用质量风险管理的方法,正确识别质量风险、评估质量风险,科学控制质量风险,降低质量风险危害程度,确保所经营药品的质量。
2、定义:质量风险管理是对药品的整个流通供应链进行质量风险的识别、评估、控制、沟通和审核的系统过程,运用时可采用前瞻或回顾的方式。
3、适用:适用于药品经营过程中质量风险管理。
4、职责:质量管理部负责组织药品质量风险的评估、沟通、审核等工作,总经理、质量负责人、各部门负责人负责相关的质量风险管理工作。
5、内容:5.1、企业应当采用前瞻或者回顾的方式,对药品流通中的质量风险进行风险评价、风险控制、风险沟通、和风险审核。
5.1.1、前瞻方式:对经排查发现的风险点但尚未发生质量事故或事件(预期风险),应采取风险控制措施和预防措施;5.1.2、回顾方式:对已经发生的质量事故或事件(风险已发生,并已控制)采取的防止再次发生的改进控制措施;5.2、企业可以采用事件性定性评估为主,数据分析定量评估为辅的方式,用“高”“中”“低”三个等级评估风险的等级。
5.2.1、企业应对自身药品经营活动过程中可能发生质量风险进行排查和分类,分析经营过程中每一环节所面临的质量风险,对这些质量风险的性质、等级进行评估;5.2.2、药品质量风险的关键影响因素有:企业负责人的质量风险意识、组织机构、人员配置、管理制度和职责的制定、仓储设施和管理条件、过程管理(采购、收货、验收、储存养护、销售、出库、运输、售后服务)等,应对这些关键因素进行风险识别,对不同的风险提出切实可行的防控措施,制定预案。
5.2.3、药品风险属性的分类:药品风险的性质按来源可分为人为因素引起的风险和药品本身因素造成的风险。
5.2.3.1、人为因素可导致假劣药经营、药品质量问题、标识缺陷和包装质量问题、用药差错问题等,多属于可控制风险。
5.2.3.2、药品本身属性因素包括药品已知风险和未知风险。
已知风险包括药品已知的不良反应和已知药物的相互作用等,属于可控制风险;药品的未知风险包括未知的药品不良反应,非临床适应症患者使用,未试验人群的应用等,多属于不可控风险。

(完整word版)风险管理方案风险管理方案1. 引言风险是指不确定性因素对项目或组织目标的可能产生的负面影响。
为了有效管理风险并减少其对项目或组织的影响,制定一个全面的风险管理方案是至关重要的。
本文档旨在提供一个风险管理方案的框架,以帮助组织识别、评估和控制风险,确保项目的成功实施和组织目标的达成。
2. 风险管理流程风险管理是一个持续的过程,它包括以下几个关键步骤:2.1 风险识别风险识别是确定和记录项目或组织可能面临的风险的过程。
通过与相关方进行讨论、收集经验教训、分析历史数据等方法,识别潜在的风险因素。
风险识别的输出是一个风险清单,其中包含已识别的风险及其描述。
2.2 风险评估风险评估是对已识别的风险进行定量或定性评估的过程。
根据风险的概率和影响程度,确定其优先级,并为每个风险分配一个风险等级。
风险评估的输出是一个风险矩阵,其中风险按照其优先级进行排序。
2.3 风险控制风险控制是采取相应措施以减少风险的概率、影响程度或接受风险的决策过程。
通过制定适当的控制策略、实施风险控制措施,并制定应急预案等手段,降低风险对项目或组织的影响。
2.4 风险监控风险监控是持续监督和评估已识别风险的实施效果的过程。
定期检查风险的状态和进展,识别新风险的出现,并对控制措施进行调整和优化。
风险监控的结果是更新风险清单和风险矩阵,以反映实际情况。
3. 风险管理工具为了支持风险管理流程的实施,可以使用以下工具:- 风险登记表:用于记录已识别的风险及其描述、优先级等信息。
风险登记表:用于记录已识别的风险及其描述、优先级等信息。
- 风险矩阵模板:用于根据风险的概率和影响程度,确定其优先级和风险等级。
风险矩阵模板:用于根据风险的概率和影响程度,确定其优先级和风险等级。
- 风险控制措施清单:用于记录已制定的风险控制策略和相应的实施措施。
风险控制措施清单:用于记录已制定的风险控制策略和相应的实施措施。
- 风险监控表格:用于跟踪和评估已识别风险的状态和进展情况。

新版GSP认证零售药店需要哪些记录表格?一、质量管理体系文件1 文件发放回收记录……………………………… ZD—WJ—01—012 文件变更履历表………………………………… ZD—WJ—01—023 文件销毁申请单………………………………… ZD—WJ—01—034 文件销毁记录…………………………………… ZD—WJ—01—045 文件制作申请单………………………………… GC—WJ—02—016 文件会审单……………………………………… GC—WJ—02—02二、质量管理7 质量信息处理审批单…………………………… ZD—ZG—03—018 质量信息汇总表………………………………… ZD—ZG—03—029 现场调查记录…………………………………… ZD—ZG—04—0110 质量事故报告…………………………………… ZD—ZG—04—0211 质量查询函……………………………………… ZD—ZG—05—0112 质量查询及处理记录…………………………… ZD—ZG—05—0213 药品不良反应报告表…………………………… ZD—ZG—06—0114 归档资料凭单…………………………………… ZD—ZG—08—0115 档案资料借阅登记簿…………………………… ZD—ZG—08—0216 档案资料销毁审批表…………………………… ZD—ZG—08—0317 档案资料销毁记录……………………………… ZD—ZG—08—0418 质量制度检查考核记录………………………… ZD—ZG—09—0119 供货单位质量管理体系评价表………………… ZD—ZG—10—0120 供货单位质量管理体系评价报告表…………… ZD—ZG—10—0221 购货单位质量管理体系评价表(生产、经营) ZD—ZG—11—0122 购货单位质量管理体系评价表(医疗机构)… ZD—ZG—11—0223 药品质量评审计划…………………………… ZD—ZG—12—01 序号记录名称记录编号24 药品购进情况质量评审表……………………… ZD—ZG—12—0225 药品质量评审报告……………………………… ZD—ZG—12—0326 质量管理体系内部审核计划………………………GC—ZG—01—0127 质量管理体系内部审核实施方案……………… GC—ZG—01—0228 质量管理体系内部审核检查表……………………GC—ZG—01—0329 纠正/预防措施跟踪记录表………………………GC—ZG—01—0430 质量管理体系内部审核会议记录…………………GC—ZG—01—0531 质量管理体系内部审核报告………………………GC—ZG—01—0632 参加会议人员签到表………………………………GC—ZG—01—0733 公司质量方针、目标实施情况检查表……………GC—ZG—02—0134 部门质量方针、目标实施情况自查表……………GC—ZG—02—0235 质量方针、目标实施情况评价汇总表……………GC—ZG—02—0336 质量投诉调查处理记录……………………………GC—ZG—03—0137 质量投诉处理结果反馈与跟踪记录………………GC—ZG—03—0238 药品经营各环节质量风险管理评价与控制表……GC—ZG—04—0139 质量风险评估表……………………………………GC—ZG—04—0240 质量风险控制表……………………………………GC—ZG—04—0341 质量风险审核表……………………………………GC—ZG—04—0442 管理评审计划………………………………………GC—ZG—05—0143 管理评审报告………………………………………GC—ZG—05—0244 管理评审改进跟踪验证表…………………………GC—ZG—05—03三、人员与培训45 职工教育培训计划…………………………………ZD—RP—01—0146 培训方案……………………………………………ZD—RP—01—0247 培训签到表…………………………………………ZD—RP—01—0348 个人培训考核记录…………………………………ZD—RP—01—0449 培训考核汇总表……………………………………ZD—RP—01—05 序号记录名称记录编号50 培训汇总表…………………………………………ZD—RP—01—0651 外出培训登记表……………………………………ZD—RP—01—0752 健康检查工作安排…………………………………ZD—RP—02—0153 员工健康档案表……………………………………ZD—RP—02—0254 体检汇总表…………………………………………ZD—RP—02—0355 员工健康异常情况报告单…………………………ZD—RP—02—0456 企业员工花名册……………………………………ZD—RP—03—0157 应聘登记表…………………………………………ZD—RP—03—02四、设施设备58 设施设备台帐…………………………………… ZD—SS—01—0159 设备检查记录…………………………………… ZD—SS—01—0260 设备保养记录…………………………………… ZD—SS—01—0361 设备维修记录…………………………………… ZD—SS—01—0462 设施设备档案…………………………………… ZD—SS—01—05五、校准与验证63 检定、校准与验证计划………………………… ZD—JY—01—01六、计算机64 计算机系统操作权限授权审批表…………………ZD—JX—02—01七、采购65 首营企业审批表………………………………… ZD—CG—02—0166 首营品种审批表………………………………… ZD—CG—03—0167 销售员资格验证记录卡………………………… ZD—CG—04—0168 药品采购计划…………………………………… GC—CG—01—0169 中药材采购计划………………………………… GC—CG—01—0270 中药饮片采购计划……………………………… GC—CG—01—0371 药品采购记录…………………………………… GC—CG—01—0472 中药材采购记录………………………………… GC—CG—01—05 序号记录名称记录编号73 中药饮片采购记录……………………………… GC—CG—01—0674 专门管理药品采购记录………………………… GC—CG—01—0775 冷藏、冷冻药品采购记录……………………… GC—CG—01—0876 直调药品采购记录……………………………… GC—CG—01—0977 购进药品退出通知单…………………………… GC—CG—01—1078 购进药品退出记录……………………………… GC—CG—01—1179 购进专门管理药品退出记录…………………… GC—CG—01—1280 购进中药材退出记录…………………………… GC—CG—01—1381 购进中药饮片退出记录………………………… GC—CG—01—14八、收货与验收82 药品收货记录…………………………………… GC—SY—01—0183 中药材收货记录………………………………… GC—SY—01—0284 中药饮片收货记录……………………………… GC—SY—01—0385 冷藏、冷冻药品收货记录……………………… GC—SY—01—0486 专门管理药品收货记录………………………… GC—SY—01—0587 药品到货拒收记录……………………………… GC—SY—01—0688 中药材到货拒收记录…………………………… GC—SY—01—0789 中药饮片到货拒收记录………………………… GC—SY—01—0890 冷藏、冷冻药品到货拒收记录………………… GC—SY—01—0991 专门管理药品到货拒收记录…………………… GC—SY—01—1092 委托运输药品收货记录………………………… GC—SY—01—1193 委托运输中药材收货记录……………………… GC—SY—01—1294 委托运输中药饮片收货记录…………………… GC—SY—01—1395 委托运输冷藏、冷冻药品收货记录…………… GC—SY—01—1496 委托运输专门管理药品收货记录……………… GC—SY—01—1597 药品到货拒收单……………………………………GC—SY—01—1698 销后退回药品收货记录………………………… GC—SY—01—17序号记录名称记录编号99 销后退回中药材收货记录…………………………GC—SY—01—18 100 销后退回中药饮片收货记录………………………GC—SY—01—19 101 销后退回冷藏、冷冻药品收货记录………………GC—SY—01—20 102 销后退回专门管理药品收货记录…………………GC—SY—01—21 103 销后退回药品到货拒收单…………………………GC—SY—01—22 104 销后退回药品到货拒收记录………………………GC—SY—01—23 105 销后退回中药材到货拒收记录……………………GC—SY—01—24 106 销后退回中药饮片到货拒收记录…………………GC—SY—01—25 107 销后退回冷藏、冷冻药品到货拒收记录…………GC—SY—01—26 108 销后退回专门管理药品到货拒收记录……………GC—SY—01—27 109 药品验收记录…………………………………… GC—SY—02—01 110 中药材验收记录………………………………… GC—SY—02—02 111 中药饮片验收记录……………………………… GC—SY—02—03 112 专门管理药品验收记录………………………… GC—SY—02—04 113 冷藏、冷冻药品验收记录……………………… GC—SY—02—05 114 销后退回药品验收记录………………………… GC—SY—02—06 115 销后退回中药材验收记录……………………… GC—SY—02—07 116 销后退回中药饮片验收记录………………………GC—SY—02—08 117 销后退回专门管理药品验收记录…………………GC—SY—02—09 118 销后退回冷藏、冷冻药品验收记录………………GC—SY—02—10119 直调药品验收记录…………………………………GC—SY—02—11 120 药品验收拒收单…………………………………GC—SY—02—12 121 药品验收拒收记录…………………………………GC—SY—02—13 122 中药材验收拒收记录………………………………GC—SY—02—14 123 中药饮片验收拒收记录……………………………GC—SY—02—15 124 专门管理药品验收拒收记录………………………GC—SY—02—16 125 冷藏、冷冻药品验收拒收记录……………………GC—SY—02—17 序号记录名称记录编号126 销后退回药品验收拒收单………………………GC—SY—02—18 127 销后退回药品验收拒收记录……………………GC—SY—02—19 128 销后退回中药材验收拒收记录……………………GC—SY—02—20 129 销后退回中药饮片验收拒收记录…………………GC—SY—02—21 130 销后退回专门管理药品验收拒收记录……………GC—SY—02—22 131 销后退回冷藏、冷冻药品验收拒收记录…………GC—SY—02—23 九、储存与养护132 近效期药品催销月报表…………………………ZD—CY—03—01 133 外来人员进出库房登记表…………………………ZD—CY—05—01 134 药品库存记录……………………………………GC—CY—01—01 135 专门管理药品库存记录………………………… GC—CY—01—02 136 中药材库存记录………………………………… GC—CY—01—03 137 中药饮片库存记录……………………………… GC—CY—01—04 138 冷藏、冷冻药品库存记录……………………… GC—CY—01—05 139 库房巡检记录…………………………………… GC—CY—01—06 140 药品养护计划…………………………………… GC—CY—02—01 141 重点养护药品养护计划………………………… GC—CY—02—02 142 药品养护记录……………………………………GC—CY—02—03 143 中药材养护记录…………………………………GC—CY—02—04 144 中药饮片养护记录………………………………GC—CY—02—05 145 重点养护药品养护记录…………………………GC—CY—02—06 146 重点养护中药材养护记录………………………GC—CY—02—07 147 重点养护中药饮片养护记录……………………GC—CY—02—08 148 设施设备、环境、卫生养护检查记录…………GC—CY—02—09 149 药品养护分析报告表……………………………GC—CY—02—10 150 不合格药品库存记录……………………………GC—CY—03—01 151 不合格药品销毁审批表…………………………GC—CY—03—02 序号记录名称记录编号152 不合格药品报损审批表…………………………GC—CY—03—03 153 不合格药品报损记录…………………………… GC—CY—03—04 154 不合格药品销毁记录…………………………… GC—CY—03—05 155 不合格药品情况汇总分析表…………………… GC—CY—03—06 156 可疑药品报告确认表………………………………GC—CY—03—07 157 库存盘点报表…………………………………… GC—CY—04—01 158 盘点情况原因分析及处理报告………………… GC—CY—04—02 159 直接入库单……………………………………… GC—CY—04—03160 直接出库单……………………………………… GC—CY—04—04 161 直接入库记录…………………………………… GC—CY—04—05 162 直接出库记录…………………………………… GC—CY—04—06 163 库存不合格药品盘点报表……………………… GC—CY—04—07 164 温湿度监测记录………………………………… GC—CY—05—01 十、销售165 购货单位资格审批表…………………………… ZD—XS—01—01 166 药品销售单……………………………………… GC—XS—01—01 167 药品销售记录…………………………………… GC—XS—01—02 168 专门管理药品销售记录………………………… GC—XS—01—03 169 冷藏、冷冻药品销售记录……………………… GC—XS—01—04 170 中药材销售记录………………………………… GC—XS—01—05 171 中药饮片销售记录……………………………… GC—XS—01—06 172 直调药品销售记录……………………………… GC—XS—01—07 173 药品抽样检查出库单…………………………… GC—XS—01—08 174 药品抽样检查出库记录。

全面风险管理策略通过整理的全面风险管理策略相关文档,渴望对大家有所扶植,感谢观看!风险管理策略第一章总则第一条为推动全面风险管理体系建设,提升风险管理水平,依据《银行业金融机构全面风险管理指引》(银监发〔2021〕44号)、《全省农村商业银行全面风险管理工作指导看法》等相关文件,依据本行实际,特制定本策略。
其次条全面风险管理是指本行董事会、监事会、高级管理层和全行员工各自履行相应职责,有效限制涵盖全行各个业务层次的全部风险,进而为各项目标的实现供应合理保证的过程。
第三条本行应当建立全面风险管理体系,实行定性和定量相结合的方法,识别、计量、评估、监测、限制或缓释所担当的各类风险。
(一)信用风险。
是指因借款人或交易对手未依据约定履行义务从而使本行业务发生损失的风险。
(二)市场风险。
是指因市场价格(利率等)的不利变动而使本行表内和表外业务发生损失的风险。
(三)流淌性风险。
是指因本行无法以合理的成本刚好筹集到客户和交易对手当前和将来所需资金而对本行经营所产生的风险。
(四)操作风险。
是指由不完善或有问题的内部程序、员工和信息科技系统,以及外部事务所造成损失的风险,包括法律风险,但不包括策略风险和声誉风险。
(五)合规风险。
指因没有遵循法律、规则和准则,可能遭遇法律制裁、监管惩罚、重大财产损失和声誉损失风险。
(六)声誉风险。
指由各行经营、管理及其他行为或外部事务导致利益相关方对各行负面评价的风险。
(七)其他风险。
包括银行账户利率风险、声誉风险、战略风险、信息科技风险以及其他风险。
第四条全面风险管理应遵循以下原则:(一)匹配性原则。
全面风险管理体系应当与风险状况相适应,并依据环境变更进行调整。
本行担当的风险是在本行的风险容忍度以内,并有预期的收益覆盖风险。
(二)全覆盖原则。
全面风险管理应当覆盖各个业务条线,包括表内外业务;覆盖全部分支机构,部门、岗位和人员;覆盖全部风险种类和不同风险之间的相互影响;贯穿决策、执行和监督全部管理环节。

【最新资料,WORD文档,可编辑修改】质量风险管理操作规程文件题目质量风险管理操作规程文件编码SOP01(03)-0001制定(变更)原实施《药品生产质量管理规范(2010年修订)》因及目的起草(修订)人日期年月日版本号0审核人日期年月日页数共9页批准人日期年月日文件类型操作标准生效日期年月日颁发部门质量管理部分发部门质量管理部、生产技术部、业务部、生产车间、化验室1.目的:采取有效可行的分析控制方法,最大限度地降低产品质量风险。
2.范围:原辅材料采购、生产、销售的全过程。
3.责任:采购、生产、销售全体高层管理人员,特别是质量管理部门、生产管理部门对执行和实施本规程负有组织检查责任。
4.内容:4.1风险评估使用的工具:风险排列和过滤 (1)矩阵图:风险评估的矩阵图风险评估评分表 (2)RRF 列表:严重性可能性4.2风险分析4.2.1供应商风险评估4.2.1.1供应商质量风险评估物料供应商具备不具备供应资质是关键,没有合法的生产经营条件,很难保证其所供物料质量,同时其可追溯性更差,其人员素质、质量保证系统的完善性、售后服务等存在一定风险,现利用风险排列和过滤(RRF列表)的风险评估工具对供应商存在的风险进行评估。
供应商质量风险评估表:通过对供应商的风险评估,其最大风险为质量保证系统的完善性,为中等风险,能通过供应商现场考察、走访等方法督促其改善或更换体系完善的供应商,进而解决,可以使风险控制在可接受的范围。
4.2.1.2供应商风险等级评估针对原药材、辅料、直接接触药品的内包材供应商进行等级评估,确定存在风险最大的供应商,采取必要的管理办法。
供应商风险等级评估表:通过对供应商风险等级评估,显示中药材风险最大,对中药材严格按质量标准采购,采购药材按规定全检,不合格的严禁使用。
4.2.2物料储存风险评估储存条件的变化可以引起物料成分的变化;虫害、鼠害防范措施不到位,容易污染引起物料质量的变化;温湿度的变化超过范围容易引起霉变、虫蛀等现象;特殊物料的储存,管理不完善容易引起混淆,现利用风险排列和过滤(RRF列表)的风险评估工具对供应商存在的风险进行评估。

第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
第二条企业应当建立药品质量管理体系。
该体系应当涵盖影响药品质量的所有因素,包括确保药品质量符合预定用途的有组织、有计划的全部活动。
第三条本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。
第四条企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为。
第二章质量管理第一节原则第五条企业应当建立符合药品质量管理要求的质量目标,将药品注册的有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、贮存、发运的全过程中,确保所生产的药品符合预定用途和注册要求。
第六条企业高层管理人员应当确保实现既定的质量目标,不同层次的人员以及供应商、经销商应当共同参与并承担各自的责任。
第七条企业应当配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量保证第八条质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,同时建立完整的文件体系,以保证系统有效运行。
第九条质量保证系统应当确保:(一)药品的设计与研发体现本规范的要求;(二)生产管理和质量控制活动符合本规范的要求;(三)管理职责明确;(四)采购和使用的原辅料和包装材料正确无误;(五)中间产品得到有效控制;(六)确认、验证的实施;(七)严格按照规程进行生产、检查、检验和复核;(八)每批产品经质量受权人批准后方可放行;(九)在贮存、发运和随后的各种操作过程中有保证药品质量的适当措施;(十)按照自检操作规程,定期检查评估质量保证系统的有效性和适用性。
第十条药品生产质量管理的基本要求:(一)制定生产工艺,系统地回顾并证明其可持续稳定地生产出符合要求的产品;(二)生产工艺及其重大变更均经过验证;(三)配备所需的资源,至少包括:1.具有适当的资质并经培训合格的人员;2.足够的厂房和空间;3.适用的设备和维修保障;4.正确的原辅料、包装材料和标签;5.经批准的工艺规程和操作规程;6.适当的贮运条件。
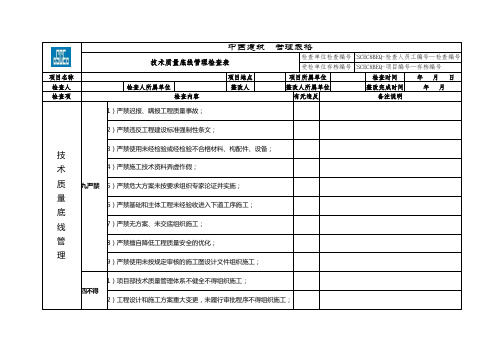

完整word版)风险分级管控清单___制定了安全风险分级管控体系,以下是作业活动风险分级管控清单:1.风险点序号、类型、危险源、作业步骤、诱发事故类型、评价级别、风险分级、管控措施、责任单位、责任人、管控层级等内容都在清单中列出。
2.对于电线破损外漏、线缆穿管防护、电缆老化短路、火灾、身体部位触及设备工作区域、机械伤害等风险点,制定了相应的管控措施,如加强巡检、设置警示标志、正确佩戴劳动防护用品等。
3.对于用切割机下料、对管路进行弯曲、经加工后焊接成型等作业步骤,也制定了相应的管控措施,如加设防护措施、进行岗位培训教育等。
4.对于长期接触有毒气体的职业病风险点,制定了车间级定期查体的管控措施。
总之,该公司的风险分级管控体系覆盖了多个作业活动风险点,旨在确保生产过程中的安全。
编制触电应急预案并进行演练。
注意检查电缆老化破损和物料存储发放情况,加强消防器材和警示标志的设置,并建立健全相关管理制度。
同时,加强本岗位的培训教育,正确佩戴劳动防护用品。
针对驾驶员超速、疲劳驾驶、注意力不集中等问题,设置限速标志,建立健全相关车间级管理制度,划分人车分隔线,并加强本岗位的培训教育,正确佩戴劳动防护用品。
在发生事故时,根据伤害程度使用应急救护设施,拨打120急救电话。
货物堆叠过高或倾斜可能会导致车辆伤害。
因此,建立健全相关车间级管理制度,加强本岗位的培训教育,正确佩戴劳动防护用品。
同时,货物不宜堆放过高,以避免坍塌事故的发生。
安全阀失灵或爆炸是一种严重的安全风险。
定期检测安全阀和压力表,建立健全相关公司级管理制度,并加强本岗位的培训教育,正确佩戴劳动防护用品。
编制爆炸应急预案并进行演练。
在气瓶存放区,存放气瓶时要注意避免明火作业。
增加安全消防器材和警示标志,建立健全相关管理制度,并加强本岗位的培训教育,正确佩戴劳动防护用品。
同时,根据伤害程度,由救护员使用应急救护设施,拨打120急救电话。
有毒气体泄漏可能会导致中毒和窒息事故的发生。

版本号:C0编号:XXXXX-XXXX状态:(受控印章)质量手册(模板)编辑:审核:批准:XXXXXXXXXXXX公司二〇XX年XX月更改控制页目录引言 1 ..................................具体按《质量手册》实际内容定。
前言本手册于XXXX年XX月按照GB/T19001-94的要求制定并首次发布,XXXX年XX月按照GB/T19001-2008和GJB9001B-2009的要求重新修订为B版,XXXX年XX月按照GB/T19001-2016和GJB9001C-2017的要求重新修订为C版。
本手册为公司质量管理体系的基础要求,为了便于识别各行业标准的特殊要求,针对GB/T19001-2008标准内容采用小四号宋体字表示;GJB9001C-2017标准内容采用小四号楷体字表述。
程序文件和三层次文件均按此执行。
本手册的附录A、B是资料性附录。
本手册由质量管理部提出并归口。
本手册由质量管理部负责起草。
本手册主要起草人:XXX、XXX、XXX、XXX、XXX。
引言0.1 总经理授权书授权书兹委任 XXX (先生/女士)担任XXXXXXXXX公司总经理,代表法人对公司进行管理,全权负责公司工作。
法人(签名):日期:年月日0.2 管理者代表任命书任命书兹任命 XXX 为管理者代表,负责确保XXXXXXXX公司质量管理体系的建立、实施和保持;领导质量管理体系的管理和内部审核工作,负责向总经理报告质量管理体系运行情况,需要改进的包括资源需求的情况;确保在全体员工中提高满足顾客要求的意识。
授权质量管理部为质量管理体系建立、实施和保持的主管部门,协助管理者代表完成质量管理体系运行的日常事务管理工作;负责质量管理体系的外部联络工作。
总经理(签名):日期:年月日0.3 质量手册颁布令质量手册颁布令产品质量是永恒的主题,是公司的生命。
关注顾客期望是公司的焦点,追求持续改进是公司永恒的目标。

质量体系文件(word版本)10危险辨识、风险评估及风险控制管理程序6-43青岛天能重工股份有限公司质量-环境-职业健康安全管理体系编号:QDTN-II-CX10-xxC 版本 C/0 实施日期xx、1、15 属性 II 责任部门:办公室共5页第1页主题: ISO9001:xx条款 ISO14001:2004条款:危险辨识、风险评估及风险控制管理程序8、24、5、11 目的为辨识出公司作业场所内的所有危险源,评估其对人员、设施的职业安全卫生风险,划分并确定其风险等级,有效实施风险控制规划,特制定本程序。
2 适用范围本程序适用于公司各作业场所内危险辨识、风险评估及其控制规划的管理。
3 工作职责3、1 管理者代表负责确认批准危险辨识与风险评估的结果。
3、2 办公室负责汇总、审定和反馈各部门危险辨识与风险评估的结果。
3、3 各部门1)负责辨识评估本部门的危险及其风险;2)负责随时辨识评估其新设备、新工艺、新材料的采用可能产生的新的环境和职业健康安全管理风险。
3、4 各外包过程主管部门负责随时辨识评估其外包过程中可能产生的新的环境和职业健康安全管理风险。
4 工作程序4、1 危险源识别的任务 a)识别出可能发生的事故后果;b)识别能引起事故的材料、系统、生产过程和设备。
4、2 危险源识别的范围: a)公司各作业场所内所有生产管理活动中常规和非常规的活动; b)所有接近作业场所的人员(包括外包方和参观者)的活动; c)作业场所的设施,无论是本企业的还是其他组织提供的; d)对以下危险源尤其要重点识别:1)易燃、易爆、有毒物质的贮存区(贮罐);2)易燃、易爆、有毒物质的库区(库);3)具有火灾、爆炸、中毒危险的生产场所;4)企业危险建(构)筑物;1 青岛天能重工股份有限公司编号:QDTN-II-CX10-xxC 版本 C/0 实施日期xx、1、15 属性 II 责任部门:办公室共5页第2页主题: ISO9001:xx条款 ISO14001:2004条款:危险辨识、风险评估及风险控制管理程序8、24、5、15 青岛天能重工股份有限公司质量-环境-职业健康安全管理体系编号:QDTN-II-CX10-xxC 版本 C/0 实施日期xx、1、15 属性 II 责任部门:办公室共5页第2页主题: ISO9001:xx条款 ISO14001:2004条款:危险辨识、风险评估及风险控制管理程序8、24、5、15)锅炉;6)压力管道;7)压力容器。

(完整 word 版)风险管理报告模板XXXX 产品风险管理报告文件编号:LX-RM-项目编号 版本:V1。
0风险管理编写参与人员: 编制时间: 审核人员: 审核时间 批准人员: 批准时间:第一章 概述1.1 目的识别 XXX 产品可能对病人、操作者、服务人员、仪器附近人员及环境造成的危害,并找出消 除风险或控制风险的解决方法。
1.2 依据1.2。
1 相关标准(按企业所生产产品的类型列举相关标准,以下标准为举例) 1)YY0316-2008 医疗器械—-风险管理对医疗器械的应用 2)注册产品技术要求 3)其他标准1.3 范围1。
3.1 此风险管理报告包含研发初期可以识别的所有风险及按照预期目的使用时可能发生的风 险,建议使用的附件也包括在本风险分析范围之内。
而关于使用到产品之后外延部分的风险将 在具体的产品中进行分析,此报告不予进行分析。
1。
3.2 风险管理适用产品:产品名称(完整 word 版)风险管理报告模板产品型号型号:xxxxxxx1。
3。
3 本报告适用于 xxxxx 产品,该产品处于试产\批量生产阶段。
1.4 产品信息1.4.1 产品描述产品预期用途.。
产品应用范围、功能、性能描述。
.。
1.5 产品研发背景描述产品研究历程,1.6 产品使用描述产品使用说明书,描述产品安装服务,作用对象。
1.7 产品标准配置部件数量 1台 1台 1台 1套 1份1份 1份 1份1.8 产品可选配置部件数量 1台 1台 1台 1套 1份1.9 风险管理计划及实施情况简述(完整 word 版)风险管理报告模板 1份 1份 1份XXXX 产品于 20XX 年开始策划立项。
立项同时,我们就针对该产品进行了风险管理活动的策划, 指定了风险管理计划(文件编号:XXXX,版本号 XX)。
该风险管理计划确定了风险管理活动范围、参加人员及职责和权限的分配、基于 制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计时的可接受风 险的准则、风险管理活动计划等内容。

序号12 3 4 5 6风险名称土方回填质量风险模板支撑系统安装质量风险混凝土浇筑质量风险预埋件制作质量风险预埋件安装质量风险锅炉受热面安装检查质量风险风险类别交付产品类交付产品类交付产品类交付产品类交付产品类交付产品类风险内容描述土方回填材料不合格、回填密实度不合格,未按要求进行见证取样模板支撑系统未进行方案针对性承载力计算,支撑系统未按方案进行安装,螺栓紧固力不足,脚手钢管等材料规格不符合要求 1、泵管架未能与模板支撑架分开;2、混凝土落差过大,导致混凝土离析; 3、混凝土存在过振或者漏振现象;4、混凝土浇筑间隔时间超过混凝土初凝时间; 5、大体积混凝土未采用分层浇筑; 6、未按规范要求留置足够数量同条件和标养试块。
1、铁板厚度偏薄,不符合设计及规范要求; 2、锚筋数量、规格及尺寸不符合设计和规范要求; 3、焊缝高度不够; 4、焊缝存在咬边、气孔或者夹渣等现象; 5、焊缝药皮未清理; 6、预埋件未进行矫正。
1、预埋件在安装时图省事或者为安装方便未经设计允许擅自割除埋件锚脚; 2、预埋件未与模板紧贴;3、预埋件固定不坚固; 4、固定架刚度不够; 5、拆模后未及时涂刷防锈漆。
锅炉受热面合金钢材料未进行 100%光谱复查、受热面焊口未进行探伤检测、锅炉系统组合安装质量隐患及后果易造成地基下沉,基础不均匀沉降,设备损坏。
模板支撑系统结构失稳造成安全事故。
混凝土表面产生蜂窝、麻面、孔洞、露筋、裂缝,造成修补、加固、返工。
埋件强度不足,造成安装的附着设备脱落造成设备损坏,引发安全事故。
埋件与墙面不平,表面锈蚀,工艺质量不美观,承载力不足;导致结构或者设备垮塌事故。
造成锅炉爆管,影响机组连续运行。
风险等级重大重大重大重大重大重大时洁净化施工措施不到位。
1、使用不合格割刀或者技能不熟练工人实施操作, 割伤母材; 2、鳍片开好 后,不及时组织检查。
1、设备与管道连接前未 进行清洁度检查验收;2、 管道未固定;3、应力未 释放强力对口。

质量风险的管理的流程和工具下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!质量风险管理是确保产品和服务满足既定标准的关键过程。
以下是质量风险管理的流程和工具的详细说明:1. 风险识别:这是质量风险管理的第一步。

四、多选题1.构成侵权的要件是(abce )。
a.加害行为;b.不法行为;c.有权益受损害;d.伤害未遂;e.近因2.财务型非保险转移与保险的区别是( abcd )。
a. 受让人不是保险人;b. 不会有意识地接受大量的风险单位;c. 不会进行有关的风险预测;d. 需附着于其它合同和契约;e. 是事前的风险转移3.损失期望值决策法包括( abcde )。
a.最大损失最小化;b.最小损失最小化;c.后悔期望值最小化;d.忧虑因素模式;e.效用期望值分析法4.购买保险决策取决于( abcd )。
a.保险费率;b.公司的风险承受能力;c.机会成本;d.公司投资能力;e.风险转移合同5.企业直接财产损失的衡量方法有( acde )。
a.重置全价;b.机会成本;c.有形损耗估算;d.无形损耗估算;e.固定资本折旧6.雇主责任风险包括( abcd )。
a.对内责任;b.对外责任;c.产品责任;d.公害责任;e.行政责任7.侵权抗辩理由包括( abce )。
a.自甘冒险;b.受害人自己过失;c.被害人同意;d.无过失责任;e.过失主义8.损害赔偿的基本原则包括( abcd )。
a.补偿损失;b.损益相抵;c.民事责任不受该行为是否应受刑罚影响;d.当事人的资力;e. 直接损失赔偿9.风险预防和抑制的措施包括(abcde )。
a. 工程物理法;b.人们行为法; c.分割风险;d.分散风险;e.复制风险10.采取风险回避措施的条件和缺陷有(abcde )。
a.损失频率和损失幅度高;b.采取其它风险管理措施代价高; c.某些风险无法回避;d.规避一种风险带来另一种风险;e.回避风险的同时损失了利益11.多米诺骨牌理论中引起事故的连续作用因素分别是( abcde )。
a.遗传和社会环境;b.个人的失误;c.危险动作和机械缺陷;d.事故;e.伤害12.损失抑制的特殊形式包括( abcde )。
a.分离;b.分散;c.复制;d.分隔;e.分摊13.控制风险转移的形式分别为( abc )。

质量风险分级管理制度内容一、总则为了规范质量管理工作,减少和控制质量风险,提高产品和服务质量,提高客户满意度,确保企业可持续发展,特制定本制度。
二、适用范围本制度适用于公司所有部门及其相关单位在质量管理工作中的活动。
三、分级管理原则1. 制度执行全员参与,贯彻全面质量管理理念,实行全员质量管理。
2. 坚持问题导向,从全流程全方位的角度找问题、改进问题,追求创新、提高。
3. 着眼于全面把握质量风险,充分利用现代科技手段,不断完善质量风险识别、评估、控制和监督管理体系。
4. 依法合规,厘清职责,严格执行,确保安全可靠、经济合理、高效节约。
5. 不断改进,实现全面提升,推动企业持续发展。
四、质量风险分级管理1. 风险分级原则风险分级是指将质量风险依据其可能性和影响程度划分为多个等级,并采取相应的风险控制措施,在一定范围内使风险得以控制,确保风险处于可接受的水平。
风险分级原则是要有针对性、适应性、灵活性,必须要考虑到风险所处的环境,同时也要综合考虑风险的可能性和影响程度。
2. 分级管理内容(一)风险识别风险识别是保证正确的风险处置的第一步。
在识别风险的过程中,首先要分析现有的信息,进行风险的人员和部门的调查和走访,查明可能存在的风险点。
(二)风险评估风险评估是指在识别了风险后,要对风险进行分析,确定风险的可能性和影响程度,确定合适的分级方法,将风险依照其可能性和影响程度划分为不同的级别。
分级原则是要有针对性、适应性、灵活性,必须要考虑到风险所处的环境,同时也要综合考虑风险的可能性和影响程度。
在确定了风险的级别后,要根据风险的级别,进行相应的控制措施的落实。
(三)风险控制风险控制是指按照风险等级的高低,采取不同的控制措施,将风险控制在可接受的水平。
(四)风险监督风险监督是指在风险控制措施执行后,要对风险控制的效果进行监督,以便及时发现问题,及时进行整改。
五、风险分级管理的操作方法1. 对于初步识别的风险,可以根据风险可能性和影响程度进行初步划分,并给予相应的标识。

GBT19001-2019质量管理体系要求(word版无加密)ICS 03.120.10A 00中华人民共和国国家标准GB/T19001—2016/ISO9001:2015代替GB/T19001—2008质量管理体系要求Quality management systems—Requirements(ISO 9001:2015,IDT)2016-12-30发布 2017-07-01实施中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会发布目次前言 (I)引言................................................................................................................................................................. I I 1范围.. (1)2 规范性引用文件 (1)3 术语和定义 (1)4 组织环境 (1)4.1理解组织及其环境 (1)4.2理解相关方的需求和期望 (1)4.3确定质量管理体系的范围 (1)4.4质量管理体系及其过程 (2)5 领导作用 (2)5.1领导作用和承诺 (2)5.1.1总则 (2)5.1.2以顾客为关注焦点 (3)5.2方针 (3)5.2.1制定质量方针 (3)5.2.2沟通质量方针 (3)5.3组织的岗位、职责和权限 (3)6 策划 (3)6.1应对风险和机遇的措施 (3)6.2质量目标及其实现的策划 (4)6.3变更的策划 (4)7 支持 (4)7.1资源 (4)7.1.1总则 (4)7.1.2人员 (4)7.1.3基础设施 (5)7.1.4过程运行环境 (5)7.1.5监视和测量资源 (5)7.1.6组织的知识 (5)7.2 能力 (6)7.3 意识 (6)7.4 沟通 (6)7.5成文信息 ........................................................................................................................................ .. (6)7.5.1总则 (6)7.5.2创建和更新 (6)7.5.3成文信息的控制 (7)8 运行 (7)8.1 运行的策划和控制 (7)8.2 产品和服务的要求 (7)8.2.1顾客沟通 (7)8.2.2产品和服务要求的确定 (8)8.2.3产品和服务要求的评审 (8)8.2.4产品和服务要求的更改 (8)8.3 产品和服务的设计和开发 (8)8.3.1总则 (8)8.3.2设计和开发策划 (8)8.3.3设计和开发输入 (9)8.3.4设计和开发控制 (9)8.3.5设计和开发输出 (9)8.3.6设计和开发更改 (9)8.4外部提供的过程、产品和服务的控制 (10)8.4.1总则 (10)8.4.2控制类型和程度 (10)8.4.3提供给外部供方的信息 (10)8.5生产和服务提供 (10)8.5.1生产和服务提供的控制 (10)8.5.2标识和可追溯性 (11)8.5.3顾客或外部供方的财产 (11)8.5.4防护 (11)8.5.5交付后活动 (11)8.5.6更改控制 (12)8.6产品和服务的放行 (12)8.7不合格输出的控制 (12)9 绩效评价 (12)9.1监视、测量、分析和评价 (12)9.1.1总则 (12)9.1.2顾客满意 (13)9.1.3分析与评价 (13)9.2内部审核 (13)9.3管理评审 (13)9.3.1总则 (13)9.3.2管理评审输入 (14)9.3.3管理评审输出 (14)10 改进 (14)10.1 总则 (14)10.2不合格和纠正措施 (14)10.3 持续改进 (15)附录A(资料性附录)新结构、术语和概念说明 (16)附录B(资料性附录)SAC/TC151制定的其他质量管理和质量管理体系标准 (19)参考文献 (22)本标准按照GB/T 1.1—2009给出的规则起草。
质量风险管理一、法规要求二、质量风险点◆质量风险管理的两大主要原则:质量风险的评估应基于科学知识并与保护患者相联系;质量◆风险管理的资源投入、形式和文件应与风险的水平相适应。
◆无菌制剂是指法定药品标准列有无菌检查项目的制剂。
◆注射剂指药物制成的供注入人体内的无菌溶液(包括乳浊液和混悬液)以及供临用前配成溶液或混悬液的无菌粉末或浓溶液。
其质量保证的重点在于无菌保证、细菌内毒素和微粒污染的控制。
也需要特别关注防止混淆和交叉污染。
三、最终灭菌产品的质量风险评估案例(一)无菌保证风险与质量风险控制点无菌保证的风险主要来自于:产品灭菌前微生物污染水平;灭菌工艺的可靠性;容器密封的完整性;无菌保证管理体系。
1.产品灭菌前微生物污染水平产品灭菌前通常都存在一定程度的微生物。
微生物污染主要受以下因素影响:◆原材料和包装材料中的微生物——风险在于其可能进入产品。
质量风险控制方法:✧制定原辅料采购标准,规定微生物限度。
通常应不超过100CFU/g,并不得含致病菌。
✧进行供应商的确认时应重点关注供应商的生产过程对微生物污染、细菌内毒素的污染、产品混淆和交叉污染风险的控制措施。
✧对供应商及其供应的原料进行年度质量回顾分析,以评估其质量状况。
对不良趋势的供应商应采取针对性的措施,如增加现场检查的频率,更加严格的抽样方案。
✧严格管理仓储条件,确保原料储存过程中质量受控。
如干燥、防虫、防鼠等。
包装材料如玻璃瓶应定点采购,其包装应能防止昆虫进入,储存过程防止受潮长霉。
2.生产环境注射剂的生产从原料称量开始直至完成密封,都分别在相应的卫生洁净区中进行。
生产过程各步骤都可能存在药物直接暴露于环境的环节,存在来自于生产环境的微生物污染的风险。
如果能证明在动态下生产区的洁净度能符合上述标准,则来自环境的微生物污染风险是较低的。
3.生产设备注射剂通常采用固定的设备,安装了生产及在线清洗、消毒等多种工艺管道。
因此设备存在残留物或微生物的可能,对产品有潜在风险。
质量风险控制方法:✧设备在线清洁和在线灭菌的方法应足够详细,应包括所有影响清洁效果的参数,如水温、清洁剂浓度、流速、时间、阀门的开闭次序和时间、蒸汽温度、压力等书面规定,以确保清洁效果的重现性。
✧清洁与灭菌方法,包括清洁、灭菌后最长的存放时间应经过验证。
✧认真执行、执行可靠的设备状态管理措施,保证设备的状态受控。
✧最好采用经验证的计算机系统,自动执行、记录清洁和灭菌程序,设备状态管理由计算机完成。
✧与药品接触的公用介质(如压缩空气、惰性气体等),将对产品质量产生直接影响,因此需要对公用介质的质量进行严格控制,要求其质量等级应满足ISO8573.1(GB/T13277—91)的要求,即露点≤-40℃,尘粒数≤0.1mg/m3(药品生产企业可按照A级空气标准评定),含油量≤0.01mg/m3。
4.人员与生产操作人员及其活动被视为最大的污染源。
质量风险控制方法:✧生产操作人员应掌握微生物的基本知识,养成良好的卫生习惯。
✧应配备质地良好的个人防护服装。
所有进入洁净室的人员需经过更衣程序培训,制定合理的工作服管理制度。
✧工艺及生产操作设计应能尽量降低人员和生产操作导致的风险。
✧选用质量可靠的药液终端过滤器,配合使用适当的预过滤器,以截留药液中的微生物。
终端过滤器使用后须经完整性测试,使用周期经过验证。
✧灭菌前各工序的最长时限应经过验证。
✧生产设备或生产过程发生偏差后应分批,并增补产品灭菌前微生物污染水平样品,以质量评价提供依据。
✧包装材料的清洗设备,如洗瓶机应经清洗效果和微生物残留验证。
设置设备关键参数监控和报警装置。
5.微生物在产品中的增殖活微生物在适宜的条件下能迅速繁殖而使产品带菌量急剧增加。
充足的水分是必要条件,不同的微生物适宜的繁殖温度跨度很大。
药液的性质,如有无抑菌性、pH等也能显著影响微生物的繁殖速度。
通常可将原料和水混合作为生产的开始时间。
一般分为配制时间,从配制结束到灌装结束的时间,从灌装开始到最后一瓶产品灭菌的时间等。
在配制或灌装前的储罐中的药液的微生物和内毒素污染可视为均匀的,但经过灌装后,就有可能存在污染不均匀的情况。
质量风险控制方法:✧根据经验和验证制定各步骤的时限。
对每一种产品都应进行微生物繁殖验证。
通过在产品中接入有代表性的菌株并在生产工艺温度下培养,可直接地获得微生物数量和时间的关系曲线。
✧生产过程中严格执行各步骤时限。
发生偏差后应分批、取样。
✧对以上各风险因素和风险控制方法效果评价,可通过对一定周期内的产品灭菌前微生物污染水平检验结果进行统计分析而进行,如果超过95%的样品为低污染水平(如药液不超过10CFU/100ml),则说明生产过程整体上微生物污染风险控制措施是有效的。
6.微生物耐热性检查从灭菌原理可知,产品无菌保证水平不仅与灭菌前产品中的污染数量有关,也与污染菌的耐热参数相关。
耐热参数(D值)的测定是非常繁琐且费时的工作,仅在灭菌工艺验证的微生物挑战试验中进行,很难用在日常质量控制。
由于日常生产中产品污染的微生物绝大多数是不耐热的,因此可以通过简便可行的耐热性检查作为日常监控手段。
耐热性检查的步骤如下(应遵循无菌操作的要求)✧将100ml灭菌前的产品经0.45μm滤膜过滤。
✧滤膜浸没于装有产品的试管中,将试管置于沸水浴中,保持15分钟,迅速冷却。
✧试管中加入一定量的液体培养基,于30℃~35℃培养7天。
✧如无生长,则通过。
如有生长,则说明可能存在耐热菌,需做进一步确认,如:测定D 值或与验证用生物指示剂做耐热性比较,以确定产品是否达到无菌保证水平。
(二)灭菌工艺的可靠性灭菌工艺的目的是使具有一定微生物污染水平的产品,经灭菌后达到残存微生物概率不超过百万分之一的水平。
灭菌工艺的可靠性通过以下四个环节保证。
1.灭菌设备的适用性灭菌设备的适用性是指灭菌设备执行灭菌工艺能力,即灭菌设备对灭菌工艺各参数的控制正确度和精确度能否使任意位置的产品的实际F0值符合灭菌工艺规定的F0值的范围。
现代化的灭菌设备为加热、冷却介质的流量,以实现预定的灭菌工艺,计算机同时自动记录整个灭菌过程数据。
影响灭菌设备适用性的因素主要为灭菌设备的设计制造,安装、传感器的准确性和精确度、计算机程序、设备的维护保养等。
质量风险控制方法:✧通过灭菌设备的设计确认,使灭菌设备以预定的灭菌工艺为设计目标。
✧通过安装确认、运行确认、性能确认、灭菌工艺验证,证明设备性能达到设计要求适用于灭菌工艺。
✧至少每半年校验一次关键参数传感器,如温度传感器,至少每年进行一次灭菌设备再确认。
✧灭菌工艺的验证✧灭菌工艺的验证都要经以下四个步骤,因此质量风险控制方法需确保各步骤的有效性。
✧选择能抵抗灭菌工艺的生物指示剂✧考察各种变量对生物指示剂耐热性的影响(例如:生物指示剂的繁殖,生物指示剂与被灭菌物资之间的相互影响)。
✧建立生物指示剂在灭菌过程中破坏的定量指标。
✧测定被灭菌物资在特定工艺条件下实现灭菌的可能性。
2.灭菌工艺的执行应确保灭菌执行了灭菌程序,完成了灭菌工艺。
主要风险在于:灭菌设备中的温度传感器准确度发生漂移,使记录的灭菌数据与真实值不符合导致的偏差;意外事件如停电导致的灭菌中断和数据丢失。
质量风险控制方法:✧至少每6个月进行一次温度传感器的校验,每年对灭菌设备进行一次再验证,再验证或校验应至少重复运行两次灭菌程序,以证明其重现性。
✧启动灭菌程序之前,操作人员必须确认设备、灭菌工艺、温度探头等均在验证或校验的有效期内。
3.防止二次微生物污染产品经灭菌后再次污染微生物称为二次微生物污染。
二次污染的主要原因是高温灭菌完成后用于冷却产品的介质中存在的微生物穿过密封屏障进入产品。
高温状态时产品的密封可能和平时存在差异。
质量风险控制方法:✧灭菌设备设计应充分考虑二次微生物污染的风险。
尽量采用过热喷淋或过热水浴的灭菌方式。
✧定期监控冷却水的微生物质量。
定期维护灭菌设备,确保冷却水不发生微生物污染。
4.药品容器密封完整性注射剂容器应能在整个药品有效期内有完好的密封性,防止微生物的侵入。
在有密封系统的部件发生变更时,必须评估其对密封系统完好性的影响,必要时重新进行密封完好性验证。
5.无菌保证管理体系无菌保证管理体系涉及GMP关注的各个方面管理,对注射剂而言需要特别强调的有以下两个方面。
✧生产管理应采取必要的措施防止发生未灭菌产品和已灭菌产品的混淆。
主要的措施可包括但不限于以下各项,应根据风险评估的结果组合采用某些措施。
●灭菌工作所在区域应与其他工序隔离并上锁,防止无关人员随意进入。
●采用能防止未灭菌产品不受控离开灭菌车的装置。
●待灭菌区与已灭菌之间最好有物流隔离。
●在每辆灭菌车上放置灭菌指示胶带。
●灭菌结束后的产品在已灭菌区卸载,并计数。
不立即包装的产品应上锁并有封签,封签的解封由双人负责并记录。
●严格的物料平衡,待灭菌产品和已灭菌产品、灭菌破损产品的数量应完全吻合。
✧质量管理对生产过程及其产品应实施严格的微生物监控。
而可能导致监控失败的主要风险因素是样品缺乏代表性和检验方法有缺陷。
以采用残存概率灭菌工艺的产品为例,需要特别强调的措施主要如下。
●在每批产品灌封的开始、中间、结束阶段取样进行灭菌前微生物污染水平的检查和污染菌的耐热试验。
●所有原辅料的含菌量检验方法、产品灭菌前微生物污染水平的检验方法及污染菌的耐热试验方法均经过科学的验证。
●质量评价应能发现生产和质量控制试验中出现的偏差并正确地判断和处理。
相应的管理措施包括以下几个方面。
●严格的质量评价程序:批生产记录、中间控制记录、质量检验记录必须经相应的负责人审核。
在此基础上,QA质量评价员、QA经理对批生产、中控和检验记录进行双重审核。
●应设计科学合理的评价记录表,防止遗留对重要参数和质量控制点的审核。
●质量评价人员应有足够的资质和经验,有能力发现潜在的问题并作出正确的决定。
●偏差和变更管理是质量管理至关重要的部分。
注射剂应从微生物风险的角度判断有关偏差和变更。
具体的方法如下。
●应有严谨的偏差报告和处理程序,确保所有偏差均经微生物专业人员审核,对偏差的定性和结论应征询微生物专业人员的意见,质量放行责任人应授予微生物专业人员放行的否决权。
●应有严谨的变更管理程序,确保微生物专业人员参加该程序,即所有的变更需要经微生物专业人员审核,专业人员应对变更是否增加微生物进行风险进行分析、判断;对变更进行的验证结果进行审核并提出专业意见。
(三)细菌内毒素风险与控制细菌内毒素污染来组以下两个方面:物料(原辅料、包装材料)本身携带的细菌内毒素;产品中能产生细菌内毒素的活微生物,在灭菌前繁殖代谢产生。
因此,细菌内毒素的风险控制主要针对这两方面。
1.物料的细菌内毒素污染控制物料携带的细菌内毒素可采取以下措施。
✧根据原辅料在成品中的含量合理制定原料和辅料细菌内毒素限度。