D-二聚体测定试剂盒(胶乳免疫比浊法)产品技术要求saikexide
- 格式:docx
- 大小:17.08 KB
- 文档页数:2
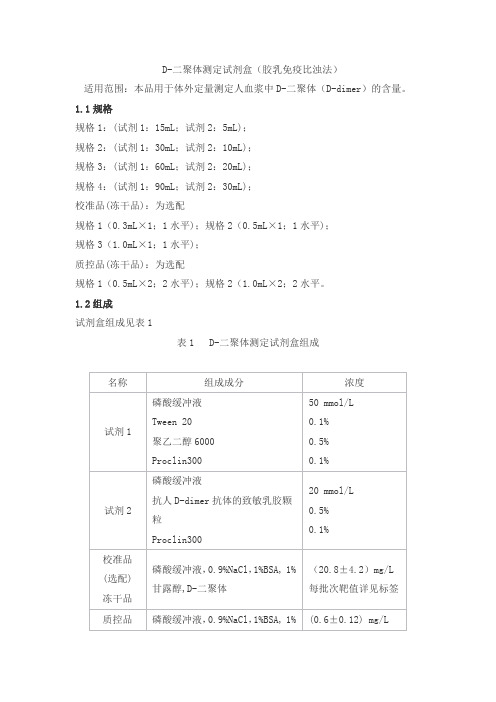
D-二聚体测定试剂盒(胶乳免疫比浊法)适用范围:本品用于体外定量测定人血浆中D-二聚体(D-dimer)的含量。
1.1规格规格1:(试剂1:15mL;试剂2:5mL);规格2:(试剂1:30mL;试剂2:10mL);规格3:(试剂1:60mL;试剂2:20mL);规格4:(试剂1:90mL;试剂2:30mL);校准品(冻干品):为选配规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品(冻干品):为选配规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平。
1.2组成试剂盒组成见表1表1 D-二聚体测定试剂盒组成2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;组分齐全,液体无漏液;试剂1为透明液体,不得有沉淀和絮状物;试剂2为乳白色液体。
2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在A600nm处测定试剂空白吸光度A≤1.50。
2.1.4分析灵敏度测定1.0mg/L的样品,吸光度差值△A≥0.005。
2.1.5线性范围2.1.5.1在[0.2,20] mg/L内,相关系数R≥0.980。
2.1.5.2在[0.2,5] mg/L内,线性绝对偏差不超过±0.5 mg/L;(5,20] mg/L 内,线性相对偏差不超过±10%。
2.1.6 重复性重复测试(0.6±0.12) mg/L正常质控样品,所得结果的变异系数应不大于15% ,重复测试(12±2.4) mg/L异常质控样品,所得结果变异系数应不大于10%。
2.1.7批间差测定(0.6±0.12) mg/L和(12±2.4) mg/L质控样品所得结果的批间相对极差(R)应不大于15%。
2.1.8阴性预测率用于静脉血栓排除时,结合临床诊断的验前概率进行D-二聚体定量检测,其阴性预测率应不低于97%。

D二聚体测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量检测人血清中D二聚体的浓度。
1.1包装规格a) 试剂1:1×18ml,试剂2:1×6ml;b) 试剂1:1×30ml,试剂2:1×10ml;c) 试剂1:2×30ml,试剂2:2×10ml;d) 试剂1:1×15ml,试剂2:1×5ml;e)试剂1:2×150ml,试剂2:2×50ml;f)试剂1:1×16.8ml,试剂2:1×5.6ml。
1.2主要组成成分试剂1主要组成成分试剂2组成成分2.1 外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2试剂1应为无色透明液体;试剂2应为乳白色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白吸光度测定试剂空白吸光度,应≤1.70;2.4 分析灵敏度测试18mg/L的被测物时,吸光度变化率(△A)应不低于0.05。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应在80%~120% 范围内。
2.6 精密度2.6.1重复性重复测定正常值和高值浓度的样本,变异系数(CV)应不超过5%。
2.6.2.批间差用两个不同浓度样本分别测试3个不同批号的试剂盒,变异系数(CV)应不超过10%。
2.7 线性2.7.1 在(0.5,48.0)mg/L范围内,线性回归的相关系数应不低于0.990;2.7.2(2.5,48.0)mg/L范围内,相对偏差≤15%。
2.7.3(0.5,2.5]mg/L范围内,绝对偏差≤0.5mg/L。
2.8 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

D-二聚体测定试剂盒(胶乳免疫比浊法)适用范围:本产品与ABBOTT仪器配套使用,用于体外定量测定人血清或血浆中的D-二聚体的含量。
1.1 包装规格表1 包装规格1.2 主要组成成分表2 组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为乳白色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或黄色粉末状物质,复溶后为无色或黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或黄色粉末状物质,复溶后为无色或黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A570nm下测定空白吸光度应≤2.3000。
2.4 准确度与已上市产品进行比对试验:在[0.5,30.0] μg/mL区间内,相关系数r≥0.975,在[0.5,10.0] μg/mL区间内测定的偏差应不超过±1.0 μg/mL,在(10.0,30.0] μg/mL区间内测定的偏差应不超过±10%。
2.5 分析灵敏度样本浓度为8.0 μg/mL时,其吸光度变化在0.0200~0.1000之间。
2.6 线性区间在[0.5, 30.0] μg/mL区间内,线性相关系数r≥0.990,在[0.5,10.0] μg/mL 区间内测定的偏差应不超过±1.0 μg/mL,在(10.0, 30.0] μg/mL区间内测定的偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低两个浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 瓶间精密度校准品、质控品的瓶间精密度应≤10%。
2.9 稳定性2.9.1 试剂稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。

D-二聚体测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血浆中D-二聚体的含量。
1.1 型号定制规则试剂1:1×15mL ,试剂2 :1×5mL;试剂1:1×30mL,试剂2:1×10mL;试剂1:3×30mL,试剂2:1×30mL;试剂1:1×45mL,试剂2:1×15mL;试剂1:1×60mL,试剂2:1×20mL;试剂1:2×60mL,试剂2: 2×20mL;试剂1:3×60mL,试剂2:1×60mL;试剂1:28×4mL,试剂2:14×2.8mL。
产品组成:试剂1:Tris缓冲液(pH8.0),浓度20 mmol/L;试剂2:包被羊抗人D-二聚体多抗的胶乳颗粒液,≥1.5 mg/L。
2.1外观2.1.1 试剂1为无色透明液体,无可见不溶物。
2.1.2 试剂2为白色或微黄色胶乳液体。
2.1.3 标签内容清晰,字迹不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤1.5(波长600nm,光径1cm)。
2.4 分析灵敏度2mg/L的D-二聚体样本,吸光度变化在0.010~0.100范围内。
2.5 线性范围2.5.1 [0.5,40]mg/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)不低于0.990。
2.5.2 [0.5,5]mg/L范围内,绝对偏差介于±0.75mg/L之间;(5,40]mg/L 范围内,相对偏差介于±15%之间。
2.6 测量精密度2.6.1 批内精密度低值控制样品,变异系数CV≤15%,高值控制样品,变异系数CV≤10%。
2.6.2 批间差低值控制样品,变异系数CV≤15%,高值控制样品,变异系数CV≤10%。
2.7 准确度与已上市产品进行对比试验,相关系数r≥0.975。

D-二聚体(D-Dimer)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血浆中D-二聚体的含量。
1.1 包装规格试剂1:1×80mL,试剂2:1×20mL;试剂1:50×240μL,试剂2:1×3mL;试剂1:30×240μL,试剂2:1×1.8mL。
1.2 主要组成成分2.1 外观和性状试剂1应为无色澄清液体,无异物。
试剂2应为乳白色悬浮液,无沉淀。
2.2 净含量每瓶试剂的净含量应不少于标示值。
2.3 试剂空白吸光度用纯化水加入试剂作为样品测试时,试剂空白吸光度A应≤1.70。
2.4 分析灵敏度测含已知浓度D-二聚体(D-Dimer)的样本时,吸光度差值(ΔA)应≥0.10。
2.5 线性试剂盒在[0.5,20]mg/L的线性范围内分析性能应符合如下要求:2.5.1 性相关系数(r)≥0.990;2.5.2 相对偏差:(2.5,20]mg/L范围内,相对偏差不超过8%;2.5.3 绝对偏差:[0.5,2.5]mg/L范围内,绝对偏差不超过0.2mg/L。
2.6 测量精密度2.6.1 重复性用高低两个浓度样本重复测试,所得结果的变异系数(CV)应≤8.0%。
2.6.2 批间差试剂盒的批间相对极差(R)应≤10.0%。
2.7 准确度与已上市产品比对,用线性回归方法计算两组结果,相关系数(r)≥0.975,各个浓度点中≤2.5mg/L的绝对偏差不超过±0.2mg/L。
各个浓度点中>2.5mg/L的相对偏差不超过±8%。
2.8 稳定性2℃~8℃避光贮存,有效期为12个月,取过有效期后一个月内的试剂盒进行检测,试剂盒应仍能符合2.1、2.3、2.4、2.5、2.6.1、2.7要求。

D-二聚体测定试剂盒(上转发光法)
适用范围:与本公司生产的上转发光免疫分析仪配套使用,用于体外定量测定人血浆样本中D-二聚体(D-dimer)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 外观
2.1.1 液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2 液体试剂的净含量应不少于标示值。
2.1.3 试纸条宽度应为4.0±0.1nm。
2.1.4 液体移行速度应不低于10mm/min。
2.2准确性
检测D—二聚体(D-dimer)纯品,其回收率应在(85%~115%)范围内。
2.3线性范围
[50,5000]ng/mL范围内,相关系数(r)应不低于0.9900。
2.4 精密度
2.4.1 批内变异系数(CV):分别检测(1000±100)ng/mL、(200±20)ng/mL 的样本,批内变异系数应均不高于15.0%。
2.4.2 批间变异系数(CV):检测(200±20)ng/mL的样本,批间变异系数应不高于15.0%。
2.5空白检测限
试剂盒空白检测限应不大于25ng/mL。
2.6 特异性
2.7 稳定性
本产品有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6项要求。

D-二聚体检测试剂盒(免疫比浊法)适用范围:用于体外定量检测人血浆的D-二聚体含量。
1.1 包装规格乳胶试剂:1×3ml、磷酸缓冲液:1×7ml、氯化钠溶液:1×5ml;乳胶试剂:2×3ml、磷酸缓冲液:2×7ml、氯化钠溶液:2×5ml;乳胶试剂:1×4.5ml、磷酸缓冲液:1×10ml、氯化钠溶液:1×10ml;乳胶试剂:2×4.5ml、磷酸缓冲液:2×10ml、氯化钠溶液:2×10ml;乳胶试剂:1×6ml、磷酸缓冲液:1×12ml、氯化钠溶液:1×12ml;乳胶试剂:2×6ml、磷酸缓冲液:2×12ml、氯化钠溶液:2×12ml。
1.2 主要成份2.1 外观a)试剂盒外观应该整洁,文字符号标识清晰,包装无破损。
b)乳胶试剂位乳白色悬浊液。
c)磷酸缓冲液为无色透明液体。
d)氯化钠溶液为无色透明液体。
2.2 装量各组成成分的装量应不低于产品标示量。
2.3 准确性用纯品做回收试验,回收率在85%-115%之间。
2.4 线性测定试剂在(50, 3200)ng/ml范围内,线性相关系数应r>0.98。
2.5 重复性用正常质控血浆和异常质控血浆重复测定所得结果的变异系数(CV)应≤10%。
2.6 批间差用三个不同批号的试剂测试正常值质控血浆,所得结果的变异系数(CV)≤14%。
2.7 稳定性a)开瓶稳定性:开瓶后样品在2℃~8℃条件下,保存24小时,取该样品检测外观、准确性应符合2.1、2.3的要求。
b)效期稳定性:试剂在2℃~8℃条件有效期为12个月。
取到效期后的样品检测外观、准确性、线性、重复性,应符合2.1、2.3、2.4、2.5的要求。
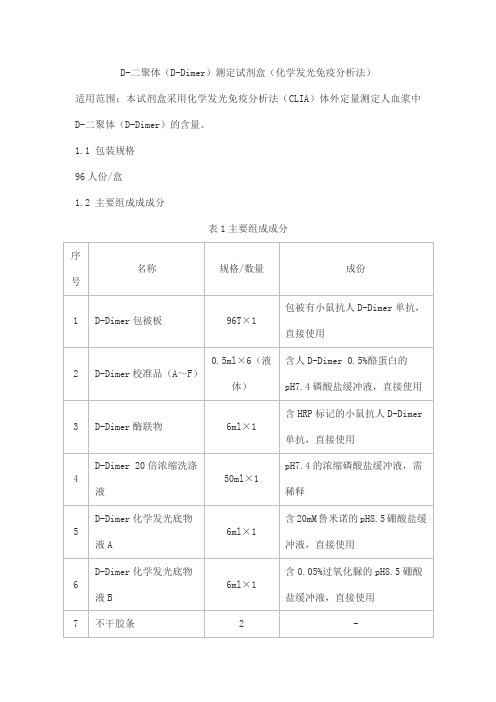
D-二聚体(D-Dimer)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血浆中D-二聚体(D-Dimer)的含量。
1.1 包装规格
96人份/盒
1.2 主要组成成成分
表1主要组成成分
注:校准品采用生物梅里埃D-二聚体排除试验试剂盒(酶联免疫荧光法)比对赋值,校准品(A~F)目标浓度为0、100、300、1000、2000、5000ng/ml FEU。
2.1 外观
组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量
液体装量应不少于标示值。
2.3 准确度
在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在
85~115%范围内。
2.4 线性
在线性范围[50,5000]ng/ml FEU内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限
应不大于50ng/ml FEU。
2.6 重复性
变异系数(CV)应不大于10.0%。
2.7 批间差
批间变异系数(CV)应不大于15.0%。
2.8 分析特异性
测定浓度为4g/L纤维蛋白原,交叉反应率小于0.013%。
2.9 稳定性
产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语
4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析
4.2 D-Dimer:D-二聚体
4.3 RLU:Relative Light Unit相对光单位。

D-二聚体(D-Dimer)测定试剂盒(胶体金免疫层析法)产品技术要求贝尔D-二聚体(D-Dimer)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量测定人血清或血浆中的D-二聚体(D-Dimer)含量。
1.1 包装规格20人份/盒1.2主要组成成分本试剂盒由D-Dimer检测卡、干燥剂和滴管组成。
D-Dimer检测卡由试纸条外壳与试纸条构成,试纸条由样品垫、胶体金垫(喷有由胶体金标记的D-Dimer单克隆抗体)、层析膜(T线包被有D-Dimer 单克隆抗体,C线包被有羊抗鼠IgG抗体)、吸水纸、衬垫构成。
检测卡为20人份/盒,干燥剂为1个/袋、滴管为20个/盒。
2.1 物理性状2.1.1 外观试剂盒各组分齐全、完整;包装袋应密封性好无破损;标签清晰;材料附着牢固,条宽应适应于卡壳且装配紧密。
2.1.2 膜条宽度膜条宽度应不低于4.0mm。
2.1.3 液体移行速度液体移行速度应不低于10mm/min。
2.2 空白检出限应小于0.1mg/L。
2.3 分析特异性分别用浓度为1000ng/mL肌酸激酶同工酶MB(CK-MB)、1000ng/ml肌红蛋白(Myo)、1000ng/ml心肌肌钙蛋白T(cTnT)、1000ng/ml心肌肌钙蛋白I(cTnI)、5000ng/ml C反应蛋白(CRP)分析特异性参考品进行测定,结果应小于0.1mg/L。
2.4 重复性用0.5mg/L D-二聚体(D-Dimer)参考品和2.0mg/L D-二聚体(D-Dimer)参考品重复检测10次,其变异系数(CV)应不大于15%。
2.5 准确度将D-Dimer含量为5.0mg/L人血清参考品加入到D-Dimer含量为0.1mg/L的正常人血清参考品中,参考品按照体积比1:9混合,对混合后样本进行检测,回收率应在85%~115%范围内。
2.6 线性D-二聚体(D-Dimer)检测线性范围为[0.1,5.0]mg/L,试剂盒相关系数r应≥0.99。
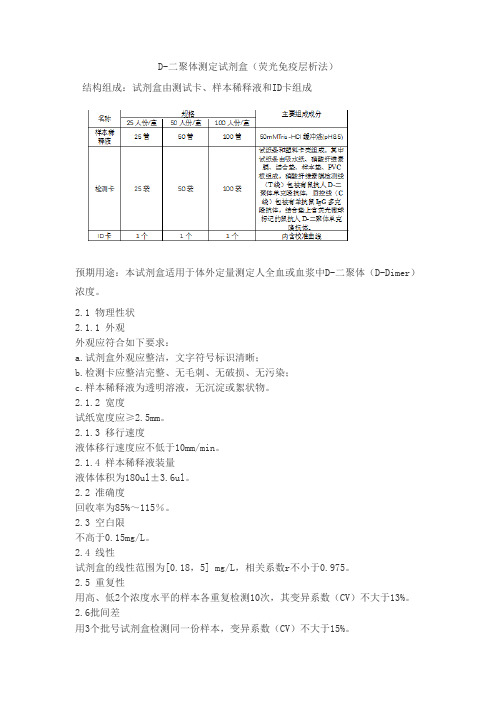
D-二聚体测定试剂盒(荧光免疫层析法)
结构组成:试剂盒由测试卡、样本稀释液和ID卡组成
预期用途:本试剂盒适用于体外定量测定人全血或血浆中D-二聚体(D-Dimer)浓度。
2.1 物理性状
2.1.1 外观
外观应符合如下要求:
a.试剂盒外观应整洁,文字符号标识清晰;
b.检测卡应整洁完整、无毛刺、无破损、无污染;
c.样本稀释液为透明溶液,无沉淀或絮状物。
2.1.2 宽度
试纸宽度应≥2.5mm。
2.1.3 移行速度
液体移行速度应不低于10mm/min。
2.1.4 样本稀释液装量
液体体积为180ul±3.6ul。
2.2 准确度
回收率为85%~115%。
2.3 空白限
不高于0.15mg/L。
2.4 线性
试剂盒的线性范围为[0.18,5] mg/L,相关系数r不小于0.975。
2.5 重复性
用高、低2个浓度水平的样本各重复检测10次,其变异系数(CV)不大于13%。
2.6批间差
用3个批号试剂盒检测同一份样本,变异系数(CV)不大于15%。
2.7 效期稳定性
试剂盒在2℃~30℃保存,有效期为18个月,取到效期后产品进行检测,检测结果应符合2.1~2.5项要求。
2.8 校准品的溯源性
根据GB/T21415-2008及有关规定提供所用校准品的来源、赋值过程以及不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。

D二聚体测定试剂盒(胶乳免疫比浊法)适用范围:本试剂盒用于体外定量测定人血浆中D-二聚体的浓度。
1.1 规格试剂1:1×60mL,试剂2:1×20mL;试剂1:4×60mL,试剂2:4×20mL;试剂1:1×7.2mL,试剂2:1×1.8mL;试剂1:1×12mL,试剂2:1×3mL;试剂1:1×80mL,试剂2:1×20mL;试剂1:4×7.5mL,试剂2:4×2.5mL;试剂1:1×60mL,试剂2:1×30mL;试剂1:4×60mL,试剂2:4×30mL;试剂1:1×60mL,试剂2:1×15mL;试剂1:4×60mL,试剂2:4×15mL;试剂1:1×60mL,试剂2:1×10mL;试剂1:4×60mL,试剂2:4×10mL;试剂1:2×45mL,试剂2:2×15mL;试剂1:1×45mL,试剂2:1×15mL;试剂1:1×3L,试剂2:1×1L;试剂1:1×15L,试剂2:1×5L。
1.2 主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色透明溶液;试剂2:乳白色溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在570nm(540nm-600nm)处测定试剂空白吸光度,应≤1.80。
2.4 分析灵敏度测试18mg/L的被测物时,吸光度变化(ΔA)应不低于0.005。
2.5 准确度采用比对试验。
在(0.5,20]mg/L区间内,线性回归的相关系数r应不低于0.990。
在(0.5,8)mg/L区间内绝对偏差不超过±1.2mg/L;[8,20]mg/L区间内相对偏差不超过±15%。
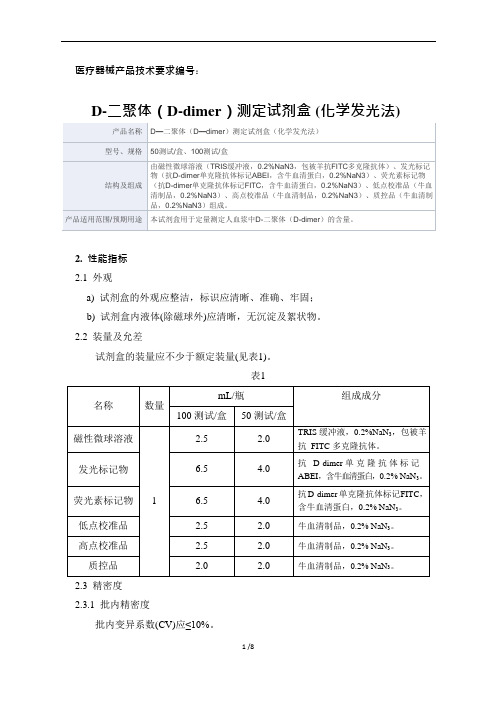

D-二聚体(DD)测定试剂盒(免疫比浊法)产品技术要求lidemanD-二聚体(DD)测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人体血浆或血清中D-二聚体的含量。
1.1规格缓冲液:6×10mL,胶乳试剂: 5×4mL;缓冲液:6×5mL,胶乳试剂: 2×5mL;缓冲液:2×12mL,胶乳试剂: 2×4mL;缓冲液:5×9mL,胶乳试剂: 5×3mL;1.2试剂组成:缓冲液:MOPS缓冲液:50mM (PH=6.7)。
试剂:胶乳颗粒包被的DD抗体:0.6mg/mL。
2.1 外观试剂盒外观应整洁,文字符号标识清晰;D-二聚体胶乳试剂应为均匀的乳浊液;D-二聚体缓冲液为透明溶液,无沉淀或絮状物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 分析灵敏度用光学法(绿色滤光片)检测浓度为1μg/ml的样品时,吸光度变化的绝对值范围为(0.01–0.20)ABS。
2.4 线性范围在[0.2,20.0]μg/ml线性范围内,线性相关系数r ≥0.990。
测定结果在(2,20]μg/ml范围内,相对偏差不超过±15%;测定结果在[0.2,2]μg/ml范围内,绝对偏差不超过±0.3 μg/ml。
2.5 精密度检测血浆样本,CV≤15%。
2.6 批间差检测血浆样本,CV≤15%。
2.7 准确度回收率:回收率85%-115%。
2.8 稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其线性范围、精密度和准确度应分别符合2.4、2.5和2.7的要求。

D-二聚体(DD)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人体血浆中D-二聚体的含量。
1.1试剂盒包装规格试剂1:1×15ml,试剂2:1×5ml;试剂1:2×45ml,试剂2:2×15ml;试剂1:4×54ml,试剂2:4×18ml;试剂1:2×300ml,试剂2:1×200ml。
校准品(选配,冻干品):1×1ml。
质控品(选配,冻干品):2×0.5ml(两水平)。
稀释液(选配):2×4ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色澄清液体,无沉淀和絮状物;试剂2均匀的乳浊液。
校准品:冻干品,复溶后为无色至淡黄色澄清液体。
质控品:冻干品,复溶后为无色至淡黄色澄清液体。
稀释液:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、570nm波长、1cm光径条件下,试剂空白吸光度应不大于2.0。
2.4 分析灵敏度测定浓度为0.5mg/L样本时,吸光度变化的绝对值(|ΔA|)应在(0.005,0.15)范围内。
2.5 线性范围在(0.2,15.0)mg/L范围内,线性相关系数r不小于0.990。
在(2.0,15.0)mg/L区间内线性相对偏差应不大于±15%,(0.2,2.0] mg/L区间内线性绝对偏差应不大于±0.3mg/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于10%。
2.7 批间差不同批号试剂测试同一份样本,测定结果批间相对极差应不大于15%。
2.8 准确度与已上市产品进行比对试验:在(0.2,15.0)mg/L范围内,与比对系统的相关系数r不小于0.975;在(2.0,15.0)mg/L区间内与比对系统的相对偏差应不大于±15%,(0.2,2.0] mg/L区间内与比对系统的绝对偏差应不大于±0.3mg/L。

D-二聚体检测试纸(胶体金免疫层析法)
适用范围:该产品用于体外定性检测人血浆样本中的D-二聚体。
1.1 规格
卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2 组成
包括D-二聚体检测试纸、滴管和干燥剂。
D-二聚体检测试纸由样品垫、硝酸纤维素膜(T线包被鼠抗人D-Dimer单克隆抗体;C线包被兔抗鼠多克隆抗体)、金标垫(胶体金标记的鼠抗人D-Dimer单克隆抗体)、吸水纸、塑料载板组成。
2.1 物理性状
2.1.1 外观
试纸应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2膜条宽度
试纸的宽度≥2.5mm。
2.1.3液体移行速度
液体移行速度应不低于10 mm/min。
2.2 临界值及重复性
本试剂盒临界值为0.3μg/mL。
a)对浓度为0.5μg/mL的D-二聚体样本检测次数≥20,结果的阳性率应≥95%。
b)对浓度为0.1μg/mL的D-二聚体样本检测次数≥20,结果的阴性率应≥95%。
2.3分析特异性
检测含有干扰物质15mg/mL纤维蛋白原的阴性样本3次,结果应不出现阳性。
2.4钩状效应
检测浓度为20.0μg/mL的人D-二聚体样本3次,结果应不出现阴性。
2.5批间差
抽取三个批号的D-二聚体检测试纸,每个批次至少40人份,按2.2临界值的检验方法检测,3个批次各浓度反应结果应一致。
2.6稳定性
将试纸在4℃~30℃的环境中放置18个月,效期后1个月内取样分别检测2.1~2.4项,结果应符合各项目的要求。

D-二聚体校准品适用范围:与本公司生产的试剂盒配套使用,用于D-二聚体检测系统的校准。
1.1包装规格水平1:1×0.5mL、水平2:1×0.5mL、水平3:1×0.5mL、水平4:1×0.5mL、水平5:1×0.5mL、水平6:1×0.5mL。
1.2组成本产品状态为冻干粉末,是以人血清为基质,含D-二聚体。
主要组分见表1:表1主要组成成分校准品靶值批特异,详见说明书。
2.1外观和性状2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度做样品比对,待测系统与比对系统相关系数(r)应不小于0.975;在[5,20]mg/L 区间内,相对偏差应不超过±15%;在[0.5,5)mg/L区间内,绝对偏差应不超过±0.75mg/L。
2.3重复性变异系数(CV)应不超过10%。
2.4批内瓶间差变异系数(CV)应不超过10%。
2.5量值溯源根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,本公司D-二聚体校准品溯源至公司内部工作校准品,并与已上市产品比对赋值。
2.6稳定性2.6.1复溶稳定性复溶后的校准品在2℃~8℃条件下密闭保存,可以稳定2天,应符合2.2、2.3之规定。
复溶后的校准品在-20℃条件下密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性该产品在2℃~8℃条件下贮存有效期为24个月,取效期末的产品进行检测,应符合2.2、2.3之规定。
D-二聚体测定试剂盒(胶乳免疫比浊法)
适用范围:本产品用于体外定量测定人血浆中D-二聚体(D-Dimer)含量。
1.1 包装规格
见表1。
表1 包装规格
1.2 主要组成成分
本产品由D-Dimer试剂1、D-Dimer试剂2组成。
D-Dimer试剂1主要成分为三羟甲基氨基甲烷缓冲液,含量0.01mol/L;D-Dimer试剂2主要成分为包被鼠抗人D-Dimer单克隆抗体的胶乳颗粒悬浊液,含量0.17%。
2.1 外观
2.1.1 试剂盒外观应整洁,文字符号标识清晰;
2.1.2 D-Dimer试剂1应为无色均匀液体;D-Dimer 试剂2应为白色均匀乳液。
2.2 空白吸光度
试剂空白吸光度差值(△A)≤0.02。
2.3 灵敏度
D-Dimer 8μg/mL时,吸光度差值(△A)应≥0.02。
2.4 准确度
用于静脉血栓排除时,结合临床诊断的验前概率进行D-二聚体定量检测。
其阴性预测率应不低于97%。
2.5 线性范围
2.5.1 在D-Dimer试剂盒线性范围0.2~8μg/mL,γ≥0.990。
2.5.2 线性偏差: 在[0.2,1]μg/mL浓度范围内,线性偏差≤±0.1μg/mL;在(1,8]μg/mL浓度范围内,线性偏差≤±10%。
2.6 重复性
2.6.1 用正常质控血浆(浓度范围是0.5±0.3μg/mL)重复测试D-Dimer试剂盒,所得结果变异系数(CV)≤8%。
2.6.2 用异常质控血浆(浓度范围是4±2μg/mL)重复测试D-Dimer试剂盒,所得结果变异系数(CV)≤5%。
2.7 批间差
用正常质控血浆(浓度范围是0.5±0.3μg/mL)重复测试不同批号D-Dimer试剂盒,所得结果变异系数(CV)≤10%。
2.8 装量
D-Dimer试剂盒中液体性状试剂的装量不少于其试剂瓶瓶签的标称量。
2.9 稳定性
D-Dimer试剂盒在2℃~8℃密闭的贮存条件下保存至有效期12个月后3个月内,产品性能应符合2.3、2.4.2、2.5、2.6条规定的要求。