
电导分析法(2)
课题导入:
前面学过了电导分析法的基本原理,以及电导和浓度的关系。下面我们继续学习怎样利用电导进行浓度的测量。
三、溶液电导的测量
电导是电阻的倒数,因此测量电导实际上就是测量它的电阻。
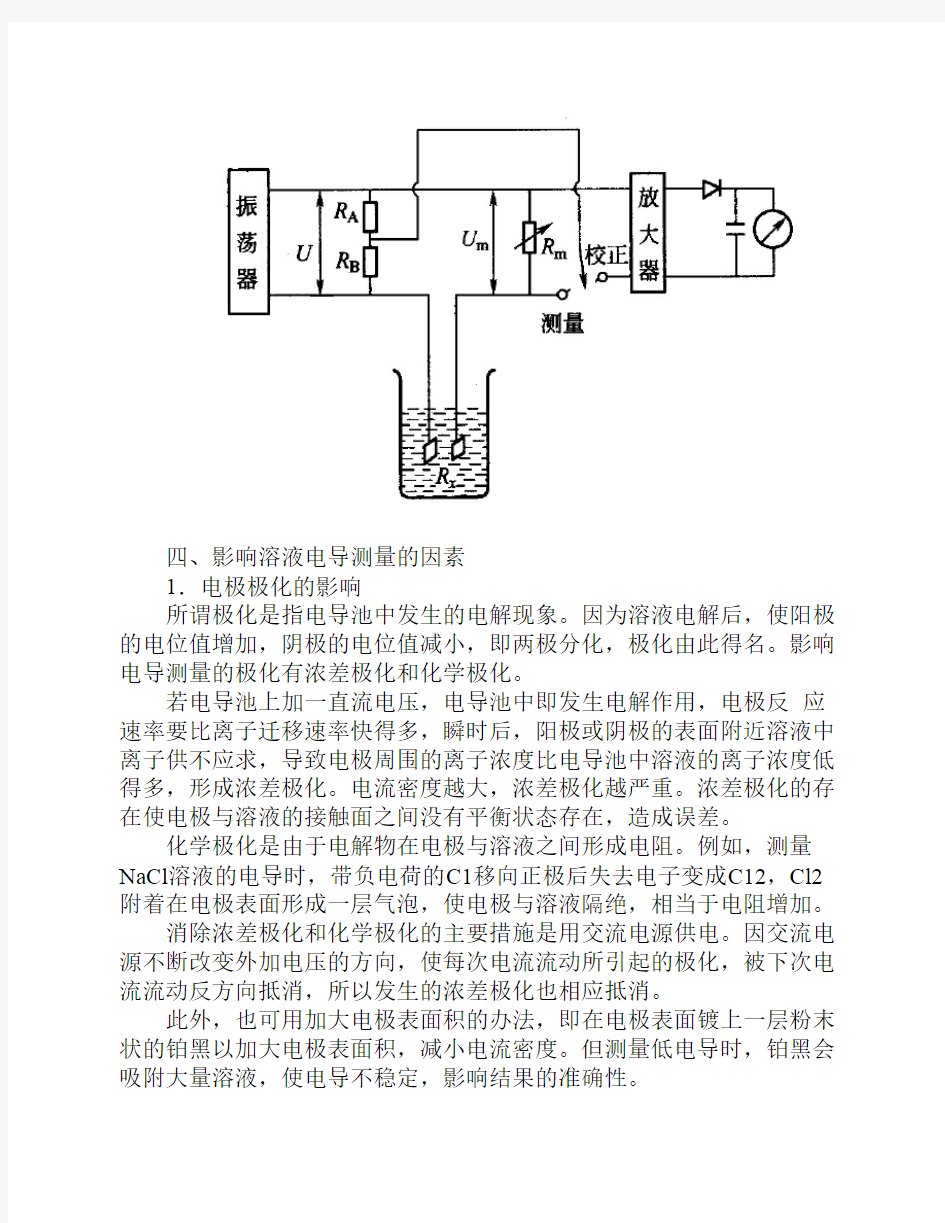
电导的测量装置包括电导池和电导仪。
1.电导池
电导池是有两个电导电极构成。电导电极一般由两片平行的铂制成的。
测量电导的铂黑电极,表面积大,电流密度小,极化作用也就小,用于测量电导率高的溶液。在测量低电导率的溶液时,铂黑对电解质有强烈的吸附作用而出现不稳定现象,这时不宜用光亮铂电极。
2.溶液电导的测量方法
电阻分压法,平衡电桥法,不平衡电桥法。平衡电桥法的原理如下:
四、影响溶液电导测量的因素
1.电极极化的影响
所谓极化是指电导池中发生的电解现象。因为溶液电解后,使阳极的电位值增加,阴极的电位值减小,即两极分化,极化由此得名。影响电导测量的极化有浓差极化和化学极化。
若电导池上加一直流电压,电导池中即发生电解作用,电极反应速率要比离子迁移速率快得多,瞬时后,阳极或阴极的表面附近溶液中离子供不应求,导致电极周围的离子浓度比电导池中溶液的离子浓度低得多,形成浓差极化。电流密度越大,浓差极化越严重。浓差极化的存在使电极与溶液的接触面之间没有平衡状态存在,造成误差。
化学极化是由于电解物在电极与溶液之间形成电阻。例如,测量NaCl溶液的电导时,带负电荷的C1移向正极后失去电子变成C12,Cl2附着在电极表面形成一层气泡,使电极与溶液隔绝,相当于电阻增加。
消除浓差极化和化学极化的主要措施是用交流电源供电。因交流电源不断改变外加电压的方向,使每次电流流动所引起的极化,被下次电流流动反方向抵消,所以发生的浓差极化也相应抵消。
此外,也可用加大电极表面积的办法,即在电极表面镀上一层粉末状的铂黑以加大电极表面积,减小电流密度。但测量低电导时,铂黑会吸附大量溶液,使电导不稳定,影响结果的准确性。
2.电容的影响
仪器用交流电源供电后,电容的影响就不容忽视。因为电容的存在会改变两个极片间的电阻值,影响测量结果。消除电容影响可采取两种措施:一是加大极片面积和极间距离,从而加大溶液的电阻,这种措施必然受到一定的限制;二是加大电源的频率,因为频率愈高,电容影响愈小,尤其是在溶液浓度较大的情况下,所用电源的频率都要略高一此。
3.温度的影响
电解质溶液的电导率随温度的升高而增加,一般每升高1℃,电导率约增加2%。温度升高后可增加离子活动的能量,使离子迁移速率加快,从而使电导率增加。因此,对于精密测量应在恒温下进行,或者仪器增设温度补偿线路。一般的电导测定要求在短时间内温度稳定就行了。
4.其他杂质的影响
由于溶液电导与浓度存在线性关系,因此空气中若存在某些杂质(如CO2、NH3)而被溶液吸收或蒸馏水中存在微量杂质均会影响电导的测定。为了减少这些杂质的影响,要求使用纯度较高的蒸馏水,必要时应用蒸馏水加少量高锰酸钾的碱性溶液进行重蒸馏以驱除氨。
五、电导分析法及应用
(一)直接电导法
直接根据溶液的电导与被测离子浓度的关系来进行分析的方法,叫做电导法。电导法主要应用于水质纯度的鉴定及生产中某些中间流程的控制及自动分析,强电解质溶液总浓度的测定,土壤,海水的盐度。
1、水质监测
工业上的锅炉用水及排放的废水、河流、湖泊,实验室用水等都需要对水的质量指标作监测。水的电导率是反映水质的很重要的一个指标。它反映了水中电解质的总含量——可溶性的无机盐类。但一些非导电物质,如有机物、细菌、藻类及其它
悬浮杂质不能在电导率上反映出来。
水的类型自来水普通蒸馏
水离子交换水
电导率(κ/s·cm-1)5.26×10-4
(~10-
4)
2.9×10-6
(~10-
6)
5×10-7
(~10-
7)
2.大气监测
由各种污染源排放的大气污染气体主要有SO2、CO、CO2及N X O Y等。可利用气体吸收装置,将这些气体通过一定的吸收液,利用反应前后电导率的变化来间接反映气体的浓度.该法灵敏度高,操作简单,并能获得连续读数,因而在环境监测中广泛应用.
例:大气中SO2的测定,SO2气体用H2O2吸收,SO2被H2O2氧化为H2SO4后电导率增加,由此可计算出大气中SO2的含量。
SO2 + H2O2 → H2SO4 + H2O
可用此法测定大气中HCl、 HF、 CO2等气体。
(二)电导滴定法
电导滴定法是根据滴定过程中溶液电导的变化
来确定滴定终点,滴定剂与溶液中待测离子反应生成水,沉淀或难离解的化合物,使溶液的电导发生变化,而在化计点时滴定曲线上出现转折点,指示滴定终点。
摩尔电导H+> OH- > Na+
1.强酸强碱的滴定
如用NaOH滴定HCl,反应为
H+ + Cl- + Na+ + OH- = Na+ + Cl- +H2O
H++Cl-H+余+Na++Cl-+H2O 滴定前化计点前
Na++Cl-+ H2O Na+ + Cl- +OH-
化计点化计点后
在滴定过程中,由于滴定剂的加入而使溶液不断稀释,为了减小稀释效应的影响和提高方法的准确度,应使用浓度较大的滴定剂,一般是滴定剂浓度比被滴溶液浓度大10倍。
电导滴定法还可以测定用指示剂法或电位法无法直接准确测定的相当弱的酸,例如,硼酸
(Ka=5.8×10-10)。
电导滴定还可应用于沉淀滴定、配位滴定、氧化还原滴定。
2.弱酸(或弱减)的滴定
如NaOH滴定弱酸
HA + Na+ + OH- = H2O + Na+ + A-
若弱酸的离解常数越小,起始电导值越低,滴定开始时,由于滴定反应产物A-抑制HA的离解,溶液电导逐渐降低,随着滴定的进行,非电导的弱
酸HA转变为导电较好的盐、Na+、A-。溶液的电导开始上升,在化计点以后,NaOH过量,使电导
增加迅速,转折点为溶液终点。
HA→HA余+Na++A- →A-+Na+→A- +Na++ OH-
滴定前化计点前化计点化计点后
电导分析法(2) 课题导入: 前面学过了电导分析法的基本原理,以及电导和浓度的关系。下面我们继续学习怎样利用电导进行浓度的测量。 三、溶液电导的测量 电导是电阻的倒数,因此测量电导实际上就是测量它的电阻。 电导的测量装置包括电导池和电导仪。 1.电导池 电导池是有两个电导电极构成。电导电极一般由两片平行的铂制成的。 测量电导的铂黑电极,表面积大,电流密度小,极化作用也就小,用于测量电导率高的溶液。在测量低电导率的溶液时,铂黑对电解质有强烈的吸附作用而出现不稳定现象,这时不宜用光亮铂电极。 2.溶液电导的测量方法 电阻分压法,平衡电桥法,不平衡电桥法。平衡电桥法的原理如下:
四、影响溶液电导测量的因素 1.电极极化的影响 所谓极化是指电导池中发生的电解现象。因为溶液电解后,使阳极的电位值增加,阴极的电位值减小,即两极分化,极化由此得名。影响电导测量的极化有浓差极化和化学极化。 若电导池上加一直流电压,电导池中即发生电解作用,电极反应速率要比离子迁移速率快得多,瞬时后,阳极或阴极的表面附近溶液中离子供不应求,导致电极周围的离子浓度比电导池中溶液的离子浓度低得多,形成浓差极化。电流密度越大,浓差极化越严重。浓差极化的存在使电极与溶液的接触面之间没有平衡状态存在,造成误差。 化学极化是由于电解物在电极与溶液之间形成电阻。例如,测量NaCl溶液的电导时,带负电荷的C1移向正极后失去电子变成C12,Cl2附着在电极表面形成一层气泡,使电极与溶液隔绝,相当于电阻增加。 消除浓差极化和化学极化的主要措施是用交流电源供电。因交流电源不断改变外加电压的方向,使每次电流流动所引起的极化,被下次电流流动反方向抵消,所以发生的浓差极化也相应抵消。 此外,也可用加大电极表面积的办法,即在电极表面镀上一层粉末状的铂黑以加大电极表面积,减小电流密度。但测量低电导时,铂黑会吸附大量溶液,使电导不稳定,影响结果的准确性。
德国AMER电导率仪OLM 在线电导率仪,电阻率,酸碱浓度计 l iquisys M OLM223,OLM253电导率 仪采用模块化设计,应用广泛。基本 型变送其提供简单的测量和报警功能, 扩展功能软件和硬件模块化后可以应 用于特殊的场合,如果需要,可使用扩 展模块。 德国AMER在线电导率仪应用 超纯水 水处理 离子交换 污水 反渗透 冷却水脱盐 德国AMER在线电导率仪OLM一般参数 分辨率: 0.5%显示 隔离输出: 0-20mA或4-20mA,500ohm负荷(最大) 报警器:最多4组报警点,SPDT, NO或NC 控制输出: P,PI,PD,PID电磁阀或脉冲泵 电极兼容性:两个电极或感应电导电池 电源: 115/230V AC,50/60Hz或24V AC/DC 温度补偿:自动或手动Pt 100 防护等级: OLM223 IP54(面板),IP30(机体) OLM253 IP65 尺寸:OLM223 LxWxD 96X96X145mm 面板安装 OLM253 LxWxD 247X170X115mm 现场壁挂安装 德国AMER在线电导率仪OLM特点和优点 适用于双电极测量传感器(电导式或电感式) 触电可设定为USP报警(预先报警/可调) 触电可长时间延迟,适用于冷却水应用场合 专门超纯水补偿 极化监测和报警信号输出
直接进入手动触点控制 HART或PROFIBUS-PA通信 可扩展的基本单元: 2个或4个触点用于: - 限位触点(也可用作温度) - P(ID)控制器 - 冲洗过程的定时器 - 完全的化学清洗 扩展软件包 - 任意电流输出组态 - 报警或超限时启动自动清洗 - 超纯水监测系统,符合USP 23(限电导式传感器) - 极性检测(限电导式传感器) - 浓度测量(%/TDS) - 通过表对温度进行补偿 - 测量单元的在线检查 HART通讯协议 第二路电流输出用于温度 电导率电极: OLS19 OLS15 OLS21 飞蓝
电导分析法的基本原理 一、电解质溶液的导电性能 电解质溶液和非电解质溶液的最显著的差别是:前者能够导电,后者不能。前者能够导电是因为电解质在水溶液中能够电离,生成阳离子和阴离子,在电场作用下他们将向相反方向移动,形成电流,产生导电现象。因此电解质溶液是一种离子导体。离子导体还包括熔盐、固体电解质、离子交换树脂膜等,所以电解质泛指有一定离子导电性的物相。 1、调节恒温水浴温度为25.00±0.1℃ 2、配制标准溶液要用去离子水或二次蒸馏水。 将电导率仪常数调节器置于电导池常数的相应位置,并将电导仪调至相应的量程档,对该档进行校正,指针能满量程指示。分别将电导率标准溶液放入恒温在20℃的恒温槽内,用电导率仪直接测量恒温在20℃的电导率标准溶液,重复测量3次。 使用方法: 1、未开电源开关前,观察表针是否指零,如不指零,可调正表头上的螺丝,使表针指零。 2、将校正、测量开关K2扳在“校正”位置。 3、插接电源线,打开电源开关,并预热数分钟(待指针完全稳定下来为止)调节“调正” 调节器使电表指示满度。 4、 电导、电导率、摩尔电导率的概念 (1)电导(conductance) 描述离子导体(电解质溶液等)的导电能力时常采用电阻R的倒数——电导G来描述,即 式中,电导G的单位是S[西门子(siemens)],1S=1Ω-1;R的单位为Ω(欧);l为导体的长度,m;A为导体的截面积,m2;ρ为电阻率,Ω·m。电导的数值除与电解质溶液的本性有关外还与离子浓度、电极大小、电极距离有关。 (2)电导率(conductivity) 电导率k是电阻率的倒数 K的单位是S/m或1/(Ω·m)。k是电极距离为1m,且两极板面积均为1 m2时电解质溶液的电导,故k有时亦称为比电导。K的数值与电解质种类、温度、浓度有关。若溶液中含有B种电解质时,则该溶液的电导率应为B种电解质的电导率之和,即 (3)摩尔电导率(molar conductivity)
川仪工业电导率分析仪检修规程 1总则 1.1适用范围 工业电导率仪与相应的电导池配套,可广泛用于电力、化工、冶金、制药、造纸、半导体等工业部门,是工业流程中连续准确监测电解质溶液电导率的重要仪器。 1.2 基本工作原理 电极式电导率测量:工作时,通过交流电测得流过电极的电流,就知道溶液的电导率。 1.3 构成及功能 仪器由五大块相对独立的电路组成:电源、微机电路、显示电路、信号电路、输出电路。信号电路将电极测量到的信号处理后传送给微处理器进行处理,微处理器对信号进行处理,将结果送给显示电路和输出电路,并反馈给信号电路进行控制。 1.4主要技术性能指标 a电导率测量范围:
b温度补偿范围: 0~60℃ c仪器基本误差: 不大于±2%F·S d输出信号:直流隔离输出:4~20mA 负载不大于600Ω 0~1V 负载不小于200Ωe报警: (1)报警点及死区可设置 (2)继电器触点负荷:220V(交流),3A f仪器使用条件 环境温度:0~40℃ 相对湿度:≤90% 介质温度:-10~140℃ 电源:电压220V±10%
频率50±0.5Hz 无强磁场干扰,无强烈振动,无腐蚀性气体。 1.5主要安装要求 仪器一定要可靠接地; 电源线从仪器的右下方出线套中穿入; 电导池电缆从仪器左下方出线套中穿入; 避免将电导池与控制器间的连线与高电位开关电路(电机启动负载等)平行。 1.6 对分析仪表维修人员的要求 分析仪表维修人员应具备如下条件 a. 熟悉本规程及仪表说明书等有关技术资料; b. 熟悉工艺流程,了解该仪表在其中的作用; c. 必须具有高中以上文化程度,有一定的物理、化学、电子技术、机械等基础知识,具有色谱专业基础和基本的维修技能; d. 能够正确地使用常用和具体仪表要求的专用测试仪器; e. 对一些常见的仪表故障应具有分析判断和处理能力。 2 维护 2.1.1.更换保险丝 a)切断电源; b)适当用力向下拉面板下方的弹性搭扣,打开机箱门; c)取下显示电路板; d)更换位于电源接线端子下面的保险丝管。 2.1.2电源检查 机箱内电源板上“X2”为直流电源24V、±5V、±15V直流电源测试点。2.1.3输出板调节:端子A、B开路;
电位分析仪的基本原理 电位分析法是电化学分析法的一种。电化学分析法是仪器分析法的一个重要组成部分.它是根据溶液中物质的电化学性质及其变化规律,通过在电位、电导、电流和电量 竿电学量与被测物质的某些量之间建止计量关系,对被测组分进行定性和定量的仪器分 析方法。 1.电化学分析法的分类 电化学分析法—般可以分为以F二类。 第一炎是根据试液的浓度在特定实验条件下与化学电池中的某一心参数之间的义系求得 分析结果的方法。这是电化学分析法的主要类型。电导分析法、库仑分析法、电位分析法、伏文法和极诺分析法等均属于这种类型。 第二类是利用电参数的突变来指示容量分析终点的方法。这类力法仍以容量分析为基础,根据所用标准溶液的浓度和消耗的体积求出分析结果。这类方法根据所测定的电参数的不同.分为电才滴定法、电位滴定法和电流摘定法。 第二类是电重量法,或称电解分析法。这类方法通过在试液中通人直流电流,位被测组分在电极JI:还原沉积祈比,与共存组分分离,然后再对电极上的析出物进行重量分析以求出 被测组分的含量。 2.电化学分析法的特点 电化学分析法的灵敏度和准确度都很高,适用面也很广泛。由于征测定过程中得到的是IU学信号,因而易于实现自动化和连续分析。电化学分析法齐化学研究中也具有十分重要的 作用,现已广泛应用于电化学基础理论、有机化学、药物化学、生物化学、临床化学等许多领域的研究中。总之,屯化学分析法对成分分析(定性教定量分析)、生产过程控制和科学 研究等许多方面部且花很重要的意义。 3.电位分析法的特点 电伦分析法是电化学分析法的一个重要分支,它的实质是通过在罕电流条件下测定两电极间的电伦差(即所构成原电他的电动势)进行分析测定。电位分析法包括直接电位法和电位滴定法,本章将对这两种方法进行详细介绍。 电位分析法具有如下特点 (1)设备简单、操作方便 tr即可,操作起来也非常方便 至三二旦坚29鱼LJl— (2)方法多、应用范围广直接电位法中可采用标准曲线法、一次标准加入法和格氏作图法等进行测定;电位滴定法也可根据灾际情况灵活选择滴定方式和滴定剂。 (3)pJ用于这续、门功和遥控测定由于电位分析测量的是电学信号,所以可方便地将其传播、放大,也pI作为反馈信号来遥控测定和控制。 (4)灵敏度高、选样性好、更现性电伦分析法的灵敏度高。例如直接电位法的一般 pJ测离子的浓度范围为https://www.doczj.com/doc/077153912.html,/10’一10 i m01/I‘个别可达10☆mol/I—l对H’的浓度还可以更 低;而电位滴定这的灵敏皮则吏向。电位分析法还具有较好的选择性和重现性,有些已经作
第二章电化学分析法概论 教师:李国清 一. 教学目的: ⑴掌握电化学电池的结构和表示方法 ⑵了解电极电位、液体接界电位、电极极化的形成过程 ⑶了解电极的作用及分类 二. 教学重点: ⑴掌握电池的表示方法 ⑵了解电极的极化和电极的分类 三.教学难点: 电池的表示方法、电极的分类 四.教具:多媒体计算机。 五.教学方法:讲授、演示、提问、讨论。 六.教学过程: §1. 电化学分析的定义及特点: 一、电化学分析: 根据物质在溶液中的电化学性质及其变化来进行分析的方法称电化学分析。它是以溶液电导、电位、电流和电量等电化学参数与被测物质含量之间的关系作为计量基础。 二、电化学分析法优点: 1、准确度高 精密的库仑滴定分析法,不需要标准物质做比较,仅参考法拉第常数,误差为0.0001% 2、灵敏度高; 一般可测到10-4 ~ 10-8 mol/L,伏安分析法可测到10-10 ~ 10-12 mol/L 3、选择性好 可通过控制化学电池的某些条件,大大提高测定的选择性 4、分析速度快; 5、测定范围宽:电导、电位、电解分析法可测定常量组分,而极谱和伏安分析法可以测定痕量组分 6、仪器设备简单
§2. 电化学分析方法分类 电化学分析方法主要有下面几类: 1.电导分析法 2.电位分析法 3.电解分析法 4.库仑分析法 5.极谱法和伏安法 1.电导分析法 (1)电导滴定法:通过电导的突变来确定滴定终点,然后计算被测物质的含量。(2)直接电导法:直接测定溶液的电导值而测出被测物质的浓度。 2.电位分析法 电位分析法:用一指示电极和一参比电极与试液组成电化学电池,在零电流条件下测定电池的电动势,依此进行分析的方法。包括:⑴直接电位法⑵电位滴定法3.电解分析法 电解分析法:应用外加电源电解试液,电解后称量在电极上析出的金属的质量,依此进行分析的方法。也称电重量法。 4. 库仑分析法 库仑分析法:应用外加电源电解试液,根据电解过程中所消耗的电量来进行分析的方法。分为: ⑴控制电位库仑分析法:直接根据被测物质在电解过程中所消耗的电量来求含量。 ⑵库仑滴定法:用恒电流在100%的电流效率下进行电解,使电解过程中产生一种物质,该物质与被测物进行定量的化学反应,反应的化学计量点可用指示剂或电化学方法来指示,根据电解电流和电解消耗的时间按法拉第电解定律计算分析物的量。 5.极谱法和伏安法 两者都是以电解过程中所得的电流—电压曲线为基础来进行分析的方法。 ⑴极谱法:使用滴汞电极或其它表面能够周期性更新的液体电极,称为极谱法。 ⑵伏安法:使用表面静止的液体或固体电极,称为伏 安法。
川仪工业电导率分析仪检修规程 1总则1.1适用范围 工业电导率仪与相应的电导池配套,可广泛用于电力、化工、冶金、制药、造纸、半导体等工业部门,是工业流程中连续准确监测电解质溶液电导率的重要仪器。 1.2基本工作原理 电极式电导率测量:工作时,通过交流电测得流过电极的电流,就知道溶液的电导率。 1.3构成及功能 仪器由五大块相对独立的电路组成:电源、微机电路、显示电路、信号电路、输出电路。信号电路将电极测量到的信号处理后传送给微处理器进行处理,微处理器对信号进行处理,将结果送给显示电路和输出电路,并反馈给信号电路进行控制。 1.4主要技术性能指标 a 电导率测量范围: 电极 程控放大器 单 片 机 LCD 显示器
A/D 温度测量及变化 EPROM RAM D/A 隔离输出 键盘 4~20mA 0~1V 报警清洗及自动量程 切换继电器接点输出 信号源 量程仪器量程设置电极常数 0~20.00μS/cm 0~0.200μS/cm低量程0.01 0~2.000μS/cm中量程 0~20.00μS/cm高量程 0~200.0μS/cm 0~2.000μS/cm低量程0.1 0~20.00μS/cm中量程 0~200.0μS/cm高量程
0~2000μS/cm 0~20.00μS/cm低量程 1 0~200.0μS/cm中量程 0~2000μS/cm高量程 0~20.00mS/cm 0~200.0μS/cm低量程 10 0~2000μS/cm中量程 0~20.00mS/cm高量程 0~100.0mS/cm 0~1000μS/cm低量程 50 0~10.00mS/cm中量程 0~100.0mS/cm高量程 b温度补偿范围:0~60℃ c仪器基本误差:不大于±2%F·S d输出信号:直流隔离输出:4~20mA负载不大于600Ω0~1V负载不小于200Ωe报警: (1报警点及死区可设置 (2继电器触点负荷:220V(交流,3A f仪器使用条件 环境温度:0~40℃ 相对湿度:≤90% 介质温度:-10~140℃
第十一章电导分析法 (书后习题参考答案) 1.在25℃时,用面积为1.11cm2,相距1.00cm的两个平行的铂黑电极来测定纯水的电导, 其理论值为多少? 解:已知A=1.11cm2, l=1.00cm 查表知,H+、OH-离子的极限摩尔电导率分别为 λH+=349.82×10-4S·m2·mol-1,λOH-=349.82×10-4S·m2·mol-1 纯水的极限摩尔电导率Λm=λH+ +λOH-=547.42×10-4S·m2·mol-1 纯水中氢离子、氢氧根离子的浓度均为10-7mol·L-1,即c=10-4mol·m-3 由纯水的电导率为k=cΛm=5.4742×10-6S·m-1 所以纯水电导率为G=kA/l=5.4742×10-6×1.11×10-2=6.08×10-8S 2.用电导池常数为0.53cm-1的电导池测得某硝酸溶液的电导为22.7mS,计算该硝酸溶液的 物质的量的浓度。 解:电导池常数θ=l/A=0.53cm-1=53m-1, G=22.7mS 由条件,得G=c·Λm/θ, Λm=λH+ +λNO3- 则 6. 28 10 ) 44 . 71 82 . 349 ( 53 10 7. 22 4 3 = ? + ? ? = Λ ? = - - m G c θ mol·m-3 即c=0.0286mol·L-1 3.在电池中,放有两支面积为1.25×10-4m2的平行电极,相距0.105m,测得某溶液的电阻 为1995.6Ω,计算池常数和溶液的电导率。 解:已知A=1.25×10-4m2, l=0.105m, R=1995.6Ω 池常数 840 10 25 .1 105 .0 4 = ? = = - A l θ m-1 由G=1/R=k/θ得到:k=θ/R=840/1995.6=0.421S·m-1 4.某电导池内装有两个直径为 4.0×10-2m并相互平行的圆形电极,电极之间的距离为 0.12m,若池内盛满浓度为0.1mol·L-1的AgNO3溶液,并施加20V电压,则所测电流强 度为0.1976A。试计算池常数、溶液的电导、电导率和AgNO3的摩尔电导率。 解:已知A=3.14×4×10-4=1.256×10-3m2, l=0.12m, c=0.1mol·L-1=100mol·m-3 池常数θ=l/A=0.12/(1.256×10-3)=95.5m-1 溶液的电导G=i/E=9.88×10-3S 电导率k=G·θ=9.88×10-3×95.5=0.943S·m-1 Λm=k/c=9.43×10-3S·m2·mol-1 5.用一个具有池常数为555m-1的电导池测得饱和AgCl水溶液的电阻值为67953Ω(298K), 实验用水的电导率为8×10-5S·m-1。计算AgCl的溶度积。 解:k溶液=θ/R=555/67953=8.167×10-3S·m-1 k AgCl= k溶液-k水=8.167×10-3-8×10-5=8.087×10-3S·m-1 以于AgCl的离解平衡,AgCl==Ag+ + Cl-, a(Ag+)=a(Cl-) k AgCl=a(Ag+)·λAg+ + a(Cl-)·λCl-=a(Ag+) (λAg+ + λCl-) 即8.087×10-3= a(Ag+)× (61.9+76.34)×10-4 则a(Ag+) =0.585mol·m3=5.85×10-4=mol·L-1 K sp-AgCl= a(Ag+)·a(Cl-)=(5.85×10-4)2=3.42×10-7 6.给出下列滴定体系的电导滴定曲线:(1)用KCl滴定AgNO3;(2)用LiCl滴定AgAc. 解:
第十一章电导分析法 1.在25℃时,用面积为1.11cm2,相距1.00cm的两个平行的铂黑电极来测定纯水的电导,其理论值为多 少? 解:已知A=1.11cm2, l=1.00cm 查表知,H+、OH-离子的极限摩尔电导率分别为 λH+=349.82×10-4S·m2·mol-1,λOH-=349.82×10-4S·m2·mol-1 纯水的极限摩尔电导率Λm=λH+ +λOH-=547.42×10-4S·m2·mol-1 纯水中氢离子、氢氧根离子的浓度均为10-7mol·L-1,即c=10-4mol·m-3 由纯水的电导率为k=cΛm=5.4742×10-6S·m-1 所以纯水电导率为G=kA/l=5.4742×10-6×1.11×10-2=6.08×10-8S 2.用电导池常数为0.53cm-1的电导池测得某硝酸溶液的电导为22.7mS,计算该硝酸溶液的物质的量的 浓度。 解:电导池常数θ=l/A=0.53cm-1=53m-1, G=22.7mS 由条件,得G=c·Λm/θ, Λm=λH+ +λNO3- 则 6. 28 10 ) 44 . 71 82 . 349 ( 53 10 7. 22 4 3 = ? + ? ? = Λ ? = - - m G c θ mol·m-3 即c=0.0286mol·L-1 3.在电池中,放有两支面积为1.25×10-4m2的平行电极,相距0.105m,测得某溶液的电阻为1995.6Ω, 计算池常数和溶液的电导率。 解:已知A=1.25×10-4m2, l=0.105m, R=1995.6Ω 池常数 840 10 25 .1 105 .0 4 = ? = = - A l θ m-1 由G=1/R=k/θ得到:k=θ/R=840/1995.6=0.421S·m-1 4.某电导池内装有两个直径为4.0×10-2m并相互平行的圆形电极,电极之间的距离为0.12m,若池内盛 满浓度为0.1mol·L-1的AgNO3溶液,并施加20V电压,则所测电流强度为0.1976A。试计算池常数、溶液的电导、电导率和AgNO3的摩尔电导率。 解:已知A=3.14×4×10-4=1.256×10-3m2, l=0.12m, c=0.1mol·L-1=100mol·m-3 池常数θ=l/A=0.12/(1.256×10-3)=95.5m-1 溶液的电导G=i/E=9.88×10-3S 电导率k=G·θ=9.88×10-3×95.5=0.943S·m-1 Λm=k/c=9.43×10-3S·m2·mol-1 5.用一个具有池常数为555m-1的电导池测得饱和AgCl水溶液的电阻值为67953Ω(298K),实验用水的 电导率为8×10-5S·m-1。计算AgCl的溶度积。 解:k 溶液 =θ/R=555/67953=8.167×10-3S·m-1 k AgCl= k溶液-k水=8.167×10-3-8×10-5=8.087×10-3S·m-1 以于AgCl的离解平衡,AgCl==Ag+ + Cl-, a(Ag+)=a(Cl-) k AgCl=a(Ag+)·λAg+ + a(Cl-)·λCl-=a(Ag+) (λAg+ + λCl-) 即8.087×10-3= a(Ag+)× (61.9+76.34)×10-4 则a(Ag+) =0.585mol·m3=5.85×10-4=mol·L-1 K sp-AgCl= a(Ag+)·a(Cl-)=(5.85×10-4)2=3.42×10-7 6.给出下列滴定体系的电导滴定曲线:(1)用KCl滴定AgNO3;(2)用LiCl滴定AgAc. 解:
第二章 电位与电导分析法 重点内容概要 一、电位分析法 1.电位分析基本原理与过程 将两支电极(如饱和甘汞电极和玻璃电极)放入溶液,测量时 (1)两支电极间的电位差△E=E+一E-十E L= E测; (2)在两支电极间施加一个反向的外加电压E外,且E外=E测,并使外加电压随两支电极间电位变化; (3)E外与E测大小相等,方向相反,则电路中I=0,即测定过程中并没有电流流过电极; (4)电位分析时的两支电极分别称为参比电极和指示电极; (5)由于参比电极保持相对恒定,测定不同溶液时,两电极间电动势变化反映指示电极电位变化,指示电极电位与试样溶液中待测组分活度有关,故由电动势的大小可以确定待测溶液的活度(常用浓度代替)大小。 2.液体接界电位(E L) 液体接界电位:在两种不同离子的溶液或两种不同浓度的溶液接触界面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位的产生是由于两种溶液中存在的各种离子具有不同的迁移速率而引起的。如果两种溶液组成相同,浓度不同,接触时,高浓度区向低浓度区扩散,由于正负离子迁移速率不同,溶液两边分别带有电荷,也出现液界电位。
3.参比电极与指示电极 参比电极:电极电位不随测定溶液和浓度变化而保持相对恒定的电极。 指示电极:电极电位随测量溶液和浓度不同而变化。 三种参比电极:标准氢电极(标准,不常用);甘汞电极;银-氯化银电极。 五种指示电极: ①第一类电极——金属-金属离子电极,一个相界面; ②第二类电极——金属-金属难溶盐电极,两个相界面(常用作参比电极); ③第三类电极——汞电极; ④惰性金属电极; ⑤膜电极——最重要的一类电极。 4.膜电极(离子选择性电极)——最重要的一类电极 (1)特点:仅对溶液中特定离子有选择性响应。 (2)膜电极的关键是选择膜的敏感元件。 (3)敏感元件有单晶、混晶、液膜、高分子功能膜及生物膜等。 (4)膜内外被测离子活度不同从而产生电位差。 将膜电极和参比电极一起插到待测溶液中,则电池结构为
第二章 电化学分析法 6.计算[OH –] = 0.05 mol/L ,p(O2)=1.0×103 Pa 时,氧电极的电极电势,已知O2 +2H2O+4e= 4OH –,φθ=0.40 V 。 解:根据能斯特方程 ()ln (Re )RT a Ox nF a d θ??=+ 代入数据计算得?=0.438V 7. 试从有关电对的电极电势,如?θ(Sn2+/Sn )、?θ(Sn4+/Sn2+)及?θ(O2/H2O ),说明为什么常在SnCl2溶液加入少量纯锡粒以防止Sn2+被空气中的氧所氧化? 答:?θ值较大的电对中的氧化态物质能和?θ值较小的电对中的还原态物质反应。所以在SnCl2溶液加入少量纯锡粒以防止Sn2+被空气中的氧所氧化\ 11. 下述电池中溶液,pH = 9.18时,测得电动势为0.418 V ,若换一个未知溶液,测得电动势为0.312 V ,计算未知溶液的pH 值 玻璃电极 ) (H x s a a 或+饱和甘汞电极 答:根据pH 的实用定义公 式: F /RT .E E 3032s x pHs pHx -+ =, 代入数据得PH=7.39 12. 将ClO4-离子选择性电极插入50.00 mL 某高氯酸盐待测溶液,与饱和甘汞电极(为负极)组成电池,测得电动势为358.7 mV ;加入 1.00 mL 、0.0500 mol /L NaClO4标准溶液后,电动势变成346.1 mV 。求待测溶液中ClO4-浓度。 答:根据 /0.059(101)s s x n E x c V c V ±?= -,代入数据 Cx=1.50?10-3mol/L 第五章 气相色谱分析法 6.当下述参数改变时: (1)增大分配比,(2) 流动相速度增加, (3)减小相比, (4) 提高柱温,是否会使色谱峰变窄?为什么? 答:(1)保留时间延长,峰形变宽; (2)保留时间缩短,峰形变窄; (3)保留时间延长,峰形变宽; (4)保留时间缩短,峰形变窄。 11. 分析某种试样时,两个组分的相对保留值r21=1.11, 柱的有效塔板高度H=1mm ,需要多长的色谱柱才能完全分离? 解:根据公式 21212121 11(()r r R r r --= 得L=3.67 m
BT-2001电导率分析仪 电导率用于测定水中电导率。溶解于水的酸、碱、盐电解质,在溶液中解离成正、负离子,使电解质溶液具有导电能力,其导电能力大小可用电导率表示。电电导率反应了水中含盐量的多少,是水质“纯度”的一个重要指标。水的纯度越高,含盐量越低,电导率也越小;反之,水的含盐量越高,水的电导率也越大,而水的纯度也越低。电解质溶液的电导率,通常是用两个金属片(即电极)插入溶液中,测量两级间电阻率大小来确定。电导率时电阻率的倒数。其定义是截面积为1cm2,极间距离为1cm时,该溶液的电导。电导率的单位为西每厘米(S/cm)。在水分析中常用它的万分之一即微西每厘米(μS/cm)表示水的电导率。 溶液的电导率与电解质的性质、浓度、溶液温度有关。一般,溶液电导率是指25℃时的电导率。 为了避免电极极化,仪表采用高稳定度的方波电压信号加到电极上,流过电极的电流与被测溶液的电导率成正比。二次仪表将电流由高阻抗运算放大器转化为交流电压信号后,经程控信号放大、全波整流和滤波后得到反映电导率值的直流电压信号,微处理器通过程控电子开关切换,对温度信号和电导率信号交替采样,经过运算和温度补偿后得到被测溶液在25℃时的电导率值和溶液当时的温度值。 注意事项:电导电极如发现沾污时,应及时清洗。如有油污则需用四氯化碳、丙酮或无水乙醇的棉球仔细擦洗,也可用50%的温热洗涤剂清洗,用尼龙毛刷刷洗,随后用蒸馏水淋洗电极内部,确保电极
表面无油污沉积。切忌用手指触摸电导电极。对于粘着力强的污物沉积,可用2%左右的盐酸溶液浸泡清洗,然后再用蒸馏水反复清洗。BT-2001型电导率分析仪操作程序 一、使用前的检查 1.电源正常,仪表处于良好备用状态 2.查看所用电极是否正确。(电导率测量范围为0-200us/cm应选 择电极常数为0.1电导电极;电导测量范围为0-2000us/cm应 选择电极常数为1.0电导电极。) 二、操作步骤 1.取样:取样前,用样水冲洗取样瓶三次以上,取样瓶满水后, 溢流1min,至取样瓶内无气泡。 2.冲洗电极:在测量前,用除盐水充分清洗电极,并用滤纸吸干 电极表面水分。 3.测量:然后将电导电极和温度电极同时插入被测水样中,当测 量值基本稳定时,即可进行读数。 4.测量样品较多时,为了避免样品交叉污染,每个样品测量之前, 用少量的样品溶液冲洗电极后再将电极插入样品中进行测量。 三、仪表维护 化验完毕后,将仪表电源关闭,并用除盐水冲洗电极,最后将电极浸泡在除盐水中。
第二章电位与电导分析法 重点内容概要 一、电位分析法 1.电位分析基本原理与过程 将两支电极(如饱和甘汞电极和玻璃电极)放入溶液,测量时 (1)两支电极间的电位差△E=E +一E - 十E L = E 测 ; (2)在两支电极间施加一个反向的外加电压E 外,且E 外 =E 测 ,并使外加电 压随两支电极间电位变化; (3)E 外与E 测 大小相等,方向相反,则电路中I=0,即测定过程中并没有 电流流过电极; (4)电位分析时的两支电极分别称为参比电极和指示电极; (5)由于参比电极保持相对恒定,测定不同溶液时,两电极间电动势变化反映指示电极电位变化,指示电极电位与试样溶液中待测组分活度有关,故由电动势的大小可以确定待测溶液的活度(常用浓度代替)大小。 2.液体接界电位(E L ) 液体接界电位:在两种不同离子的溶液或两种不同浓度的溶液接触界面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位的产生是由于两种溶液中存在的各种离子具有不同的迁移速率而引起的。如果两种溶液组成相同,浓度不同,接触时,高浓度区向低浓度区扩散,由于正负离子迁移速率不同,溶液两边分别带有电荷,也出现液界电位。 3.参比电极与指示电极 参比电极:电极电位不随测定溶液和浓度变化而保持相对恒定的电极。
指示电极:电极电位随测量溶液和浓度不同而变化。 三种参比电极:标准氢电极(标准,不常用);甘汞电极;银-氯化银电极。 五种指示电极: ①第一类电极——金属-金属离子电极,一个相界面; ②第二类电极——金属-金属难溶盐电极,两个相界面(常用作参比电极); ③第三类电极——汞电极; ④惰性金属电极; ⑤膜电极——最重要的一类电极。 4.膜电极(离子选择性电极)——最重要的一类电极 (1)特点:仅对溶液中特定离子有选择性响应。 (2)膜电极的关键是选择膜的敏感元件。 (3)敏感元件有单晶、混晶、液膜、高分子功能膜及生物膜等。 (4)膜内外被测离子活度不同从而产生电位差。 将膜电极和参比电极一起插到待测溶液中,则电池结构为 (5)当膜电极放入待测溶液中时,敏感膜位于待测溶液和内充溶液之间。内外参比电极的电位值固定,且内充溶液中离子的活度也一定,则电池电动势
龙源期刊网 https://www.doczj.com/doc/077153912.html, 一种直接电导率法TOC分析仪的设计 作者:张立琛张朋亮 来源:《电子技术与软件工程》2016年第15期 摘要本文介绍一种直接电导率法TOC检测仪设计方案,以STM32微处理器为控制核心,通过测试两路电极中溶液导电率的差值计算TOC,具有数据存储、输出、打印、报警等 功能。 【关键词】STM32 直接电导率 TOC 1 前言 当前制药、半导体等行业生产中,对纯水、去离子水中TOC(总有机碳)的含量要求越 来越严格,需要实时对水中的TOC进行检测,因此需要一款TOC分析仪能够对生产用水进行在线检测,本文主要介绍一款直接电导率法的TOC分析仪的设计,能够满足当前制药、半导体等行业生产中对纯水及去离子水中TOC的在线检测。 2 系统原理 通过步进电机带动蠕动泵的转动,将测试样品采集到系统管路中,通过三通接头将进样水溶液一分为二,一路通过一段延长水路直接流过一个电极传感器进行测量,所得浓度值为IC (无机碳)的浓度;另外一路要经过氧化反应器的充分氧化,将水中所含的有机碳氧化成二氧化碳(作为一种导电离子存在),再流过另一个电极传感器进行测量,所得浓度值为TC(总碳)的浓度,TC与IC的差值即为TOC的浓度: TOC = TC – IC 系统原理如图1所示。 3 硬件设计 整个系统在硬件上分为:电源模块、主控模块、TOC检测模块、信号控制模块、温度采 集模块、显示模块、存储模块等几个部分。 电源模块为整个系统提供电源,采用开关电源和变压器结合的供电方式,开关电源输出的电源直接为紫外灯、报警信号及步进电机驱动器提供电源;变压器输出的电源主要为电路板提供电源,变压器输出电源经过AC-DC转换成直流电源后,再经过线性稳压源给对应元器件供电,电路板的数字电路与模拟电路分割开来,数字地与模拟地进行单点连接,减小数字电路对模拟电路的干扰。
北京化工大学 仪器分析习题解答 董慧茹编 2010年6月
第二章 电化学分析法习题解答 25. 解: pHs = , Es = pHx = pHs +059 .0Es Ex - (1) pHx 1 = + 059.0209 .0312.0- = (2) pHx 2 = +059 .0209 .0088.0- = (3) pHx 3 = +059 .0209 .0017.0-- = 26. 解: [HA] = L , E = [A -] = L , ΦSCE = E = ΦSCE - Φ2H+/H2 = - lg[H + ] [H + ] = k a ] [][- A HA = 01.001.0k a = - lg 01 .001.0k a lg k a = - k a = ×10 -5 27. 解: 2Ag + + CrO - 24 = Ag 2CrO 4 [Ag +]2 = ] [24- CrO Ksp
Ag CrO Ag SCE E /42φφ-= - = - [ + 2 24)] [lg(2059.0-CrO Ksp ] ][lg 24-CrO Ksp = - , ] [24- CrO Ksp = ×10-10 [CrO - 24 ] = 10 1210 93.6101.1--?? = ×10-3 (mol/L) 28. 解:pBr = 3 , a Br- = 10-3 mol/L pCl = 1 , a Cl- = 10-1 mol/L 百分误差 = - - --?Br Cl Cl Br a a K ,×100 = 3 1 31010106---??×100 = 60 因为干扰离子Cl -的存在,使测定的a Br- 变为: a -Br = a -Br +K --Cl Br .×a -Cl = 10-3 +6×10-3 ×10-1 =×10-3 即a -Br 由10-3 mol/L 变为×10-3mol/L 相差 - = pBr 单位 29. 解:
一、在线电导率分析仪 1.数量:2台,进口产品。 2.设备用途:用于二次供水水质电导率的在线测量。 3.主要技术性能指标 原理:电极法 测量范围: 0.1μS/cm -- 100 mS/cm 精度:测量值的0.5% 内置温度电池,可实时测量水样的温度和流量 温度测量范围-30—130℃,温度分辨率为0.1℃ 变送器AMI Solicon铝质外壳 输出:0/4-20mA(备选RS-485串口输出,可选MODBUS或PROFIBUS 等通用协议) 控制器防护等级:IP66 大屏幕背光液晶显示测量值、水温、流量和操作状态。 二、在线ORP分析仪 1.数量:2台,进口产品。 2.设备用途:用于二次供水水质ORP的在线测量。 3.主要技术性能指标 原理:电极法,、 电极:长寿命复合固态电解液电极,具有电极故障自诊断和报警功能流量:4—15L/h 测量范围:-400 – 1200 mv,分辨率1mv 可同时测量水样温度和流量,可拆卸流通杯,校准方便,并可对缓冲液进行温度补偿 温度测量范围-30—130℃,温度分辨率为0.1℃ 自动温度补偿符合Nernst方程 输出:0/4-20mA(备选RS-485串口输出,可选MODBUS或PROFIBUS 等通用协议) 变送器外壳:铝,防护等级:IP66/NEMA 4X 三、高低温交变试验箱(数量1台) 1.名称:高低温交变试验箱 2.容积:100L 3. 性能 3.1测试环境条件:环境温度为5~35℃、相对湿度≤ 85%RH 3.2温度范围 -40℃~+150℃ 3.3温度波动度≤±0.5℃ 3.4温度偏差≤±2.0℃ 3.5最大升温速率 3℃≤1min (全程平均)
第四章 电化学分析法 基本要求 1.了解玻璃电极的构造,掌握玻璃电极的作用原理及特性。 2.掌握溶液的pH 值的测定方法。 PH x = PH s + 059 .0S x E E - 3.了解常见离子选择性电极的种类,掌握离子选择性电极的膜电位的表示方法 膜=K+0.059lg (a i +a j ?K ij ) K ij = j i a a 利用K ij 估量某种干扰离子对测定造成的误差 相对误差= K ij 100)(?i n n j a a j i 4.掌握测定离子活度的基本原理和测定方法,计算溶液的离子浓度。 (1) 组成原电池 甘汞电极‖试液‖离子选择性电极 (2) 比较法测定离子浓度 阳离子:s E E s x s x c c )(10-?= 阴离子:s E E s x x S c c )(10-?= s = nF RT 303.2 (3) 标准加入法测定离子活度 1)110 (-??-=s E x c c 0V c V c s s = ? nF RT s 303.2= 5.掌握用二阶微商内插法测定滴定终点的方法 V b a a V V ep ?-+ = 6.掌握永停滴定确定终点的方法。 典型例题解析 例1.当下列电池中溶液是pH=4的缓冲溶液时,电池电动势为0.209V 玻璃电极H + (a=x)‖SCN 当缓冲溶液由未知溶液代替时,测得电池电动势为0.312V,计算未知溶液的pH 值。 解:设标准pH 缓冲溶液为s ,待测溶液为x 。则
pH x =pH s + 059 .0s x E E - =4.00+ 059 .0209 .0312.0-=5.75 例2.用氯离子选择性电极测定果汁中氯化物含量时,在100ml 的果汁中测得电动势为-26.8mv ,加入1.00mL0.500mol/L 经酸化得NaCl 溶液,测得电动势为-54.2mv ,计算果汁中氯化物的浓度? 解:已知:L mol C s /500.0= ml V s 00.1= ml V x 100= mV E 8.261-= mV E 2.542-= 根据式=x C x S E s x s s V V V V C -+= ?10)( = 100 10)00.1100(500 .000.1059.00274.0-+?-=0.00499 0.531=2.59mol/L 10 3 -? 例3.用0.1052 mol/LNaOH 标准溶液电位滴定含25.00mlHCl 溶液,用玻璃电极作指示 计算:(1)用二阶微商计算法确定滴定终点体积; (2)计算HCl 溶液浓度。 解:(1)用滴定终点附近的几组数据,求出2 E /V 2正负号改变前后的数值。 则:
一、在线电导率分析仪 1. 数量:2台,进口产品。 2. 设备用途:用于二次供水水质电导率的在线测量。 3. 主要技术性能指标 原理:电极法 测量范围:0.1 [1 S/cm -- 100 mS/cm 精度:测量值的0.5% 内置温度电池,可实时测量水样的温度和流量温度测量范围-30 —130 C,温度分辨率为0.1 C 变送器AMI Solicon铝质外壳 输出:0/4-20mA (备选RS-485 串口输出,可选MODBI或PROFIBUS 等通用协议) 控制器防护等级:IP66 大屏幕背光液晶显示测量值、水温、流量和操作状态。 二、在线ORP分析仪 1. 数量:2台,进口产品。 2. 设备用途:用于二次供水水质ORP勺在线测量。 3. 主要技术性能指标原理:电极法,、 电极:长寿命复合固态电解液电极,具有电极故障自诊断和报警功能 流量:4—15L/h 测量范围:-400 -1200 mv,分辨率1mv 可同时测量水样温度和流量,可拆卸流通杯,校准方便,并可对缓冲液进行温度补偿 温度测量范围-30 —130 C,温度分辨率为0.1 C 自动温度补偿符合Nernst方程 输出:0/4-20mA (备选RS-485 串口输出,可选MODBU或PROFIBUS 等通用协议) 变送器外壳:铝,防护等级:IP66/NEMA 4X 三、高低温交变试验箱(数量1台) 1. 名称:高低温交变试验箱 2. 容积:100L 3. 性能 3.1测试环境条件:环境温度为5?35 C、相对湿度w 85%RH 3.2温度范围-40 C?+150C 3.3温度波动度w 士0.5 C 3.4温度偏差w 士2.0 C
T B 8 2 T E电导率分析仪培训 栾明华 2012-6-22
1、ABB公司生产的两线制电导率分析仪外型如下: 探头(传感器)如下图:
2、选型 公司使用于测量蒸汽冷凝水、锅炉给水,脱盐水,两线制,安装及调试都很方便。 变送器(传换器)选型: T B 8 2 T E _ _ _ _ _ _ _Input(测量方式)针对探头而言 P H _ _ _ _ _ _ _ pH/ORP/pION 测量PH E C _ _ _ _ _ _ _ Four-electrode conductivity 四电极型电导率 T E _ _ _ _ _ _ _ Two-electrode conductivity 二电极型电导率 T C _ _ _ _ _ _ _ Toroidal conductivity 圆环型电导率 Programming(程序) 1 _ _ _ _ _ _ Basic 基本型 2 _ _ _ _ _ _ Advanced 先进型 Digital Communications(通讯) 0 _ _ _ _ _ None 无 1 _ _ _ _ _ HART1 HART通讯 Lightning Arrestor(防雷装置) 0 _ _ _ _ None 无 1 _ _ _ _ Included 包含 Housing Type(外壳类型) 0 _ _ _ Powder coated, alodined aluminum电源防护,铝外壳 Mounting Hardware(安装方式) 0 _ _ None 无 1 _ _ Pipe 管道 2 _ _ Hinge 悬挂 3 _ _ Panel 屏装 4 _ _ Wall 壁装 Agency Approvals(机构认证) 0 _ None 无 1 _ FM FM认证 2 _ CSA CSC认证 3 _ CENELEC CENELEC认证 Label(标签) 0 None 无 1 Stainless steel 不锈钢式 2 Mylar 塑料片式 公司使用的二线制型号:TB82TE2110431