【化学】 化学方程式的计算练习题(含答案)经典
- 格式:doc
- 大小:163.00 KB
- 文档页数:6

化学方程式的计算练习题(含答案)一、中考化学方程式的计算1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量2.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O2+2H2SO4=2CuSO4+2H2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算:(1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg,则该稀硫酸溶质的质量分数是多少_____?【答案】40% 12.25%【解析】【分析】【详解】(1)CuSO4中Cu元素质量分数=6464100%=100%=40% 6432416160⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO 2CuSO 2Cu O 2=2982160x 40kg2H O+++⨯⨯ x 29840kg 2160⨯=⨯ x=24.5kg则稀硫酸溶质的质量分数=24.5kg 100%=12.25%200kg⨯。
3.向 100 克 MgCl 2 和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至 N 点时所得溶液的 pH 值为_______(填编号); A 大于 7 B 等于 7 C 小于 7(2)通过计算,确定 M 点时所得溶液中溶质的质量分数,写出计算过程____。
【答案】A 9.2%(详见解析)【解析】【分析】向 100 克 MgCl 2 和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,氢氧化钠先与盐酸反应,等盐酸完全反应后再与氯化镁反应。


化学方程式的计算专题(含答案)经典一、中考化学方程式的计算1.向盛有100g质量分数为8%的氧氧化钠溶液的烧杯中,逐滴加入193.8g硫酸铜溶液,二者恰好完全反应。
请计算:(化学方程式为 CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4)(1)恰好完全反应时生成沉淀的质量__________。
(2)恰好完全反应时溶液中溶质的质量分数__________。
【答案】9.8g 5%【解析】【分析】100g质量分数为8%的氧氧化钠溶液中溶质质量为:100g×8%=8g。
【详解】设恰好完全反应时,生成沉淀氢氧化铜质量为x,生成硫酸钠的质量为y。
42422NaOH+CuSO=Na SO+Cu(OH)80142988g y x8014298 ==8g y x↓x=9.8g,y=14.2g100g+193.8g-9.8g=284g恰好完全反应时溶液中溶质的质量分数14.2g100%=5% 284g⨯。
2.在含少量NaCl的某纯碱样品23g中加入盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。
(提示:相关反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑)计算当恰好完全反应时:(1)产生的二氧化碳的质量是______克。
(2)此纯碱样品中碳酸钠的质量分数______(写出必要的计算过程,结果保留到0.1%)。
【答案】8.8 92.2%【解析】【分析】【详解】(1)据图可以看出,生成的二氧化碳的质量为8.8g,故填:8.8;(2)解:设纯碱样品中碳酸钠的质量分数为x2322Na CO+2HCl=2NaCl+CO+H O1064423gx8.8g↑10623gx=448.8gx≈92.2%答:纯碱样品中碳酸钠的质量分数为92.2%。
3.我国科学家实现电催化高效分解硫化氢制氢技术,反应的化学方程式为H2S一定条件S↓ +H2 .请计算生产 3吨 H2,理论上需要 H2S多少吨?【答案】51吨【解析】【分析】【详解】解:设理论上需要H2S的质量为x22S+H342x3tH S↓一定条件34x=23tx=51 t答:理论上需要H2S 51吨。4.(1)工业上若冶炼出含铁98%的生铁1000t,至少用含氧化铁80%的赤铁矿石的质量是_________t。


【化学】化学化学方程式的计算题20套(带答案)一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x8.8g100x =448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量3.有一种自生氧防毒面具,其使用的生氧剂的主要成分是(KO2)。
取100g生氧剂放入质量为20g的烧杯中,再向其中加入20g水,使生氧剂KO2全部反应,其充分反应后(4KO2+2H2O═4KOH+3O2↑),称得烧杯及烧杯中物质的总质量为116g,计算(假设杂质不含钾元素且不与稀硫酸反应)(1)100g生氧剂生成氧气的质量_____;(2)KO2中钾元素的质量分数为_____;(计算结果精确到 0.1%)(3)要将烧杯中的溶液完全中和,通过计算,需要溶质质量分数为10%的稀硫酸溶液的质量_____。
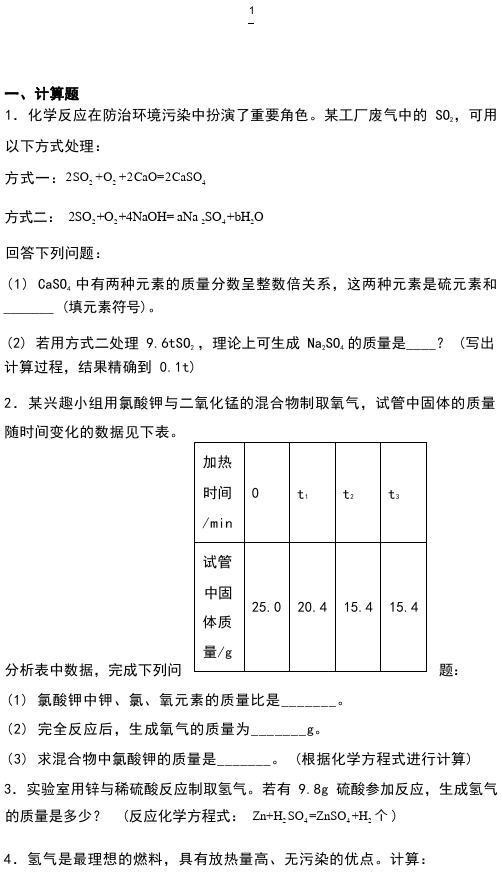
1.化学反应在防治环境污染中扮演了重要角色。
某工厂废气中的 SO2,可用以下方式处理:方式一:2SO2 +O2+2CaO=2CaSO4方式二:2SO2 +O2 +4NaOH= aNa 2SO4 +bH2O回答下列问题:(1) CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和_______ (填元素符号)。
(2) 若用方式二处理 9.6tSO2 ,理论上可生成 Na2SO4的质量是____? (写出计算过程,结果精确到 0.1t)2.某兴趣小组用氯酸钾与二氧化锰的混合物制取氧气,试管中固体的质量随时间变化的数据见下表。
(1) 氯酸钾中钾、氯、氧元素的质量比是_______。
(2) 完全反应后,生成氧气的质量为_______g。
(3) 求混合物中氯酸钾的质量是_______。
(根据化学方程式进行计算) 3.实验室用锌与稀硫酸反应制取氢气。
若有 9.8g 硫酸参加反应,生成氢气的质量是多少? (反应化学方程式:Zn+H2 SO4=ZnSO4+H2个)4.氢气是最理想的燃料,具有放热量高、无污染的优点。
计算:分析表中数据,完成下列问题:(1) 10kg 氢气完全燃烧可生成水的质量是多少?(2) 消耗氧气的质量至少是多少?5.碳酸氢钠固体受热易分解生成一种盐和两种氧化物,反应的化学方程式为______;将 10g 碳酸钠和碳酸氢钠的混合物充分加热至固体的质量不再改变,冷却,称量剩余固体的质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为______。
6.实验室常用氯酸钾和二氧化锰的混合物制取氧气。
现有氯酸钾和二氧化锰的混合物 50g,完全反应后称量剩余物质的质量为 40.4g。
请计算:(1) 制得氧气的质量为__________。
(2) 混合物中氯酸钾的质量分数。
7.加热氯酸钾和二氧化锰固体混合物来制取氧气时,反应时间和剩余固体质量的关系如图所示。
计算:的质量是___________g。

(化学)中考化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金 10g ,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示:求:合金中铜的质量分数______。
【答案】67.5% 【解析】 【分析】铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据图示数据可以得出生成氢气的质量,根据氢气的质量可以计算出锌的质量,进一步计算出铜锌合金中铜的质量分数。
【详解】由图示数据可知,当加入20g 稀硫酸时,合金中的锌恰好反应完全,产生0.1g 氢气。
设参加反应的锌的质量为ag 。
2442n +H SO nSO H 652ag0.1gZ Z =+↑65a =20.1,解得a=3.25g 则合金中铜的质量为10g-3.25g=6.75g , 合金中铜的质量分数=6.75g10g×100%=67.5%, 答:合金中铜的质量分数为67.5%。
2.海洋是地球上最大的聚宝盆,浩瀚的海洋蕴含着丰富的化学资源,海水中化学资源的利用具有非常广阔的前景,目前世界上60%的镁是从海水中提取的,主要步骤如下图(1)在第①步中观察到的实验现象是_____。
(2)步骤②产生的氯化镁的质量与原卤水中氯化镁的质量相比_____(填“增大”、“减小”或“不变”之一)。
(3)某兴趣小组的同学取一定量的氢氧化镁固体,放入干净的烧杯中,向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中固体的质量与加入稀盐酸的质量关系如图所示,当加入10%的稀盐酸73g (即A 点)时,请通过计算,求此时所得不饱和溶液的质量_____。
【答案】产生白色沉淀 不变 78.8g 【解析】 【分析】 【详解】(1)石灰乳中的氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,在第①步中观察到的实验现象是产生白色沉淀;(2)根据中镁元素守恒,所以步骤②产生的氯化镁的质量与原卤水中氯化镁的质量相比不变;(3)设反应的氢氧化镁的质量为x222Mg(OH)2HCl =MgCl 2H O5873x73g 10%5873=x 73g 10%++⨯⨯x=5.8g此时所得不饱和溶液的质量为73g+5.8g=78.8g 答:所得不饱和溶液的质量为78.8g 。

【化学】化学化学方程式的计算题20套(带答案)及解析一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6%【解析】【分析】【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl 208142233117104g 20%y z x 208104g 20%208104g 20%208104g 20%===117x 142y 233zx=11.7g y=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g 100%10.6%205g ⨯≈ 答:溶质质量分数为10.6%2.如图是某胃药标签的部分内容,某校同学测定该药品 中 NaHCO 3 含量的过程如下:取 10 粒该药剂研碎后放入烧杯中,加入 50g 水后充分搅拌,再向其中滴加稀盐酸至恰好完全反应(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),共消耗稀盐酸 11.5g 。

【化学】化学《化学方程式》练习题及答案一、选择题1.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z【答案】C【解析】由表中数据分析可知,反应前后X的质量减少了4 g﹣0 g=4 g,故X是反应物,参加反应的X的质量为4 g;反应前后Y的质量增加了12 g﹣10 g=2 g,故Y是生成物;同理确定Z 是生成物,生成的Z的质量为15 g﹣1 g=14 g;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故待测的数值为21g﹣12 g=9 g。
A、根据分析,可知反应物是X和Q,生成物是Y和Z,故选项说法错误;B、参加反应的Y的质量为12 g ﹣10 g=2 g,参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故参加反应的Y和Q的质量比是1∶6,故选项说法错误;C、参加反应中X、Q的质量比为4 g∶12 g=1∶3,故选项说法正确;D、根据表格中的数据,反应后生成Z的质量为15 g﹣1 g=14 g,故选项说法错误。
故选C。
2.如图为某反应的微观示意图,下列说法正确的是()A.该反应属于分解反应B.反应前后分子种类没有改变C.反应前后原子数目发生改变D.参加反应的两种分子个数比为1:1【答案】D【解析】A、根据图可知:两种单质生成一种化合物,属于化合反应,不属于分解反应,故错误;B、根据图可知:氢分子和氯分子变化成了氯化氢分子,反应前后分子种类发生了改变,故错误;C 、由微粒的变化可知,反应前后原子数目没有发生改变,故错误;D 、由微粒的变化可知,参加反应的两种分子个数比为1:1,故正确。
点睛:化学反应的实质一般是指在化学变化中,分子分成原子,原子重新组合成新的分子(或直接聚集构成新物质)。


【化学】化学《化学方程式》练习题及答案一、选择题1.CH 4和某种氮的氧化物反应的化学方程式为CH 4+2口催化剂N 2+CO 2+2H 2O ,则框内物质的化学式是 A .NO B .NO 2C .N 2OD .N 2O 5【答案】B 【解析】试题分析:化学变化前后各种原子的个数不变,反应后有2N 、C 、4H 、4O ,而反应前有4H 、一个C 原子,反应前后差2N 、4O ,所以框内物质的化学式为NO 2,故选B 考点:质量守恒定律的应用2.将一定质量的氧化铜和氧化铁混合粉末与足量的CO 充分反应后,测得质量减少了4.0g 。
另取等质量的该粉末用适量的稀硫酸完全溶解后,再加入足量的氢氧化钠溶液,得到了20.5g 的沉淀。
则粉末中的氧化铜的质量分数为 A .20% B .40%C .50%D .80%【答案】C 【解析】 【分析】分别假设氧化铜和氧化铁的质量,进而结合化学方程式、关系式及对应的数据求解,进而求出粉末中氧化铜的质量分数。
【详解】设粉末中氧化铜的质量为x ,氧化铁的质量为y ,21CO +CuO Cu +CO 806416x m 高温固体质量减少116x xm ==80523223CO +Fe O 2Fe +3CO 16011248ym 高温固体质量减少248y 3ym ==16010氧化铜与稀硫酸反应生成硫酸铜和水,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和氢氧化钠反应生成氢氧化铁沉淀和硫酸钠,根据元素守恒列关系式:423CuO ~CuSO ~Cu(OH)8098xm398x 49xm ==80402324334Fe O ~Fe (SO )~2Fe(OH)160214ym4214y 107ym ==16080结合题干,列出方程:x 3y+=4.051049x 107y+=20.54080解得x=8g ,y=8g则粉末中氧化铜的质量分数为:8g100%50%8g+8g⨯= ,故选C 。

化学方程式练习题(含答案)经典一、化学方程式选择题1.科学家采用“组分转化”技术,将 CO2和H2按一定比例混合,在一定条件下反应的化学方程式为2CO2 + 6H2= X + 4H2O中,X的化学式是A.CH4 B.C2H4 C.H2CO3 D.H2C2O4【答案】B【解析】化学反应前后各种原子个数相等,反应前有2C、4O、12H,反应后(X除外)有4O、8H,所以x中有有2C、4H,X的化学式为C2H4,故选B。
点睛:要顺利解答此题,必须熟练掌握质量守恒定律并会灵活应用,化学反应前后各种原子个数相等,根据反应前后原子个数的差量即可推断出X的化学式。
2.某反应前后分子变化的微观示意图如下(图中“●”和“○”分别代表不同元素的原子),下列说法不正确的是()A.该反应前后涉及到三种物质B.反应后分子种类没有改变C.反应后分子数增多D.该反应属于分解反应【答案】B【解析】【详解】由化学反应的微观示意图可知,各物质反应的微粒个数关系是:A、由图示可知,该反应前后涉及到三种物质,故A正确;B、由微粒的变化可知,反应后分子种类发生了改变,故B不正确;C、由微粒的变化可知,该反应后分子数增多,故C正确;D、该反应由一种物质生成了两种物质,属于分解反应,故D正确。
故选B。
【点睛】化学变化中分子的种类一定改变,数目可变可不变。
3.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。

九年级化学有关化学方程式的计算经典好题汇编(含答案)一、选择题1. (·眉山)10 g A和足量B混合加热,充分反应后生成8 g C和4 g D,则参加反应的A和B 的质量比为()A. 1∶1B. 2∶1C. 4∶1D. 5∶12. (·天津)已知A+3B===2C+3D中,已知2.3 g A跟4.8 g B恰好完全反应生成4.4 g C。
又知D的相对分子质量为18,则A的相对分子质量为()A. 23B. 46C. 92D. 963. (·天水)把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间A. 物质aB. x=2.2C. d一定是催化剂D. 反应后原子数目减少了4. (·龙东)(已知甲、丙两种物质的相对分子质量之比为1∶1)则下列说法正确的是()A. 该反应为化合反应B. 待测值为18C. 反应中丁和丙的质量比为3∶1D. 甲、丙两种物质化学计量数之比为1∶25. (·湘潭)一定条件下,一个密闭容器内发生反应,测得反应前后各物质的质量如下表所示。
下列有关说法不正确的是()A. x的取值范围是:0≤x≤45B. 参加反应的A和B的质量之比为3∶1C. 当y≤20时,该反应为化合反应D. x+y=656. (·黔东南)某密闭容器中有X、氧气、二氧化碳三种物质,在一定条件下充分反应,反应前在下列判断中,正确的是()A. 物质X 由碳、氢元素组成B. 物质X 由碳、氢、氧元素组成C. 充分反应后剩余氧气质量为16克D. 生成CO 2与H 2O 的质量比是89∶54 7. (·泰安)四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。
则有关说法中不正确的是( )第7题A. 丁一定是化合物B. 乙可能是这个反应的催化剂C. 生成的甲、丙两物质的质量比为8∶1D. 参加反应的丁的质量一定等于生成甲和丙的质量之和 8. (·六盘水)在“宏观—微观”之间建立联系,是学习化学学科必备的思维方式。

第五单元课题3 利用化学方程式的简单计算测试题1。
在反应X+2Y====R+2M中,当1。
6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为()A.23∶9 B.16∶9 C.32∶9 D.46∶92。
氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为()A.(A+B—C)克 B.(A-B—C)克 C.(A+B+C)克 D.(A+C)克3。
已知A物质与B物质反应生成C物质,现有12克A与32克B恰好完全反应,则生成C物质的质量是()A.44克 B.32克 C.22克 D.12克4。
已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B和44克C;则实际发生分解的A物质的质量为( )A.12克 B.44克 C.56克D.100克5。
只含铜和氧两种元素的固体样品9。
0 g,测得铜的质量为8。
0 g。
已知铜的氧化物有CuO和Cu2O,下列说法正确的是()A.固体样品的组成只有两种情况B.固体样品一定是CuO与Cu2O的混合物C.固体样品可能是Cu2OD.若固体样品由两种物质组成,则其中一种质量分数为4/96.在2A+B====2C的反应中,1.2 g A完全反应生成2 g C,又知B的式量是32,则C的式量为___________.7.已知在反应3A+2B====2C+D中,反应物A、B的质量比为3∶4.当反应生成C和D的质量共140 g时,B消耗的质量为___________g。
8.蜡烛燃烧后的产物有二氧化碳和水,由质量守恒定律可知,石蜡的组成中一定含有_______、_________元素。
(填写元素名称)9。
在化学反应3X+4Y====2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____________。
10。
火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2.(1)若100克废气中含6。
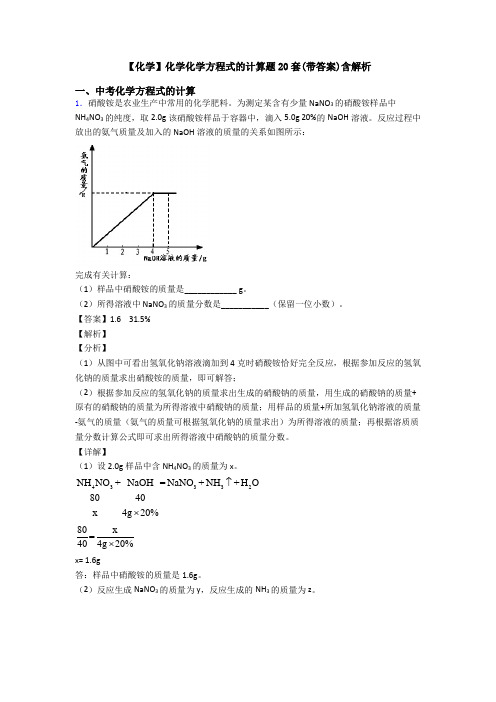
【化学】化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.硝酸铵是农业生产中常用的化学肥料。
为测定某含有少量NaNO 3的硝酸铵样品中 NH 4NO 3的纯度,取2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH 溶液。
反应过程中放出的氨气质量及加入的NaOH 溶液的质量的关系如图所示:完成有关计算:(1)样品中硝酸铵的质量是____________ g 。
(2)所得溶液中 NaNO 3的质量分数是___________(保留一位小数)。
【答案】1.6 31.5%【解析】【分析】(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数。
【详解】(1)设2.0g 样品中含NH 4NO 3的质量为x 。
43332NH NO NaOH NaNO NH H O4g 20%+=++8040x ↑⨯48g 0x =4020%⨯ x= 1.6g答:样品中硝酸铵的质量是1.6g 。
(2)反应生成 NaNO 3的质量为 y ,反应生成的NH 3的质量为z 。
43332NH NO NaOH N +=++408517y aNO NH H O40%zg 2↑⨯404g 20%=85y⨯ 404g 20%=17z⨯ y= 1.7gz= 0.34g 反应后所得溶液中NaNO 3的质量分数为= 1.7g+(2g-1.6g)100%=31.5%2g+5g-0.34g⨯ 答:所得溶液中 NaNO 3的质量分数是31.5%。
【点睛】做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克。

化学方程式的计算练习题附答案一、初中化学利用化学方程式选择题1.在加热条件下,将一定量的一氧化碳气体通过12g氧化铜粉末,充分反应后,将生成的气体通入足量氢氧化钠溶液中,测得溶液增重4.4g,则加热后得到的固体混合物中,铜、氧元素的质量比为A.14:1 B.12:1 C.8:1 D.4:12.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法不正确的是A.X的值为165.6B.该反应可能为复分解反应C.反应过程中,B与D的质量比为36∶142D.若A与C的相对分子质量之比为98∶40,则A与C的化学计量数比为2∶13.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H84.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量5.向一定量的锌粉中滴加稀盐酸至过量,下图表示反应过程中某种物质的质量m随加入盐酸质量的变化关系,则m不可能表示()A.溶液总质量B.消耗锌粉的质量C.生成ZnCl2的质量D.生成H2的质量6.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y7.已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C和1 g D,若B 的相对分子质量为98,则A的相对分子质量为( )A.16 B.27 C.44 D.568.如图所示:在密闭容器中充入CO和2CO的混合物10g,测得其中氧元素含量为64%,再向密闭容器中通入足量的氧气,通电使电火花塞点火让其中的一氧化碳完全燃烧成二氧化碳。

【化学】 化学方程式的计算练习题(含答案)经典
一、中考化学方程式的计算
1.碳酸氢钠用于焙制糕点,在270℃时分解:323222NaHCO Na C ΔO H O CO ++↑。
现取3NaHCO 16.8g ,在敞口容器中加热到质量不再改变为止,减少的质量为( ) A .4.4g
B .6.2g
C .8.8g
D .10.6g
【答案】B
【解析】
【分析】
【详解】
根据题意可知,在敞口容器中加热到质量不再改变为止,剩余物质为固体碳酸钠。
此题为固体的差量计算,设减少的质量为x 。
3
23222NaHCO Na CO +H O +CO 168
1066216.8g x ↑△固体减少的质量
16816.8g =62x
x=6.2g
2.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al 2O 3
通电 4Al +3O 2↑。
请计算生成1.08t 金属铝,理论上需要氧化铝的质量是多少
____?
【答案】2.04t
【解析】
【分析】
【详解】
解:设生成1.08t 金属铝,理论上需要氧化铝的质量为x 23
22Al O 4Al +3O 204
108x 1.08t
↑通电 204x =108 1.08t
x=2.04t
答:生成1.08t 金属铝,理论上需要氧化铝的质量为2.04t 。
3.我国科学家实现电催化高效分解硫化氢制氢技术,反应的化学方程式为
H 2S 一定条件S ↓ +H 2 .请计算生产 3吨 H 2,理论上需要 H 2S 多少吨?
【答案】51吨
【解析】
【分析】
【详解】
解:设理论上需要H 2S 的质量为x
2
2S +H 342x
3t
H S ↓一定条件
34x =23t
x=51 t
答:理论上需要H 2S 51吨。
4.某工厂需要16kg 氧气作原料,若用电解水的方法制取这些氧气,消耗水的质量是_________?(要求写出计算过程)
【答案】18kg
【解析】
【分析】
【详解】
设消耗水的质量为x
2222H O
2H +O 36
32x 16kg
↑↑通电 36x =3216kg
x=18kg
答:消耗水的质量是18kg 。
5.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O 2+2H 2SO 4=2CuSO 4+2H 2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算: (1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg ,则该稀硫酸溶质的质量分数是多少_____?
【答案】40% 12.25%
【解析】
【分析】
【详解】
(1)CuSO 4中Cu 元素质量分数=
6464100%=100%=40%6432416160
⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO 2CuSO 2Cu O 2=2982160
x 40kg
2H O
+++⨯⨯ x 29840kg 2160
⨯=⨯ x=24.5kg
则稀硫酸溶质的质量分数=24.5kg 100%=12.25%200kg
⨯。
6.过氧化钙是一种常用的制氧剂,过氧化钙与水反应的化学方程式
为:()22222CaO +2H O=Ca OH +2O ↑ ,当反应消耗掉150g 含过氧化钙96%的样品时,请计算:
(1)过氧化钙中氧元素的质量分数是多少? (结果保留至0.1%)_____________
(2)理论上可以制得氧气的质量是多少?_____________
【答案】44.4% 32g
【解析】
【分析】
【详解】
(1)过氧化钙中氧元素的质量分数为:
32100%44.4%40+32
⨯≈ (2)解:设理论上可以制得氧气的质量为X 。
2
2222CaO +2H O=2Ca(OH)+O 144
32150g 96%X
↑⨯ 144150g 96%=32X
X=32g
⨯ 答:理论上可以制得氧气的质量为32 g 。
7.某校化学兴趣小组欲利用氢氧化钠与氯化铁会发生复分解反应的原理,测定某氯化铁溶液的溶质质量分数,取100g 氯化铁溶液,向其中滴加一定质量分数的氢氧化钠溶液60g 恰好完全反应,过滤,称得滤液的质量为149.3g 。
请计算:
(1)反应生成沉淀的质量为________g。
(2)氯化铁溶液的溶质质量分数______(结果精确到0.1%)。
【答案】10.7 16.3%
【解析】
【分析】
【详解】
(1)根据质量守恒定律,反应生成沉淀的质量为:100g+60g-149.3g=10.7g
(2)解:设氯化铁溶液中溶质质量为X。
33
3NaOH+FeCl=3NaCl+Fe(OH)
162.5107
X10.7g
↓
162.5X
=
10710.7g
X=16.25g
氯化铁溶液的溶质质量分数为16.25g
100%16.3% 100g
⨯≈。
答:氯化铁溶液的溶质质量分数为16.3%。
8.如图是某胃药标签上的部分内容,孔明中学化学兴趣小组欲测定该药品中碳酸氢钠(NaHCO3)的质量分数,取20片该药品研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水,也不参加反应),共消耗稀盐酸46. 0g,测得反应后烧杯内物质的总质量为51.6g。
请计算:
(1)反应共生成气体的质量为_____。
(2)反应后所得溶液中溶质的质量分数_____。
【答案】4.4g 11.7%
【解析】
【分析】
【详解】
(1)20片该药品质量=
50g
×20=10g
100
片
片
,根据质量守恒定律可知,反应共生成气体的
质量=10g+46g-51.6g=4.4g;
(2)设生成4.4g二氧化碳需要碳酸氢钠的质量为x,同时生成氯化钠的质量为y。
3228458.544x y NaHCO +HCl =NaCl +H O +g
CO 4.4↑
84x =44 4.4g
,x=8.4g 58.5y =44 4.4g
,y=5.85g ; 反应后所得溶液中溶质的质量分数= 5.85g 100%=11.7%8.4g+46.0g-4.4g
⨯ 答:反应后所得溶液中溶质的质量分数为11.7%。
【点睛】
化学反应后所得溶液的质量等于所有加入物质的质量总和减去生成的气体、沉淀质量以及没有参加反应的不溶物的质量。
9.为了测定某铝样品(杂质不溶于水,也不参加反应)的纯度,将6 g 铝样品投入某氢氧化钠溶液中,恰好完全反应后,得到100g 质量分数为16.4%的偏铝酸钠(NaAlO 3)溶液。
发生反应的化学方程式为:2222Al 2H O 2NaOH 2NaAlO 3H ++=+↑。
求: (1)铝样品的纯度为_____。
(2)所用氢氧化钠溶液的溶质质量分数。
_____(写出计算过程,结果保留至0.1%)
【答案】90% 8.4%
【解析】
【分析】
【详解】
(1)解:设样品中铝的质量为x ,消耗氢氧化钠的质量为y ,生成氢气的质量为z 。
2222Al 2H O 2NaOH =
2NaAlO 3H 5480
1646x y
100g 16.4%z 54806164===x y z 100g 16.4%
+++⨯⨯↑
x=5.4g ,y=8.0g ,z=0.6g 所以铝样品的纯度为:5.4g 100%6g
⨯=90% 答:铝样品的纯度为90%。
(2)所用氢氧化钠溶液的溶质质量分数为:8.0g 100%8.4%100g+0.6g-5.4g
⨯≈ 答:所用氢氧化钠溶液的溶质质量分数为8.4%。
10.将10克的石灰石放入烧杯中,加入一定质量的稀盐酸恰好完全反应,生成3.3克气
体。
(杂质不溶解,也不参加反应。
)反应后称量烧杯中剩余物质的总质量为106.7克。
试求
(1)石灰石中碳酸钙的质量是多少___?
(2)所用盐酸的溶质质量分数是多少?____(结果保留到0.1%)
【答案】7.5克 5.5%
【解析】
【详解】
(1)设石灰石中碳酸钙的质量为x ,所用盐酸的溶质质量为y ,
3
2
22CaCO +2HCl =CaCl +H O +CO 1007344
x y
3.3g 1007344==x y 3.3g
↑
解得x=7.5g ,y=5.475g
答:石灰石中碳酸钙的质量是7.5g 。
(2)所用盐酸的溶质质量分数为:106.7g 3.3g 10g
5.475g 100% 5.5%+⨯-≈ 答:所用盐酸的溶质质量分数为5.5%。